Professional Documents
Culture Documents
Laporan Praktikum Aspirin
Uploaded by
Himpro Tekkim UnnesCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Laporan Praktikum Aspirin
Uploaded by
Himpro Tekkim UnnesCopyright:
Available Formats
LAPORAN PRAKTIKUM ASPIRIN I. Tujuan Praktikum 1.
Melakukan sintesis aspirin dari asam salisilat dan asam asetat anhibrida 2. Menjelaskan prinsip asetilasi Landasan Teoritis Reaksi asam salisilat (asam o-hidroksibenzoat) dengan anhidrida asetat digunakan untuk menyintesis aspirin. Dalam reaksi ini, gugus hidroksil fenolik diasetilasi (dikonversi menjadi ester asetat). Asetilasi adalah penggantian atom H dari asam salisilat dengan gugus asetil dari anhidrida asetat.
II.
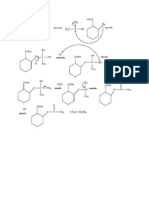
Gambar II.1. Reaksi asam salisilat dengan asam asetat anhidrida Ester dapat terbentuk salah satunya dengan cara mereaksikan alkohol dengan anhidrida asam. Dalam hal ini asam salisilat berperan sebagai alkohol karena mempunyai gugus OH , sedangkan anhidrida asam asetat tentu saja sebagai anhidrida asam. Ester yang terbentuk adalah asam asetil salisilat (aspirin). Gugus asetil (CH3CO-) berasal dari anhidrida asam asetat, sedangkan gugus R-nya berasal dari asam salisilat (pada gambar di atas gugus R ada di dalam kotak). Hasil samping reaksi ini adalah asam asetat.
Gambar II.2. Reaksi pembentukan asam asetil salisilat Tetapi harus diperhatikan bahwa sebelum dipanaskan, reaksi tidak benar-benar terjadi. Reaksi baru akan berlangsung dengan baik pada suhu 50-60C. Juga pada
1
percobaan ini baru terbentuk endapan putih (aspirin) setelah dipanaskan. Kemudian endapan tersebut dilarutkan dalam air dan disaring untuk memisahkan aspirin dari pengotornya. Tetapi tentu saja dengan penyaringan ini aspirin yang dihasilkan belum benar-benar murni.
NaHCO3
Gambar. II.3 Reaksi pemebentukan natrium asetil salisilat Asam asetil salisilat dapat bereaksi dengan NaHCO3 membentuk garam natrium yang larut dalam air, sedang hasil samping yang merupakan polimer, tidak larut dalam bikarbonat. Perbedaan sifat ini akan digunakan untuk pemurnian aspirin. Sifat-Sifat Aspirin: Formula BM Titik didih Titik lebur Berat jenis Sinonim : C9H8O4 : 180,2 : 140 0C : 138 0C 140 0C : 1.40 g/cm : 2-acetyloxybenzoic acid 2-(acetyloxy)benzoic acid Acetylsalicylate acetylsalicylic acid O-acetylsalicylic acid Kelarutan dalam air : 10 mg/mL (20C)
Asetosal mengandung tidak kurang dari 99,5% dan tidak lebih dari 100,5% C9H8O4 dihitung terhadap zat yang telah dikeringkan
2
Asam sulfat memiliki rumus kimia H2SO4. memiliki titik leleh 10C. dan titik didih 290C. asam sulfat banyak digunakan dalam industri. Berupa cairan kental dan amat korosif. Bereaksi dengan jaringan tubuh. Bereaksi hebat dengan air dan mengeluarka panas, bereaksi pula dengan logam, kayu, pakaian dan zat organik. Pada sintesis aspirin asam sulfat berfungsi sebagai katalis yang mempercepat proses reaksi. Kegunaan dari aspirin: sebagai analgesik (obat yang dapat mengurangi atau menghilangkan rasa nyeri dan akhirnya akan memberikan rasa nyaman pada orang yang menderita) sebagai antipirentik (obat yang dapat menurunkan demam (suhu tubuh yang tinggi) sebagai antiinflamasi
III.
Alat dan Bahan Alat a. b. c. d. e. f. g. h. i. j. k. l.
Waterbath Timbangan Gelas ukur Beker Glass Glass arloji Pengaduk kaca Statif dan Klem Saringan Penghisap Termometer Pipet Ukur Kertas saring Oven
Bahan a. b. c. d. e.
Asam Salisilat Asam asetat anhidrida Asam sulfat pekat Akuades Alkohol 96%
(3 gram) (8 ml) (5 tetes) (100 ml) (10 ml)
IV.
Cara Kerja
3 gr Asam Salisilat 8 ml Asam Asetat Anhidrida 5 tetes Asam Sulfat Pekat
Campuran Dipanaskan dengan suhu 5060 C selama 15 menit Campuran Dinginkan 75 ml Aquades Campuran
Aduk dan saring kristal Aspirin dengan corong buchner Kristal Aspirin Tempatkan pada beker glass Kristal Aspirin 10 ml Alkohol 96% 25 ml aquadest
Aduk dan panaskan hingga larut Larutan Aspirin murni Dinginkan dan terbentuk kristal aspirin saring dengan corong buchner dan Oven hingga berat aspirin konstan Aspirin
Gambar IV.1. Skema Kerja Pembuatan Aspirin
V. Data pengamatan NO Perlakuan 3 gr asam salisilat + 8 ml asam asetat anhibrida 1 (+) 5 tetes asam sulfat pekat Campuran dipanaskan dengan suhu 50-60oC 2 selama 15 menit Didinginkan dan ditambah 75 ml aquadest 3 4 5 Saring dengan corong Buchner Kristal aspirin kotor ditambah dengan 10 ml alkohol 96% dan 25 ml aquadest, dan panaskan hingga larut Saring dengan corong buchner Dioven hingga berat aspirin konstan
Pengamatan - cairan jernih - endapan putih, putih keruh Cairan putih keruh Terdapat endapan putih Kristal aspirin kotor Kristal aspirin kotor
6 7
Kristal aspirin murni
Kristal Aspiin murni Berat 1 : 4,15 gram Berat 2 : 2,37 gram Berat 3 : 2,37 gram Gambar V.I. Data Pengamatan
VI.
Analisis Data dan Pembahasan 1. Analisis Data Perhitungan aspirin teoritis Diket : gram asam salisilat = 3 gram BM asam salisilat = 138,12 BM Aspirin = 180,2 Dit : berat teoritis aspirin Jawab : Mol aspirin = Mol asam salisilat Mol asam salisilat
Asam Salisilat M R S 0,021 mol 0,021 mol -
Asam asetat anhidrida
Aspirin
Asam asetat
0,021 mol 0,021 mol
0,021 mol 0,021 mol
0,021 mol 0,021 mol
Berat Aspirin Teoritis
= Mol Aspirin x BM Aspirin = 0,021 mol x 180,2 = 3,91 gram
6
Perhitungan Rendemen aspirin yang dihasilkan :
2. Pembahasan Dasar dari pembuatan aspirin adalah asetilasi antara asam salisilat dengan asam asetat anhidrida. Penggunaan asam asetat anhidrida bertujuan agar reaksi yang terjadi lebih maksimal dan irreversibal, sehingga aspirin yang dapat juga maksimal. pada praktikum pembuatan aspirin, langkah pertama adalah melarutkan 3 gram asam salisilat pada 8 ml asam asetat anhidrida, larutan yang di dapat berwarna putih keruh. Kemudian larutan ditetesi dengan asam sulfat pekat sebagai katalis dalam reaksi asetilasi. Penghidrasi juga untuk menghindari terjadinya air kristal pada akhir raksi. Larutan yang telah ditambah asam sulfat pekat dipanaskan pada waterbath selama 15 menit pada suhu 50-60C kemudian di dinginkan sambil diaduk sesekali. Langksah selanjutnya adalah penambahan 75ml akuades sambil diaduk, pada tahap ini kristal aspirin mulai terbentuk. Selanjutnya krista aspirin kotor dipisahkan dengan cairannya dengan menggunakan corong buchner. Pemurnian aspirin dilakukan dengan cara menambahkan 10ml alkohol96% dan 25 ml akuades pada kristal aspirin kotor. Pada tahap ini telah terbentuk kristal aspirin murni. Kristal aspirin murni dipisahkan dari cairannya menggunakan corong buchner. Tahap terakhir adalah pengovenan kristal aspirin murni agar didapat massa yang konstan dengan suhu 100-110C karena aspirin meleleh pada suhu 140C. Rendemen aspirin tidak 100% dikarenakan faktor teknis yaitu ketidaksempurnaan pada waktu penyaringan sehingga aspirin masih tertinggal pada kertas saring, dan faktor non-teknis yaitu pada saat rekristalisasi dengan air dan alkohol 96% di lakukan pada waktu yang lama sehingga kristal aspirin murni yang terbentuk dapat lebih banyak.
VII.
Kesimpulan dan Saran 1. Kesimpulan a. Berat Aspirin secara teoritis adalah 3,91 gram b. Berat aspirin yang didapat dari praktikum adalah 2,37 gram c. % rendemen adalah 60,61% 2. Saran a. berhati-hatilah dengan bahan yang digunakan terutama asam sulfat pekat yang merupakan asam kuat b. Pembagian tugas saat praktikum mutlak diperlukan agar lebih efektif dan efisien terhadap waktu.
VIII.
Daftar Pustaka Anwar, C., Purwono, B., Pranowo, H.D Wahyuningsih, T.D., 1994. Pengantar Praktikum Kimia Organik, FMIPA UGM Yogyakarta Pavia, D.L., Lampman, G.M., Kriz G.S., 1976, Introduction to Organic Laboratory Technique, Washington: WB Savaders Company Suminar,S.A., 2003, Kimia Organik: suatu kuliah singkat, Ed.11 Jakarta: Erlangga Tim Dosen Pembimbing , 2003, Buku Petunjuk Praktikum Kimia Organik PreparatifKuantitatif, Laboratorium Kimia Organik, Jurusan Teknik Kimia Fakultas Teknik, Undip, Semarang Tim Dosen Praktikum Kimia Organik, 2007, Petunjuk Praktikum Kimia Organik II, Labolatorium Kimia Organik, Jurusan Kimia FMIPA UNNES Anonim, 2003, Encyclopedia Aspirin, http://www.statemaster.com/encyclopedia/Aspirin, (diakses tanggal 5 mei 20010 ). Kusuma, Ersanghono, 2003, Sintesis Organik, Jurusan Kimia FMIPA UNNES : Semarang. http://dedy9.wordpress.com/2012/08/02/pengertian-analgesik-antipiretik
Mengetahui Dosen Praktikum
Dewi Artanti, ST.MT.
You might also like
- Sintesis AspirinDocument13 pagesSintesis AspirinNayla IshmaNo ratings yet
- Laporan Praktikum Pembuatan AspirinDocument6 pagesLaporan Praktikum Pembuatan AspirinLulu Igaalamsyah100% (2)
- Dasar Teori-Sintesis Aspirin Part 1Document4 pagesDasar Teori-Sintesis Aspirin Part 1Ricky RiansyahNo ratings yet
- Laprak Kimor Sintesis AspirinDocument13 pagesLaprak Kimor Sintesis AspirinSinthiya Nur SeptianiNo ratings yet
- Pembuatan AspirinDocument8 pagesPembuatan AspirinFrengky AfrimirzaNo ratings yet
- Pembuatan AspirinDocument8 pagesPembuatan AspirinRanti Rin100% (1)
- Laporan Praktikum Sintesis Aspirin Kelompok 8Document8 pagesLaporan Praktikum Sintesis Aspirin Kelompok 8Ester Lusiana100% (1)
- Pembuatan AspirinDocument8 pagesPembuatan AspirinPuryantoNo ratings yet
- Percobaan IV AspirinDocument14 pagesPercobaan IV AspirinAstri Sulistia100% (1)
- AspirinDocument15 pagesAspirinAlfiyah TrisyaniNo ratings yet
- Pembuatan Aspirin DapDocument11 pagesPembuatan Aspirin DapDitoAPrasetyoNo ratings yet
- Laporan Sintesis AspirinDocument12 pagesLaporan Sintesis AspirinRizki Alfi Muhammad100% (1)
- Laporan Tetap Amyl Asetat.Document10 pagesLaporan Tetap Amyl Asetat.Wulandari Sajho100% (1)
- EsterifikasiDocument8 pagesEsterifikasiKim Hye NieNo ratings yet
- AsetanilidaDocument6 pagesAsetanilidaNathasya Humaira AdrianiNo ratings yet
- Laporan Metil SalisilatDocument13 pagesLaporan Metil SalisilatFelicia Viona100% (1)
- Mekanisme Reaksi AspirinDocument3 pagesMekanisme Reaksi AspirinTaufik Rahman100% (2)
- IodoformDocument7 pagesIodoformSa'dur RifkiNo ratings yet
- Pembuatan AspirinDocument6 pagesPembuatan AspirinFumin Tjia100% (2)
- Laporan Organik IiDocument11 pagesLaporan Organik Iiyeyem hasim0% (1)
- AsetilasiDocument11 pagesAsetilasiKhoirin Najiyyah Sably100% (1)
- Laporan Sintesis Metil SalisilatDocument14 pagesLaporan Sintesis Metil Salisilataliyah maulidyaNo ratings yet
- Laporan Praktikum Kimia Organik AspirinDocument13 pagesLaporan Praktikum Kimia Organik AspirinAngelina Debbie100% (1)
- Laporan Praktikum Kimia Organik Sintesis Etil AsetatDocument6 pagesLaporan Praktikum Kimia Organik Sintesis Etil AsetatIpung MbilawangNo ratings yet
- Sintesis Etil AsetatDocument19 pagesSintesis Etil AsetatNur Indah Lesthary67% (3)
- Laporan Sintesis Metil Salisilat Salsabilah Lutfiah 15020190242Document19 pagesLaporan Sintesis Metil Salisilat Salsabilah Lutfiah 15020190242SALSABILAH LUTFIAHNo ratings yet
- Kelmpok 6 Alkilasi Ester AsetoasetatDocument12 pagesKelmpok 6 Alkilasi Ester AsetoasetatmayaNo ratings yet
- Laporan Rekristalisasi IodoformDocument10 pagesLaporan Rekristalisasi IodoformMinny DevganNo ratings yet
- Laporan Pembuatan Aspirin (Na'Ima)Document20 pagesLaporan Pembuatan Aspirin (Na'Ima)Balqis Nilnaizar Ramadhan100% (1)
- Bundelan Aldol KondensasiDocument12 pagesBundelan Aldol KondensasiFakhri Al JenarNo ratings yet
- Laporan AsetaldehidDocument8 pagesLaporan AsetaldehidKathrin Dian Cintika100% (2)
- Asetat AnhidridaDocument9 pagesAsetat AnhidridaInge_Afridiant_8309No ratings yet
- Pembuatan IodoformDocument5 pagesPembuatan IodoformIrfan Ramadhan100% (1)
- Sintesis Metil SalisilatDocument17 pagesSintesis Metil SalisilatFerani Cendrianti100% (3)
- Laporan Metil SalisilatDocument17 pagesLaporan Metil SalisilatDhiya LuthfiyyahNo ratings yet
- Lapres ..AspirinDocument29 pagesLapres ..AspirinulfatikhahNo ratings yet
- Sintesis Asam Salisilat Dari Minyak Gandapura Dan Uji Titik LelehDocument6 pagesSintesis Asam Salisilat Dari Minyak Gandapura Dan Uji Titik LelehChristopher HermanNo ratings yet
- Esterifikasi Metil BenzoatDocument35 pagesEsterifikasi Metil BenzoatIndah Shaliha67% (3)
- Asamkarboksilat (Repaired)Document17 pagesAsamkarboksilat (Repaired)Yuniasari Syawali100% (1)
- Sintesis Asam SalisilatDocument5 pagesSintesis Asam SalisilatNicholas ReedNo ratings yet
- ASPIRINDocument24 pagesASPIRINfanesa100% (1)
- Asam SalisilatDocument2 pagesAsam SalisilatpantatbolongNo ratings yet
- AsetanilidaDocument33 pagesAsetanilidafirda arifatuNo ratings yet
- Laporan Praktikum Kimia Organik IIDocument17 pagesLaporan Praktikum Kimia Organik IIpratiwi suyantoNo ratings yet
- Kondensasi AldolDocument6 pagesKondensasi AldolDiah Syafitri UnesNo ratings yet
- Sintesa AspirinDocument13 pagesSintesa AspirinDhiya Luthfiyyah100% (1)
- Sintesa AspirinDocument12 pagesSintesa AspirinviriyalNo ratings yet
- 150406-Laporan Praktikum KI2251-Sintesis Senyawa Kumarin (Coumarin) Dengan Reaksi PechmannDocument9 pages150406-Laporan Praktikum KI2251-Sintesis Senyawa Kumarin (Coumarin) Dengan Reaksi PechmannlutviaputriNo ratings yet
- Laporan Ko 2 Destilasi AsetildehidDocument10 pagesLaporan Ko 2 Destilasi AsetildehidVivianna Tyassari50% (2)
- Reaksi Asetilasi LanjutanDocument11 pagesReaksi Asetilasi LanjutanSri MardiatyNo ratings yet
- Sintetis AspirinDocument9 pagesSintetis AspirinvivijunNo ratings yet
- Kelompok 5 - 20B1 - Kimor IIDocument9 pagesKelompok 5 - 20B1 - Kimor IIEster LusianaNo ratings yet
- Bab II (Aspirin)Document9 pagesBab II (Aspirin)Brylian Rizky PratamaNo ratings yet
- Laporan Praktikum 8 Kimia OrganikDocument10 pagesLaporan Praktikum 8 Kimia OrganiklawrensiusNo ratings yet
- Laporan AspirinDocument15 pagesLaporan AspirinAamNo ratings yet
- Laporan Resmi Kimor 2 (Aspirin)Document14 pagesLaporan Resmi Kimor 2 (Aspirin)Sary AyixsNo ratings yet
- Acara Vi Pembuatan AspirinDocument11 pagesAcara Vi Pembuatan AspirinVera FitrianaNo ratings yet
- AspirinDocument11 pagesAspirinmarianti_nainggolanNo ratings yet
- Pembuatan AspirinDocument15 pagesPembuatan Aspirinnashinta putriNo ratings yet
- Sint. AspirinDocument18 pagesSint. AspirinNora AsyikNo ratings yet
- Laporan Praktikum Sabun ColekDocument8 pagesLaporan Praktikum Sabun ColekHimpro Tekkim Unnes100% (2)
- Laporan Praktikum Pasta GigiDocument10 pagesLaporan Praktikum Pasta GigiHimpro Tekkim UnnesNo ratings yet
- Laporan Praktikum Pembersih Pembersih PorselenDocument8 pagesLaporan Praktikum Pembersih Pembersih PorselenHimpro Tekkim Unnes67% (3)
- Laporan Praktikum TrimiristinDocument6 pagesLaporan Praktikum TrimiristinHimpro Tekkim UnnesNo ratings yet
- Laporan Praktikum Isoamil AsetatDocument10 pagesLaporan Praktikum Isoamil AsetatHimpro Tekkim Unnes100% (2)