Professional Documents
Culture Documents
Valoracion Del NaOH Con Biftalato de Potasio
Uploaded by
Carlos Andrés MatizOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Valoracion Del NaOH Con Biftalato de Potasio
Uploaded by
Carlos Andrés MatizCopyright:
Available Formats
5. PREPARACION Y VALORACION DE HCL 0.1N Y NaOH 0.
1N
5.1 OBJETIVOS Aplicar los principios de neutralizacin que rigen las reacciones cido - base. Preparar una solucin patrn de HCL aproximadamente 0.1N y titularla para hallar su concentracin exacta. Preparar una solucin patrn de NaOH aproximadamente 0.1N y titularla para hallar su concentracin exacta. 5.2 ASPECTOS TEORICOS.
5.2.1
Volumetras de neutralizacin. En numerosos anlisis qumicos es necesaria la utilizacin de soluciones cidos y bases fuertes de concentraciones conocidas.
La concentracin de dichas soluciones puede determinarse por medio de titulaciones o valoraciones de neutralizacin. La titulacin o valoracin es la operacin bsica de la volumetra, mediante la cual se agrega solucin patrn o un peso exacto de reactivo puro disuelto a la muestra que se analiza, hasta que se completa la reaccin. Se considera que una titulacin de neutralizacin o valoracin cido - base termina cuando el nmero de equivalentes del cido es igual al nmero de equivalentes de la base, momento en el cual se alcanza el punto de equivalencia de la reaccin. El punto de equivalencia de la titulacin es un concepto terico; la estimacin prctica de su valor se conoce como punto final. Para las titulaciones cido - base, los dos mtodos ms comunes para la determinacin de los puntos finales son el empleo de indicadores coloreados o el uso de un peachmetro para controlar el pH de la solucin en funcin del volumen del titulante agregado.
5.2.2
Preparacin de soluciones de HCl. El cido clorhdrico se usa frecuentemente en los anlisis volumtricos de neutralizacin porque sus soluciones diluidas son estables y porque se puede utilizar en presencia de la mayora de los cationes sin que ocurran reacciones de precipitacin.
Las soluciones patrn de HCl se preparan diluyendo cido clorhdrico concentrado calidad reactivo.
5.2.3 Valoracin de las soluciones de HCl. Como el HCl no es un patrn primario se hace necesario valorarlo para conocer su concentracin exacta. El Na 2CO3 anhidro se emplea comnmente para estandarizar soluciones de HCl. La reaccin de neutralizacin del HCl con el Na2CO3 es: 2HCl + Na2CO3 2NaCl + H2CO3
5.2.4 Preparacin de soluciones de NaOH. El hidrxido de sodio tanto en solucin como en estado slido reacciona con el CO2 atmosfrico produciendo Na2CO3 segn la reaccin: CO2 + 2NaOH Na2CO3 + H2O
Existen diversos mtodos para la preparacin de soluciones de NaOH exentas de carbonato. El mtodo ms utilizado aprovecha la poca solubilidad del carbonato de sodio en concentraciones altas de hidrxido de sodio. El carbonato de sodio formado se elimina por filtracin o centrifugacin. Las soluciones de hidrxido de sodio se deben preparar en agua a la que previamente se le ha eliminado el CO2; para ello se debe hervir durante algunos minutos el agua destilada; una vez fra se le aade el hidrxido de sodio. Para impedir el acceso de CO2 del aire se guarda la solucin en un recipiente provisto de cal sdica. En caso de no utilizar cal sdica, un frasco de polietileno cerrado hermticamente producir la suficiente proteccin durante una o dos semanas. 5.2.5 Valoracin de soluciones de NaOH. La solucin bsica se valora con un tipo primario como son los cidos dbiles, ftalato cido de potasio (FAP), cido benzico o yodato cido de potasio. La reaccin de neutralizacin que ocurre entre el NaOH y el FAP es: O C NaOH + C O OK C OH C O OK O ONa + HOH
5.3 ASPECTOS TEORICOS POR CONSULTAR Defina los siguientes trminos: patrn primario o estndar primario, solucin patrn estndar, normalidad de un cido, peso equivalente de un cido, normalidad de una base, peso equivalente de una base, equivalente de un cido, equivalente de una base, miliequivalentes de un cido, miliequivalentes de una base. Numere los requisitos que deben cumplir las soluciones patrn ideales.
Defina qu es formula molecular y formula estructural. Escriba las frmulas estructurales de los compuestos: cido benzico, cido ftlico, cido tereftlico.
Halle el nmero de equivalentes y el peso equivalente en funcin del peso formula gramo, de los compuestos HCL, Na2CO3 y FAP. Para cada una de las sustancias adjunte la reaccin de neutralizacin.
5.4 MATERIALES, REACTIVOS Y EQUIPOS.
5.4.1
Materiales. 1 Vaso de precipitados de 600mL, 1 vaso de precipitados de 100 mL, 1 baln aforado de 500mL, 1 baln aforado de 100mL, 1 frasco lavador, 1 agitador de vidrio, 1 embudo pequeo, 1 vidrio de reloj pequeo, 1 vidrio de reloj de dimetro apropiado para tapar el vaso de precipitados de 600mL, 1 pipeta de 1mL, 1 pipeta de 25mL, 1 erlenmeyer de 500mL, 2 erlenmeyer de 250mL, 1 bureta de 25 mL, 1 probeta de 100mL, 2 frascos de polietileno de 500mL, 1 pipeteador, 1 cpsula de porcelana, 1 tubo de centrifuga. Reactivos. Carbonato de sodio (secado durante 2 horas a 100C y centrifugado en un desecador), cido clorhdrico concentrado, metil naranja al 0.5% (p/v), fenolftalena al 0.1% en etanol (p/v), hidrxido de sodio, ftalato cido de potasio FAP (secado durante 2 horas a 110C y enfriado en un desecador). Equipos. Balanza analtica, centrfuga, balanza semianaltica.
5.4.2
5.4.3
5.5 PROCEDIMIENTO.
5.5.1 Preparacin de HCl aproximadamente 0.1N. Coloque en un baln aforado de 500mL,
aproximadamente 200mL de agua destilada; adicione 4.2mL de HCl concentrado, agite y complete el volumen con agua destilada; homogenice la solucin. 5.5.2 Valoracin de la solucin de HCl. Pese en un vidrio de reloj, con aproximacin a la dcima de mg, 0.11g de Na2CO3 y transldelos a un erlenmeyer de 250mL; disulvalos en 50mL de agua destilada y aada 2 gotas de metil naranja; lave una bureta con agua destilada; para el enjuague final utilice aproximadamente 5mL de la solucin preparada de HCL; posteriormente llene la bureta con la solucin de HCl y adicione el cido al erlenmeyer que contiene el carbonato de sodio, hasta que vire el color de la solucin de amarillo a rojo. Informe la normalidad de la solucin de HCl a partir del promedio de dos valoraciones. Almacene la solucin en un recipiente plstico, anote su concentracin y fecha de valoracin y resrvela para la prctica siguiente.
5.5.2
Preparacin de NaOH aproximadamente 0.1N. Hierva durante tres minutos en un vaso de precipitados de 600mL, 500mL de agua destilada; retire el recipiente del fuego, tpelo con un vidrio reloj y enfre a temperatura ambiente.
Pese 5g de NaOH en un vaso de precipitados de 100mL; adicione 5mL de agua destilada y disuelva completamente el NaOH; coloque la solucin en u tubo de centrfuga por 10 minutos a 5000rpm. Pese en una cpsula de porcelana 4g de la solucin de NaOH centrifugada y transfrmelos con la ayuda de un embudo y de un frasco lavador a un baln volumtrico de 500mL que contenga aproximadamente 200mL de agua destilada hervida y fra. Disuelva la solucin; complete el volumen con el agua destilada hervida y fra y homogenice. 5.5.4 Valoracin de la solucin de NaoH. Pese 2.0422g de FAP en un vidrio de reloj o introdzcalo con la ayuda de un embudo y de un frasco lavador, en u baln aforado de 100mL que contenga aproximadamente 30mL de agua destilada; disuelva el soluto y complete a volumen; homogenice la solucin. Deposite en un erlenmeyer de 250mL, 25mL de la solucin preparada de FAP; agregue tres gotas de fenolftalena; lave una bureta con agua destilada; para el enjuague final, utilice aproximadamente 5mL de la solucin preparada de NaOH y adicione la base al erlenmeyer que contiene el FAP hasta que una gota de la base coloree la solucin de rosa plido que persista por lo menos 30 segundos. Informe la normalidad a partir del promedio de dos valoraciones con FAP que no difieran en ms de 0.2mL de volumen gastado. Almacene la solucin de NaOH en un frasco de polietileno; anote su concentracin y fecha de valoracin y resrvela para la siguiente prctica. 5.6 PREGUNTAS Y CALCULOS Demuestre que para preparar 500ml de HCL aproximadamente 0.1N debe medir 4.2ml de HCL concentrado disponible en el laboratorio. Qu datos necesita conocer del HCL concentrado disponible?. Calcule el nmero de equivalentes de cada una de las muestras de carbonato de sodio. Demuestre que el volumen de agua que se le adiciona al Na2CO3 para disolverla no incide en la cantidad de miliequivalentes. Llene la siguiente tabla y calcule la normalidad de la solucin preparada de HCl; adjunte los clculos respectivos.
TABLA DE DATOS Informacin requerida Peso de Na2CO3 gr.
Volumen de HCL consumido (ml) Normalidad de la solucin de HCL (promedio)
Ensayo 1
Ensayo 2
Halle la normalidad de la solucin de FAP preparada.
Llene la siguiente tabla y calcule la normalidad de la solucin de NaOH preparada.
adjunte los clculos respectivos.
TABLA DE DATOS Informacin requerida
Volumen de FAP (ml) Volumen de NaOH consumido (ml) Normalidad de la solucin de FAP Normalidad de la solucin de NaOH (promedio)
Ensayo 1
Ensayo 2
Al efectuar una titulacin de cido fuerte con base fuerte, es una buena prctica colocar el NaOH en la bureta, sea que se trate de la solucin patrn o de la muestra problema; explique la razn. Qu son indicadores cido base? Haga una tabla en la que se observe el rango de pH de cambio de color y los colores que toman en los cambios, los siguiente indicadores: naranja de metilo, rojo de metilo, verde de bromocresol, fenolftalena y timofenolftaleina.
Describa un procedimiento diferente al realizado en la practica para valorar una solucin de NaOH y una solucin de HCL, explique los clculos para hallar la concentracin.
5.7 BIBLIOGRA CONSULTADA CRISTIAN, G. Qumica Analtica. 3 Ed. Limusa. Mxico. 1981 pg. 156-257. KLTHOFF, I. M. Y otros. Anlisis Qumico Cuantitativo. 6 Ed. Editorial Nigar, S. R. L. Buenos Aires, 1985. Pg 805-811. RAMETTE, R. Equilibrio y Anlisis Qumico,. Fondo Educativo Interamericano. Mxico. 1983. Pg 356-365. SKOOG, D y WEST, D, HOLLER F. Qumica Analtica. 4 Ed. Mc Graw-Hill. Mxico. 1990 Pgs. 225-230. 5.8 BILBIOGRAFIA POR CONSULTAR. CRISTIAN, G. Qumica Analtica. 3 Ed. Limusa. Mxico. 1981 RAMETTE, R. Equilibrio y Anlisis Qumico,. Fondo Educativo Interamericano. Mxico. 1983
SOLUMON, T.W.G. Qumica Orgnica. Limusa. 1 Ed. 3 reimpresin. Mxico. 1981
You might also like
- Practica 2 y 3 Preparacion y Valoracion de HCL y NaOH 0.1NDocument8 pagesPractica 2 y 3 Preparacion y Valoracion de HCL y NaOH 0.1NYeny Edith Villa Venzor100% (3)
- Volumetria de Oxido Reduccion Determinacion Volumetrica de Hierro Por PermanganometriaDocument3 pagesVolumetria de Oxido Reduccion Determinacion Volumetrica de Hierro Por PermanganometriaEDWIN MOLLINEDO VELIZNo ratings yet
- Determinacion de PeroxidoDocument2 pagesDeterminacion de Peroxidofordonezr67% (3)
- Práctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote TDocument5 pagesPráctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote Ttania pinargoteNo ratings yet
- Valoración Potenciométrica de NeutralizaciónDocument3 pagesValoración Potenciométrica de NeutralizaciónDani BerrioNo ratings yet
- Estandarización de NaOH con biftalato de potasioDocument9 pagesEstandarización de NaOH con biftalato de potasioHeyfferKelvinIgApNo ratings yet
- Determinación potenciométrica del % de carbonato de sodioDocument4 pagesDeterminación potenciométrica del % de carbonato de sodioanon_138266853No ratings yet
- Determinación de Ácido Ascórbico Por PotenciometriaDocument3 pagesDeterminación de Ácido Ascórbico Por PotenciometriaRonald67% (6)
- Mezclas AlcalinasDocument15 pagesMezclas AlcalinasbrayanNo ratings yet
- Informe 1 - Volumen Molar Parcial-Grupo 3Document34 pagesInforme 1 - Volumen Molar Parcial-Grupo 3Nahomy Malasquez PeñaNo ratings yet
- Informe - Titulación de Peróxido de HidrogenoDocument8 pagesInforme - Titulación de Peróxido de HidrogenoKarla CabreraNo ratings yet
- Titulaciones ComplexometricasDocument8 pagesTitulaciones ComplexometricasJulián EzNo ratings yet
- PermanganometriaDocument9 pagesPermanganometriaLuis Adalberto Santiago Melendez100% (2)
- Reporte DETERMINACIÓN DE PERMANGANATO DE POTASIODocument8 pagesReporte DETERMINACIÓN DE PERMANGANATO DE POTASIOJose Antonio Silva50% (2)
- Determinación de Aluminio en Una MuestraDocument3 pagesDeterminación de Aluminio en Una Muestracintyh_1100% (2)
- Yodometria YodimetriaDocument16 pagesYodometria YodimetriaDeinir SolanoNo ratings yet
- Informe #6. Anaranjado de Metilo.Document2 pagesInforme #6. Anaranjado de Metilo.Alonso Martinez Briseño50% (2)
- Anteproyecto para La Preparación y Estandarización de Una Disolución 0.05 M de EDTA Con Carbonato de Calcio Mediante La Técnica de Valoración.Document7 pagesAnteproyecto para La Preparación y Estandarización de Una Disolución 0.05 M de EDTA Con Carbonato de Calcio Mediante La Técnica de Valoración.Yael Rivera MarquezNo ratings yet
- Determinacion de Hierro Total Volumetria RedoxDocument3 pagesDeterminacion de Hierro Total Volumetria RedoxLuis Armando Hernandez Molina92% (12)
- Informe Práctica Determinación de HierroDocument9 pagesInforme Práctica Determinación de HierroAndrés PitoNo ratings yet
- Practica º 4 Titulaciones Potenciometricas de Precipitacion Determinacion de ClorurosDocument11 pagesPractica º 4 Titulaciones Potenciometricas de Precipitacion Determinacion de ClorurosLuis CalcinaNo ratings yet
- Lab10 Determinacion de R2O3 en CementoDocument5 pagesLab10 Determinacion de R2O3 en CementoAlexhitoo TlvNo ratings yet
- Determinación Gravimétrica de AluminioDocument24 pagesDeterminación Gravimétrica de Aluminioanon_8488453730% (1)
- Determinación Gravimétrica de SiO2, Fe2O3 y Al2O3 en Una Muestra de CementoDocument21 pagesDeterminación Gravimétrica de SiO2, Fe2O3 y Al2O3 en Una Muestra de CementoJulian Cardozo RodriguezNo ratings yet
- A Preparación de Una Solución Estándar de Ácido OxálicoDocument7 pagesA Preparación de Una Solución Estándar de Ácido OxálicoD. Patricia RamonNo ratings yet
- Practica 9. Determinación de Cloruros Por El Metodo de MohrDocument5 pagesPractica 9. Determinación de Cloruros Por El Metodo de MohrHeribertoNo ratings yet
- Determinación Gravimétrica de HierroDocument5 pagesDeterminación Gravimétrica de HierroPaola A Caicedo M40% (5)
- Práctica Final DeterminaciónDocument10 pagesPráctica Final DeterminaciónMike100% (1)
- Determinacion Hierro Volumetría Redox 1Document4 pagesDeterminacion Hierro Volumetría Redox 1DanielAlexanderChaparroNo ratings yet
- Informe H3po4Document6 pagesInforme H3po4FlakitaBellaNo ratings yet
- Volumetría de Óxido-Reducción. Determinación Volumétrica de Hierro Por PermanganometríaDocument3 pagesVolumetría de Óxido-Reducción. Determinación Volumétrica de Hierro Por PermanganometríaLuisaGordon0% (3)
- Warder y WinklerDocument19 pagesWarder y Winklerjuan diego villegasNo ratings yet
- Resumen PotenciometriaDocument13 pagesResumen PotenciometriaANA LUISA CRUZ MARQUEZNo ratings yet
- Determinación de Hierro en Una Muestra Por GravimetríaDocument7 pagesDeterminación de Hierro en Una Muestra Por GravimetríaMercedes100% (1)
- Caracteristicas de Patrones PrimariosDocument3 pagesCaracteristicas de Patrones PrimariosValeriita Marisol BasantesNo ratings yet
- Permanganato Acido Oxalico Redox ...Document5 pagesPermanganato Acido Oxalico Redox ...Luiza Fuentes100% (1)
- Determinacion de Hierro en Comprimidos de FeSO4Document9 pagesDeterminacion de Hierro en Comprimidos de FeSO4brayan gutierrez100% (1)
- Determinación de Cloruros Por El Método de Volhard y El Método de MohrDocument18 pagesDeterminación de Cloruros Por El Método de Volhard y El Método de MohrYesly Brigith Fernandez100% (1)
- Determinación de La Constante de SolubilidadDocument6 pagesDeterminación de La Constante de Solubilidadsantiago cardonaNo ratings yet
- Estandarización de ácido clorhídricoDocument8 pagesEstandarización de ácido clorhídricoEmiliano PicconiNo ratings yet
- Tarea No. 2 Ley de Beer Lambert Analisis InstrumentalDocument17 pagesTarea No. 2 Ley de Beer Lambert Analisis InstrumentalDerek Ebenezer Mata NavarroNo ratings yet
- Determinación de Hierro en Comprimidos de FeSO4Document10 pagesDeterminación de Hierro en Comprimidos de FeSO4zackdricklNo ratings yet
- Complejo EDTADocument6 pagesComplejo EDTAErika AlexandraNo ratings yet
- Modelo de Glasman o de BenchDocument1 pageModelo de Glasman o de BenchKarla VTNo ratings yet
- Informe Punto Isosbestico.Document13 pagesInforme Punto Isosbestico.Jesus Gerardo Lopez ColmanNo ratings yet
- Informe Determinación Gravimétrica de Níquel Con DimetilglioximaDocument4 pagesInforme Determinación Gravimétrica de Níquel Con DimetilglioximaDaniel RiveraNo ratings yet
- Determinación de Cloruros en Muestras AcuosasDocument4 pagesDeterminación de Cloruros en Muestras AcuosasJavier San Juan MercadoNo ratings yet
- Argentometría: Preparación y estandarización de nitrato de plataDocument7 pagesArgentometría: Preparación y estandarización de nitrato de plataDoriita YépezNo ratings yet
- Práctica N 5 - .Efecto Del Ión ComunDocument4 pagesPráctica N 5 - .Efecto Del Ión ComunPiero RojasNo ratings yet
- Determinacion de Carbonato de Calcio Mediante RetrocesoDocument8 pagesDeterminacion de Carbonato de Calcio Mediante RetrocesolorenaNo ratings yet
- Preparacion y Valoracion de HCL 0Document62 pagesPreparacion y Valoracion de HCL 0Merly Lizeth Aparicio Cayetano50% (4)
- 73541436Document62 pages73541436alonsoNo ratings yet
- Preparacion y Valoracion de HCL 0Document65 pagesPreparacion y Valoracion de HCL 0Pamela Jackeline Otero CuevaNo ratings yet
- Grupo2 Inf 6Document11 pagesGrupo2 Inf 6Evelyn Paguay CarrilloNo ratings yet
- Práctica No2 Sin portadaDocument9 pagesPráctica No2 Sin portadamikihibito1994No ratings yet
- Universidad Autónoma "Benito Juárez" de Oaxaca: Facultad de Ciencias QuimicasDocument7 pagesUniversidad Autónoma "Benito Juárez" de Oaxaca: Facultad de Ciencias QuimicasDiego O PerezNo ratings yet
- Innforme de La Practica Nro 6 QuimDocument6 pagesInnforme de La Practica Nro 6 QuimBrayan Geronimon CruzNo ratings yet
- Preparación y valoración de HCl y NaOHDocument5 pagesPreparación y valoración de HCl y NaOHJhojans Enrriquex riveraNo ratings yet
- Valoracion 1Document8 pagesValoracion 1Angie CampoverdeNo ratings yet
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Soluciones - MEZCLAS - JULIO2014Document37 pagesSoluciones - MEZCLAS - JULIO2014Clau MinettiNo ratings yet
- Clasificacion de LA MATERIA Soluciones Coloides Mezclas JULIO2014Document23 pagesClasificacion de LA MATERIA Soluciones Coloides Mezclas JULIO2014Clau Minetti100% (1)
- Apuntes RedoxDocument13 pagesApuntes Redoxcruces109No ratings yet
- Ecuaciones y Graficos-Cinética Fscqca IIDocument8 pagesEcuaciones y Graficos-Cinética Fscqca IIClau MinettiNo ratings yet
- Libro Química para TodosDocument105 pagesLibro Química para TodosClau MinettiNo ratings yet
- Problemas Solucionados CINETICA QUIMICADocument11 pagesProblemas Solucionados CINETICA QUIMICAPompeyo CesarNo ratings yet
- 41 CineticaDocument0 pages41 CineticaDiego PerezNo ratings yet
- Tabla de Energías de Enlace EnergíaDocument2 pagesTabla de Energías de Enlace EnergíaClau Minetti100% (2)
- Sol AmortiguadoraDocument6 pagesSol AmortiguadoraWendy Carolina Vargas AraujoNo ratings yet
- Proteínas ColorímetroDocument28 pagesProteínas ColorímetroClau MinettiNo ratings yet
- EJERCICIOS Ecuaciones Químicas IGUALACIÓNDocument1 pageEJERCICIOS Ecuaciones Químicas IGUALACIÓNClau MinettiNo ratings yet
- Calibración PotenciometroDocument7 pagesCalibración PotenciometroSergio Escobar0% (1)
- Permanganimetría TITULACIÓN REDOX CON OXALATO DE SODIODocument9 pagesPermanganimetría TITULACIÓN REDOX CON OXALATO DE SODIOClau Minetti100% (7)
- Materia Inerte y Materia VivaDocument5 pagesMateria Inerte y Materia VivaInn delta amacuroNo ratings yet
- Uso de Materiales Del EntornoDocument3 pagesUso de Materiales Del EntornoI.A. Esp. Luis Alberto Begambre GonzálezNo ratings yet
- Manual de Prácticas de Laboratorio de FitoquímicaDocument27 pagesManual de Prácticas de Laboratorio de FitoquímicaEdwin Pomatanta Plasencia33% (3)
- DETERMINACIÓN DE NaOH, NaHCO3, Na2CO3 O MEZCLAS POSIBLES EN UNA SOLUCION ALCALINADocument4 pagesDETERMINACIÓN DE NaOH, NaHCO3, Na2CO3 O MEZCLAS POSIBLES EN UNA SOLUCION ALCALINAMiguel FerreiraNo ratings yet
- Sena Actividad 1Document5 pagesSena Actividad 1FERNANDO JANESNo ratings yet
- Quimica Organica HidrocarburosDocument20 pagesQuimica Organica HidrocarburosYacira MosqueraNo ratings yet
- Examen de On Boarding #01Document2 pagesExamen de On Boarding #01H PNo ratings yet
- Muestreo de cuerpos mineralizadosDocument23 pagesMuestreo de cuerpos mineralizadosSTARCCINo ratings yet
- PRÁCTICA 3 - MEDICIONES DE PH Y CAPACIDAD REGULADORADocument13 pagesPRÁCTICA 3 - MEDICIONES DE PH Y CAPACIDAD REGULADORAmaferNo ratings yet
- Campus - Introduccion Form MagistralDocument16 pagesCampus - Introduccion Form MagistralDanae KokoeNo ratings yet
- Sustancias CorrosivasDocument3 pagesSustancias CorrosivasYasmín VerdeNo ratings yet
- Crecimiento de CristalesDocument10 pagesCrecimiento de CristalesMauro VanNo ratings yet
- Anexo 4 - Códigos de Usos y ActividadesDocument46 pagesAnexo 4 - Códigos de Usos y Actividadesmikex28No ratings yet
- MSDS-SF S-460-Col - 50-29823Document9 pagesMSDS-SF S-460-Col - 50-29823MANIKIN SUBNo ratings yet
- Procedimiento de Inspección Mediante Partículas MagnéticasDocument9 pagesProcedimiento de Inspección Mediante Partículas MagnéticasAna QUISPENo ratings yet
- Protocolo para Retenedor IntraradicularDocument16 pagesProtocolo para Retenedor IntraradicularZULLY MARCELA RIASCOS HERNANDEZNo ratings yet
- 2 Expo Del Grupo 8Document19 pages2 Expo Del Grupo 8yennyNo ratings yet
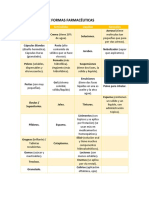
- Clasificación de Formas FarmacéuticasDocument2 pagesClasificación de Formas FarmacéuticasZúñiga EstherNo ratings yet
- Identificacion de Biomoleculas en AlimentosDocument13 pagesIdentificacion de Biomoleculas en AlimentosSpartan John75% (12)
- 9 Media Logaritmica de La Diferencia de TemperaturaDocument17 pages9 Media Logaritmica de La Diferencia de TemperaturaAlejandro Muriel GarciaNo ratings yet
- Curso Mineralogia II Diapositivas UntDocument176 pagesCurso Mineralogia II Diapositivas UntJiménez ManuelNo ratings yet
- Propiedades de Los PolicarbonatosDocument6 pagesPropiedades de Los Policarbonatosjhony_sucasaca100% (1)
- Aceros Reseller TUBERIASDocument5 pagesAceros Reseller TUBERIAStordos7183No ratings yet
- Flex I CokingDocument28 pagesFlex I CokingJosee Gregorio MedinaNo ratings yet
- Aplicacion de Yeso. DiscusionesDocument4 pagesAplicacion de Yeso. DiscusionesCintya Katerine Espinoza AldaveNo ratings yet
- Guia Lab N°6 Hidrocarburos Alifaticos Saturados e InsaturadosDocument16 pagesGuia Lab N°6 Hidrocarburos Alifaticos Saturados e InsaturadosSilvana CcaritaNo ratings yet
- Materiales ProtesicosDocument1 pageMateriales Protesicosambar naianNo ratings yet
- 1236-Texto Del Artículo-2472-1-10-20161214Document12 pages1236-Texto Del Artículo-2472-1-10-20161214Kinverlly GuerreroNo ratings yet
- Convección Forzada en Flujo InternoDocument3 pagesConvección Forzada en Flujo InternoAlmijail ZamoraNo ratings yet
- Cambios FísicosDocument3 pagesCambios Físicosashley barriosNo ratings yet