Professional Documents
Culture Documents
MN O4
Uploaded by
meli789Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
MN O4
Uploaded by
meli789Copyright:
Available Formats
PRCTICA 2
DETERMINACIN ESPECTROFOTOMTRICA DE MnO 4-
1.- FUNDAMENTO TERICO. 1.1.- Introduccin Un mtodo espectrofotomtrico est basado en la medida directa de la absorcin de radiacin electromagntica por parte de una muestra, cuantificable a travs de la Absorbancia, y la correlacin de esta variable con la concentracin de la especie de inters en dicha muestra. Todo analito molecular tiene la capacidad de absorber ciertas longitudes de onda caractersticas de la radiacin electromagntica. En este proceso, la radiacin es transferida temporalmente a la molcula y, como consecuencia, disminuye la intensidad de la radiacin. Dicha disminucin, debida a la absorcin experimentada por el analito, puede ser cuantificada utilizando diversas magnitudes, siendo la Absorbancia, A, la ms comnmente utilizada en la espectrofotometra de UV-VIS. Dicha absorbancia se define por la expresin: A = log P0 P
donde A es la Absorbancia, P0 la potencia del haz de radiacin incidente y P la potencia de dicho haz tras atravesar la muestra. 1.2.- Ley de Beer De acuerdo con la ley de Beer, la absorbancia est relacionada linealmente con la concentracin de la especie absorbente, c, y con la longitud de la trayectoria de la radiacin en el medio absorbente o camino ptico, b. Esto es: A = log P0 = a b c P
donde a es una constante de proporcionalidad llamada absortividad. Cuando la concentracin c se expresa en moles por litro, y b en centmetros, la constante de proporcionalidad se denomina absortividad molar, y se designa por el smbolo , y, puesto que la absorbancia es una magnitud adimensional, tendr unidades de L cm-1 mol-1. En este caso, la ley de Beer adquiere la forma:
A= b c 2-1
1.3.- Espectros de absorcin Un espectro de absorcin es una representacin grfica de la absorbancia de un analito (o de otra magnitud equivalente) en funcin de la longitud de onda de la radiacin, , (o de otro parmetro relacionado con la energa de la radiacin utilizada). El mximo de absorbancia obtenido en el espectro de absorcin de un analito, nos dar la longitud de onda que proporciona la mayor sensibilidad posible, y por tanto ser la que se utilizar en el anlisis espectrofotomtrico de dicho analito. Todas las disoluciones que presentan color, absorben radiacin electromagntica perteneciente al espectro visible, el cual puede dividirse en varias zonas segn se muestra en la tabla siguiente:
{PRIVADO }Longitud de Onda, (nm) 380-435 435-480 480-490 490-500 500-560 560-580 580-595 595-650 650-780
Color
Color Complementario
Violeta Azul Azul-verdoso Verde-azulado Verde Verde-amarillo Rojo Anaranjado Rojo
Verde-amarillo Amarillo Anaranjado Rojo Prpura Violeta Azul Azul-verdoso Verde-azulado
En dicha tabla, la columna del "color" indica la porcin del espectro que es absorbida, mientras que la correspondiente al "color complementario" indica la porcin de radiacin electromagntica que no absorbe la muestra y que por tanto es transmitida a travs de ella y puede ser captada por el ojo humano (color de la disolucin). As, por ejemplo, una disolucin de color amarillo absorbe la radiacin de color azul, y por tanto cabe esperar que presente un mximo de absorbancia en la zona de longitud de onda en la banda de 435-480 nm
2-2
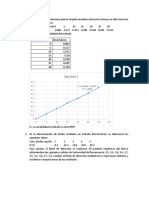
1.4.- Anlisis Cuantitavivo Para llevar a cabo el anlisis cuantitativo de una especie mediante la espectroscopa de absorcin molecular, es preciso realizar una etapa previa de calibracin. En dicha etapa se mide la absorbancia de varias muestras de concentracin conocida, las cuales sern utilizadas para, mediante "comparacin", calcular la concentracin de una muestra problema tras medir su absorbancia. Para llevar a cabo la etapa de calibracin, se representa la absorbancia de las muestras de concentracin conocida (llamadas patrones) a la longitud de onda de mxima absorbancia, frente a la concentracin de dichas muestras. De esta manera se obtiene la Curva de Calibracin. Segn la ley de Beer, el resultado obtenido ser una lnea recta, cuya expresin matemtica puede ser obtenida mediante un tratamiento de ajuste estadstico por mnimos cuadrados. 2.- OBJETIVO DE LA PRCTICA. Determinacin cuantitaviva de la concentracin de MnO 4- en una muestra problema mediante espectroscopa de absorcin molecular UV-VIS. 3.- MATERIAL Y REACTIVOS. 3.1.- MATERIAL. 3 matraces aforados de 25 mL. 1 matraz aforado de 100 mL. 2 vasos de precipitado de 100 mL. 2 pipetas graduadas. 2 cubetas para espectrofotmetro 1 frasco de agua destilada 1 pipeteador 3.2.- REACTIVOS. Disolucin KMnO4 0,1M Muestra problema 4.- PROCEDIMIENTO EXPERIMENTAL. 4.1.- Obtencin del espectro de absorbancia. A. Con una pipeta graduada, tomar 1 mL de la disolucin 0,1M de KMnO 4 y verterlo en un vaso de precipitado de 100 mL. Aadir poco a poco, y agitando cuidadosamente, agua 2-3
destilada hasta que la disolucin resultante presente un color similar al de la muestra problema. B. Con la disolucin preparada se obtendr el espectro de absorcin como sigue: - Debido al color prpura de la disolucin de MnO 4-, podemos predecir la zona del espectro en la que se obtendr la mxima absorbancia. Despus de poner a punto el espectrofotmetro, con la ayuda del profesor, seleccionar una longitud de onda 20 nm por debajo del lmite inferior del intervalo correspondiente. - "Hacer el blanco" para dicha longitud de onda. Es decir, toma una de las cubetas y, tras llenarla con agua destilada (es el blanco para este caso particular), sitala en el portacubetas del espectrofotmetro y ajusta la lectura al cero de Absorbancia. - A continuacin llena la otra cubeta con la disolucin previamente preparada, sitala en el portacubetas y espera unos segundos hasta que la lectura de absorbancia se estabilice. Anota el valor de absorbancia obtenido para esta longitud de onda. - Selecciona en el espectrofotmetro una longitud de onda 10 nm superior a la anterior y repite el proceso anteriormente descrito. - Repite de nuevo todo el proceso hasta alcanzar una longitud de onda 20 nm por encima del lmite superior del intervalo de longitudes de onda correspondiente al espectro de absorcin del MnO4-. C. Sobre un papel milimetrado representa el espectro de absorcin del KMnO 4 en la forma A vs. . Selecciona la longitud de onda correspondiente al mximo de absorbancia. Dicha longitud de onda ser la utilizada en el anlisis cuantitativo del MnO4-. 4. 2.- Preparacin de la recta de calibrado A. En un matraz aforado de 100 ml, preparar una disolucin de KMnO 4 0,01 M. Para ello, toma una cantidad de la disolucin de KMnO 4 0,1M en un vaso de precipitado y pipetea el volumen necesario. Virtelo en el matraz aforado de 100 ml y enrasa hasta la marca con agua destilada. B. A partir de esta disolucin de KMnO 4 0,01M, prepara, utilizando los matraces aforados de 25 ml, y siguiendo el mismo procedimiento experimental, tres disoluciones patrn de KMnO4 de concentraciones 2 x 10-5 M, 6 x 10-5 M y 1 x 10-4 M. 4. 3.- Medicin de los patrones y obtencin de la curva de calibrado A. Siguiendo el procedimiento ya conocido, medir la absorbancia de cada una de las 2-4
disoluciones patrn a la longitud de onda seleccionada. Recordar que antes de la medicin de cada patrn debe hacerse el blanco. La medicin de la absorbancia de los tres patrones debe realizarse en orden creciente de concentraciones y utilizando una misma cubeta. Para ello, despus de cada medida: - Desechar la disolucin patrn ya medida - Limpiar la cubeta con agua destilada varias veces - Limpiar la cubeta con la nueva disolucin patrn una vez - Llenar la cubeta con la nueva disolucin patrn y medir B. Con las absorbancias anotadas para cada una de las disoluciones patrn, representar grficamente, en un papel milimetrado, la curva de calibrado en la forma: A vs. c C. Mediante un ajuste de regresin por mnimos cuadrados, calcular la ecuacin de la recta obtenida. 4. 4.- Medicin de la muestra problema A. Siguiendo el procedimiento conocido, medir la absorbancia de la muestra problema. B. Calcular la concentracin de dicha muestra mediante dos mtodos: - Grficamente, mediante interpolacin del valor de absorbancia obtenido - Matemticamente, mediante la utilizacin de la ecuacin de la recta de calibrado
5.- RESULTADOS EXPERIMENTALES - Longitud de onda seleccionada: - Ecuacin de la recta de calibrado: - Concentracin de MnO 4- en la muestra problema: a. Grficamente: b. Matemticamente: M M nm
2-5
You might also like
- Determinación de Cu por absorción atómicaDocument18 pagesDeterminación de Cu por absorción atómicaAbel PachecoNo ratings yet
- Medidores 2 OUA Ciclo 21A 38452 I3305 D01Document13 pagesMedidores 2 OUA Ciclo 21A 38452 I3305 D01Emma CastellanosNo ratings yet
- Ejercicios de Volumetria Por NeutralizacionDocument2 pagesEjercicios de Volumetria Por NeutralizacionKatty Rojas DiazNo ratings yet
- Unidad I Cinetica y Reactores QuimicosDocument17 pagesUnidad I Cinetica y Reactores QuimicosJosé Juan RamírezNo ratings yet
- Absorciometria CorregidoDocument13 pagesAbsorciometria CorregidoMaximiliano MederoNo ratings yet
- DeLunaElvira Post5 TermoV11Document5 pagesDeLunaElvira Post5 TermoV11menaNo ratings yet
- Cromatograma: Parámetros y PartesDocument47 pagesCromatograma: Parámetros y PartesJulian BarreraNo ratings yet
- Obtención FG análisis gravimétricoDocument4 pagesObtención FG análisis gravimétricoharyNo ratings yet
- Características Biofísicas y Bioquímicas de Proteínas Terapéuticas - RodriguezMoyaDocument4 pagesCaracterísticas Biofísicas y Bioquímicas de Proteínas Terapéuticas - RodriguezMoyaVIVIANA PAOLA RODRIGUEZ MOYANo ratings yet
- Lab 8Document11 pagesLab 8Santiago Bonilla VelasquezNo ratings yet
- Soluciones RealesDocument21 pagesSoluciones RealesFer CusimanoNo ratings yet
- Ejercicios PotenciometriaDocument13 pagesEjercicios Potenciometriaraul enrique valdeiglesias abarca100% (1)
- Primer Parcial QMC 1400Document1 pagePrimer Parcial QMC 1400Harold Cesar Gabriel HerreraNo ratings yet
- Deber de InfrarrojoDocument3 pagesDeber de InfrarrojoKathy Darquea100% (1)
- Curva de Calibración Por Standar Interno: Dr. Arturo Mallea AnglesDocument4 pagesCurva de Calibración Por Standar Interno: Dr. Arturo Mallea AnglesCAROLINA MAMANI MAYTANo ratings yet
- Sistemas de Cultivo CelularDocument38 pagesSistemas de Cultivo CelularGeorgia Maria González MezaNo ratings yet
- Rango Lineal de Una Curva de Calibración PDFDocument8 pagesRango Lineal de Una Curva de Calibración PDFMarcela Ramos IglesiasNo ratings yet
- Pruebas Colorimétricas para AnfetaminasDocument3 pagesPruebas Colorimétricas para AnfetaminasMonika OlguinNo ratings yet
- Ejer Cici OsDocument5 pagesEjer Cici OsJerry Zapana JimemezNo ratings yet
- Factor Gravimétrico: Relación Masa Comp Buscado/PesadoDocument4 pagesFactor Gravimétrico: Relación Masa Comp Buscado/PesadoMarco Antonio Ordinola SandovalNo ratings yet
- Taller - Prop. - Coligativas - y - PH SoluDocument3 pagesTaller - Prop. - Coligativas - y - PH Soluaber0523No ratings yet
- Determinación de fósforo por espectrofotometría (≤40Document7 pagesDeterminación de fósforo por espectrofotometría (≤40Juan David López QuinteroNo ratings yet
- Reporte #4 - Análisis VolumétricoDocument7 pagesReporte #4 - Análisis VolumétricoRaoulHernndezBonllaNo ratings yet
- Volumetria de PrecipitaciomDocument27 pagesVolumetria de PrecipitaciomedelNo ratings yet
- Farma 1 Practica 8Document6 pagesFarma 1 Practica 8Roxana HernandezNo ratings yet
- Cuestionario U3Document3 pagesCuestionario U3Karla A. RodríguezNo ratings yet
- Informe de RefractometríaDocument5 pagesInforme de Refractometríajuli sanchezNo ratings yet
- Purificación proteínas espinacaDocument6 pagesPurificación proteínas espinacaDaniela Ramirez MartinezNo ratings yet
- C.G. PlatosDocument13 pagesC.G. PlatosKartel KalientitoxNo ratings yet
- ANALISIS QUIMICO INSTRUMENTALDocument6 pagesANALISIS QUIMICO INSTRUMENTALTayna Rqp100% (2)
- CURVAS DE CALIBRACIÓN DEL ANARANJADO DE METILO Y VERDE DE BROMOCRESOL Práctica 13Document2 pagesCURVAS DE CALIBRACIÓN DEL ANARANJADO DE METILO Y VERDE DE BROMOCRESOL Práctica 13Pamela Ponce MoralesNo ratings yet
- Problemas3ab Ib2Document4 pagesProblemas3ab Ib2chinis93No ratings yet
- Cultivo batch alimentado: cálculos de diseño y operaciónDocument19 pagesCultivo batch alimentado: cálculos de diseño y operaciónJuan Carlos Sasintuña0% (1)
- El Punto IsoeléctricoDocument9 pagesEl Punto IsoeléctricoDainer SalgadoNo ratings yet
- 1.1 Metodos Clasicos e InstrumentalDocument15 pages1.1 Metodos Clasicos e InstrumentalSamael GonzalezNo ratings yet
- InstrumentalDocument2 pagesInstrumentalGilbert GómezNo ratings yet
- Práctica 1 Calor Diferencial de SoluciónDocument7 pagesPráctica 1 Calor Diferencial de SoluciónDaniel Ortiz LealNo ratings yet
- Boletin 5Document4 pagesBoletin 5Ruben Fernandez100% (1)
- EQF Practica2Document5 pagesEQF Practica2JP López FraireNo ratings yet
- Uv Vis InformeDocument6 pagesUv Vis InformeJavier QuirogaNo ratings yet
- Titulacion de AminoacidosDocument8 pagesTitulacion de AminoacidosCharly Gonzalez100% (1)
- Semana 3 Transmisión de Calor - ProblemasDocument21 pagesSemana 3 Transmisión de Calor - Problemaskaren ramosNo ratings yet
- Reconocimiento de equipos de bioseparación UPIIGDocument32 pagesReconocimiento de equipos de bioseparación UPIIGLuisa NavarroNo ratings yet
- Determinación de formaldehido en viruta de madera por espectroscopia UVDocument1 pageDeterminación de formaldehido en viruta de madera por espectroscopia UVKelly XiomiNo ratings yet
- Cuestionario 1 FQIIDocument4 pagesCuestionario 1 FQIIBryan BautistaNo ratings yet
- 3BV1 2021-01 MC E8 Problemario3Document4 pages3BV1 2021-01 MC E8 Problemario3Aislin IxchelNo ratings yet
- Serie de ProblemasCromatografíaDocument3 pagesSerie de ProblemasCromatografíaDavid Nieves CamañoNo ratings yet
- Difusividad y el número de SchmidtDocument8 pagesDifusividad y el número de Schmidtdavid pizzanoNo ratings yet
- TALLER DE TITULACIONES ÁCIDO-BASE CON CÁLCULO DE CONCENTRACIONESDocument3 pagesTALLER DE TITULACIONES ÁCIDO-BASE CON CÁLCULO DE CONCENTRACIONESJaider FlórezNo ratings yet
- Análisis de plata y berilio mediante absorción atómica y fluorometríaDocument2 pagesAnálisis de plata y berilio mediante absorción atómica y fluorometríaNatasha VargasNo ratings yet
- Puntos de fusión y ebulliciónDocument10 pagesPuntos de fusión y ebulliciónDiego Armando Frias VazquezNo ratings yet
- PreguntaDocument4 pagesPreguntaAndrea JimenezNo ratings yet
- Ejercicios Espectrofotometria 2012Document2 pagesEjercicios Espectrofotometria 2012Rosa RosaeNo ratings yet
- Informe-Grupos - SanguíneosDocument13 pagesInforme-Grupos - SanguíneosJessicaElizabethVillafuerteNo ratings yet
- Guia RedoxDocument3 pagesGuia RedoxMatii VegaNo ratings yet
- 3BM2 MC Ejp P12Document6 pages3BM2 MC Ejp P12Diego CarreonNo ratings yet
- OBJETIVOS Azul de MitilenoDocument11 pagesOBJETIVOS Azul de MitilenoMas Diana100% (1)
- Análisis cuantitativo K2Cr2O7 espectrofotometríaDocument6 pagesAnálisis cuantitativo K2Cr2O7 espectrofotometríaChiitoBolaNo ratings yet
- Práctica 4. Curva de Calibración Azul de MetilenoDocument8 pagesPráctica 4. Curva de Calibración Azul de MetilenoAndres Bohorquez75% (4)
- COLORIMETRÍADocument6 pagesCOLORIMETRÍAJuan Manuel Bárcenas LeyvaNo ratings yet
- Boletín Parametros AguaDocument6 pagesBoletín Parametros AguaEduardo Camarena SullcaNo ratings yet
- Poe PDFDocument16 pagesPoe PDFEduardo Camarena SullcaNo ratings yet
- Evaluación de Riesgo Psicosocial PDFDocument2 pagesEvaluación de Riesgo Psicosocial PDFEduardo Camarena SullcaNo ratings yet
- Validación métodos calibraciónDocument6 pagesValidación métodos calibraciónAngélica Ramos LopezNo ratings yet
- Incertidumbre Método K Sub CeroDocument8 pagesIncertidumbre Método K Sub CeroEduardo Camarena SullcaNo ratings yet
- Directrices validación medidas control inocuidad alimentosDocument16 pagesDirectrices validación medidas control inocuidad alimentosAndres Mauricio Salgado LopezNo ratings yet
- Rne SencicoDocument439 pagesRne Sencicoblpoficina89% (9)
- Análisis de riesgos en laboratorio de ensayos universitarioDocument1 pageAnálisis de riesgos en laboratorio de ensayos universitarioEduardo Camarena SullcaNo ratings yet
- Diseño de Planta Procesadora de LacteosDocument6 pagesDiseño de Planta Procesadora de LacteosFranklinCiezaCaruajulcaNo ratings yet
- Validación y acciones correctivasDocument28 pagesValidación y acciones correctivasEduardo Camarena SullcaNo ratings yet
- Ejecucion de La Auditoria VM (Presentacion)Document23 pagesEjecucion de La Auditoria VM (Presentacion)Jose Alfredo Lupaca GarciaNo ratings yet
- Cuantificación de La Incertidumbre en Medidas AnalíticasDocument144 pagesCuantificación de La Incertidumbre en Medidas AnalíticasImmer100% (1)
- Report e Alum No Program Ac I OnDocument7 pagesReport e Alum No Program Ac I Onceloma4No ratings yet
- GUÍA Validacion e IncertidumbreDocument10 pagesGUÍA Validacion e IncertidumbreAnonymous pj7XzRJNo ratings yet
- Incertidumbre de Una MedicionDocument11 pagesIncertidumbre de Una MedicionDanny TCNo ratings yet
- La Ecoinnovación Cruza FonterasDocument31 pagesLa Ecoinnovación Cruza FonterasEduardo Camarena SullcaNo ratings yet
- Estimación de La Incertidumbre en Las MedicionesDocument89 pagesEstimación de La Incertidumbre en Las MedicionesEduardo Camarena SullcaNo ratings yet
- Centros Médicos PDFDocument17 pagesCentros Médicos PDFEduardo Camarena SullcaNo ratings yet
- Formato - Ficha de Procedimiento - Versión 2Document1 pageFormato - Ficha de Procedimiento - Versión 2Eduardo Camarena SullcaNo ratings yet
- Centros Médicos PDFDocument17 pagesCentros Médicos PDFEduardo Camarena SullcaNo ratings yet
- Los-Animales para Unir PDFDocument37 pagesLos-Animales para Unir PDFEduardo Camarena SullcaNo ratings yet
- 2.2. La Evaluación Del Impacto AmbientalDocument5 pages2.2. La Evaluación Del Impacto AmbientalHeydi AguilarNo ratings yet
- Fichas de Procedimientos - ComunicaciónDocument3 pagesFichas de Procedimientos - ComunicaciónEduardo Camarena SullcaNo ratings yet
- Deducción Ec. Hagen-PousielleDocument8 pagesDeducción Ec. Hagen-PousielleLiliam Teresita Manrique DelgadoNo ratings yet
- Aportes de La Normalización A La Gestión AmbientalDocument25 pagesAportes de La Normalización A La Gestión AmbientalEduardo Camarena SullcaNo ratings yet
- Ing Mines Nantes EsDocument1 pageIng Mines Nantes EsEduardo Camarena SullcaNo ratings yet
- Automatización de ProcesosDocument41 pagesAutomatización de ProcesosEduardo Camarena SullcaNo ratings yet
- 7-Huella-de-Carbono-y normativa-ISO-14006-sobre-Ecodiseño-BUREAU-VERITAS PDFDocument23 pages7-Huella-de-Carbono-y normativa-ISO-14006-sobre-Ecodiseño-BUREAU-VERITAS PDFEduardo Camarena SullcaNo ratings yet
- Metrologia para No Metro LogosDocument146 pagesMetrologia para No Metro Logosjljimenez196995% (20)
- Dirigida 04Document12 pagesDirigida 04Milton César Ochoa MogollónNo ratings yet
- Actividad - 1 Corte Septiembre 24 de 2018-Ingenieria Civil DistanciaDocument24 pagesActividad - 1 Corte Septiembre 24 de 2018-Ingenieria Civil DistanciaEMERSON AMADO LEONNo ratings yet
- CYPEDocument23 pagesCYPEAntonio Rodriguez ZambranoNo ratings yet
- Conceptos Relacionados CentroideDocument3 pagesConceptos Relacionados CentroidewalterNo ratings yet
- GeologíaDocument11 pagesGeologíaFreddy CardozeNo ratings yet
- Practica #1 - Curso EesDocument4 pagesPractica #1 - Curso EesJuan Jonel Canales SotoNo ratings yet
- 136-2015-01-27-Experimento de Young PDFDocument6 pages136-2015-01-27-Experimento de Young PDFVictor Joel Pacori PaucarNo ratings yet
- Mecanica de Fluidos EjerciciosDocument414 pagesMecanica de Fluidos Ejerciciosalex100% (1)
- PP1 Barragan JeannDocument4 pagesPP1 Barragan JeannJean Carlos Barragan VillaNo ratings yet
- Guia Como Hacer Un Molino de Viento VelozDocument9 pagesGuia Como Hacer Un Molino de Viento VelozPaul Loaiza0% (1)
- Jlfihuqwgwbiraep: Diego Ramon Arcia HernandezDocument2 pagesJlfihuqwgwbiraep: Diego Ramon Arcia HernandezJ̶ S̶t̶i̶c̶k̶ ̶h̶e̶r̶r̶e̶r̶a̶ ̶m̶a̶n̶r̶i̶q̶u̶e̶No ratings yet
- Practica de La CoordinadoraDocument9 pagesPractica de La CoordinadoraAXALONSONo ratings yet
- Martín Buber: Yo y Tú: Traducción de Horacio Crespo. Ed. Nueva Visión, Buenos Aires, 1969Document9 pagesMartín Buber: Yo y Tú: Traducción de Horacio Crespo. Ed. Nueva Visión, Buenos Aires, 1969Anonymous I78Rzn6rSNo ratings yet
- Informe topográfico de terreno en Valle OlmosDocument18 pagesInforme topográfico de terreno en Valle OlmosDreitaMonzonNo ratings yet
- Un1 Taller1Document2 pagesUn1 Taller1Moisés BarriosNo ratings yet
- Cuadernillo 5 Fenomenos Electromagneticos en Un Motor Electrico 2Document6 pagesCuadernillo 5 Fenomenos Electromagneticos en Un Motor Electrico 2jhonatan torres martinezNo ratings yet
- Funciones básicas y transformaciones matemáticasDocument12 pagesFunciones básicas y transformaciones matemáticasVickyAyusoNo ratings yet
- PAA Prueba PracticaDocument48 pagesPAA Prueba PracticaLucia Fuentes0% (1)
- Guia Estudio ETS F1 PDFDocument40 pagesGuia Estudio ETS F1 PDFjavier carrascoNo ratings yet
- Psicofisiología siglo XIX: 9 hallazgos claveDocument2 pagesPsicofisiología siglo XIX: 9 hallazgos claveAndrés Díaz MataNo ratings yet
- Reflexión de la luz: concepto, leyes y tiposDocument9 pagesReflexión de la luz: concepto, leyes y tiposCatalina Katai Catadora AriasNo ratings yet
- Automatización Sistema de Bombeo de AguaDocument71 pagesAutomatización Sistema de Bombeo de AguaEduvigues SerrudoNo ratings yet
- Escala FIM evalua independencia tras lesión medularDocument4 pagesEscala FIM evalua independencia tras lesión medularManuel Cuevas EspinozaNo ratings yet
- Principios inmediatosDocument14 pagesPrincipios inmediatosEstefanía Carvajal OrtízNo ratings yet
- Taller # 2 Fundamentacion MatemáticaDocument2 pagesTaller # 2 Fundamentacion MatemáticaOscar Xavier OviedoNo ratings yet
- Magia de RedenciónDocument140 pagesMagia de RedenciónJonathan AlcántarNo ratings yet
- Informe .. Sistemas MecánicosDocument23 pagesInforme .. Sistemas MecánicosAlex DanielNo ratings yet
- 2008 07 07 Mat SepDocument11 pages2008 07 07 Mat Sepjuan gomez del angelNo ratings yet
- Los Cuasicristales INFORMEDocument18 pagesLos Cuasicristales INFORMEyesNo ratings yet