Professional Documents
Culture Documents
Mengukur Titik Didih Larutan
Uploaded by
Muhammad IkhlasCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Mengukur Titik Didih Larutan
Uploaded by
Muhammad IkhlasCopyright:
Available Formats
LAPORAN PRAKTIKUM KIMIA
MENGUKUR TITIK DIDIH LARUTAN
Disusun oleh : 1. Arthur Beiser Akbar 2. Muhammad Ikhlas 3. Rahmat Raharjo 4. Retno Wulandari 5. Sulaeha Kelas : XII IA2
DINAS PENDIDIKAN KEBUDAYAN PEMUDA DAN OLAHRAGA
SMA NEGERI 2 KABUPATEN TEBO
TAHUN AJARAN 2013/2014
MENGUKUR TITIK DIDIH LARUTAN A. Tujuan Mengukur titik didih larutan serta faktor-faktor yang mempengaruhinya. B. Landasan Teori Titik didih suatu zat adalah suhu yang tekanan uap jenuhnya sama dengan tekanan di atas permukaan zat cair. Bila tekanan uap sama dengan tekanan luar atau tekanan diatas permukaan zat cair , mulai terbentuk gelembung-gelembung uap dalam cairan. Karena tekanan uap dalam gelembung sama dengan tekanan udara, maka gelembung itu dapat mendorong diri lewat permukaan dan bergerak ke fasa gas diatas cairan, sehingga cairan tersebut mendidih. Titik didih suatu zat cair dipengaruhi oleh tekanan udara, artinya makin besar tekanan udara makin besar pulatitik didih zat cair tersebut , begitu juga sebaliknya semakin rendah tekanan udara , maka semakin rendah titik didih. Pada tekanan dan temperatur udara standar (76 cmHg, 25C) titik didih air sebesar 100C. Selain itu, titik didih juga dapat diartikan temperatur dimana tekanan uap sama dengan tekanan atmosfer. Selama gelembung terbentuk dalam cairan, berarti selama cairan mendidih, tekanan uap sama dengan tekanan atmosfer, karena tekanan uap adalah konstan maka suhu dan cairan yang mendidih akan tetap sama. Penambahan kecepatan panas yang diberikan pada cairan yang mendidih hanya menyebabkan terbentuknya gelembung uap air lebih cepat. Cairan akan lebih cepat mendidih, tapi suhu didih tidak naik. Jelas bahwa titik didih cairan tergantung dari besarnya tekanan atmosfer. Titik didih merupakan satu sifat lagi yang dapat digunakan untuk memperkirakan secara tak langsung berapa kuatnya gaya tarik antara molekul dalam cairan. Cairan yang gaya tarik antar molekulnya kuat, titik didihnya tinggi dan sebaliknya bila gaya tarik lemah, titik didihnya rendah.
Pendidihan merupakan hal yang sangat khusus dari penguapan. Pendidihan adalah pelepasan cairan dari tempat terbuka ke fase uap. Suatu cairan dikatakan mendidih pada titik didihnya, yaitu bila suhu dimana tekanan uap cairan sama dengan tekanan atmosfer sekitarnya. Pada titik didih, tekanan uap cairan cukup besar sehingga atmosfer dapat diatasi hingga gelembung uap dapat terbentuk dipermukaan cairan yang diikuti penguapan yang terjadi di setiap titik dalam cairan. Pada umumnya, molekul dapat menguap bila dua persyaratan dipenuhi, yaitu molekul harus cukup tenaga kinetik dan harus cukup dekat dengan batas antara cairan-uap. Bila dalam larutan biner, komponen suatu mudah menguap (volatile) dan komponen lain sukar menguap (non volatile), makin rendah. Dengan adanya zat terlarut tekanan uap pelarut akan berkurang dan ini mengakibatkan kenaikan titik didih, penurunan titik beku dan tekanan uap osmose. Keempat sifat ini hanya ditentukan oleh banyaknya zat terlarut dan tidak ditentukan oleh jenis zat terlarut. Seperti telah disebutkan, sifat-sifat ini disebut sifat koligatif larutan. Adanya zat terlarut (solute) yang sukar menguap (non volatile), tekanan uap dari larutan turun dan ini akan menyebabkan titik didih larutan lebih tinggi dari pada titik didih pelarutnya. Ini disebabkan karena untuk mendidih, tekanan uap larutan sama dengan tekanan udara dan untuk temperatur harus lebih tinggi. C. Alat dan Bahan Alat Gelas Kimia Kasa penyepit Tabung reaksi Bunsen Batang statif Termometer Penyepit tabung Kaki tiga Bahan Larutan Urea (1 molal) Larutan Urea (2 molal) Larutan NaCl (1 molal) Larutan NaCl (2 molal) Air Garam
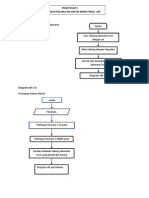
D. Cara Kerja Rangkailah alat. Masukan air 175 ml, tambahkan garam 3 sendok sampai melebihi suhu 112 C, jika belum sampai pada suhu tersebut, kemudian garamnya habis, maka tambahkan garam sampai suhunya melebihi 112 C. Kemudian matikan Bunsen. Masukkan air ke dalam tabung reaksi ruas anak jari, kemudian ukur suhunya menggunakan termoteter air raksa. Kemudian rangkai kembali alat. Hidupkan bunsen. Catat suhunya dalam rentang waktu 10 detik, sampai mendidih (konstan / tidak bergerak). Matikan bunsen, ganti air yang berada dalam tabung reaksi dengan larutan Urea 2 mol, Urea 1 mol, NaCl 2 mol, NaCl 1mol, mengikuti cara sebelumnya.
E. Hasil Pengamatan Waktu (s) 0 10 20 30 40 50 60 70 80 90 100 Air 27 C 68 C 80 C 87 C 95 C 100 C 101 C Urea 2 mol 30 C 50 C 63 C 78 C 89 C 98 C 101 C 102 C Suhu Larutan Urea 1 mol 31 C 60 C 72 C 82 C 87 C 94 C 98 C 99 C 100 C NaCl 2 mol 33 C 48 C 68 C 83 C 92 C 98 C 100 C 101 C 102 C NaCl 1 mol 32 C 55 C 72 C 80 C 92 C 98 C 100 C 101 C
F. Pertanyaan 1. Jelaskan pengaruh kemolalan larutan terhadap titik didih a) Larutan Urea b) Larutan NaCl Jawab : a) Pengaruhnya adalah semakin besar molalitas urea, titik didih larutan akan semakin tinggi dan kenaikkan titik didih larutan pun semakin besar. b) Pengaruhnya adalah Semakin besar molalitas NaCl, titik didih larutan akan semakin tinggi, dan kenaikkan titik didih larutan pun akan semakin besar. 2. Untuk molaritas yang sama, jelaskan pengaruh NaCl dibandingkan dengan Urea! Jawab : Titik didih larutan NaCl lebih tinggi dari larutan urea. Begitu juga dengan kenaikkan titik didih larutan, kenaikkan titik didih larutan NaCl lebih besar daripada kenaikkan titik didih larutan urea, karena NaCl merupakan larutan elektrolit yang mempunyai energy ionisasi (derajat ionisasi) yang menyebabkan nilai kenaikkan titik didih larutan semakin besar jika dibandingkan dengan larutan urea yang merupakan larutan non elektrolit yang memiliki derajat ionisasi. Hal ini sesuai dengan hokum Vant Hoff. 3. Apa fungsi penambahan garam pada air? Jawab : Fungsi penambahan garam pada air adalah untuk membantu menaikkan titik didih air tersebut dimana jikalau tanpa garam suhu air hanya bisa mencapai suhu maksimal (100 C) sedangkan dalam praktikum ini dibutuhkan suhu 112 C, dan juga berfungsi untuk mempercepat mendidihnya air tersebut.
G. Kesimpulan 1. Titik didih suatu zat adalah suhu yang tekanan uap jenuhnya sama dengan tekanan di atas permukaan zat cair. Bila tekanan uap sama dengan tekanan luar atau tekanan diatas permukaan zat cair , mulai terbentuk gelembung-gelembung uap dalam cairan. 2. Pengaruh kemolalan larutan Urea terhadap titik didih adalah semakin besar molalitas urea, titik didih larutan akan semakin tinggi dan kenaikkan titik didih larutan pun semakin besar. 3. Pengaruh kemolalan larutan NaCl terhadap titik didih adalah semakin besar molalitas NaCl, titik didih larutan akan semakin tinggi, dan kenaikkan titik didih larutan pun akan semakin besar. 4. Titik didih larutan NaCl lebih tinggi dari larutan urea. Begitu juga dengan kenaikkan titik didih larutan, kenaikkan titik didih larutan NaCl lebih besar daripada kenaikkan titik didih larutan urea, karena NaCl merupakan larutan elektrolit yang mempunyai energy ionisasi (derajat ionisasi) yang menyebabkan nilai kenaikkan titik didih larutan semakin besar jika dibandingkan dengan larutan urea yang merupakan larutan non elektrolit yang memiliki derajat ionisasi. Hal ini sesuai dengan hokum Vant Hoff. 5. Fungsi penambahan garam pada air adalah untuk membantu menaikkan titik didih air tersebut dimana jikalau tanpa garam suhu air hanya bisa mencapai suhu maksimal (100 C) sedangkan dalam praktikum ini dibutuhkan suhu 112 C, dan juga berfungsi untuk mempercepat mendidihnya air tersebut.
H. Daftar Pustaka http://www-supadi.blogspot.com/2012/06/pengaruh-penambahangaram-pada-es.html http://hatopikchem.wordpress.com/pbm-kimia/kenaikan-titik-didih%E2%88%86tb-dan-penurunan-titik-beku-%E2%88%86tf-larutan-contohsoal-praktikum/ http://id.answers.yahoo.com/question/index?qid=20111125150845AAYF dUU http://wulanthestarshine.wordpress.com/2011/02/17/praktikumkenaikan-titik-didih/ http://iney-mirayana.blogspot.com/
You might also like
- Penentuan Titik DidihDocument10 pagesPenentuan Titik DidihIin Buyundwi71% (7)
- Ebook Sukses Mendidik AnakDocument47 pagesEbook Sukses Mendidik AnakDedi Pramono100% (1)
- Electric FieldDocument41 pagesElectric FieldMuhammad Ikhlas100% (2)
- Alkena dan Alkuna: Ikatan Rangkap dan TatanamaDocument23 pagesAlkena dan Alkuna: Ikatan Rangkap dan TatanamaIbrahim DoteraNo ratings yet
- PENURUNAN TITIK BEKU LARUTANDocument10 pagesPENURUNAN TITIK BEKU LARUTANDuvi Ahmad Duvi DekanNo ratings yet
- SIFAT KOLIGATIF LARUTANDocument28 pagesSIFAT KOLIGATIF LARUTANMochammadKhoirulHuda100% (1)
- Kelarutan Dan KSPDocument15 pagesKelarutan Dan KSPMelati sukmaNo ratings yet
- Materi Percepatan GravitasiDocument13 pagesMateri Percepatan GravitasiSafira DamayantiNo ratings yet
- Laporan Praktikum Kimia RedoksDocument18 pagesLaporan Praktikum Kimia RedoksSeija WijayaNo ratings yet
- Laporan Vitamin C Kel.6Document22 pagesLaporan Vitamin C Kel.6Muhammad MahendraNo ratings yet
- Abstrak KoligatifDocument2 pagesAbstrak KoligatifSofi AmaliaNo ratings yet
- REDOKS DAN ELEKTROKIMIADocument56 pagesREDOKS DAN ELEKTROKIMIASaputra RaharjaNo ratings yet
- LAPRAK PENENTUAN PH LARUTANDocument11 pagesLAPRAK PENENTUAN PH LARUTANNanda RazifNo ratings yet
- Makalah Kimia Fisika Sifat Koligatif Dan LarutanDocument30 pagesMakalah Kimia Fisika Sifat Koligatif Dan LarutanBagas Pratama II75% (4)
- Perubahan Fasa ZatDocument3 pagesPerubahan Fasa ZatBiruNo ratings yet
- LAPORAN KIMIADocument4 pagesLAPORAN KIMIAFarhan RamadhandyNo ratings yet
- LARUTAN KIMIADocument23 pagesLARUTAN KIMIAshff. slshaxzNo ratings yet
- TyndallDocument3 pagesTyndallGita Ayu100% (1)
- Uji Warna LogamDocument18 pagesUji Warna LogamFriska Monalisa0% (1)
- ACARA IV Volume MolarDocument9 pagesACARA IV Volume MolarlinNo ratings yet
- Materi 5 Pelapisan Pada LogamDocument21 pagesMateri 5 Pelapisan Pada LogamZa'im F.R.No ratings yet
- Laporan Praktikum Kimia Analitik 1Document34 pagesLaporan Praktikum Kimia Analitik 1Khalisa Nisrina RayhanNo ratings yet
- Aturan Bilangan OksidasiDocument1 pageAturan Bilangan Oksidasirohman mtkNo ratings yet
- Bab 1,2,3,4,5Document13 pagesBab 1,2,3,4,5Harry P. AgyNo ratings yet
- Diagram Fasa AirDocument5 pagesDiagram Fasa AirTaufik AfandiNo ratings yet
- Penurunan Titik Beku LarutanDocument4 pagesPenurunan Titik Beku LarutanArif YuniartoNo ratings yet
- Istilah Dan Defenisi Dalam PengukuranDocument6 pagesIstilah Dan Defenisi Dalam PengukuranIccang Sibali0% (1)
- Pada Praktikum Penetapan Khlorida Sebagai Perak Klorida Dengan Tujuan Untuk Mengetahui Kadar CL Di Dalam AgClDocument4 pagesPada Praktikum Penetapan Khlorida Sebagai Perak Klorida Dengan Tujuan Untuk Mengetahui Kadar CL Di Dalam AgClChandra WijayaNo ratings yet
- Revisi Diagram Alir Exp.1Document5 pagesRevisi Diagram Alir Exp.1Agnes IkawatiNo ratings yet
- AZAS LE CHATELIERDocument8 pagesAZAS LE CHATELIERSanti Delina100% (1)
- LAPORAN KIMIA ORGANIKDocument13 pagesLAPORAN KIMIA ORGANIKNadia NadiaNo ratings yet
- Fraksi MolDocument12 pagesFraksi MolHardy Young HostelNo ratings yet
- Penurunan Tekanan Uap LarutanDocument7 pagesPenurunan Tekanan Uap LarutanSyukmaidi RasyidinNo ratings yet
- Pengenalan AlatDocument14 pagesPengenalan AlatGhina KhoerunisaNo ratings yet
- Laporan NitrogenDocument9 pagesLaporan NitrogenMuhammad IrvanNo ratings yet
- OPTIMASI LARUTANDocument12 pagesOPTIMASI LARUTANWidiya ApriliantyNo ratings yet
- Analisis Ion Penganggu Dan Kation Golongan III: Dwi Ariani, S.PD., M.SCDocument16 pagesAnalisis Ion Penganggu Dan Kation Golongan III: Dwi Ariani, S.PD., M.SCNovia MaharaniNo ratings yet
- Jenis SpektrofotometriDocument3 pagesJenis SpektrofotometriHokkieds channelNo ratings yet
- Acara I Pemisahan Dan PemurnianDocument10 pagesAcara I Pemisahan Dan PemurnianNurul QamriNo ratings yet
- KATION GOLONGAN I DAN IIDocument7 pagesKATION GOLONGAN I DAN IIFriti AuliaNo ratings yet
- TITIK BEKU DAN TITIK DIDIHDocument9 pagesTITIK BEKU DAN TITIK DIDIHArdian SuhendraNo ratings yet
- Sifat Fisik Benzena dan TurunannyaDocument1 pageSifat Fisik Benzena dan TurunannyaAyu TNo ratings yet
- PENENTUAN MRDocument20 pagesPENENTUAN MRMuh Alkadri SalamNo ratings yet
- ElektronegativitasDocument4 pagesElektronegativitasAnah ZeeNo ratings yet
- Pertanyaan Dan Jawaban Kelompok 3Document6 pagesPertanyaan Dan Jawaban Kelompok 3Kim ChochoNo ratings yet
- Isoterm, Isobar, Isometric Gas IdealDocument13 pagesIsoterm, Isobar, Isometric Gas IdealKevinNo ratings yet
- Chaliq Farhan StoikiometriDocument11 pagesChaliq Farhan StoikiometriChaliq FNo ratings yet
- Pengaruh Faktor Van Hoff Terhadap Sifat Koligatif LarutanDocument3 pagesPengaruh Faktor Van Hoff Terhadap Sifat Koligatif LarutanRenky Adi SaputraNo ratings yet
- Zat CairDocument18 pagesZat CairolongkodokNo ratings yet
- (Laporan) Sifat Koligatif LarutanDocument5 pages(Laporan) Sifat Koligatif LarutanWidya Nur RamadhaniNo ratings yet
- Makalah Golongan 11 PDFDocument12 pagesMakalah Golongan 11 PDFThimNo ratings yet
- Resume Jurnal Minyak JarakDocument4 pagesResume Jurnal Minyak JarakAriantama DjatisulistyoNo ratings yet
- Laporan Praktikum Kesetimbangan KimiaDocument6 pagesLaporan Praktikum Kesetimbangan KimiaGuna TugasNo ratings yet
- Laporan Praktikum Sifat Koligatif LarutanDocument15 pagesLaporan Praktikum Sifat Koligatif LarutanSri ArgariniNo ratings yet
- Kelarutan Dua Cairan Bercampur SebagianDocument21 pagesKelarutan Dua Cairan Bercampur SebagianAnisah RachmawatiNo ratings yet
- Titik Didih KonsepDocument8 pagesTitik Didih KonseparyaNo ratings yet
- SP Pertemuan 3 (Dinamika) P 2019Document18 pagesSP Pertemuan 3 (Dinamika) P 2019agi dahtiarNo ratings yet
- Jenis Titrasi Asam BasaDocument5 pagesJenis Titrasi Asam BasaWilson WinarnoNo ratings yet
- Kimia Dasar Kel 2 Bangunan Atom A Hubungan BerkalaDocument24 pagesKimia Dasar Kel 2 Bangunan Atom A Hubungan Berkalalisa andriani100% (1)
- Tugas 11 Siklus CarnotDocument11 pagesTugas 11 Siklus CarnotDenil SonNo ratings yet
- LAP KIMIA DASAR IIDocument13 pagesLAP KIMIA DASAR IIcharin PartikasariNo ratings yet
- Laporan Kegiatan OsnDocument2 pagesLaporan Kegiatan OsnMuhammad IkhlasNo ratings yet
- Gerak ParabolaDocument8 pagesGerak ParabolaMuhammad IkhlasNo ratings yet
- RANCANGAN PENELITIAN NARASI DAN ETNOGRAFIDocument34 pagesRANCANGAN PENELITIAN NARASI DAN ETNOGRAFIMuhammad IkhlasNo ratings yet
- RPP Gerak MelingkarDocument14 pagesRPP Gerak MelingkarMuhammad IkhlasNo ratings yet
- FISIKADocument21 pagesFISIKAFitri Megasari Ega'unikNo ratings yet
- Surat Lamaran KerjaDocument1 pageSurat Lamaran KerjaMuhammad IkhlasNo ratings yet
- Rekomendasi 2Document1 pageRekomendasi 2Muhammad IkhlasNo ratings yet
- Rancangan Etnografi Hal 967-975Document5 pagesRancangan Etnografi Hal 967-975Muhammad IkhlasNo ratings yet
- GALAT NUMERIKDocument12 pagesGALAT NUMERIKMuhammad IkhlasNo ratings yet
- Pende KatanDocument3 pagesPende Katanhusna269No ratings yet
- MODUL 2 Osilasi TeredamDocument8 pagesMODUL 2 Osilasi TeredamIphink Thahir0% (1)
- J00857Document10 pagesJ00857Muhammad IkhlasNo ratings yet
- Surat Lamaran KerjaDocument1 pageSurat Lamaran KerjaMuhammad IkhlasNo ratings yet
- Lampiran 5jadiDocument2 pagesLampiran 5jadiMuhammad IkhlasNo ratings yet
- Laporan Akhir Praktikum Elektronika Dasar IIDocument64 pagesLaporan Akhir Praktikum Elektronika Dasar IIMuhammad IkhlasNo ratings yet
- Surat Pemanggilan OSN 2014Document21 pagesSurat Pemanggilan OSN 2014PESANTREN MATEMATIKA INDONESIA100% (1)
- Surat LabDocument1 pageSurat LabMuhammad IkhlasNo ratings yet
- Makalah Psikologi Pendidikan (Pandangan Behavioral Terhadap Pembelajaran, Belajar Dan Perkembangan, Pendidikan Di Sekolah)Document29 pagesMakalah Psikologi Pendidikan (Pandangan Behavioral Terhadap Pembelajaran, Belajar Dan Perkembangan, Pendidikan Di Sekolah)Muhammad Ikhlas100% (1)
- FISIKADocument21 pagesFISIKAFitri Megasari Ega'unikNo ratings yet
- Ueu Undergraduate 381 Daftar PustakaDocument2 pagesUeu Undergraduate 381 Daftar PustakaMuhammad IkhlasNo ratings yet
- Akhlaqul KarimahDocument1 pageAkhlaqul KarimahMuhammad IkhlasNo ratings yet
- Makalah Penilaian Hasil Belajar Fisika Penilaian AutentikDocument45 pagesMakalah Penilaian Hasil Belajar Fisika Penilaian AutentikMuhammad Ikhlas67% (6)
- Amplop PeminjamanDocument1 pageAmplop PeminjamanMuhammad IkhlasNo ratings yet
- Fismod 6.34Document1 pageFismod 6.34Muhammad IkhlasNo ratings yet
- Makalah Arti Pendidikan Dan Tujuan PendidikanDocument10 pagesMakalah Arti Pendidikan Dan Tujuan PendidikanMuhammad IkhlasNo ratings yet
- 7.persamaan KuadratDocument3 pages7.persamaan KuadratTitik SugiartiNo ratings yet
- Percobaan IngenhouszDocument10 pagesPercobaan IngenhouszMuhammad IkhlasNo ratings yet