Professional Documents
Culture Documents
Factores Externos Que Alteran La Actividad Enzimática
Uploaded by
Negrita GuevaraOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Factores Externos Que Alteran La Actividad Enzimática
Uploaded by
Negrita GuevaraCopyright:
Available Formats
Factores externos que alteran la actividad enzimtica Una vez descrito el mecanismo de actuacin de las enzimas se analizar por
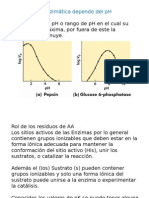
qu la variacin de algunos factores del medio puede afectar a la actividad enzimtica. Concentracin de enzima Las enzimas proteicas se aslan de sus principales fuentes biolgicas (bacterias, hongos, tejidos animales y vegetales) mediante procesos habituales de aislamiento y purificacin de protenas, por lo que la pureza del preparado no es absoluta. Esto hace necesario definir dos conceptos: la unidad de actividad enzimtica y la actividad especfica. Unidad de actividad enzimtica (t/): es la cantidad de enzima capaz de transformar 1,0 jumol de sustrato por minuto a 25 C en condiciones ptimas. Actividad especfica: es el nmero de unidades enzimticas por mg de protena purificada. Constituye una medida de la pureza del preparado. Temperatura El aumento de la temperatura conduce a un aumento en la velocidad de la reaccin, que tiene un lmite cuando se sobrepasa la temperatura de desnaturalizacin de la enzima, lo que conlleva una prdida de su funcin. Debido a este fenmeno, la mutacin de una enzima que produce una forma termolbil puede tener consecuencias muy graves. pH Tal y como se ha visto con detalle en el captulo de protenas, los cambios en el pH del medio pueden alterar al estado de ionizacin de las cadenas laterales de los aminocidos cidos y bsicos. Estos cambios pueden afectar a la afinidad de la enzima por el sustrato, si se ven alteradas las cargas de los aminocidos que participan en la formacin de interacciones no covalentes entre la enzima y el sustrato para formar el complejo ES. Tambin se puede alterar la etapa de transformacin del sustrato en producto, si se modifican los residuos catalticos. El pH al que se producen estas variaciones puede aportar datos sobre qu tipo de residuo es el que se ve modificado. Por ejemplo, un cambio en la actividad enzimtica en un pH prximo a 7 indica que se afecta un residuo de His (con un pKa prximo a 6). Siempre hay que tener en cuenta que el pKz de un mismo residuo puede variar ligeramente dependiendo del entorno molecular en el que se localiza. Reacciones multisustrato
Hasta ahora se han descrito reacciones en las que se transforma un solo sustrato. Pero existen numerosas reacciones catalizadas por enzimas en las que intervienen dos o ms sustratos. En este tipo de reacciones los sustratos pueden unirse a la enzima de forma simultnea o sucesiva. Existen dos mecanismos que explican este comportamiento: Mecanismo secuencial En algunas reacciones en las que intervienen dos sustratos se forma en algn momento un complejo ternario no covalente E S ^. Los sustratos pueden fijarse al azar o hacerlo en un orden especfico. Mecanismo de doble desplazamiento o Ping-pong En estas reacciones no se forma un complejo ternario, sino que el primer sustrato se libera como producto antes de la unin del segundo sustrato a la enzima que ya ha sido modificada en la reaccin anterior. Las quinasas siguen este tipo de mecanismo. El primer sustrato es el ATP que se une a la enzima que libera ADP como producto y se queda fosforilada. El segundo sustrato se une a la protena fosforilada que le transfiere el grupo fosfato. Las enzimas se pueden inhibir de forma reversible e irreversible Existen cierto tipo de molculas, denominadas inhibidores, que ralentizan o detienen las reacciones enzimticas. En algunas ocasiones han resultado tiles para conocer ms datos sobre el mecanismo de reaccin enzimtica pero, sobre todo, resultan muy eficaces en la bsqueda y elaboracin de frmacos. Por ejemplo, un inhibidor puede actuar sobre una enzima que est presente en un organismo patgeno pero no en el organismo husped. En otras ocasiones actan sobre enzimas con una actividad alterada y que son la causa de la patologa tratada. En ambos casos, los frmacos ms adecuados sern los que operen sobre una enzima m uy especfica para evitar efectos secundarios. Los inhibidores reversibles alteran los parmetros cinticos Son molculas que se unen a la enzima mediante interacciones no covalentes, ms o menos estables, de forma reversible. Para estudiar su efecto sobre la actividad cataltica de la enzima se realizan ensayos, con las mismas condiciones experimentales, en ausencia (E + S) y presencia (E + S + I) de inhibidor. Esto permite comparar los parmetros cinticos caractersticos de la reaccin ( V ^ y Km) con los obtenidos en presencia de inhibidor (denominados Vmaxi y Km o parmetros cinticos aparentes). Los datos se reflejan en una grfica de Lineawever- Burk para una mejor comparacin de los resultados. El inhibidor se puede unir a la enzima en el centro activo formando un complejo El que no da producto o en un lugar especfico para el inhibidor. En este ltimo caso la fijacin puede realizarse antes o despus de la unin del sustrato y se forma un complejo
ternario ESI. El complejo El o ESI puede ser ms o menos estable y est definido por las reacciones: E + I <= El (10) si la enzima se une al inhibidor en el centro activo, impidiendo que se una el sustrato; o bien ES + I <= ESI (11) en el caso de que el inhibidor se una al complejo ES. De igual forma que el valor de ks refleja la afinidad de la enzima por el sustrato, la mayor o menor afinidad de la enzima por el inhibidor quedar reflejada por las constantes de disociacin de estos complejos por las frmulas: jy- _ [E] ffl ( , 2) ^ I m T (12) y [E] [I] 1 [ESI] J Dependiendo del tipo de inhibidor se pueden diferenciar tres tipos de inhibicin reversible. Inhibicin competitiva Se caracteriza porque el inhibidor se une al mismo sitio que el sustrato, impidiendo, por tanto, la formacin del complejo ES y la formacin de producto. Suele ser una molcula semejante al sustrato de la reaccin de forma que los dos ligandos compiten por unirse al centro activo (Fig. 8-20.1-a), aunque algunos tienen una estructura diferente. Como la unin es reversible, cuando la concentracin de sustrato es elevada es muy poco probable que el inhibidor se una a la enzima, por lo que la reaccin muestra una Vmax normal (Vm3X = Sin, embargo se necesita ms sustrato para alcanzar la mitad de la Vm3X por lo que la Kmi tiene un valor mayor. El incremento de este valor est relacionado con la [I] y con la Kx y se puede calcular mediante la frmula: = (Fig. 8-20b-c-d) El factor mediante el que se relacionan los parmeros cinticos sin inhibidor y los aparentes (1 + [I\!IQ se denomina a o grado de inhibicin. Inhibicin no competitiva El inhibidor muestra afinidad tanto por la enzima libre como por el complejo ES y la unin se realiza en un lugar distinto del centro activo. Por tanto, su efecto no se puede evitar aumentando la concentracin de sustrato y produce una disminucin de la Vmax ya que el complejo ternario ESI no genera producto. La Vmaxi disminuye por el efecto del inhibidor de forma que Vmaxi - VmJ a . Al no unirse en el centro activo la Km no cambia en presencia de inhibidor por lo que
Km = K ^ (Fig. 8-20.2). Inhibicin acompetitiva o incompetitiva Los inhibidores acompetitivos se unen exclusivamente al complejo ES en un lugar diferente al centro activo. El efecto aparente sobre los parmetros cinticos en presencia de inhibidor es la disminucin de y Km (Fig. 8-20.3), que se pueden calcular mediante las siguientes expresiones: V K y _ ' m a x TS- maxiJmi Inhibidores irreversibles Son molculas que se suelen unir a la enzima mediante enlaces covalentes con los residuos imprescindibles para la catlisis, impidiendo su funcin; aunque tambin pueden unirse mediante interacciones no covalentes m uy estables. Este tipo de inhibidores no tienen un comportamiento cintico de Michaelis-Menten. Su principal utilidad es la creacin de frmacos, pero tambin se utilizan para conocer el mecanismo de reaccin de las enzimas inhibidas.
You might also like
- EnzimasDocument62 pagesEnzimasyurd leidy100% (4)
- EnzimasDocument10 pagesEnzimasvickyNo ratings yet
- Inhibicion EnzimaticaDocument14 pagesInhibicion EnzimaticaFiorella Rosas RuizNo ratings yet
- Enzimas ReguladorasDocument4 pagesEnzimas ReguladorasLucas Tapia Parra0% (1)
- Inhibidores EnzimáticosDocument9 pagesInhibidores EnzimáticosVariedades Y-JNo ratings yet
- Práctica 2. Determinación de Los Parámetros Cinéticos de La InvertasaDocument6 pagesPráctica 2. Determinación de Los Parámetros Cinéticos de La InvertasaMARTIN GARCIANo ratings yet
- CursoDocument37 pagesCursoMarco Antonio Salazar PalaciosNo ratings yet
- Qué Es La Cinética EnzimáticaDocument4 pagesQué Es La Cinética EnzimáticaJesús RGNo ratings yet
- Trabajo 3 de CineticaDocument9 pagesTrabajo 3 de Cineticachrismetal 188No ratings yet
- Ejercicios de Inhibición-Activación y Efectos de PHDocument3 pagesEjercicios de Inhibición-Activación y Efectos de PHaaron30102023No ratings yet
- Inhibidor EnzimáticoDocument18 pagesInhibidor EnzimáticoAdri CruzNo ratings yet
- Repaso de Cinética Enzimática e Inhibición Enzimática Fabián Rodríguez 2010Document4 pagesRepaso de Cinética Enzimática e Inhibición Enzimática Fabián Rodríguez 2010luis19401809No ratings yet
- Inhibición y Regulación EnzimáticaDocument5 pagesInhibición y Regulación EnzimáticaLourdes SoriaNo ratings yet
- Regulacion EnzimaticaDocument12 pagesRegulacion EnzimaticaKurtis JuarezNo ratings yet
- EnzimasDocument8 pagesEnzimasDavid JimenezNo ratings yet
- Qué Es Cinética EnzimáticaDocument21 pagesQué Es Cinética EnzimáticaStefa WupamNo ratings yet
- Propiedades Fundamentales de Una EnzimaDocument6 pagesPropiedades Fundamentales de Una Enzima•Estella Bemón•No ratings yet
- Tp02 de Bioquímica UNLPDocument11 pagesTp02 de Bioquímica UNLPAlyson GuilhermeNo ratings yet
- Tema 5 - EnzimasDocument14 pagesTema 5 - EnzimasSara DoradoNo ratings yet
- 6.3 BioquimicaDocument40 pages6.3 BioquimicaBrenda Soto100% (1)
- Definiciones QuimicaDocument5 pagesDefiniciones Quimicadenisse floresNo ratings yet
- Taller y Glosario de Enzimas y Factores Que Afectan Las EnzimasDocument12 pagesTaller y Glosario de Enzimas y Factores Que Afectan Las EnzimasAngie Villarreal100% (1)
- Aporte Tarea 3 BioquimicaDocument15 pagesAporte Tarea 3 BioquimicaSandra PeñaNo ratings yet
- Bioquimica Guia de Estudio 2Document21 pagesBioquimica Guia de Estudio 2daniel torresNo ratings yet
- Cinética EnzimaticaDocument23 pagesCinética EnzimaticaArturo MoraNo ratings yet
- Factores EnzimasDocument4 pagesFactores EnzimasMatiasHerreraNo ratings yet
- Cinética EnzimáticaDocument4 pagesCinética EnzimáticaDanii Castle RoblesNo ratings yet
- ME-Objetivos Enzimas RevDocument20 pagesME-Objetivos Enzimas Revapi-369665675% (4)
- Resúmen 3Document30 pagesResúmen 3Ramiro MartinNo ratings yet
- Efecto de La Concentracion de SustratoDocument9 pagesEfecto de La Concentracion de SustratoFatima SanchezNo ratings yet
- Bitacora 6Document4 pagesBitacora 6Morales Ramos PriscilaNo ratings yet
- Mecanismos de Union e Inhibición de EnzimasDocument7 pagesMecanismos de Union e Inhibición de EnzimasNALLELY GUADALUPE VITAL CARMONANo ratings yet
- Cinética EnzimáticaDocument7 pagesCinética EnzimáticaCelisdey CastilloNo ratings yet
- Resoluciön Ejercicios de Inhibición-Activación y Efectos de PHDocument2 pagesResoluciön Ejercicios de Inhibición-Activación y Efectos de PHaaron30102023No ratings yet
- Inhibidores PDFDocument7 pagesInhibidores PDFAnais FagundezNo ratings yet
- Info de Diapo Jorya AngelloDocument7 pagesInfo de Diapo Jorya AngelloJESUS ALBERTO GUERRERO DE LA ROSA ESTUDIANTE ACTIVONo ratings yet
- Enzimas IDocument6 pagesEnzimas IV PrNo ratings yet
- Documento Completo de Cinetica EnzimaticaDocument11 pagesDocumento Completo de Cinetica EnzimaticaMonica VegaNo ratings yet
- II Enzimología DiagnósticaDocument5 pagesII Enzimología DiagnósticaKaty LopezNo ratings yet
- Cuestionarios de BioquimicaDocument33 pagesCuestionarios de Bioquimicameme.gdjgtxNo ratings yet
- 5) Regulación de La Actividad Enzimática.: Figura 1. Enzimas ReguladorasDocument7 pages5) Regulación de La Actividad Enzimática.: Figura 1. Enzimas ReguladorasCortes Burgos Cielo SherlynNo ratings yet
- Enzimas 4Document48 pagesEnzimas 4MicuentoDehadasNo ratings yet
- Tarea No.9 Cinética EnzimáticaDocument8 pagesTarea No.9 Cinética EnzimáticaRodrigo ViguerasNo ratings yet
- Enzimas T6Document4 pagesEnzimas T6mzspqbzx7dNo ratings yet
- Inhibicion y SustratoDocument3 pagesInhibicion y SustratoYara HernandezNo ratings yet
- Lecture - 4 - QUÍMICA AMBIENTAL Y ELEMENTOS DE BIOQUÍMICA UNI IVDocument45 pagesLecture - 4 - QUÍMICA AMBIENTAL Y ELEMENTOS DE BIOQUÍMICA UNI IVfernando felipe reyes castilloNo ratings yet
- Bioquimica Biologia Celular Yt MolecularDocument89 pagesBioquimica Biologia Celular Yt MolecularGiulli DuránNo ratings yet
- Bioquimica 2023 TP 02 Enzimas - Preguntas Domiciliarias BIOQUIDocument8 pagesBioquimica 2023 TP 02 Enzimas - Preguntas Domiciliarias BIOQUIMati DPNo ratings yet
- Enzimas 2Document5 pagesEnzimas 2mpmNo ratings yet
- Inhibidores Enzimáticos de Uso ClínicosDocument5 pagesInhibidores Enzimáticos de Uso ClínicosAngélica RomanNo ratings yet
- Catálisis EnzimáticaDocument8 pagesCatálisis EnzimáticaMarta CastroNo ratings yet
- Práctica No 3 BioquimicaDocument9 pagesPráctica No 3 BioquimicaJesus E. Cabezudo CalderonNo ratings yet
- Arreglado para ImprimirDocument31 pagesArreglado para ImprimirMilton Cesar Rodrigo TantaleanNo ratings yet
- Inhibicion CompetitivaDocument9 pagesInhibicion Competitivakarla torrezNo ratings yet
- En ZimasDocument71 pagesEn ZimasLeidy ItzelNo ratings yet
- Clase 11 - Enzimas ReguladorasDocument81 pagesClase 11 - Enzimas ReguladorasJaime Saavedra Guevara100% (3)
- Ilovepdf - Merged (1) - MergedDocument190 pagesIlovepdf - Merged (1) - MergedMARIA FERNANDA SERVIN ROBLEDONo ratings yet
- Cuestionario ENZIMASDocument18 pagesCuestionario ENZIMASCristina Russell100% (1)
- Bbioquimica de Los Alimentos - Enzimas en Panaderia y ConfiteriaDocument33 pagesBbioquimica de Los Alimentos - Enzimas en Panaderia y ConfiteriaHenry Oré Gutiérrez83% (6)
- Enzimas Reguladoras o Enzimas AlostéricasDocument5 pagesEnzimas Reguladoras o Enzimas AlostéricasNitgma DcNo ratings yet
- Hematología MicrobiologiaDocument62 pagesHematología MicrobiologiaNegrita GuevaraNo ratings yet
- En La Investigación Cuantitativa WordDocument2 pagesEn La Investigación Cuantitativa WordNegrita GuevaraNo ratings yet
- LigandosDocument7 pagesLigandosNegrita GuevaraNo ratings yet
- HONGOSDocument3 pagesHONGOSNegrita GuevaraNo ratings yet
- AjedrezDocument8 pagesAjedrezNegrita GuevaraNo ratings yet
- Jugo GástricoDocument5 pagesJugo GástricoNegrita GuevaraNo ratings yet
- Prueba de CatalasaDocument3 pagesPrueba de CatalasaNegrita Guevara100% (1)
- NEFELÓMETRODocument2 pagesNEFELÓMETRONegrita Guevara0% (1)
- Ejercicios Enzimas PDFDocument3 pagesEjercicios Enzimas PDFDavid AntonioNo ratings yet
- GPT (Alt) : Determinación Cuantitativa de Alanina Aminotransferasa GPT (Alt)Document1 pageGPT (Alt) : Determinación Cuantitativa de Alanina Aminotransferasa GPT (Alt)FernandaNo ratings yet
- Citocromo p450Document17 pagesCitocromo p450Natalia BahamonNo ratings yet
- EnzimasDocument5 pagesEnzimasMaría Belén Hernández OrtizNo ratings yet
- Aspectos Generales y Propiedades de Las EnzimasDocument37 pagesAspectos Generales y Propiedades de Las Enzimasronald stevn alvarez osorioNo ratings yet
- EnzimasDocument13 pagesEnzimasMariana CastilloNo ratings yet
- 5) Regulación de La Actividad Enzimática.: Figura 1. Enzimas ReguladorasDocument7 pages5) Regulación de La Actividad Enzimática.: Figura 1. Enzimas ReguladorasCortes Burgos Cielo SherlynNo ratings yet
- Mapa Mental BiocaDocument1 pageMapa Mental BiocaAna ReyesNo ratings yet
- Modificación de La Actividad Enzimática de La TirosinasaDocument28 pagesModificación de La Actividad Enzimática de La TirosinasaDaniela VeraNo ratings yet
- Tabla Comparativa de Inhibición EnzimáticaDocument2 pagesTabla Comparativa de Inhibición EnzimáticaLizbeth RamirezNo ratings yet
- ENZIMIOLOGÍA - Obstetricia PDFDocument65 pagesENZIMIOLOGÍA - Obstetricia PDFDerecho IcaNo ratings yet
- ENZIMAS Capitulo 13 BISHOPDocument25 pagesENZIMAS Capitulo 13 BISHOPCRISTIAN EDUARDO MARTINEZ DAVILANo ratings yet
- Problemas de Bioquímica - Primer Curso Del Grado en Bioquímica - Curso 2010 11Document8 pagesProblemas de Bioquímica - Primer Curso Del Grado en Bioquímica - Curso 2010 11cristipisti88No ratings yet
- Metabolismo Del GlucogenoDocument23 pagesMetabolismo Del GlucogenoFeer RangelNo ratings yet
- Reaccion de TransaminacionDocument2 pagesReaccion de TransaminacionXkevin ZNo ratings yet
- Bioquimica Basica Base Molecular de Los Procesos Fisiologicos Cap 3Document20 pagesBioquimica Basica Base Molecular de Los Procesos Fisiologicos Cap 3Elda PasosNo ratings yet
- Enzimas. Enzimología ClínicaDocument39 pagesEnzimas. Enzimología ClínicaAlexNo ratings yet
- Rodriguez - MariaJose - Tarea 2.1Document4 pagesRodriguez - MariaJose - Tarea 2.1Majo RodriguezNo ratings yet
- Clase 6 Control de La Actividad EnzimáticaDocument36 pagesClase 6 Control de La Actividad EnzimáticaHarold JoseNo ratings yet
- Presentación EnzimasDocument33 pagesPresentación EnzimasAndrea HinestrozaNo ratings yet
- Original Trabajo de EnzimaDocument22 pagesOriginal Trabajo de Enzimadaysi raquel florez vertelNo ratings yet
- Enzimologia ClinicaDocument18 pagesEnzimologia ClinicaRoberto Castellanos100% (1)
- Tiosulfonil TransferasaDocument3 pagesTiosulfonil TransferasaJorge Ramirez RaherNo ratings yet
- Cardona - Los Enzimas. Introducción A La Enzimología.Document9 pagesCardona - Los Enzimas. Introducción A La Enzimología.Danher EscalanteNo ratings yet
- Semana 4 EnzimasDocument65 pagesSemana 4 EnzimasYassimNo ratings yet
- EXTRACCIÓN DE FOSFATASA ALCALINA, EFECTO DE PH, TEMPERATURA, VELOCIDAD DE REACCIÓN Y ACTIVIDAD ENZIMÁTICADocument6 pagesEXTRACCIÓN DE FOSFATASA ALCALINA, EFECTO DE PH, TEMPERATURA, VELOCIDAD DE REACCIÓN Y ACTIVIDAD ENZIMÁTICAa.agudelo2No ratings yet
- Unidad 3 Enzimas - Parte IDocument70 pagesUnidad 3 Enzimas - Parte IYony RMNo ratings yet
- AlosteríaDocument1 pageAlosteríaDaniela MNo ratings yet
- Ciclo de KrebsDocument2 pagesCiclo de Krebsshin e izanely The hedgehogNo ratings yet