Professional Documents
Culture Documents
Ac Carboxilicos
Uploaded by
Alejandrov RocenOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ac Carboxilicos
Uploaded by
Alejandrov RocenCopyright:
Available Formats
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
UNIDAD 3
ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
A la combinación de un grupo carbonilo y uno hidroxilo en el mismo átomo de
carbono se le denomina grupo carboxilo, por lo que los compuestos que contienen
este grupo se les llama ácidos carboxílicos, debido a que presentan un carácter
ácido.
Los ácidos carboxílicos no son tan importantes por sí mismos, si no que el grupo
carboxilo es el grupo base de una gran familia de compuestos derivados, como los
cloruros de acilo, esteres, amidas, anhídridos y nitrilos; como se verá en esta unidad.
3.1 CARACTERÍSTICAS ESTRUCTURALES Y NOMENCLATURA DE
ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O
C
El grupo carboxilo OH es uno de los grupos funcionales más comunes en la
química y la bioquímica. Los ácidos carboxílicos no sólo son importantes por sí
mismos, si no que el grupo carboxilo es el grupo base de una gran familia de
compuestos relacionados.
Todos estos derivados de los ácidos carboxílicos, contienen al grupo acilo. Como
resultado, a veces se les denomina compuestos acilo. Se les llama derivados de los
ácidos carboxílicos por que se derivan del ácido carboxílico por la sustitución con
algún otro grupo, del -OH del RCOOH.
Los compuestos orgánicos que contienen el grupo funcional carboxilo, constituyen
los ácidos carboxílicos. Su carácter notable es la acidez o sea la tendencia a liberar
protones [H+]. El carbono está ligado a dos átomos de oxígeno, determinando que se
encuentre un grado de oxidación alto. La presencia de un grupo carbonilo y un grupo
oxidrilo ligado al mismo carbono hace que se interfieran entre sí e impide que las dos
funciones se comporten como tales. El grupo carboxilo se liga a radicales alquilo o
arilo formando una gran variedad de ácidos.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 68
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O O
H3 C H2 C C OH CH2 CH C OH HC C C OH
ácido propiónico ácido propenoico ácido propinoico
Forman un conjunto de compuestos orgánicos de gran importancia en la industria
como materia prima para obtener un gran número de derivados y varios productos de
uso industrial.
El grupo funcional carboxilo, al estar formado por dos grupos funcionales, no
presentan reacciones típicas del grupo carbonilo o del grupo hidroxilo. Estas
estructuras muestran que tales moléculas son polares y, como los alcoholes, forman
puentes de hidrógeno entre sí, así como con otras estructuras tales como el H2O.
La característica fundamental de la estructura de los ácidos es la interferencia de los
dos grupos que constituyen el grupo carboxilo, originando la formación de esta
función con características específicas.
La presencia de los dos oxígenos y el doble enlace, provocan que los electrones π
del doble enlace y la densidad electrónica del oxígeno del OH se dispersen o
deslocalicen entre los tres átomos O–C–O: en esta forma el protón H+ del OH, tiende
a liberarse formándose el ión del ácido provocando su acidez.
Nomenclatura
La nomenclatura UIQPA para los ácidos carboxílicos emplea el nombre del alcano
que corresponde a la cadena continua más larga de átomos de carbono que incluye
al ácido. La o final del nombre del alcano se sustituye por el sufijo oico y se
antepone la palabra ácido. Se numera la cadena comenzando con el átomo de
carbono del carboxilo, para especificar las posiciones de los sustituyentes a lo largo
de ella. Al dar el nombre, el grupo carboxilo tiene prioridad sobre cualquier grupo
funcional.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 69
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O
C C C C C C C OH
7 6 5 4 3 2 1
El nombre de un ácido no saturado se forma con el nombre del alqueno
correspondiente, anteponiendo la palabra ácido y sustituyendo la terminación o por la
terminación oico. La cadena de carbonos se numera comenzando con el carbono del
carboxilo y se usa un número para especificar la ubicación del doble enlace.
O O O
H C OH CH3 C OH CH3CH2 C OH
ácido metanóico ácido etanóico ácido propanóico
O O
O O CH3 C CH C OH
CH3CH C OH CH3CH2CHCH2 C OH CH2CH2CH3
ácido 2 -ciclohexilpropanóico ácido 3 -fenilpentanóico ácido 3 -oxo-2-propilbutanóico
Los términos estereoquímicos cis y trans (z y E) se emplean como con los demás
alquenos. Los cicloalcanos con sustituyente –COOH se llaman por lo general ácidos
cicloalcanocarboxílicos.
Los ácidos aromáticos de la forma Ar- COOH se nombran como derivados del ácido
benzoico, Ph- COOH. Se usan los prefijos orto, meta y para cuando se especifica las
posiciones de otros sustituyentes. Se usan números si hay más de dos sustituyentes
en el anillo aromático.
Muchos ácidos aromáticos tienen nombres comunes que no se relacionan con su
estructura. Dichos nombres de algunos ácidos carboxílicos alifáticos se conocen
desde hace muchos años, y reciben su nombre según sea su origen. En la Tabla 3.1
aparecen los nombres de los ácidos carboxílicos simples.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 70
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
COOH
H2CH3C H Ph H
CH3
C C H C C
H3C C C OH H COOH
H2
CH3
ác.(E)-4 metil-3-hexenoico ác. (E)-3 fenil-2-propenoico ác. 2,3-dimetilciclohexano-carboxílico
Tabla 3.1 Ácidos carboxílicos simples
Nombres UIQPA Nombre común Fórmula
2,2-dimetilpropanoico piválico (CH3)3C-COOH
2-metil propanoico isobutírico (CH3)2CHCOOH
2-metilbenzoico o-tolúico o-CH3C6H4COOH
2-propenoico acrílico CH2=CH-COOH
3-metilbenzoico m-tolúico m-CH3C6H4COOH
3-metilbutanoico isovalérico (CH3)2CHCH2COOH
4-metilbenzoico p-tolúico p-CH3C6H4COOH
benzoico benzoico C6H5-COOH
butanoico butírico CH3(CH2)2COOH
cis,cis-9,12-octadecadienoico* linoléico CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
cis-9-octadecenoico* oléico CH3(CH2)7CH=CHCH(CH2)7COOH
decanoico cáprico CH3(CH2)8COOH
dodecanoico láurico CH3(CH2)10COOH
etanoico* acético CH3COOH
hexadecanoico palmítico CH3(CH2)14COOH
hexanoico caproico CH3(CH2)4COOH
metanoico* fórmico HCOOH
octadecanoico esteárico CH3(CH2)16COOH
octanoico caprílico CH3(CH2)6COOH
pentanoico valérico CH3(CH2)3COOH
propanoico propiónico CH3CH2COOH
tetradecanoico mirístico CH3(CH2)12COOH
trans-2-butenoico* crotónico CH3-CH=CH-COOH
* En raras ocasiones se usa el nombre UIQPA.
Fuente: WADE JR., L. G. 2004. Química orgánica. Ed. Prentice-Hall, Madrid, España, Pág.
901.
El ácido fórmico se extraía de las hormigas: formica en latín. El ácido acético se aisló
del vinagre, del latín acetum (agrio). El ácido butírico es el ácido que se encuentra en
la mantequilla: butyrum en latín. Los ácidos caproíco, caprílico y cáprico se
encuentran en las secreciones cutáneas de las cabras: capri en latín.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 71
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
En los nombres comunes, las posiciones de los sustituyentes se indican con letras
griegas. La asignación de letras comienza en el átomo de carbono adyacente al
carbono carbonilo, que es el carbono α. En ocasiones en los nombres comunes, se
usa el prefijo iso para los ácidos que terminan con el grupo –CH(CH3)2.
O
C C C C C C OH
ε δ γ β α
Nomenclatura común de ácidos dicarboxílicos
Un ácido dicarboxílico (algunas veces nombrado diácido) es un compuesto con dos
grupos carboxilo. Los nombres comunes de estos ácidos se emplean con más
frecuencia que sus nombres sistemáticos. En la Tabla 3.2 aparecen los nombres de
algunos ácidos dicarboxílicos simples.
Tabla 3.2 Ácidos dicarboxílicos simples
Nombre UIQPA Nombre común Fórmula
benceno-1,2-dicarboxílico ftálico 1,2-C6H4(COOH)2
benceno-1,3-dicarboxílico isoftálico 1,3-C6H4(COOH)2
benceno-1,4-dicarboxílico tereftálico 1,4-C6H4(COOH)2
butanodioico succínico HOOC(CH2)2COOH
cis-2-butenodioico maléico cis HOOCCH=CHCOOH
etanodioico oxálico HOOC-COOH
heptanodioico pimélico HOOC(CH2)5COOH
hexanodioico adípico HOOC(CH2)4COOH
pentanodioico glutámico HOOC(CH2)3COOH
propanodioico malónico HOOCCH2COOH
trans-2-butenodioico fumárico trans-HOOCCH=CHCOOH
Fuente: WADE JR., L. G. 2004. Química orgánica. Ed. Prentice-Hall, Madrid, España, Pág.
903.
A los ácidos dicarboxílicos sustituidos se les dan nombres comunes empleando
letras griegas como los ácidos carboxílicos. Se asignan las letras griegas
comenzando con el átomo de carbono adyacente al grupo carboxilo más próximo a
los sustituyentes.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 72
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
CH3 Ph CH3
COOH H2C CH CH2 CH2 COOH COOH HC CH CH2 COOH
ác. beta-metiladípico ác. alfa-fenil-beta-metilglutárico
Los compuestos derivados del benceno con dos grupos carboxílicos se llaman
ácidos ftálicos. El ácido ftálico es el isómero orto. El isómero meta se llama ácido
isoftálico y el isómero para se llama ácido tereftálico.
COOH COOH HOOC COOH
ác. ftálico COOH HOOC ác. isoftálico ác. tereftálico
Nomenclatura según la UIQPA para ácidos dicarboxílicos
Los ácidos alifáticos dicarboxílicos se nombran simplemente agregando el sufijo
dioico al nombre del alcano que le dio origen.
Para los ácidos dicarboxílicos de cadena recta, el nombre del alcano se determina
empleando la cadena continua de átomos de carbono que contiene ambos grupos
carboxilo. Se numera la cadena comenzando con el átomo de carbono del grupo
carboxilo que está más cerca de los sustituyentes, y estos números se emplean para
especificar las posiciones de dichos sustituyentes.
CH3 CH3
HOOCCH2CHCH2CH2COOH HOOCHCHCH2CH2COOH
Ph
ác. 3-metilhexanodioico ác. 2-fenil-3-metilpentanodioico
3.2 PROPIEDADES FÍSICAS
Los ácidos carboxílicos son compuestos polares, sus moléculas pueden formar
enlaces de hidrógeno entre sí y con el agua, por lo que en general son sustancias
con temperaturas de ebullición altas, considerando que los ácidos carboxílicos de
Portillo Alva Benjaín, Leticia Colón Izquierdo. 73
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
bajo peso molecular presentan solubilidad apreciable en el agua. En la Tabla 3.3 se
muestran algunas propiedades físicas de los ácidos carboxílicos.
Tabla 3.3 Propiedades físicas de ácidos carboxílicos
Nombre P.F. P.E. Solubilidad
Fórmula pKa
Común (ºC) (ºC a 1 atm) (g/100ml H2O)
acético CH3COOH 17 118 ∞ 4,75
α−cloro
CH3CHClCO2H - 186 soluble 2,83
propiónico
acrílico CH2=CH-COOH 14 141 ∞ -
benzóico C6H5-COOH 122 250 0,34 4,19
butírico CH3(CH2)2COOH -6 164 ∞ 4,81
cáprico CH3(CH2)8COOH 31 269 0,015 4,84
caprílico CH3(CH2)6COOH 16 239 0,07 4,89
caproico CH3(CH2)4COOH -2 205 1,08 4,84
cloroacético CH3ClCO2H 63 189 muy soluble 2,85
protónico CH3-CH=CH-COOH 71 185 8,6 -
dicloroacético CHCl2CO2H 10,8 192 muy soluble 1,48
esteárico CH3(CH2)16COOH 70 383 0,0903і -
fórmico HCOOH 8 101 ∞ 3,75
liobutírico (CH3)2CHCOOH -46 155 23 -
isovalérico (CH3)2CHCH2COOH -29 177 5 -
láurico CH3(CH2)10COOH 44 17918 0,0061 5,30
linoléico CH3(CH2)4CH=CHCH2 -5 - insoluble -
CH=CH(CH2)7CO2H
mirístico CH3(CH2)12COOH 59 20020 0,002 -
m-tolúico m-CH3C6H4COOH 112 263 0,1 -
oléico CH3(CH2)7CH=CHCH(CH2)7CO2H 16 - insoluble -
o-tolúico o-CH3C6H4COOH 106 259 0,1 -
palmítico CH3(CH2)14COOH 63 21917 0,0007 6,46
p-cloro
p-ClC6H4COOH 242 - 0,009 3,98
benzóico
piválico (CH3)3C-COOH 35 164 2,5 -
p-nitrobenzóico p-NO2C6H4COOH 242 - 0,03 3,41
propiónico CH3CH2COOH -21 141 ∞ 4,87
p-tolúico p-CH3C6H4COOH 180 275 0,03 4,36
tricoloroacético CCl3CO2H 56,3 198 muy soluble 0,70
valérico CH3(CH2)3COOH -34 187 4,97 4,82
β-cloro
CH2ClCH2CO2H 61 204 soluble 3,98
propiónico
Fuente: SOLOMONS, T. W. Graham. 2000. Química orgánica. Ed. Limusa-Wiley, México,
Pág. 923
Portillo Alva Benjaín, Leticia Colón Izquierdo. 74
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Puntos de ebullición. Los ácidos carboxílicos hierven a temperaturas más elevadas
que los alcoholes, cetonas o aldehídos de peso molecular (PM) semejante. Por
ejemplo, el ácido acético (PM 60) hierve a 118° C, el 1-propanol (PM 60) hierve a
97°C y el propionaldehído (PM 58) hierve a 49° C. Los altos puntos de ebullición de
los ácidos carboxílicos son el resultado de la formación de un dímero estable con
puentes de hidrógeno. Este dímero contiene un anillo de ocho miembros unidos por
dos puentes de hidrógeno, que duplican efectivamente el peso molecular de las
moléculas que dejan en la fase líquida.
O H O
R C C R
O H O
dímero del ácido con puentes de hidrógeno
Puntos de fusión. En la Tabla 3.3 se dan los puntos de fusión de los ácidos
carboxílicos más comunes. Los ácidos carboxílicos que contienen más de ocho
átomos de carbono, por lo general son sólidos, a menos que contengan dobles
enlaces.
Los puntos de fusión de los ácidos dicarboxílicos son muy altos, teniendo dos
carboxilos por molécula, las fuerzas de los puentes de hidrógeno son especialmente
fuertes en estos diácidos, se necesita una alta temperatura para romper la red de
puentes de hidrógeno en el cristal y fundir el diácido.
Solubilidad. Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los
de peso molecular más pequeños (de hasta cuatro átomos de carbono) son miscibles
en agua. A medida que aumenta la longitud de la cadena de átomos de carbono,
disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son
prácticamente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de
hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de
modo que los ácidos de cadena larga son más solubles en ellos que en agua. La
Portillo Alva Benjaín, Leticia Colón Izquierdo. 75
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares
como el cloroformo, porque el ácido continúa existiendo en la forma dimérica en los
solventes no polares.
3.2.1 Acidez
La mayoría de los ácidos carboxílicos no sustituídos tienen valores de Ka dentro del
intervalo de 10-4 – 10-5. Dicha acidez significa que los ácidos carboxílicos reaccionan
fácilmente con las soluciones acuosas de NaOH y H2CO3 para formar sales de sodio
solubles. Por lo que se pueden realizar pruebas de solubilidad para distinguir los
ácidos carboxílicos insolubles en agua de los fenoles y alcoholes insolubles en ella.
Los ácidos carboxílicos insolubles en agua se disuelven en NaOH acuoso o H2CO3
acuoso. Dado que la disociación de un ácido carboxílico es un proceso en equilibrio,
cualquier factor que estabilice el anión carboxilato en relación con el ácido carboxílico
no disociado dirigirá el equilibrio hacia una disociación mayor, incrementándola, y
como consecuencia también a la acidez.
3.2.2 pH
Puesto que las concentraciones de los iones H+ y OH- en disoluciones acuosas con
frecuencia son números muy pequeños, y por tanto difícil de trabajar con ellos. Una
medida práctica de conocer la acidez es mediante el pH. Los ácidos carboxílicos son
considerados como ácidos débiles de acuerdo a la escala de pH. La anterior
aseveración se puede constatar en la Tabla 3.3, de acuerdo a sus propiedades
físicas.
3.2.3 Constante de acidez
En la Tabla 3.3 se observa que los ácidos carboxílicos con grupos que retiran
electrones son más fuertes que los ácidos no sustituídos, como se muestra en el
siguiente ejemplo.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 76
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Cl Cl H H
Cl C COOH Cl C COOH Cl C COOH H C COOH
Cl H H H
pKa 0.7 1.48 2.85 4.75
Un ácido carboxílico se puede disociar en agua para dar lugar a un protón y un ión
carboxilato. A la constante de equilibrio de la reacción (Ka) se nombra constante de
disociación ácida, y el pKa es el logaritmo cambiado de signo de la Ka. Por lo que
para indicar la acidez relativa de los ácidos generalmente se usa el pKa.
O O
R C OH + H2O R C O + H3O
⎡R − CO− ⎤ ⎡H O+ ⎤
⎢ 2 ⎥⎦ ⎢⎣ 3 ⎥⎦
Ka = ⎣
[R − COOH]
pKa = -log Ka
10
Aún cuando los ácidos carboxílicos no son tan fuertes como los ácidos inorgánicos,
tienen mayor acidez que los grupos funcionales tratados anteriormente.
3.3 MÉTODOS DE OBTENCIÓN
3.3.1 Por oxidación de alcoholes primarios
La oxidación RCH2-OH produce un aldehído como ya se vio en la sección anterior o
un ácido carboxílico RCOOH, dependiendo de las condiciones de la reacción. El
permanganato de potasio es uno de los mejores reactivos para convertir un alcohol
primario a un ácido carboxílico. Este método se limita a los alcoholes que no
contienen otros grupos funcionales sensibles a la oxidación, por ejemplo enlaces
dobles o triples; la oxidación con permanganato básico debe ser seguida por la
neutralización con ácido ( H3O ) para producir el ácido carboxílico libre.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 77
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Los alcoholes primarios se oxidan con una solución de permanganato de potasio y
ácido sulfúrico, para posteriormente calentarse y destilar el producto.
-,
RCH2OH (1) KMnO4, OH
+
calor
RCOOH
(2) H3O
K Cr O ,H SO , calor
RCH2OH ó 2(1) 2KMnO
7 2 4
RCOOH
4, OH, calor
(2) H3O
3.3.2 Por oxidación de alquilcenos
Los anillos aromáticos que presentan un grupo alquilo se convierten en el derivado
del ácido benzoico correspondiente por tratamiento con fuertes agentes oxidantes en
condiciones vigorosas. Recordando que los grupos metilo al igual que las cadenas
laterales más complejas como los grupos n-butilo e isopropilo, se oxidan de modo
que únicamente queda el grupo carboxilo que involucra el carbono enlazado
directamente al anillo aromático; oxidando cualquier grupo alquilo unido al anillo, de
manera que pueden obtenerse ácidos di, tri, entre otros carboxílicos aromáticos. La
reacción sólo se limita a los anillos aromáticos que no están muy activados, debido a
la oxidación vigorosa que se presenta.
Por lo que a partir de los arenos o alquilbencenos (anillo ligado a grupos alquílicos),
los grupos primarios y secundarios (excepto los terciarios) que se encuentran unidos
directamente a un anillo de benceno se oxidan con el KMnO4 hasta un grupo –
COOH.
Na2Cr2O7, H2SO4, calor
Ar R ó (1) KMnO4, OH, calor Ar COOH
(2) H3O
alquilceno ácido carboxílico
Ejemplos:
Portillo Alva Benjaín, Leticia Colón Izquierdo. 78
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
KMnO4/H2SO4
O2N CH2CH3 O2N COOH
calor
p-nitrofeniletano ác. p-nitrobenzóico
CH3 COOH
KMnO4/H2SO4
calor
Br CH3 Br COOH
4-bromo-2metiltolueno ác. 4-bromoftálico
3.3.3 Hidrólisis de nitrilo
Los nitrilos alifáticos y aromáticos producen los ácidos carboxílicos correspondientes
por la hidrólisis en solución ácida o básica.
Hidrólisis ácida
O O
H3O H 3O
R C N R C OH + NH4 ó Ar C N Ar C OH + NH4
calor calor
Hidrólisis básica
O + NH3 O
OH
R C N R C OH
H2O, calor R C O
H3O
O (neutralizar)
OH O
Ar C N H2O, calor Ar C O
+ NH3 Ar C OH
Por lo que el calentamiento de un compuesto nitrilo R C N mezclado con ácido o
álcali acuoso, se hidroliza a ácido carboxilo R–COOH.
O
H 3O
R C N R C + NH4
calor
OH
Portillo Alva Benjaín, Leticia Colón Izquierdo. 79
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Ejemplo:
HCl/H2O
CH3CHCH2C N CH3CHCH2COOH + NH4Cl
CH3 CH3
3.3.4 Métodos de grignard
Este método tiene la virtud de añadir a la cadena un átomo de carbono más. Esta
reacción se debe llevar a cabo en frío, el proceso es muy sencillo, al reactivo de
grignard disuelto en éter se le añade “hielo seco”, para formar carboxilatos de
magnesio y producir ácidos carboxílicos mediante la acidificación.
Este tipo de síntesis de ácidos carboxílicos es aplicable en los haluros primarios,
secundarios, terciarios, de alilo, bencilo y arilo sólo cuando carezcan de grupos
incompatibles con una reacción de grignard.
O O
éter H3O
R X + Mg anhídro
RMgX + CO2 RCOMgX RCOH
(hielo seco)
O O
éter H 3O
Ar X + Mg anhídro
ArMgX + CO2 ArCOMgX ArCOH
(hielo seco)
En el caso del Ar-Cl se puede usar como disolvente al tetrahidrofurano.
Generalmente el CO2 se obtiene del hielo seco por lo que en ocasiones esta reacción
recibe el nombre de carbonación.
3.3.5 Síntesis malónica
Esta síntesis es uno de los métodos más importantes para la preparación de ácidos
carboxílicos, las materias primas son los compuestos llamados malonatos,
específicamente, los ésteres de fórmula CH2(COOC2H2)2.
Los dos hidrógenos del carbono alfa son de carácter ácido y pueden reaccionar con
bases, originando el H2O y la sal del éster.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 80
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Ejemplo:
O
O
H C
α OC2H5 C
C Na OH H OC2H5
C + H2O
H C OC2H5
2º Na C OC2H5
O
O
1º sal, éster sodiomálico
Esta sal puede reaccionar con halogenuro de alquilo. Por ejemplo:
O O
H C C
OC2H5 H OC2H5
C H2C Br C + NaBr
C OC2H5 H3C C OC2H5
Na
O O
Estos ésteres se pueden hidrolizar en medio ácido o alcalino, para romper el enlace
éster y de esta forma liberar el ácido y el alcohol.
O O
H C C
OC2H5 H OH
C H+/H2O
C + CH3CH2OH
H3C C OC2H5 ó OH-/H2O OH
H3C C
O O
Por calentamiento éstos ácidos se descarboxilan (pierden CO2) por degradación de
uno de sus carboxilos –COOH a CO2.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 81
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O
H C OH
C 140ºC
CH3CH2COOH + CO2
H3C C OH
O
3.3.6 Métodos especiales
Existen ciertos ácidos carboxílicos y dicarboxílicos considerados productos
industriales importantes, que son preparados por métodos especiales a partir de
compuestos iniciales alcanzables; algunos de ellos se formulan a continuación:
El ácido metanóico (ácido fórmico), comúnmente se prepara a partir de la reacción
entre el CO y una solución acuosa de NaOH.
O O
160-200ºC H3O
CO + NaOH H C O Na H C OH
15-20Kg/cm2
monóxido metanoato de sodio ácido metanóico
de carbono (formiato de sodio) (ácido fórmico)
El ácido etanóico (ácido acético), actualmente se prepara a partir de la oxidación del
etanal (acetaldehído).
O O
O2
H3C C H H3C C OH
acetato de cobalto
etanal 70-80ºC ácido etanóico
(acetaldehído) (ácido acético)
El ácido benzoico, suele obtenerse a partir de la oxidación vigorosa de los
alquilbencenos, como el tolueno. Sólo los grupos alquilo primarios y secundarios,
unidos directamente a un anillo de benceno se oxidan con el KMnO4, hasta un grupo
–COOH.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 82
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O
CH3 C OH
1. KMnO4, OH-, calor
2. H3O
tolueno ácido benzoico
3.3.7 Obtención industrial de:
Ácido oxálico
O O O
400ºC H3O
H C O Na O C C O HO C C OH
pirólisis
O O
formoato de sodio Na Na ácido oxálico
(metanoato de sodio) dietanoato de sodio (ácido dietanoico)
Ácido malónico
O O O O
NaCN H3O
Cl H2C C O Na alcohol CH2 C O Na HO C CH2 C OH
C N
cloro etanoato de sodio cianoetanoato de sodio ácido malónico
(nitriloetanoato de sodio) (ácido propanodióico)
Ácido succínico
O O
C O O
HC HC C OH
O2, ctz. O H 2O H2, Pt HO C C C C OH
óxido de vanadio CH
CH H 2 H2
(calor) C C OH
O O
buten anhídro ácido succínico
(anhídrido malónico) ácido butenodióico (ácido butanodióico)
Portillo Alva Benjaín, Leticia Colón Izquierdo. 83
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Ácido adípico
OH O
O O
HNO3 conc HNO3 conc
calor calor HO C (CH3)4 C OH
ciclohexanol ciclohexanona ácido adípico
(no aislada) (ácido hexanodioico)
Ácido tereftálico
CH3
O O
C C OH
CH3 O2 O H2O
2,3 dimetilbenceno óxido de vanadio
ó calor C
O C OH
O
anhídro benceno ácido tereftálico
naftaleno (anhídro ftálico) (ácido bencenodioico)
3.4 REACCIONES QUÍMICAS
3.4.1 Reacciones de los ácidos carboxílicos y dicarboxílicos
El ácido carboxílico consta de dos lugares, en donde los enlaces pueden fracturarse
O
conservando el grupo acilo R C o carbonilo. Las reacciones que rompen el
enlace acilo-oxidrilo pertenecen a una familia de reacciones que involucran la
sustitución nucleofílica del acilo; el reemplazo del grupo oxidrilo por otros
sustituyentes, da lugar a la formación de cloruros de acilo, amidas, ésteres, así como
anhídridos, por lo que son considerados como derivados carboxílicos; como se
muestra a continuación:
Portillo Alva Benjaín, Leticia Colón Izquierdo. 84
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O
R C OH R C Cl cloruros de acilo
O O
R C OH R C NH2 amidas
O O
R C OH R C OR´ ésteres
O O O
R C OH R C O C R´ anhídridos
3.4.2 Reducción de ácidos carboxílicos
Los ácidos se reducen a alcoholes mediante LiAlH4, que se trata de uno de los pocos
reductores que pueden realizar la conversión de un ácido carboxílico a un alcohol
primario; dicha reacción se lleva a cabo con la presencia de un éter anhídro seguido
de una hidrólisis.
RCOOH 1. LiAlH4/éter RCH2OH
2. H2O
3.4.3 Descarboxilación
La reacción por la cual el ácido carboxílico pierde CO2 se denomina
descarboxilación. Los ácidos se pueden convertir en halogenuros de alquilo con
pérdida de un átomo de carbono mediante la reacción de Hunsdiecker.
Por lo general, la reacción de Hunsdiecker se lleva a cabo tratando al ácido
carboxílico con una base de un metal pesado, como Ag2O o HgO, para formar la sal
del metal pesado, agregando después bromo o yodo y calentando la mezcla de
reacción.
R C O Ag + Br2 calor R Br + CO2 + AgBr
O
Se puede eliminar CO2 de ácidos arilcarboxílicos, colocando una mezcla de óxido de
calcio e hidróxido de sodio con un rendimiento muy pequeño.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 85
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Ar COOH NaOH/CaO ArH + CO2
La descarboxilación se lleva a cabo fácilmente y con buenos rendimientos, cuando el
carbono que está en posición β al COOH es un C = O (β-cetoácidos).
O O
RCCH2COOH calor RCHCH3 + CO2
Una reacción análoga a la anterior se trata cuando se parte de ácidos β-
dicarboxílicos.
O O
OHCCH2COOH calor CH3COH
ácido malónico
3.4.4 Reacciones de ruptura del enlace oxígeno-hidrógeno
La disociación de un ácido o de un alcohol implica la ruptura de un enlace O–H, pero
la disociación de un ácido carboxílico da un ión carboxilato con carga negativa
repartida por igual sobre dos átomos de oxígeno, en cambio sólo un oxígeno lleva la
carga negativa en el alcóxido.
3.4.5 Formación de sales
Esta reacción de los ácidos carboxílicos resulta de la acidez con la que este cuente.
Una base fuerte puede desprotonar completamente un ácido carboxílico. Los
productos son el ión carboxilato, el catión que queda de la base y agua. La
combinación de un ión carboxilato y un catión constituyen la sal de un ácido
carboxílico.
O O
+ M+ -OH - + + H2O
R C OH R C O M
ác. carboxílico base fuerte sal de ácido
Cuando los ácidos minerales son más fuertes que los ácidos carboxílicos, la adición
de ácido mineral convierte una sal de ácido carboxílico en el ácido original.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 86
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O
- + + H+ + M
+
R C O M R C OH
sal de ácido ác. regenerado
Las sales de carboxilato son solubles en agua, a menos que tengan un peso
molecular muy alto; cuando el catión es un metal alcali (Li+, Na+, K+, Rb+ ó Cs+) ó
amonio (NH4+). Las sales de metales alcalinotérreos (Mg+2, Ca+2, Ba+2), así como la
mayoría de las sales de metales pesados son insolubles en agua.
3.4.6 Reacciones de ruptura del enlace acilo-oxígeno
Este tipo de reacciones se muestran a continuación para cada uno de los casos.
Formación de derivados carboxílicos
La ruptura del enlace acilo-oxígeno de un ácido carboxílico da como resultado la
formación de sus derivados carboxílicos como son, los cloruros de acilo, ésteres,
amidas y anhídridos, que a continuación se tratarán.
O O O O O
R C Cl R C O R´ R C NH2 R C O C R
cloruro de acilo éster amida anhídrido
La sustitución nucleofílica del acilo es el mecanismo más común para interconvertir
estos derivados. Las estructuras de los derivados de ácido difieren en la naturaleza
del nucleófilo enlazado al carbono del acilo.
3.4.6.1 Cloruros de acilo
Los mejores reactivos para convertir los ácidos carboxílicos en cloruros de ácido (ó
acilo) son el cloruro de tionilo (SOCl2) y el cloruro de oxalilo (COCl2), debido a que
forman subproductos gaseosos que no contaminan al producto.
O O O
R C OH Cl S Cl R C Cl
3.4.6.2 Esteres
Portillo Alva Benjaín, Leticia Colón Izquierdo. 87
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Los cloruros de los ácidos reaccionan con alcoholes para formar ésteres a través de
una sustitución nucleófila de acilo. Esta reacción es un método eficiente que se lleva
a cabo en dos pasos para la conversión de un ácido carboxílico a éster. El ácido se
convierte en el cloruro correspondiente, que reacciona con el alcohol para producir el
éster.
O
O O Cl O
R C Cl
R C Cl + R O H R C O H R C OR´ + HCl
O R´
´R H
También se pueden obtener ésteres, mediante una esterificación de Fisher de un
ácido con un alcohol con reflujo en medio ácido.
H2SO4
R COOH + R´OH reflujo R COOR´
3.4.6.3 Amidas
El amoniaco y las aminas reaccionan con los cloruros de ácido para dar amidas. Los
ácidos carboxílicos se convierten eficientemente en amidas formando el cloruro de
ácido, el cual reacciona con una amina para formar la amida.
O O
R C Cl + R NH2 R C NH-R´
De igual manera se obtienen amidas, haciendo reaccionar directamente el ácido
carboxílico con amoniaco o aminas.
NH3 R COO-NH4 R CONH2
R COOH + R´NH2 R COO-NH3 R CONHR´
R´´ R´NH R CONR´R´´ + H2O
Portillo Alva Benjaín, Leticia Colón Izquierdo. 88
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
3.4.6.4 Anhídridos
La palabra anhídrido quiere decir “sin agua”. Un anhídrido de ácido contiene dos
moléculas de un ácido que al reaccionar pierde una molécula de agua.
La adición de agua a un anhídrido regenera dos moléculas del ácido carboxílico.
O O O O
+ + H2O
R C OH HO C R R C O C R
3.5 DERIVADOS CARBOXÍLICOS
3.5.1 Características estructurales y nomenclatura de ésteres, amidas, cloruros
de acilo y anhídridos
Esteres
Su estructura está representada de la siguiente manera.
O
R C O R´
Los nombres de los ésteres, tanto los comunes como los de UIQPA, consisten en
tres palabras que reflejan su estructura. La primera se deriva del ácido carboxílico,
en donde la terminación ico se sustituye por ato, la segunda es de y la tercera se
deriva del grupo alquilo del alcohol.
O O
O
H3C H2C C OCH3 H3C HC O C H
C O Na
CH3
propionato de metilo etanoato de 1-metiletilo
(propanato de metilo) benzoato de sodio (formiato de isopropilo)
Amidas
Las amidas se clasifican de acuerdo a los átomos de carbono que están unidos al
nitrógeno, en amidas primarias, secundarias y terciarias.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 89
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O H O R´´
R C NH2 R C N R´ R C N R´
amida secundaria amida terciaria
amida primaria (amida N-sustituída) (amida N,N-disustituída)
Para dar el nombre a una amida primaria, se menciona primero el ácido
correspondiente. Se elimina la palabra ácido y el sufijo ico, o el sufijo oico del nombre
del ácido carboxílico y se agrega el sufijo amida. Las amidas secundarias y terciarias
se nombran tratando a los grupos alquilo en el nitrógeno como sustituyentes,
especificando su posición mediante el prefijo N. Ejemplos:
O O O
H3C C NH2 H3C C N(CH3)2 H C NH CH2CH3
etanamida N,N-dimetiletanamida N-etilmetanamida
(acetamida) (N,N-dimetilacetamida) (N-etilformamida)
Cloruros de acilo (ó cloruros de ácido)
Su estructura está representada de la siguiente manera:
O
R C Cl
Su nombre se forma al eliminar la terminación del ácido –ico tanto del nombre común
como de el de la UIQPA del ácido carboxílico correspondiente, aumentando la del
cloruro –ilo. Ejemplos:
O H O O
H3C C Cl H3C HC C C Cl C
CH3 Cl
cloruro de etanoilo cloruro de 3-metilbutanoilo
(cloruro de acetilo) (cloruro de beta-metilbutirilo) cloruro de benzoilo
En sistemas complejos, si un ácido se denomina con las palabras ácido carboxílico,
el cloruro de acilo correspondiente forma su nombre al sustituir el del ácido
carboxílico por cloruro de carbonilo. Ejemplo:
Portillo Alva Benjaín, Leticia Colón Izquierdo. 90
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O
C
Cl cloruro ciclocarbonilo
Es posible preparar bromuros y yoduros de acilo mediante reacciones análogas
usadas en la preparación con los cloruros, pero rara vez son utilizados.
Como propiedades físicas, los cloruros de acilo presentan un olor nocivo,
especialmente algunos de los de menor peso molecular, que son volátiles, debido a
que reaccionan con la humedad del aire fácilmente y experimentan la hidrólisis con el
objetivo de producir ácido clorhídrico.
Anhídridos
Los anhídridos presentan la siguiente estructura:
O O
R C O C R
La nomenclatura de los anhídridos es muy simple: se cambia la palabra ácido por
anhídrido tanto en el nombre común como en el nombre UIQPA, que no es frecuente
usarla. Ejemplos:
O O
O O O O
H3C C O C CH3
O O
anhídrido etanoico anhídrido1,2-bencenodioico anhídrido 2-butenodioico
(anhídrido acético) (anhídrido ftálico) (anhídrido maléico)
Los anhídridos formados de dos moléculas de ácidos distintos se llaman anhídridos
mezclados, y para nombrarlos se emplean los nombres de los ácidos individuales.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 91
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O O O
H3C C O C H H3C C O C
anhídrido etanoicometanoico anhídrido benzoicoetanoico
(anhídrido acéticofórmico) (anhídrido acéticobenzoico)
3.5.2 Propiedades físicas
Puntos de ebullición y puntos de fusión
La Gráfica 3.1 muestra los puntos de ebullición de derivados de ácidos simples en
función de sus pesos moleculares; para comparar, se incluyen los n-alcanos. Note
que los ésteres y los cloruros de acilo tienen sus puntos de ebullición cercanos a los
de los alcanos de cadena recta y peso molecular semejante.
Gráfica.3.1 Puntos de ebullición en derivados ácido, en función de su peso
molecular.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 92
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Fuente: WADE JR., L. G. 2004. Química orgánica. Ed. Prentice-Hall, Madrid, España, Pág.
948.
Estos derivados de ácidos carboxílicos contienen grupos carbonilos muy polares,
pero esa polaridad tiene un efecto mínimo sobre los puntos de ebullición. Los ácidos
carboxílicos forman puentes de hidrógeno fuertes en fase líquida, lo que ocasiona
puntos de ebullición altos. El dímero, enlazado por puente de hidrógeno, tiene un
peso molecular efectivo mayor y necesita de mayor temperatura para que se
presente la ebullición. Los nitrilos también tienen mayores puntos de ebullición que
los ésteres y los cloruros de ácido de peso molecular semejante. Este efecto es el
resultado de una fuerte asociación dipolar entre los grupos ciano adyacentes. Las
amidas tienen puntos de ebullición y de fusión muy altos, aún cuando las amidas
terciarias puras no pueden participar en los puentes de hidrógeno (porque no tienen
Portillo Alva Benjaín, Leticia Colón Izquierdo. 93
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
enlaces N-H), tienen puntos de ebullición cercanos a los de los ácidos carboxílicos
de peso molecular semejante. Estos puntos de ebullición altos son el resultado de la
naturaleza polar de estas sustancias.
Solubilidad
Los derivados de ácido (ésteres, cloruros de ácido, anhídridos, nitrilos y amidas) son
solubles en solventes orgánicos ordinarios, como el alcohol, éteres e hidrocarburos
aromáticos. Sin embargo, los cloruros de ácido y los anhídridos no se pueden
emplear en solventes nucleófilos como el agua y el alcohol, porque reaccionan con
ellos.
3.5.3 Reacciones de los derivados carboxílicos
3.5.3.1 Reacciones de los ésteres
Hidrólisis
La adición de exceso de agua desplaza el equilibrio hacia la formación de ácido y
alcohol. A la hidrólisis de los ésteres se le nombra saponificación (del latín saponis;
jabón). El ión hidroxilo ataca al grupo carbonilo para formar intermedio tetraédrico, la
eliminación del ión alcóxido da lugar al ácido y una transferencia rápida de protones,
dando lugar al ión carboxilato y al alcohol, dicha transferencia de protones es muy
exotérmica, haciendo que se complete la saponificación.
El jabón se obtiene a través de una hidrólisis básica de las grasas (ésteres de ácidos
carboxílicos de cadena larga), con glicerol.
O H2O O
R´OH
R C OR´ (H3O o NaOH) R C OH +
Ejemplo:
O O
C OCH3 H3O C OH
+ H2O + CH3OH
Portillo Alva Benjaín, Leticia Colón Izquierdo. 94
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Amonólisis
Los ésteres sufren la sustitución nucleofílica en sus átomos de carbono acilo, cuando
se tratan con amoniaco, o con aminas primarias y secundarias. Estas reacciones son
lentas a comparación de los cloruros de acilo.
O O
+ NH3 R´OH
R C OR´ R C NH2 +
Alcohólisis (transesterificación)
Cuando un éster se trata con un alcohol diferente en presencia de un catalizador
ácido, los dos grupos –OH se pueden intercambiar, produciendo un equilibrio que se
desplaza hacia el éster que se desee obtener utilizando un gran exceso del alcohol
deseado o eliminando el otro alcohol.
La transesterificación, también se produce en condiciones básicas, catalizada por
una cantidad pequeña de ión alcóxido.
O (H3O o OR´´) O
+ R´OH R´OH
R C OR´ R C OR´´ +
Reactivos organometálicos
Los reactivos organometálicos y grignard se adicionan doblemente en forma
sucesiva a los ésteres para formar alcóxidos y así protonarlos dando lugar a los
alcoholes
O R´´
1) 2R´´MgX, ó 2R´´Li R´OH
R C OR´ R C OH +
2) H3O
R´´
Reducción total hacia alcoholes primarios
Portillo Alva Benjaín, Leticia Colón Izquierdo. 95
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Los ésteres pueden reducirse mediante el uso de hidruro de litio y aluminio, ya que
es el método más factible a pequeña escala (laboratorio) como se muestra en la
siguiente reacción.
O
1) LiAlH4, éter
R C OR´ R CH2 OH + R´OH
2) H2O
Ejemplo:
O
C OCH3 CH2OH
+ H2O 1) LiAlH4, éter + CH3OH
2) H3O
Pero también los ésteres se pueden producir por medio de la hidrogenación a
presión elevada, que se trata de una reacción usada para procesos industriales,
conocida con el nombre de hidrogenólisis, ya que en el proceso se descompone un
enlace C-O.
O
CuO.CuCr2O4
R C OR´ + H2 R CH2 OH + R´OH
175ºC, 500 psi
Condensación de claisen (formación de β-cetoésteres)
Los ésteres con hidrógenos α pueden dar reacciones de autocondensación dando
origen a los β-cetoésteres.
La condensación de un éster es semejante a la aldólica, la diferencia entre estas
recae en que el grupo –OR de un éster puede actuar como grupo saliente; dando
como resultado una sustitución, mientras que en las condensaciones aldólicas se
llevan a cabo adiciones. Teniendo en cuenta que tanto en un éster como un aldehído
o cetona, un hidrógeno es débilmente ácido, el grupo carbonilo ayuda a acomodar la
Portillo Alva Benjaín, Leticia Colón Izquierdo. 96
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
carga negativa del carbanión a través de la resonancia, se muestra la siguiente
reacción.
O O O
R H2C C OR´ R HC C OR´ R HC C OR´
ion enolato de éster
O
R H2C C OR´
O O O R O
R H2C C CH C OR´ R H2C C CH C OR´
OR´ R beta-ceto-éster
Para los ésteres este tipo de reacción representa la equivalencia exacta de la
condensación aldólica, aunque al final el producto es diferente, pero típica de la
química de compuestos de acilo. Un ejemplo específico, es el que se muestra
enseguida entre el acetato de etilo y el etóxido de sodio, para formar el β-
cetobutirato.
O O
C2H5OH H
2CH3COOC2H5 + Na OC2H5 H3C C CHCHOOC2H5 Na H3C C CH2COOC2H5
acetato de etilo etóxido de sodio éster sodioacetoacético acetatoacetato de etilo
(éster acetoacético)
un β-cetoéster
+ 2C2H5OH
3.5.3.2 Reacciones de las amidas
Hidrólisis
Las amidas se hidrolizan a ácidos carboxílicos tanto en condiciones ácidas como en
básicas, debido a que se trata de los derivados de ácido más estables, la reacción
requiere condiciones más fuertes en comparación con un éster.
O O
H3O ó NaOH
R C NH R´ + H2O R C OH + R´NH2
Portillo Alva Benjaín, Leticia Colón Izquierdo. 97
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Ejemplo:
O O
H O
H3C C NH2 + H2O 3 H3C C OH + NH4
Reducción total hacia aminas
La reducción se lleva a cabo mediante el hidruro de litio y aluminio reduciendo las
amidas a aminas, aportando una de las mejores rutas sintéticas de aminas. Como se
verá a continuación las amidas primarias se reducen a aminas primarias, las
secundarias a aminas secundarias y las amidas terciarias a aminas terciarias.
O
1) LiAlH4
R C NH2 R C NH2
2) H2O
H2
O
1) LiAlH4
R C NH R´ R C NHR´
2) H2O
H2
O
1) LiAlH4
R C N R2´ R C NR2´
2) H2O
H2
Transposición de Hofmann
O
Br2 o Cl2, NaOH, H2O, 75ºC
R C NH2 R NH2 + CO2
También llamado reordenamiento de Hoffmann, se trata de un proceso en presencia
de una base fuerte, donde las amidas primarias reaccionan con bromo o cloro para
dar lugar a aminas, con la pérdida del átomo de carbono carbonílico. Este tipo de
reacción se usa para sintetizar alquil aril y arilaminas primarias, dando lugar a aminas
primarias con grupos alquilo primarios, secundarios o con arilaminas.
Hidrólisis de nitrilos
Los nitrilos se hidrolizan a amidas y posteriormente a ácidos carboxílicos; pero si las
condiciones son suaves, el nitrilo sólo se hidroliza a amida.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 98
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
-
O
OH
R C N R C NH2
H2O
3.5.3.3 Reacciones de los cloruros de acilo
Hidrólisis
Los cloruros de acilo son muy reactivos y debido a ello se hidrolizan en condiciones
neutras, por lo que generalmente la hidrólisis es una reacción colateral no deseada
que se produce si en el medio de reacción existe humedad; dicha hidrólisis se puede
evitar almacenando los cloruros de acilo en recipientes secos bajo atmósfera de
nitrógeno seco, utilizando disolventes y reactivos anhídros. Las condiciones
anteriores también aplican a los anhídridos.
O O
H2O
R C Cl R C OH + HCl
Ejemplo:
O O
C Cl C OH
+ H2O + HCl
Acilación de Friedel-Crafts
Se trata de un medio efectivo para introducir un grupo acilo en un anillo aromático,
frecuentemente la reacción se lleva a cabo mediante el tratamiento del compuesto
aromático con un haluro de acilo; a menos que el compuesto sea muy reactivo, la
reacción también requiere de la adición de por lo menos un equivalente de un ácido
de lewis como el AlCl3, el producto de la reacción es una arilcetona.
O O
AlCl3
R C Cl + Ar-H R C Ar + HCl
Portillo Alva Benjaín, Leticia Colón Izquierdo. 99
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Reducción
Si los cloruros se tratan con tri-terc-butoxialuminio de litio a -78ºC, es posible
reducirlos hasta aldehídos; desde el punto de vista del mecanismo de reacción, la
reducción es producto de la transferencia de un ion hidruro desde el átomo de
aluminio hasta el carbono del carbonilo del cloruro de acilo, posteriormente mediante
la hidrólisis liberando el aldehído correspondiente.
O O
1.LiAlH(OC(CH3)3)3
R C Cl 2.H2O
R C H
Formación de amidas
Las aminas primarias, secundarias y el amoniaco, reaccionan rápidamente con los
cloruros de acilo para formar amidas, la reacción se lleva a cabo mediante un exceso
de amina o amoniaco para neutralizar el HCl que se formaría de otra manera.
Este método es el de más amplia aplicación en el laboratorio para la síntesis de
amidas. Esta reacción comúnmente tiene lugar a temperatura ambiente o por debajo
de ella, produciendo una amida de alto rendimiento.
O O
R´
R C Cl + R´R´´NH R C N
R´´
R´, R´´: grupo alquilo, arilo o hidrógeno
Formación de ésteres
Los ésteres se sintetizan por la reacción de cloruros de acilo con los alcoholes,
puesto que los primeros son más reactivos ante la sustitución nucleofílica que los
ácidos carboxílicos; este tipo de reacción ocurre con rapidez y no requiere de
catalizador ácido, comúnmente se adiciona piridina a la mezcla de reacción para que
reaccione con el HCl que se forma.
O O
condición neutra
R C Cl + (Ar) R´-OH ó básica R C OR´ (Ar)
Portillo Alva Benjaín, Leticia Colón Izquierdo. 100
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Formación de anhídridos
Los ácidos carboxílicos reaccionan con los cloruros de acilo en presencia de piridina
para formar anhídridos, este método se usa frecuentemente en laboratorio, es muy
general y se emplea para preparar anhídridos mixtos o anhídridos simples.
O
R C
O O
+ + O + Cl
R C OH ´R C Cl
N ´R C N
O H
Las sales de sodio de los ácidos carboxílicos también reaccionan con los cloruros de
acilo para dar anhídridos, en esta reacción el ion carboxilato actúa como nucleófilo y
produce una reacción de sustitución nucleofílica en el carbono acilo del cloruro de
acilo. Es posible preparar anhídridos cíclicos por el simple calentamiento del ácido
carboxílico adecuado, sin embargo, este método sólo es efectivo cuando la
formación del anhídrido genera un anillo de 5 o 6 miembros.
O
O O R C
+ disolvente
R C Cl ´R C O M polar O + M Cl
´R C
O
3.5.3.4 Reacciones de los anhídridos
Hidrólisis
Como se vio en la parte de hidrólisis de cloruros de acilo, los anhídridos presentan
las mismas características para este tipo de reacción, en la formación del respectivo
ácido.
O O O
R C O C R + H2O 2 R C OH
Ejemplo:
Portillo Alva Benjaín, Leticia Colón Izquierdo. 101
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O O
H3C C O C CH3 + H2O 2 H3C C OH
Alcohólisis
Los anhídridos reaccionan con los alcoholes para formar ésteres en ausencia de un
catalizador ácido. La reacción de un alcohol con un anhídrido o un cloruro de acilo es
con frecuencia el mejor método de preparación de un éster. Los anhídridos cíclicos
reaccionan con un equivalente molar de algún alcohol para formar compuestos que
son ésteres y ácidos a la vez.
O O O O
R C O C R + R´OH R C OR´ + R C OH
Formación de amidas
Los anhídridos ácidos reaccionan con el amoniaco, con las aminas primarias y con
las secundarias para formar amidas a través de reacciones análogas a las de los
cloruros de acilo.
O O O O
R C O C R + 2NH3 R C NH2 + R C O NH4
O O O O
R C O C R + 2R´NH2 R C NHR´ + R C O R´NH3
O O O O
R C O C R + 2R´NH R C NR´ + R C O R´R´´NH2
R´´ R´´
Los anhídridos cíclicos reaccionan con el amoniaco o una amida de la misma forma
que los anhídridos acíclicos, sin embargo la reacción genera un producto que es a la
vez una amida y una sal de amonio, la acidificación de la sal de amonio da un
compuesto tanto amida como ácido.
Portillo Alva Benjaín, Leticia Colón Izquierdo. 102
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
3.5.4 Cloruros de acilo como intermediarios en la preparación de derivados
carboxílicos
Tomando en cuenta que la reacción de un cloruro de ácido con amoniaco forma una
amida primaria; con una amina primaria esta reacción da una amida secundaria; y
con una amina secundaria da una amida terciaria, a parte se pueden tener las
siguientes conversiones.
Conversión de un cloruro de ácido en anhídrido
O O O O O O
R C Cl + HO C R´ R C Cl R C R C O C R´ + HCl
O O O O
cloruro de acilo ácido H C H C anhídrido
R´ - R´
Cl
Conversión de un cloruro de ácido en un éster
O O O O
R C Cl + HO R´ R C Cl R C R C O R´ + HCl
O O
cloruro de acilo alcohol H R´ H R´ éster
-
Cl
Conversión de un cloruro de ácido en amida
O O O O
R C Cl + H N R´2 R C Cl R C R C N R´2 + HCl
cloruro de acilo amina
H N R´2 H N R´2
amida
Cl
Portillo Alva Benjaín, Leticia Colón Izquierdo. 103
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
3.6 EJERCICIOS PROPUESTOS
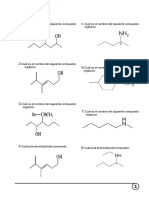
A.- Escriba el nombre de las siguientes estructuras químicas:
O 3.- CH3(CH2)16COOH
C H
1.- 4.- CH3CH2COOH
O
C OH COOH
5.-
2.- Cl
Portillo Alva Benjaín, Leticia Colón Izquierdo. 104
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O O COOH
C OH
6.- CH2CH2CH3
13.-
O
COOH
C OH
7.- CH3
14.-
O
COOH
C OH OH
8.-
15.-
O
C OH COOH
9.-
O
H2N C OH
10.- NH2
16.-
H3CH2C H
C C
11.- H3C CH2COOH
H
C C
12.- H COOH
B.- Escriba la estructura de los siguientes compuestos químicos
1.- Ác. butírico 5.- Ác. cis-1,3-ciclopentano
dicarboxílico
2.- Ác. α-etilbutírico
6.- Ác. (9Z,12Z)-octadecadienoico
3.- Ác. laúrico
7.- Ác. 2,5-dimetilhexanodioico
4.- Ác. o-hidroxibenzoico
8.- trans-1,2-ciclobutanedicarboxilico
Portillo Alva Benjaín, Leticia Colón Izquierdo. 105
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
9.- Ác. 3-propilhexanoico 15.-4-pentenamida
10.- Ác. 4,5-dibromopentanoico 16.- Ciclohexilacetamida
11.- Ác. 3,3-dimetilbutanoico 17.-Propanato de etilo
12.-Anhídrido benzoico 18.-2-metilbutanonitrilo
13.- Anhídrido ftálico
14.- Cloruro de 4-metilpentanoilo
C.- Complete las siguientes reacciones:
Br 1.- Mg, éter
2.- CO2, éter
3.- H3O+
1.-
1.- NaCN
Br 2.- H3O+
2.-
1.- Mg, éter
2.- CO2, éter
(CH3)3CCl
3.- 3.- H3O+
KMnO4/H2SO4
OH
4.-
1.- LiAlH4
2.- H3O+
1.- CH3MgBr
H3C COOH
2.- H3O+
NaOH/CaO
5.-
O
1.- CH3MgBr
N 2.- H3O+
6.- H
O
C OH
Cl
+
7.-
Portillo Alva Benjaín, Leticia Colón Izquierdo. 106
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
O + CH3NH2
8.- O
O
C
Cl + CH NH
3 2
9.-
O
1.- LiAlH4
C OCH3 2.- H3O+
10.-
D.- Los dos analgésicos que tienen mayor demanda son la aspirina y el
acetaminofen. Indique cómo podría sintetizarlos a partir de fenol.
O
O
O C CH3
NH C CH3
COOH
aspirina HO acetaminofen
E.- Indique cómo se podrían lograr las siguientes síntesis. Algunas de ellas necesitan
más de un paso.
1.- Alcohol isopropílico acetato de isopentanonitrilo
2.- Isobutilamina N-isobutilformamida
3.- Acetato de etilo 3-metil-3-pentanol
4.- Bromociclohexano diclorohexilmetanol
CH2OH CN
5.-
F.- Predecir los productos de la saponificación de los siguientes ésteres.
O O
C
1.- H C Ph 2.- O O
Portillo Alva Benjaín, Leticia Colón Izquierdo. 107
UNIDAD 3 ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
3.- O O
O
O C CH3
4.-
O
CH2 O C (CH2)12CH3
O
CH O C (CH2)12CH3
O
5.- CH2 O C (CH2)12CH3
Portillo Alva Benjaín, Leticia Colón Izquierdo. 108
You might also like
- Practica #5 Nitracion Del Benceno Q. Aromatica.Document3 pagesPractica #5 Nitracion Del Benceno Q. Aromatica.jesusbernalort100% (1)
- Acidos CarboxilicosDocument34 pagesAcidos CarboxilicosRenato KmtyNo ratings yet
- Unidad 5 Acidos CarboxilicosDocument72 pagesUnidad 5 Acidos CarboxilicosCarlos BalcazarNo ratings yet
- Compuestos AromáticosDocument105 pagesCompuestos AromáticosJaznine FloresNo ratings yet
- Grupos FuncionalesDocument19 pagesGrupos FuncionalesLucero Gonzales MelendezNo ratings yet
- Informe 6Document6 pagesInforme 6daniellgb96No ratings yet
- Tema4 Eteres y EpoxidosDocument16 pagesTema4 Eteres y EpoxidosGioSntoNo ratings yet
- Reacciones de caracterización de alcoholes y fenolesDocument38 pagesReacciones de caracterización de alcoholes y fenolesCarmenNo ratings yet
- G1 CromatografiaDocument13 pagesG1 CromatografiaMaicol Huaman CondoriNo ratings yet
- Tarea Quimica Inorganica Takeshi Raez Yseki REACCIONES PRACTICA REDOXDocument4 pagesTarea Quimica Inorganica Takeshi Raez Yseki REACCIONES PRACTICA REDOXTakeshi Diego Raez YsekiNo ratings yet
- Informe de Quimica InorganicaDocument13 pagesInforme de Quimica InorganicaMaria Soledad Ataypoma FernandezNo ratings yet
- Práctica No.2 Obtención Del N-ButanolDocument23 pagesPráctica No.2 Obtención Del N-ButanolDiana Galván HerreraNo ratings yet
- Practica 10Document4 pagesPractica 10Liliana Tello PortillaNo ratings yet
- UntitledDocument3 pagesUntitledTatiana Delesma100% (1)
- Practica de LaboratorioDocument11 pagesPractica de LaboratorioCristhian Pablo Carpio BanegasNo ratings yet
- Informe Nitrogenoides - Grupo 5Document9 pagesInforme Nitrogenoides - Grupo 5DANIELA VANESSA HERMOZA SAAZNo ratings yet
- Acidos CarboxilicosDocument14 pagesAcidos CarboxilicosCamiLorenaNo ratings yet
- Practica 12, Acido MaleicoDocument14 pagesPractica 12, Acido Maleicokatyrojas20100% (2)
- Informe 9Document5 pagesInforme 9thalia troncosNo ratings yet
- Informe de Practica #2Document13 pagesInforme de Practica #2karenNo ratings yet
- Cloruros de ácido: síntesis y aplicaciones en ésteres y amidasDocument3 pagesCloruros de ácido: síntesis y aplicaciones en ésteres y amidasGustavo JuCa100% (1)
- Ejercicios de Aplicacion de AlcoholesDocument2 pagesEjercicios de Aplicacion de AlcoholesKathia Yudith Requejo PeraltaNo ratings yet
- AcetonaDocument13 pagesAcetonaMiriam Llanque CallisayaNo ratings yet
- Azufre Lab. 3Document6 pagesAzufre Lab. 3Daniela Ancajima Ruiz100% (1)
- Quimica Hidrocarburos Aromaticos Guia 2Document3 pagesQuimica Hidrocarburos Aromaticos Guia 2Ricardo AndresNo ratings yet
- conPRACTICA AZUFRE - DocxinorganicaDocument28 pagesconPRACTICA AZUFRE - DocxinorganicaElva Roxana Chavez LiñanNo ratings yet
- Practica 3 Quimica Organica IiDocument28 pagesPractica 3 Quimica Organica IiTatiana DelesmaNo ratings yet
- Reglas de SeguridadDocument7 pagesReglas de SeguridadGunar MurilloNo ratings yet
- Reacciones Vía Carbanión-EnolatoDocument29 pagesReacciones Vía Carbanión-EnolatoJuan Jay CasalNo ratings yet
- BENZOPINACOL FarmacoquimicaDocument5 pagesBENZOPINACOL FarmacoquimicaSamira NamiNo ratings yet
- Reactivo de FehlingDocument4 pagesReactivo de FehlingMauricio BetancourNo ratings yet
- PRACTICA #11 Chanzapa SANPONIFICACIONDocument8 pagesPRACTICA #11 Chanzapa SANPONIFICACIONGABY GAMES YTNo ratings yet
- Alcaloides Derivados de La Fenilalanina y TirosinaDocument14 pagesAlcaloides Derivados de La Fenilalanina y TirosinaSergio Llontop OrdoñezNo ratings yet
- Compostaje: Proceso y Factores ClaveDocument8 pagesCompostaje: Proceso y Factores ClaveAlex DuraznoNo ratings yet
- Practica Sintesis de Ciclohexanona OrganicaDocument8 pagesPractica Sintesis de Ciclohexanona OrganicaWalter Cerna Quevedo67% (3)
- Cinética de La Hidrólisis Del Acetato de MetiloDocument8 pagesCinética de La Hidrólisis Del Acetato de MetiloRichard Cáceres100% (1)
- OligosacáridosDocument1 pageOligosacáridosGrupoDeApoyoIngenieriaCivilNo ratings yet
- Acido CitricoDocument10 pagesAcido CitricoDenis Garcia GarciaNo ratings yet
- Laboratorio Funciones InorganicasDocument3 pagesLaboratorio Funciones InorganicasKEISSY MILETH AVILEZ AGUILERANo ratings yet
- 2.1 Marco Teórico: Ii. Práctica No. 2 Caracterización de AzucaresDocument9 pages2.1 Marco Teórico: Ii. Práctica No. 2 Caracterización de AzucaresNicko Piero Q C100% (1)
- Cromatografia en Capa FinaDocument4 pagesCromatografia en Capa FinaGerardo MartínezNo ratings yet
- Practica 9 - Quimica Organica Analitica FuncionalDocument21 pagesPractica 9 - Quimica Organica Analitica FuncionalcristianNo ratings yet
- Quimica Analitica Cuantitativa 15Document19 pagesQuimica Analitica Cuantitativa 15JuanYupanquiBNo ratings yet
- Metales AlcalinosDocument5 pagesMetales AlcalinosJossue valdiviaNo ratings yet
- Acidos CarboxilicosDocument15 pagesAcidos Carboxilicosasp70% (33)
- Obtención de La Benzofenona Por Síntesis de Friedel-CraftsDocument8 pagesObtención de La Benzofenona Por Síntesis de Friedel-CraftsIxchelRivero33% (3)
- Oxidación de lípidos y reacción de Maillard: procesos de deterioro de alimentosDocument7 pagesOxidación de lípidos y reacción de Maillard: procesos de deterioro de alimentosNorberto Barragan DíazNo ratings yet
- CloroformoDocument5 pagesCloroformoBryanDuqueÁlvarez100% (1)
- PDF Practica 11 CompressDocument4 pagesPDF Practica 11 CompressRodolfo Mayo Quispe100% (1)
- Nitrocompuestos: Características y usosDocument6 pagesNitrocompuestos: Características y usoshalina pradaNo ratings yet
- 1ra Tarea de Qo-Iii-Fb5mDocument1 page1ra Tarea de Qo-Iii-Fb5mthalia troncos100% (1)
- Compuestos Oxigenados.Document8 pagesCompuestos Oxigenados.Lisbeth VallejoNo ratings yet
- Expocision NitrogenoidesDocument27 pagesExpocision NitrogenoidesolgaNo ratings yet
- Propiedades y usos del elemento rubidioDocument7 pagesPropiedades y usos del elemento rubidioEfrain Trujillo ChambiNo ratings yet
- Sal de SodaDocument5 pagesSal de SodaLalin Jr Silva RomanNo ratings yet
- Acidos Carboxilicos02Document41 pagesAcidos Carboxilicos02Ronald Remon Cruz100% (1)
- 7 - Clase Acidos CarboxilicosDocument64 pages7 - Clase Acidos CarboxilicosMiguel FerreiraNo ratings yet
- Obtención de Un Ácido CarboxílicoDocument17 pagesObtención de Un Ácido CarboxílicoCZCASEZATNo ratings yet
- 22 Semana 2017 IfddcDocument40 pages22 Semana 2017 IfddcG.CNo ratings yet
- Ácidos carboxílicos: características, clasificación, nomenclaturaDocument86 pagesÁcidos carboxílicos: características, clasificación, nomenclaturaAndrea Herrera NogalesNo ratings yet
- El Sol Como EstrellaDocument1 pageEl Sol Como EstrellaAlejandrov RocenNo ratings yet
- La LuzDocument1 pageLa LuzAlejandrov RocenNo ratings yet
- Guia Calculo de Suavizadores de AguaDocument6 pagesGuia Calculo de Suavizadores de AguaAlex Pq100% (1)
- 340 ManualDocument14 pages340 ManualHugo Rosano MoralesNo ratings yet
- Catalogo XibuDocument78 pagesCatalogo XibuAlejandrov RocenNo ratings yet
- Careta Diadema PDFDocument2 pagesCareta Diadema PDFAlejandrov RocenNo ratings yet
- Influencia de las fases lunares en la agriculturaDocument17 pagesInfluencia de las fases lunares en la agriculturaSamanta Nada100% (5)
- HttpsDocument1 pageHttpsAlejandrov RocenNo ratings yet
- Serie Arenka Ficha TécnicaDocument1 pageSerie Arenka Ficha TécnicaAlejandrov RocenNo ratings yet
- Philips - Decorativos PDFDocument80 pagesPhilips - Decorativos PDFAlejandrov RocenNo ratings yet
- T Series Filter Leaflet SpanishDocument2 pagesT Series Filter Leaflet SpanishAlejandrov RocenNo ratings yet
- Mi Manual de InstalacionDocument8 pagesMi Manual de InstalacionAlejandrov RocenNo ratings yet
- Los Conectores de TiempoDocument8 pagesLos Conectores de TiempoAlejandrov RocenNo ratings yet
- FT Ficha TecnicaDocument5 pagesFT Ficha TecnicaAlejandrov RocenNo ratings yet
- Procedimientos del Departamento de Farmacia y Nutrición Clínica del HRAEPYDocument51 pagesProcedimientos del Departamento de Farmacia y Nutrición Clínica del HRAEPYAlejandrov RocenNo ratings yet
- Weg PDFDocument1 pageWeg PDFAlejandrov RocenNo ratings yet
- FT Ficha Tecnica PRISMA 35NDocument8 pagesFT Ficha Tecnica PRISMA 35NMaynor Orestes Torres Espinoza100% (1)
- Proyecto Oasis Exprés 2020Document6 pagesProyecto Oasis Exprés 2020Alejandrov RocenNo ratings yet
- Info ConoceRIF+18062020Document1 pageInfo ConoceRIF+18062020Alejandrov RocenNo ratings yet
- TiburonDocument1 pageTiburonAlejandrov RocenNo ratings yet
- OsosDocument1 pageOsosAlejandrov RocenNo ratings yet
- Hydron HLE-4040Document1 pageHydron HLE-4040Alejandrov RocenNo ratings yet
- AguilasDocument1 pageAguilasAlejandrov RocenNo ratings yet
- Determinaciones químicas agua purificaciónDocument1 pageDeterminaciones químicas agua purificaciónAlejandrov RocenNo ratings yet
- San PedroDocument1 pageSan PedroAlejandrov RocenNo ratings yet
- CobrarDocument1 pageCobrarAlejandrov RocenNo ratings yet
- CobrarDocument1 pageCobrarAlejandrov RocenNo ratings yet
- Arcangel MiguelDocument1 pageArcangel MiguelAlejandrov RocenNo ratings yet
- Oracion Espiritu SantoDocument1 pageOracion Espiritu SantoAlejandrov RocenNo ratings yet
- Jesus de NazaretDocument2 pagesJesus de NazaretAlejandrov RocenNo ratings yet
- Espectroscopía UV-Vis e IR de compuestos orgánicosDocument37 pagesEspectroscopía UV-Vis e IR de compuestos orgánicosAngel HernandezNo ratings yet
- Compuestos Del NitrogenoDocument40 pagesCompuestos Del NitrogenonancyNo ratings yet
- Quimica OrgánicaDocument44 pagesQuimica OrgánicaBreendaaGuurrolaaNo ratings yet
- Comp NitrogenadosDocument4 pagesComp NitrogenadosEduardo Lozano MelchorNo ratings yet
- Práctica #11. Hidrólisis de La Nitro-Acetanilida FinalDocument9 pagesPráctica #11. Hidrólisis de La Nitro-Acetanilida FinalGetsa ContrerasNo ratings yet
- AlquenosDocument5 pagesAlquenosdaniloNo ratings yet
- Anexo 2 - Grupo 65 - QDocument14 pagesAnexo 2 - Grupo 65 - QLeidy Rocio Betancourth JaimesNo ratings yet
- Organica 2Document9 pagesOrganica 2ABRAHÁM CARMELO CASTILLA SILVESTRENo ratings yet
- Funciones, Grupos Organicos y Tipos de Cadenas CarbonatadasDocument21 pagesFunciones, Grupos Organicos y Tipos de Cadenas CarbonatadasMarianNo ratings yet
- Alquenos InformaciónDocument3 pagesAlquenos InformaciónTamara SirethNo ratings yet
- Evc-506 IpaDocument2 pagesEvc-506 IpaRAULNo ratings yet
- Compuestos orgánicos del azufre: tioles y aplicacionesDocument6 pagesCompuestos orgánicos del azufre: tioles y aplicacionesFábio Celso Mondlane100% (1)
- Espectroscopia infrarroja de hidrocarburos alifáticos y aromáticosDocument23 pagesEspectroscopia infrarroja de hidrocarburos alifáticos y aromáticosRENATO JAIR COSTA MINGANo ratings yet
- Taller Química OrgánicaDocument4 pagesTaller Química OrgánicaJason De La Gala RetamozoNo ratings yet
- Acido GrasoDocument9 pagesAcido GrasoLuzma CieloNo ratings yet
- Tema 1 Química OrgánicaDocument9 pagesTema 1 Química OrgánicaPablo CamisaNo ratings yet
- Lista de productos almacenados en planta GTM EcuadorDocument33 pagesLista de productos almacenados en planta GTM EcuadorGuillermoNo ratings yet
- Aldehidos y CetonasDocument6 pagesAldehidos y CetonasLia CanoNo ratings yet
- Funciones Oxigenadas OrgánicasDocument4 pagesFunciones Oxigenadas OrgánicasRomay Vera Jhamil ErickNo ratings yet
- Sintesis Organica FundamentalDocument49 pagesSintesis Organica FundamentalMarco Antonio MorenoNo ratings yet
- Atomo Del CarbonoDocument2 pagesAtomo Del CarbonoEdgard Fredy Mamani CosiNo ratings yet
- Aldehidos y CetonasDocument41 pagesAldehidos y CetonasJuan MurilloNo ratings yet
- Derivados Funcionales de Los Acidos CarboxilicosDocument41 pagesDerivados Funcionales de Los Acidos CarboxilicosLeandro FrisanchoNo ratings yet
- Obtencion de Benzoina 2Document2 pagesObtencion de Benzoina 2zethNo ratings yet
- Kami Export - Smcadena - TALLER - Alcoholes - Éteres Fenoles y TiolesDocument4 pagesKami Export - Smcadena - TALLER - Alcoholes - Éteres Fenoles y TiolesDiego PeñaNo ratings yet
- Unidad 2. Ácidos Carboxílicos QO II 2020Document79 pagesUnidad 2. Ácidos Carboxílicos QO II 2020Gabriela PinedaNo ratings yet
- Cuadernillo-15 Bio DocentesDocument4 pagesCuadernillo-15 Bio DocentesTeofilo Donaires FloresNo ratings yet
- Guía de Ejercicios Hidrocarburos AlcanosDocument6 pagesGuía de Ejercicios Hidrocarburos AlcanosRafael Emilio Chacon GalanNo ratings yet
- PRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Document34 pagesPRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Isabella Giraldo100% (2)
- Alcoholes: propiedades, tipos y usosDocument28 pagesAlcoholes: propiedades, tipos y usosLauraNo ratings yet