Professional Documents
Culture Documents
Solver
Uploaded by
ignaciovelasquezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Solver
Uploaded by
ignaciovelasquezCopyright:
Available Formats
SOLVER
Ing. Ignacio Velásquez Soza
Departamento de Procesos Industriales
Universidad Autónoma Juan Misael Saracho
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
A.6. Solver
Solver es uno de los complementos (add ins) que ofrece la aplicación Excel,
permite realizar operaciones de cierta complejidad matemática, que van más allá
de las aplicaciones clásicas del gran adelanto que significó la planilla de cálculo
para los cómputos de administración y de ingeniería.
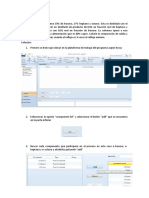
Para aplicar el Solver se debe visibilizarlo utilizando el Menú: Herramientas
– Complementos y en la forma que aparece se debe tildar el Solver. Una vez
hecho esto, cada vez que uno utiliza el menú Herramientas aparecerá Solver
como alternativa directamente disponible en el menú.
Si no se encuentran los complementos se recomienda buscar la ayuda Excel:
Programas de complementos o macros automáticas para Microsoft Excel.
El Solver determina el valor óptimo para una celda de una hoja de cálculo, que se
denomina celda objetivo. El Solver ajusta los valores en las celdas cambiantes que
se especifiquen y que se denominan celdas ajustables, para generar el resultado
en la fórmula de la celda objetivo.
Pueden aplicarse restricciones por separación de los miembros de la inecuación
en diferentes celdas y por la ventana se asigna el signo de la restricción.
A.6.1. Solver en programación lineal
La aplicación del complemento Solver en problemas simples de programación
lineal es tan fácil que hace pensar si es necesario estudiar los fundamentos de
esta técnica. Desde ya, es necesario saber plantear el problema, saber de sus
posibilidades y sacar el máximo de conclusiones de sus resultados, lo que no es
tarea del Solver.
Programación linea
F.O Máx 3 X1+ 2 X2
Variables X1
X2
Restricciones X1 + 2 X2 <= 20
2 X1 + X2 <= 20
X2 <= 8
Se sugiere abrir el libro Programación Lineal 1.xls donde, en la hoja “Solver” se ha
planteado el problema enunciado en F.6.1, de sólo 2 variables y 3 restricciones.
La planilla de cálculo correspondiente al inicio es mostrada en tabla T.A.6.1
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
T.A.6.1
A B C D E F G
7 Celda
F.O Máx 3 X1+ 2 X2 0 Objetivo
8 Variables X1 0 celdas a
9 X2 0 cambiar
10 Restricciones
11 X1 + 2 X2 <= 20 0 <= 20
12 2 X1 + X2 <= 20 0 <= 20
13 X2 <= 8 0 <= 8
En la celda objetivo se pone la fórmula correspondiente en función de las
variables, que se ubican en las celdas a cambiar. Las restricciones se ubican
en dos celdas por cada restricción. El signo de la restricción se coloca por el
cuadro de diálogo Parámetros de Solver. Ver Gráfico G.A.6.1
En este cuadro, a través del boton Opciones se pueden fijar una serie de
características del problema y precisión que se desea. Ver Gráfico G.A.6.2
Las opciones se pueden consultar en la ayuda de Excel: Opciones de Solver
(cuadro de diálogo). En este caso marcar Estimación lineal y Asumir no negativos
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
Al terminar el cálculo aparece un nuevo cuadro de diálogo
A.6.2. Informes de Solver
En el cuadro de diálogo Resultados de Solver se pueden seleccionar tres
informes:
respuestas, sensibilidad y límites, los que para el ejemplo se reproducen a
continuación:
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
2.4.1. Separación flash. Punto de burbuja y Punto de rocío
Los métodos tradicionales de los procesos de destilación se basan en la existencia
de un equilibrio entre la composición de un líquido y la del vapor en contacto con
ella.
El caso elemental es un tanque flash como el que se indica en el gráfico G 2.6.
Allí, ingresa una corriente líquida F [mol/h] de una mezcla de Nc componentes,
con composición, expresada en fracciones molares, zi, i=1... Nc, a una presión PF
y temperatura TF.
El equipo intercambia una cantidad de calor Q con el medio externo. El interior del
tanque se encuentra a una temperatura T y presión P. La corriente F se separa en
dos fases: una líquida, de L [mol/h], con fracciones molares xi, y otra vapor, de V
[mol/h] y composición yi. Las fases se encuentran en equilibrio, lo que se expresa
como:
yi = Ki xi , i = 1,...,Nc E.2.1.
El balance de materia global plantea:
F = L + V → (L / F)+(V / F) = l + v = 1 E.2.2.
El balance para cada componente es:
zi = v yi + l xi = ( v Ki + l ) xi = (v + l / Ki ) yi, i = 1,...,Nc E.2.3.
Y por último, debe cumplirse que:
ΣYi = 1 ; ΣXi = 1; i = 1…. Nc E.2.4.
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
Nótese que se plantea la disyuntiva de considerar la suma de las fracciones
molares en sólo una de las fases, no en ambas. Ello proviene de suponer
conocida la composición de la corriente de entrada, con lo cual:
ΣZi = 1; i = 1…. Nc
Si ahora se suman las Nc relaciones E 2.3, considerando E 2.2 y una de las E 2.4,
la restante surge inmediatamente.
Con esto se tienen 2 Nc + 2 relaciones con 2 Nc + 4 ( xi, y i, v, l, T, P ) variables. El
sistema tiene, en consecuencia, dos grados de libertad y el cálculo se puede
realizar fijando el valor de dos cualesquiera de las variables.
Si HF, HV y HL son los valores de entalpías molares de la corriente de entrada, de
vapor y de líquido de salida, respectivamente, el balance de calor se puede poner
como:
FHF = VHV + LHL + Q E.2.5.
Por convención, Q es positivo si se retira calor del tanque flash. Esta relación no
modifica los grados de libertad calculados anteriormente ya que, al aparecer Q, se
incrementan por igual el número de ecuaciones y de variables
En general, los valores de las entalpías – como los valores de las constantes de
equilibrio K – son funciones de la temperatura, presión y composición, por lo cual
no se las considera en el análisis de grados de libertad.
Para las entalpías de las mezclas se puede poner:
Hf = H (T ,P) zi , Hl = H (T,P) xi , Hv = H (T,P) yi
HLi y HVi, funciones de la presión y la temperatura, son las entalpías del
componente puro i en fase líquida y vapor, respectivamente. Como se puede ver,
las entalpías de las mezclas se obtiene como simple adición de los aportes de los
componentes puros.
Para la constante de equilibrio Ki, la funcionalidad más general es:
Ki = Ki(x1,..,xNc,y1,..,yNc,T,P)
Esto convierte el cálculo del equilibrio yi = Ki xi en algo verdaderamente complejo,
por el acople que implica la dependencia de la constante con las composiciones de
ambas fases.
La relación más sencilla para el equilibrio líquido – vapor se obtiene al suponer un
comportamiento ideal para la mezcla, donde no existe interacción entre los
componentes. En tal caso, se aplica la ley de Raoult:
P yi = Pvi xi ; yi = (Pvi / P) xi
Ahora la constante de equilibrio es la relación de la presión de vapor Pvi del
componente puro y la presión total P.
Esta Ki sólo depende de la presión y la temperatura. Por ejemplo, si Pvi viene dada
por la expresión de Antoine, se tendrá:
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
ln Pvi = ( A - B/T+C) Antoine
Ai, Bi, Ci Constantes del componente i
Ki = exp (Ai- Bi/T+Ci)/P
Y se facilita el cálculo del equilibrio al haber desaparecido el acople entre la
composición y la constante K.
Dos cálculos básicos del equilibrio líquido-vapor de una mezcla son los llamados
punto de burbuja y punto de rocío. Para una determinada composición el primero
es la condición de presión y temperatura a la cual, en la mezcla, en estado líquido,
se forma la primera burbuja de vapor, esto es, PB, TB tal que:
Σkizii = 1, i = 1…..Nc,
El punto de rocío es la condición de presión y temperatura para la cual, en la
mezcla en estado vapor, se forma la primera gota de líquido; PR, TR tal que:
Σzii/ki = 1, i = 1…..Nc,
Adviértase que ahora el sistema E 2.1 ,..., E 2.5 se ha reducido a una ecuación en
dos variables, con lo cual, tanto en el punto de rocío como de burbuja, se fija T ó P
y se procede a calcular P ó T, según el caso. Si la mezcla es ideal y se fija la
temperatura, el cálculo de la presión es inmediato; en el caso contrario o cuando la
mezcla no puede considerarse como ideal, se deberá apelar a un procedimiento
iterativo para poder determinar la variable incógnita.
Dentro de los límites que imponen las condiciones de rocío y burbuja, el tanque
flash requiere, como quedó dicho, de dos condiciones adicionales para su cálculo
en forma unívoca.
Se puede, por ejemplo, plantear la determinación de la presión dentro del tanque
para que, a una cierta temperatura, uno de los compuestos integrantes de la
mezcla se distribuya de una manera prefijada en las fases vapor y líquido que
abandonan el tanque.
En este sentido son clásicas dos situaciones:
• flash isotérmico: se conocen la presión y la temperatura dentro del tanque
• flash adiabático: la presión dentro del tanque es dato y la cantidad de calor Q es
nula.
La secuencia de cálculo para el flash isotérmico se puede plantear de acuerdo a la
propuesta de Rachford y Rice, suponiendo independencia de Ki con la composición:
1) Proponer un valor de la fracción vaporizada v
2) Calcular
Xi = Zi/1 + v( Ki -1) i = 1…..Nc
3) Calcular
Δ = (Yi –Xi) =Σ Zi (Ki -1)/1 + v( Ki -1) i = 1…..Nc
4) Si Δ < cota, terminar. Si no, proponer un nuevo valor de v y volver a 2)
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
Una vez concluida la iteración se está en condiciones de calcular la fracción líquida
l, el calor Q y las composiciones yi.
Para un flash adiabático el proceso es un poco más complicado:
1) Proponer sendos valores de la temperatura T y la fracción vaporizada v
2) Calcular
Xi = Zi/1 + v( Ki -1) i = 1…..Nc
3) Calcular
Δ1 = (Yi –Xi) =Σ Zi (Ki -1)/1 + v( Ki -1) i = 1…..Nc
4) Calcular
Δ2 = Σ ( HFi – (v Hvi Ki + (1-v)Hli) / (v( Ki -1)+1)) Ζ ι i = 1…..Nc
5) Si Δ1 < cota1 y Δ2 < cota2, terminar. Si no, modificar los valores de v y T y
volver a 2).
En la planilla Caso_BTX1.xls se encuentran los valores de los coeficientes A,
B y C de la ecuación de Antoine para benceno, tolueno y o-xileno. Siguiendo
las pautas establecidas en los
comentarios, determine, para una mezcla compuesta de 25 % de benceno,
40% de tolueno y 35% de o-xileno
a) la temperatura de burbuja TB a la presión de 2,5 bar
b) la temperatura de rocío TR a la misma presión
c) la temperatura de un flash que opera a una presión de 2,5 bar y con una
fracción vaporizada v = 0,4. Complete la hoja con el cálculo de las
composiciones
Bibliografía:
Análisis de Sistemas Industriales y Optimización de Procesos; Miguel de Santiago
Universidad Virtual de Quilmes
Operaciones Básicas de Ingeniería Química Omar Alfredo Iglesias
Universidad Virtual de Quilmes
Especialista en Diseño de Redes e Instalaciones de Gas Natural, Bárbara
Villanueva
Convenio UNSa –UAJMS
H.L. Mata Uso del Solver en la Asignación de Recursos
Spreadsheet Modeling & Decision Analysis; A Practical Introduction to
Management Science 4th edition Cliff T. Ragsdale
Docente: Ing. Ignacio Velásquez Soza
E Departamento de Procesos Industriales
You might also like
- Examen Final PS PI555A 2020-IIDocument2 pagesExamen Final PS PI555A 2020-IIDeysi YeraldinNo ratings yet
- Implementación de gestión de almacén para mejorar productividadDocument148 pagesImplementación de gestión de almacén para mejorar productividadJean Piere Cunza SanchezNo ratings yet
- Taller Simulación Montecarlo 02-12-2020Document13 pagesTaller Simulación Montecarlo 02-12-2020juliethNo ratings yet
- 2009 Junio Medio Ambiente LimaDocument13 pages2009 Junio Medio Ambiente LimaFernando Tuesta Soldevilla100% (2)
- Chemcad 1Document30 pagesChemcad 1FrankNo ratings yet
- Problemas CursoDocument12 pagesProblemas CursoDhrusAlvarezDominguezNo ratings yet
- Procesos Químicos: Análisis Energético Asistido Con Aspen Energy AnalyzerDocument285 pagesProcesos Químicos: Análisis Energético Asistido Con Aspen Energy AnalyzerYesidCaballeroNo ratings yet
- Destilacion Multicomponente. Masa 2Document9 pagesDestilacion Multicomponente. Masa 2Raul EvangelistaNo ratings yet
- Desorcion InformeDocument14 pagesDesorcion InformeCarlos Cabrera ManriqueNo ratings yet
- Costos FINALDocument33 pagesCostos FINALsamir laraNo ratings yet
- Clase 3Document8 pagesClase 3Petronila MedHerrNo ratings yet
- Destilación diferencial de etanol y aguaDocument6 pagesDestilación diferencial de etanol y aguaEvelyn Alvarado GuevaraNo ratings yet
- Colas IOIIDocument20 pagesColas IOIIJuan CarlosNo ratings yet
- Excel 2019 Nivel 2 Lab2-CEPSDocument5 pagesExcel 2019 Nivel 2 Lab2-CEPSLeonardo RafaelNo ratings yet
- Ex Parcial PI 510Document10 pagesEx Parcial PI 510Max1267No ratings yet
- Diseno de Planta Quimica Presentacion 1Document53 pagesDiseno de Planta Quimica Presentacion 1davysNo ratings yet
- Desorción gaseosa en columna empacadaDocument10 pagesDesorción gaseosa en columna empacadaJOSE DANIEL GUISADO PAREDESNo ratings yet
- Tarea de RefrigeraciónDocument13 pagesTarea de RefrigeraciónJuan Pablo Sagua BenitesNo ratings yet
- Trabajo de SimulaciónDocument26 pagesTrabajo de SimulaciónLuis Ángel Rios CruzNo ratings yet
- Informe Grupo Alfa Flujo de Una PiezaDocument10 pagesInforme Grupo Alfa Flujo de Una PiezaKellyCamachoNo ratings yet
- Guia de Química PDFDocument38 pagesGuia de Química PDFJose AbellaNo ratings yet
- DestiLacion Mccabe ThieleDocument32 pagesDestiLacion Mccabe ThieleJenny Salas FernándezNo ratings yet
- Metodos NumericosDocument9 pagesMetodos NumericosDiego VHNo ratings yet
- UNIVERSIDAD NACIONAL DE INGENIERÍA Laboratorio 4 - ListoDocument9 pagesUNIVERSIDAD NACIONAL DE INGENIERÍA Laboratorio 4 - ListokatiuscaNo ratings yet
- Informe Scilab 5x5Document27 pagesInforme Scilab 5x5Roger Velasquez ValenciaNo ratings yet
- Teorema de Convolución y la delta de DiracDocument8 pagesTeorema de Convolución y la delta de DiracJohan David CarrilloNo ratings yet
- Accidente químico Flixborough 40TM ciclohexanoDocument7 pagesAccidente químico Flixborough 40TM ciclohexanoMihail Meza ApolinarioNo ratings yet
- Regla de La Palanca y Composición Química de Las FasesDocument3 pagesRegla de La Palanca y Composición Química de Las FasesAndres Felipe Vergara100% (1)
- Manual Chemcad 6Document71 pagesManual Chemcad 6Teo DonairesNo ratings yet
- Unidad 3. Metodos de Integracion PDFDocument38 pagesUnidad 3. Metodos de Integracion PDFbetyvirgo7796100% (1)
- Guia de PRO II BI AD Capitulo I PDFDocument6 pagesGuia de PRO II BI AD Capitulo I PDFHenry AymaNo ratings yet
- La 8Document11 pagesLa 8Luis Gutierrez GarciaNo ratings yet
- Producción de Acido NitricoDocument23 pagesProducción de Acido NitricohenryNo ratings yet
- Plus PetrolDocument8 pagesPlus Petrolgino3101No ratings yet
- Guia ChemcadDocument5 pagesGuia ChemcadJonathan Andrés PullasNo ratings yet
- Diseno y Optimizacion de ProcesosDocument3 pagesDiseno y Optimizacion de ProcesosEsquen YajairaNo ratings yet
- CapacidadDocument3 pagesCapacidadAgus MontenegroNo ratings yet
- Lab Fisica 1Document6 pagesLab Fisica 1Germán Andrés MendozaNo ratings yet
- Examen Parcial de Operaciones Unitarias 2016 - 2 ResueltoDocument4 pagesExamen Parcial de Operaciones Unitarias 2016 - 2 ResueltoClaudia Lorena Febres EspinozaNo ratings yet
- Sesion Semana 4 Suavizado ExponencialDocument14 pagesSesion Semana 4 Suavizado ExponencialAnonymous cqRpVFQd0% (2)
- 1er Trabajo RefinoDocument5 pages1er Trabajo RefinoLuis SantistebanNo ratings yet
- Caso ConservasDocument1 pageCaso ConservasMarco Antonio Zevallos Ramos100% (1)
- Velasquez Valencia Roger Jack - 18070037 Codigo Scilab Labo 2Document12 pagesVelasquez Valencia Roger Jack - 18070037 Codigo Scilab Labo 2Roger Velasquez ValenciaNo ratings yet
- Trabajo de Simulación de Procesos 2Document26 pagesTrabajo de Simulación de Procesos 2Ljubenko Gagliuffi BlasNo ratings yet
- Control de Calidad y Cantidad Fase 1Document16 pagesControl de Calidad y Cantidad Fase 1fmjrjrcNo ratings yet
- EJERCICIO ASPEN HYSYS para MasasDocument7 pagesEJERCICIO ASPEN HYSYS para MasasAlonso Palacios GómezNo ratings yet
- Guia1 - Ecuaciones Diferenciales - Con - MatlabDocument11 pagesGuia1 - Ecuaciones Diferenciales - Con - Matlableymer cabreraNo ratings yet
- Producción de diésel verde a partir de materias primas de segunda generaciónDocument13 pagesProducción de diésel verde a partir de materias primas de segunda generaciónOmar SanchezNo ratings yet
- Caso McDonald's: Negligencia laboral causa muerte de dos jóvenes empleadosDocument4 pagesCaso McDonald's: Negligencia laboral causa muerte de dos jóvenes empleadosyuliana elizabethNo ratings yet
- Guía de Trabajos Prácticos Con HYSYS PDFDocument56 pagesGuía de Trabajos Prácticos Con HYSYS PDFhhuisaNo ratings yet
- Diagrama de Pareto TPMDocument5 pagesDiagrama de Pareto TPMFélix Espinoza GaliciaNo ratings yet
- QUIMICA ORGANICA INDUSTRIAL K Weissermel H Arpe 2 PDFDocument441 pagesQUIMICA ORGANICA INDUSTRIAL K Weissermel H Arpe 2 PDFRonnieldNo ratings yet
- Guia 7 Evaluacion Economica y Social de Proyectos AquiDocument8 pagesGuia 7 Evaluacion Economica y Social de Proyectos AquimarlenNo ratings yet
- Introduccion Sintesis de ProcesosDocument18 pagesIntroduccion Sintesis de ProcesosRickyTalaveraNo ratings yet
- Electronica (Virtual)Document67 pagesElectronica (Virtual)Bruno Morán SalazarNo ratings yet
- Iz Dp&Pqevp220222Document4 pagesIz Dp&Pqevp220222CHRISTIE RUIZ RIVASNo ratings yet
- Tubo PitotDocument31 pagesTubo Pitotcinthyava100% (1)
- Simulacion Aspen Plus PEDocument188 pagesSimulacion Aspen Plus PEZ Fernandez UrbinaNo ratings yet
- Examen Parcial PS PI555A 2020-1Document2 pagesExamen Parcial PS PI555A 2020-1Denis Garcia GarciaNo ratings yet
- Simulación triple efecto evaporaciónDocument9 pagesSimulación triple efecto evaporaciónChristian VerdeNo ratings yet
- 25 - Agosto - Multiplicación y División de FraccionesDocument2 pages25 - Agosto - Multiplicación y División de FraccionesBonita RosasNo ratings yet
- 4S COM Sesiones 3BIM 2019Document41 pages4S COM Sesiones 3BIM 2019percydiazzNo ratings yet
- 3.1-Conceptos Asociados Ala Noción de SistemasDocument5 pages3.1-Conceptos Asociados Ala Noción de SistemasDesiree PerezNo ratings yet
- Algebra de BooleDocument7 pagesAlgebra de BooleAndrés TapiaNo ratings yet
- Yesenia Segura Semana 7Document4 pagesYesenia Segura Semana 7Yesenia SeguraNo ratings yet
- BIMBO Diseño de Cursos-1003Document7 pagesBIMBO Diseño de Cursos-1003ZG AngelesNo ratings yet
- DIA 1 Ciencia y Tecnología. El Impacto de Las Tecnologías de La InformaciónDocument2 pagesDIA 1 Ciencia y Tecnología. El Impacto de Las Tecnologías de La InformaciónkattyNo ratings yet
- Cuentos SonorosDocument3 pagesCuentos SonorosPedro RaulNo ratings yet
- Acherontia Styx (Polilla de La Muerte)Document12 pagesAcherontia Styx (Polilla de La Muerte)Gustavo LimachiNo ratings yet
- Ciclo de proyectos: las etapas clave para el desarrollo de un proyectoDocument24 pagesCiclo de proyectos: las etapas clave para el desarrollo de un proyectokevinNo ratings yet
- Conf. 1 Cinemática Avanzada Feb.12Document31 pagesConf. 1 Cinemática Avanzada Feb.12Maritza Rodriguez GualNo ratings yet
- BARSIT - ResoluciónDocument4 pagesBARSIT - ResoluciónGustavoNo ratings yet
- Borrador Documento Manual de Organizacioìn y ProcedimientosDocument10 pagesBorrador Documento Manual de Organizacioìn y ProcedimientosLeonel GámezNo ratings yet
- Especificaciones técnicas 34.5kV transformadores tensiónDocument10 pagesEspecificaciones técnicas 34.5kV transformadores tensiónAdriano RamosNo ratings yet
- Hoja de Vida AdryDocument2 pagesHoja de Vida AdryhumbertoNo ratings yet
- La Etica en La Carrera de Ingenieria SeguridadDocument17 pagesLa Etica en La Carrera de Ingenieria SeguridadAgustin SarazaNo ratings yet
- Importancia Y Operaciones de NúmerosDocument4 pagesImportancia Y Operaciones de NúmeroselcoqueticoclasicoNo ratings yet
- Factores de Exito y Fracaso Por Las EmocionesDocument4 pagesFactores de Exito y Fracaso Por Las EmocionesMaria BardalesNo ratings yet
- La Asertividad 4 GradoDocument6 pagesLa Asertividad 4 GradoFrancia BlancoNo ratings yet
- Ec Fact EcciDocument1 pageEc Fact EcciGolfito Gtimk3No ratings yet
- OctopodaDocument40 pagesOctopodaALEXANDER RMNo ratings yet
- Decreto 59 05 de La Promocion de La Salud Cuales Son Los Beneficios de Su Aplicacion para Que Mejoren Las Acciones de Promocion de La SaludDocument4 pagesDecreto 59 05 de La Promocion de La Salud Cuales Son Los Beneficios de Su Aplicacion para Que Mejoren Las Acciones de Promocion de La Saludeva rodriguez.sNo ratings yet
- Detroit Diesel EnginesDocument19 pagesDetroit Diesel EnginesGonzalo Pino BastiasNo ratings yet
- Reflexiones Sobre La Construcción de La RealidadDocument3 pagesReflexiones Sobre La Construcción de La RealidadMarión Paz Betancourt GodoyNo ratings yet
- Marketing digital para prevenir enfermedades por rayos UVDocument1 pageMarketing digital para prevenir enfermedades por rayos UVFabian RamirezNo ratings yet
- Teoria Del Color 2018Document13 pagesTeoria Del Color 2018Claudia SotoNo ratings yet
- Ensayo de La Cadena de SuministroDocument4 pagesEnsayo de La Cadena de SuministroLau ServínNo ratings yet
- Aplicación Simulador de La Ley de Coulomb Con App Designer en MatlabDocument24 pagesAplicación Simulador de La Ley de Coulomb Con App Designer en MatlabLuis Carlos CastañedaNo ratings yet
- Importancia de la salud y la pobrezaDocument32 pagesImportancia de la salud y la pobrezaBrayer Tito HuamánNo ratings yet