Professional Documents
Culture Documents
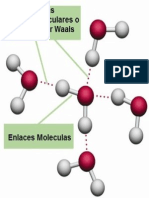
Fuerzas de Van Der Waals
Uploaded by
Marcia RichertOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Fuerzas de Van Der Waals
Uploaded by
Marcia RichertCopyright:
Available Formats
Fuerzas de Van der Waals
En fisicoqumica, las fuerzas de Van der Waals (o interacciones de Van der Waals), denominada as en honor al cientfico neerlands Johannes Diderik Van der Waals, es la fuerza atractiva o repulsiva entre molculas (o entre partes de una misma molcula) distintas a aquellas debidas al enlace covalente o a la interaccin electrosttica de iones con otros o con molculas neutras.1 El trmino incluye:
fuerzas dipolo permanente-dipolo permanente (fuerzas de Keesom o interaccin dipolo-dipolo) fuerzas dipolo permanente-dipolo inducido (fuerzas de Debye) fuerzas dipolo inducido instantneo-dipolo inducido (fuerzas de dispersin de London)
Tambin se usa en ocasiones como un sinnimo para la totalidad de las fuerzas intermoleculares.
Introduccin a la materia
Las fuerzas de van der Waals son relativamente dbiles comparadas con los enlaces qumicos normales, pero juegan un rol fundamental en campos tan diversos como qumica supramolecular, biologa estructural, ciencia de polmeros, nanotecnologa, ciencia de superficies, y fsica de materia condensada. Las fuerzas de van der Waals definen el carcter qumico de muchos compuestos orgnicos. Tambin definen la solubilidad de los alcoholes inferiores. Las propiedades del grupo polar hidrxilo dominan a las dbiles fuerzas intermoleculares de van der Waals. En los alcoholes superiores, las propiedades del radical alqulico apolar (R) dominan y definen la solubilidad. Las fuerzas de van der Waals crecen con la longitud de la parte no polar de la sustancia. Las fuerzas de van der Waals incluyen a atracciones entre tomos, molculas, y superficies. Difieren del enlace covalente y del enlace inico en que estn causados por correlaciones en las polarizaciones fluctuantes de partculas cercanas (una consecuencia de la dinmica cuntica). Las fuerzas intermoleculares tienen cuatro contribuciones importantes. En general, un potencial intermolecular tiene un componente repulsivo (que evita el colapso de las molculas debido a que al acercarse las entidades unas a otras las repulsiones dominan). Tambin tiene un componente atractivo que, a su vez, consiste de tres contribuciones distintas: 1. La primera fuente de atraccin es la interaccin electrosttica, tambin denominada interaccin de Keesom o fuerza de Keesom, en honor a Willem Hendrik Keesom. 2. La segunda fuente de atraccin es la induccin (tambin denominada polarizacin), que es la interaccin entre un ultipolo permanente en una molcula, con un multipolo inducido en otra. Esta interaccin se mide algunas veces en debyes, en honor a Peter Debye. 3. La tercera atraccin suele ser denominada en honor a Fritz London que la denominaba dispersin. Es la nica atraccin experimentada por tomos no polares, pero opera entre cualquier par de molculas, sin importar su simetra.
4. A distancias de Radios de Van der Waals. Todas las fuerzas intermoleculares de van der Waals presentan anisotropa (excepto aquellas entre tomos de dos gases nobles), lo que significa que dependen de la orientacin relativa de las molculas. Las interacciones de induccin y dispersin son siempre atractivas, sin importar su orientacin, pero el signo de la interaccin cambia con la rotacin de las molculas. Esto es, la fuerza electrosttica puede ser atractiva o repulsiva, dependiendo de la orientacin mutua de las molculas. Cuando las molculas tienen movimiento trmico, como cuando estn en fase gaseosa o lquida, la fuerza electrosttica se reduce significativamente, debido a que las molculas rotan trmicamente y experimentan las partes repulsiva y atractiva de la fuerza electrosttica. Algunas veces, este efecto se expresa indicando que el "movimiento trmico aleatorio a temperatura ambiente puede imponerlo o anularlo" (refirindose al componente electrosttico de la fuerza de van der Waals). Claramente, el efecto trmico promedio es mucho menos pronunciado para las fuerzas atractivas de induccin y dispersin. El potencial de Lennard-Jones se usa frecuentemente como un modelo aproximado para la parte istropa de una fuerza de van der Waals total (repulsin ms atraccin) como una funcin de la distancia.
Fuerza de dispersin de London
Energa de interaccin del dmero de argn. La parte long-range se debe a las fuerzas de dispersin de London. Las fuerzas de dispersin de London, denominadas as en honor al fsico germanoamericano Fritz London, son fuerzas intermoleculares dbiles que surgen de fuerzas interactivas entre multipolos temporales en molculas sin momento multipolo permanente. Las fuerzas de dispersin de London tambin son conocidas como fuerzas de dispersin, fuerzas de London o fuerzas dipolo-dipolo inducido. Las fuerzas de London pueden ser exhibidas por molculas no polares debido a que la densidad electrnica se mueve alrededor de la molcula de una manera probabilstica (ver teora mecnico cuntica de las fuerzas de dispersin). Hay una gran probablidad de que la densidad electrnica no est distribuida por igual en una molcula apolar. Cuando los electrones estn desigualmente distribuidos, existe un multipolo temporal.
Este multipolo interactuar con otros multipolos cercanos e inducir a las molculas, pero slo son una pequea parte de la fuerza de interaccin total. La densidad electrnica en una molcula puede ser redistribuida por la proximidad de otro multipolo. Los electrones se acumularn en el lado de la molcula que encara a la carga positiva y se retirarn de la carga negativa. Entonces, puede producirse un multipolo transiente por una molcula polar cercana, o incluso por un multipolo transiente en otra molcula apolar. En el vaco, las fuerzas de London son ms dbiles que otras fuerzas intermoleculares tales como las interacciones inicas, el enlace de hidrgeno, o las interacciones permanentes dipolo-dipolo. Este fenmeno es la nica fuerza intermolecular atractiva a grandes distancias, presente entre tomos neutros (vg. un gas noble), y es la principal fuerza atractiva entre molculas no polares (vg. dinitrgeno o metano). Sin las fuerzas de London, no habra fuerzas atractivas entre los tomos de un gas noble, y no podran existir en la forma lquida. Las fuerzas de London se hacen ms fuertes a la vez que el tomo o molcula en cuestin se hace ms grande. Esto es debido a la polarizabilidad incrementada de molculas con nubes electrnicas ms grandes y dispersas. Este comportamiento puede ejemplificarse por los halgenos (del ms pequeo al ms grande: F2, Cl2, Br2, I2). El diflor y el dicloro son gases a temperatura ambiente, el dibromo es un lquido, y el diyodo es un slido. Las fuerzas de London tambin se hacen fuertes con grandes cantidades de superficie de contacto. Una mayor rea superficial significa que pueden darse ms interacciones cercanas entre diferentes molculas. van der Waals considero las fuerzas de repulsion de largo alcance y la atraccion molecular, llegando a:
Tipo Fuerzas Vander Waals
Las fuerzas de Van der Waals son fuerzas de estabilizacin molecular; forman un enlace qumico no covalente en el que participan dos tipos de fuerzas o interacciones, las fuerzas de dispersin (que son fuerzas de atraccin) y las fuerzas de repulsin entre las capas electrnicas de 2 tomos contiguos. 1. Fuerzas de dispersin Todos los tomos, aunque sean apolares, forman pequeos dipolos debidos al giro de los electrones en torno al ncleo. La presencia de este dipolo transitorio hace que los tomos contiguos tambin se polaricen, de tal manera que se producen pequeas fuerzas de atraccin electrosttica entre los dipolos que forman todos los tomos 2. Repulsin electrosttica A estas fuerzas de dispersin se opone la repulsin electrosttica entre las capas electrnicas de dos tomos contiguos.
La resultante de estas fuerzas opuestas es una distancia mnima permitida entre los ncleos de dos tomos contiguos. Distancia que se conoce como radio de Van der Waals. Es sta una fuerza muy importante en biologa, porque es uno de los enlaces no covalentes que estabilizan la conformacin de las protenas. La energa del enlace de Van der Waals es de 12 kcal/mol. Las fuerzas de Van der Waals conforman el tipo ms dbil de fuerza intermolecular que puede darse en la naturaleza, necesitndose un aporte energtico de 0,1 a 35 kJ/mol para romper dicha interaccin. Distinguimos tres clases de enlace de Van der Waals: Orientacin: interaccin dipolo permanente-dipolo permanente. Induccin: interaccin dipolo permanente-dipolo inducido. Dispersin (Fuerzas de London): dipolo instantneo-dipolo instantneo. FUERZAS DE LONDON: En las molculas no polares puede producirse transitoriamente un desplazamiento relativo de los electrones originando un polo positivo y otro negativo (dipolo transitorio) que determinan una atraccin entre dichas molculas. (El polo positivo de una molcula atrae al polo negativo de la otra, y viceversa).
Propiedades fsicas es una expresin de significado muy amplio: engloba todas las propiedades de las sustancias relacionadas a fenmenos fsicos. No tendra ningn sentido intentar estudiar todas las propiedades fsicas a la vez; apenas para enumerarlas todas juntas ya sera consumidas a un espacio enorme. En general establecemos objetivos de naturaleza prctica para delimitar nuestros estudios: las propiedades fsicas que nos interesan en este momento son aquellas que utilizamos corrientemente en los trabajos comunes de laboratorio, como punto de fusin, punto de ebullicin, solubilidad. Estas propiedades estn fuertemente asociadas con las fuerzas que mantienen las molculas unidas unas a las otras, las que son llamadas fuerzas intermoleculares. Fuerzas Intermoleculares El enlace que atrapa los tomos dentro de una molcula es el enlace covalente. Las fuerzas de atraccin entre las molculas son de naturaleza elctrica. Fuerzas gravitacionales tambin existen, pero podemos despreciarlas por ser mucho menores que las fuerzas elctricas. Analicemos ahora, las fuerzas que existen entre las molculas
Estas fuerzas pueden ser divididas en dos tipos: Fuerzas de Van der Waals y Puente de Hidrgeno Fuerzas de Van der Waals Las fuerzas de atraccin o repulsin entre entidades moleculares (o entre grupos dentro de la misma entidad molecular) diferentes de aquellas que son debidas a la formacin de enlace o la interaccin electroesttica de iones o grupos inicos unos con otros o con molculas neutras. Estudiemos los tipos principales: Fuerza entre dipolos permanentes: Si la molcula de la sustancia contiene un dipolo permanente (debido a la polaridad de uno o ms de sus enlaces covalentes), entonces podemos fcilmente ver como esas molculas se atraen unas a otras: el lado positivo del dipolo de una molcula atrae al lado negativo del dipolo de la otra molcula. Esta fuerza existe, por tanto, entre molculas polares ( total 0). Ejemplo:
Fuerzas de London o fuerzas de dispersin: Es cuando las molculas no contienen dipolos (son apolares). Entonces, como es que logran atraerse? Pensemos en una molcula como una entidad no esttica, pero conteniendo electrones en constante movimiento; es razonable pensar que en un determinado momento la distribucin en esa molcula puede no ser perfectamente simtrica y aparecen entonces pequeos dipolos instantneos en este momento. Esos dipolos desaparecern en muy poco tiempo, pudiendo llevar a una molcula neutra o a otros dipolos, inclusive contrarios, pero en un corto espacio de tiempo en que ellos existen pueden inducir a la formacin de dipolos contrarios en la molcula vecina, llevando a las dos a atraerse mutuamente. Ejemplo:
Enlaces de Hidrgeno o Puentes de Hidrgeno: El tomo de hidrgeno tiene propiedades especiales por ser un tomo muy pequeo, sin electrones en el interior: por dentro de la capa de valencia existen apenas el ncleo del tomo y el protn. Una de las propiedades que solo el tomo de hidrgeno presenta es la capacidad de ejercer una fuerza de atraccin intermolecular llamada enlace de hidrgeno, o puente de hidrgeno. El enlace de hidrgeno solo puede ocurrir cuando el hidrgeno estuviese enlazado a un tomo pequeo y muy electronegativo: apenas F, O, N satisface las condiciones necesarias. Cuando el hidrgeno esta enlazado a un tomo muy electronegativo, la densidad electrnica en torno del protn se establece bastante baja, esta parte de la molcula es entonces fuertemente atrada por los pares de electrones del F, O, N de otra molcula, estableciendo el enlace de hidrgeno. Ejemplo:
Los enlaces de hidrgeno representan un importante papel tanto en las propiedades especiales del agua como en molculas de extrema importancia para los seres vivos: ellas determinan la forma de las protenas y consitutyen la fuerza que une los hlices del ADN.
Las fuerzas de van der Waals, se conocen tambin como fuerzas de dispersin, a que se debe esta expresin, es que se encuentran presentes en las molculas de muy baja polaridad, la podemos ver en los hidrocarburos. Las fuerzas de van der Waals se originan como resultado de diversos movimientos de electrones, cuando una porcin de la molcula en cierto instante se torna ligeramente negativa, en tanto que en otras regiones aparecen cargas positivas que son equivalentes a las negativas. De esta manera se forman dipolos no-permanentes, lo que se produce en estos dipolos son atracciones electrostticas muy dbiles en aquellas molculas de tamao normal, en el caso de los polmeros que son formados por miles de pequeas molculas, dichas fuerzas de atraccin se pueden multiplicar hasta llegar a ser enormes, como el ejemplo del polietileno, que tu profe nombra tanto. Te daremos una muestra en la imagen que veras en la parte inferior y superior de este articulo, en esta tabla se puede observar como cambia la densidad, la temperatura de fusin, si observamos detenidamente notaremos que al aumentar el nmero de tomos de carbono en cuanto a la serie de los hidrocarburos. En cuanto a los ms chicos son gases a temperatura ambiente, cuando aumenta de manera progresiva el nmero de carbonos, los compuestos se vuelven lquidos y despus slidos, de forma sostenida con mayor densidad y ms temperatura de fusin, hasta que logre llegar a los polietilenos con una densidad que llegaran desde 0,92 a 0, 96 g / cm3 y temperaturas de fusin entre 105 y 135 C.
You might also like
- Fuerza Acido-BaseDocument25 pagesFuerza Acido-BasehexanoNo ratings yet
- Crecimiento y Perturbacion 2016Document25 pagesCrecimiento y Perturbacion 2016zhariito100% (1)
- Propiedades de los gases: dilatación, fluidez, difusión, compresión y resistenciaDocument14 pagesPropiedades de los gases: dilatación, fluidez, difusión, compresión y resistenciatonyNo ratings yet
- Fuerzas de Van Der WaalsDocument7 pagesFuerzas de Van Der WaalsareacienciasNo ratings yet
- Membranas Biológicas y TransporteDocument30 pagesMembranas Biológicas y Transportefabiola100% (2)
- Guia para Examen Bioquimica MetabolicaDocument10 pagesGuia para Examen Bioquimica MetabolicaVodkanicos OfficialNo ratings yet
- Polaridad MoléculasDocument3 pagesPolaridad Moléculasandoba2013No ratings yet
- Ósmosis y Presión OsmóticaDocument4 pagesÓsmosis y Presión Osmóticalujul100% (1)
- Código Internacional de Ética MédicaDocument2 pagesCódigo Internacional de Ética Médicajose luis grondonaNo ratings yet
- Indice de RefracciónDocument4 pagesIndice de Refracciónm6401No ratings yet
- Cadena Transportadora de Electrones y Fosforilación OxidativaDocument6 pagesCadena Transportadora de Electrones y Fosforilación OxidativaNoeCQ100% (1)
- Sem 12 - Mezcla RacemicaDocument5 pagesSem 12 - Mezcla RacemicaMartin Eduardo Marchena Tirado100% (2)
- 1 - Adme 2017Document63 pages1 - Adme 2017PiiyyiissNo ratings yet
- Digestión de DNA Con Endonucleasas de RestricciónDocument16 pagesDigestión de DNA Con Endonucleasas de RestricciónBeatrice Maggio de GarcíaNo ratings yet
- Historia MicrobiologiaDocument11 pagesHistoria MicrobiologiaMarvin ys 2417No ratings yet
- Fenomenos BiofisicosDocument7 pagesFenomenos BiofisicosAngeline Cerezo EscobarNo ratings yet
- 10 Alteraciones EnzimaticasDocument7 pages10 Alteraciones EnzimaticasGreissy Campos CabreraNo ratings yet
- Introduccion A La Central Laguna VerdeDocument50 pagesIntroduccion A La Central Laguna VerdeAldo Pius McGardenNo ratings yet
- Relacion Medico PacienteDocument34 pagesRelacion Medico PacienteLuis E. GutierrezNo ratings yet
- Interaccion Dipolo DipoloDocument17 pagesInteraccion Dipolo DipoloAssaid Luna0% (1)
- Orientacion Juvenil y Profesional IVDocument20 pagesOrientacion Juvenil y Profesional IVnoelcohen100% (1)
- La mitocondria, generador de energía celularDocument38 pagesLa mitocondria, generador de energía celularZiany UgazNo ratings yet
- Teoria de Enlace de ValenciaDocument4 pagesTeoria de Enlace de ValenciaRicardo AlmarzaNo ratings yet
- Alcoholes - Aldehidos - CetonasDocument8 pagesAlcoholes - Aldehidos - Cetonasanon-258552100% (4)
- Cotransporte de Glucosa y Na - OliverDocument14 pagesCotransporte de Glucosa y Na - OliverZavala Nuñez100% (1)
- La Memb BiologicaDocument34 pagesLa Memb BiologicaReinaldo Rodriguez GuerreroNo ratings yet
- Daño Celular y Patogénesis ViralDocument16 pagesDaño Celular y Patogénesis ViralAlejandro Villagrana AlvarezNo ratings yet
- Termodinamica Basica 2º Edicion Muller PDFDocument324 pagesTermodinamica Basica 2º Edicion Muller PDFArianaLexyPadillaMondocorreNo ratings yet
- Estereoisomería: Isómeros con diferente orientación espacialDocument6 pagesEstereoisomería: Isómeros con diferente orientación espacialKevin Jonathan Esteban RuizNo ratings yet
- BIOQUIMICADocument11 pagesBIOQUIMICAMaria Fernanda Córdova MartínezNo ratings yet
- Ensayo 1 Que Es EcologiaDocument2 pagesEnsayo 1 Que Es EcologiaGénesis Milena RomeroNo ratings yet
- Laboratorio Pcr-BiologíaDocument11 pagesLaboratorio Pcr-BiologíaPaula Andrea MoraNo ratings yet
- Avance Expo Farmacos AntiepilepticosDocument40 pagesAvance Expo Farmacos AntiepilepticosJeffrey VegaNo ratings yet
- Circulacion Fetal y Neonatal Morfofisiologia II MebriologiaDocument7 pagesCirculacion Fetal y Neonatal Morfofisiologia II MebriologiaCandyMarNo ratings yet
- Fases de La MitosisDocument8 pagesFases de La MitosisMar De Ros FelicianoNo ratings yet
- Anticuerpo MonoclonalDocument10 pagesAnticuerpo MonoclonalJuan Felipe SanchezNo ratings yet
- ADN RecombinanteDocument31 pagesADN RecombinanteValentina BelénNo ratings yet
- Laminopatías. Enfermedades de la lámina nuclearDocument7 pagesLaminopatías. Enfermedades de la lámina nuclearBryan Solorzano JuradoNo ratings yet
- Canales iónicos y potencial de membranaDocument6 pagesCanales iónicos y potencial de membranaJoseNo ratings yet
- DienosDocument33 pagesDienosAlexis John Soncco HanccoNo ratings yet
- Resumen ComplexusDocument3 pagesResumen ComplexusMicrobiologia ParasitologiaNo ratings yet
- Acidosis RespiratoriaDocument4 pagesAcidosis RespiratoriaJositäVallejöNo ratings yet
- Biología Curtis Capítulo 3Document2 pagesBiología Curtis Capítulo 3Felipe rodriguez islas100% (1)
- Temas para El Parcial de BIOQUIMICADocument1 pageTemas para El Parcial de BIOQUIMICABioquimica50% (4)
- Ud 6. Detección de Autoanticuerpos.Document13 pagesUd 6. Detección de Autoanticuerpos.Raquel Sotelo SilvaNo ratings yet
- Fosforilación oxidativa: cadena transporte electrones y quimiosmosis ATPDocument3 pagesFosforilación oxidativa: cadena transporte electrones y quimiosmosis ATPMejeliss SALAZARNo ratings yet
- Ross 2Document58 pagesRoss 2guiastudiant100% (4)
- Especializaciones de MembranaDocument31 pagesEspecializaciones de MembranaMaria Jose HereiraNo ratings yet
- AntibioterapiaDocument57 pagesAntibioterapiapierokNo ratings yet
- Practica4.Sintesis de Benzocaina y Anhidrido FtalicoDocument3 pagesPractica4.Sintesis de Benzocaina y Anhidrido FtalicoAlberto Es VaNo ratings yet
- Comentario Del VideoDocument3 pagesComentario Del VideoChio BravoNo ratings yet
- Potencial de MembranaDocument18 pagesPotencial de MembranaRafael RequenaNo ratings yet
- Avogadro y Ejemplos Resueltos de Forma Muy Sencilla y FácilDocument7 pagesAvogadro y Ejemplos Resueltos de Forma Muy Sencilla y Fácil777RICHARDNo ratings yet
- Hemorragias y su morfología: clasificación y tiposDocument12 pagesHemorragias y su morfología: clasificación y tiposbarby reydetNo ratings yet
- Fuerzas de Van Der WalsDocument2 pagesFuerzas de Van Der WalsIsis Lilium ChanNo ratings yet
- Fuerzas de Van Der WaalsDocument4 pagesFuerzas de Van Der WaalsSuz MoonNo ratings yet
- Fuerzas de Van Der WaalsDocument4 pagesFuerzas de Van Der WaalsJ Rodrigo Castro HNo ratings yet
- Fuerza SDocument3 pagesFuerza SpgNo ratings yet
- Discusión Editar Ver Historial: 56 IdiomasDocument3 pagesDiscusión Editar Ver Historial: 56 IdiomasGP GpNo ratings yet
- Informe de Quimica N°03Document9 pagesInforme de Quimica N°03JriellNo ratings yet
- El Mundo Es PlanoDocument29 pagesEl Mundo Es PlanoAnshirley Solange Silva CabanillasNo ratings yet
- Guía Práctica para La Elaboración de Trabajos de Investigación y Tesis - Marisela Del Pilar Quezada PadillaDocument157 pagesGuía Práctica para La Elaboración de Trabajos de Investigación y Tesis - Marisela Del Pilar Quezada PadillaKappaNo ratings yet
- Frases de Victor KupperDocument3 pagesFrases de Victor KupperErnesto B. Viznado100% (1)
- Formato de Descripcion de PuestoDocument12 pagesFormato de Descripcion de PuestoMayra MilanNo ratings yet
- Control #2 - ResumenDocument4 pagesControl #2 - ResumenPsanchez1144100% (1)
- PD Ee ValladolidDocument34 pagesPD Ee ValladolidJudit Esteve GarciaNo ratings yet
- Taller de Literatura 4° Medio 2020 - 1Document6 pagesTaller de Literatura 4° Medio 2020 - 1Shirley Flores OlivarezNo ratings yet
- 25 - Agosto - Multiplicación y División de FraccionesDocument2 pages25 - Agosto - Multiplicación y División de FraccionesBonita RosasNo ratings yet
- Design ThinkingDocument21 pagesDesign ThinkingBritney Valverde SanchezNo ratings yet
- Estadística ConceptosDocument25 pagesEstadística Conceptosmerlin lopezNo ratings yet
- Adquisiciones y AbastecimientosDocument171 pagesAdquisiciones y AbastecimientosCarlos Chavolla GómezNo ratings yet
- De La Globalización y El NeoliberalismoDocument1 pageDe La Globalización y El NeoliberalismoSantiago GomezNo ratings yet
- Estructura y Desarrollo Del CuentoDocument14 pagesEstructura y Desarrollo Del CuentoManzanas TraigoNo ratings yet
- La Gestión Del Talento Humano y El Desempeño Laboral de Los Trabajadores Administrativos de La Municipalidad PROVINCIAL de HUARAL - VIERNESDocument58 pagesLa Gestión Del Talento Humano y El Desempeño Laboral de Los Trabajadores Administrativos de La Municipalidad PROVINCIAL de HUARAL - VIERNESCarlos ApeñaNo ratings yet
- EXAMEN FINAL - REALIDAD NACIONAL Y MUNDIAL - Rivera Calderon AracelyDocument6 pagesEXAMEN FINAL - REALIDAD NACIONAL Y MUNDIAL - Rivera Calderon AracelyARACELY ALEXANDRA RIVERA CALDERONNo ratings yet
- Bateria Del Automovil.Document27 pagesBateria Del Automovil.Brayan Acosta100% (1)
- Guia Practica Hospitalseguro PDFDocument24 pagesGuia Practica Hospitalseguro PDFRuben MartinezNo ratings yet
- Analisis Estadistico de Probetas - GUIADocument8 pagesAnalisis Estadistico de Probetas - GUIAFreddy Viveros MenachoNo ratings yet
- 1.lang Et Al-2018-Journal of PeriodontologyDocument8 pages1.lang Et Al-2018-Journal of PeriodontologyKarla RuizNo ratings yet
- Entrenamientos de VO2max Carrera Sportraining Nov Dic 2010Document8 pagesEntrenamientos de VO2max Carrera Sportraining Nov Dic 2010kabut81100% (1)
- Brochure - PE en Compliance 2023-IIDocument11 pagesBrochure - PE en Compliance 2023-IImaxef.auditoriaNo ratings yet
- Afrontamiento Del Estrés PowerDocument10 pagesAfrontamiento Del Estrés Powercarolina garciaNo ratings yet
- Analisis de Un Sistema MultipleDocument8 pagesAnalisis de Un Sistema MultipleBetty LopezNo ratings yet
- Procedimiento Escrito de Trabajo Seguro - Corte y EsmeriladoDocument3 pagesProcedimiento Escrito de Trabajo Seguro - Corte y Esmeriladomartvasques100% (6)
- DIA 1 Ciencia y Tecnología. El Impacto de Las Tecnologías de La InformaciónDocument2 pagesDIA 1 Ciencia y Tecnología. El Impacto de Las Tecnologías de La InformaciónkattyNo ratings yet
- Trabajo de Salud Ocupacional Tatiana HolguinDocument27 pagesTrabajo de Salud Ocupacional Tatiana HolguinLAURANo ratings yet
- Las propiedades de los suelos y su comportamiento como material de construcciónDocument5 pagesLas propiedades de los suelos y su comportamiento como material de construcciónJhonatan Francisco Villalobos AguilarNo ratings yet
- Diseño Estr RecipientesDocument316 pagesDiseño Estr RecipientesviglesNo ratings yet
- Lineas de TransmisionDocument12 pagesLineas de TransmisionKatiuska CachisNo ratings yet
- Portafolio PsicopatologíaDocument9 pagesPortafolio PsicopatologíaClarisol Peña PerezNo ratings yet