Professional Documents
Culture Documents
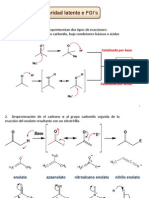
Furanos Tiofenos Pirroles
Uploaded by
Alex ValenciaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Furanos Tiofenos Pirroles
Uploaded by
Alex ValenciaCopyright:
Available Formats
PIRROL, TIOFENO, FURANO
CAP 6. HETEROCICLOS PI-EXCEDENTES PIRROL, TIOFENO, FURANO
INTRODUCCION REACTIVIDAD R. DE SUSTITUCION ELECTROFILA R. CON OXIDANTES DERIVADOS: REACTIVIDAD SINTESIS SINTESIS DE PRODUCTOS FARMACEUTICOS
PIRROL, TIOFENO, FURANO
4 Pirrol 5 N H 1 HO O O
3 2
Aislado en 1857 (rojo) Forma parte del grupo HEMO de la hemoglobina Forma parte de la clorofila R' R R R' NH N N HN R R Porfirina R' R R R R R N H H Fe++ N N N R R R
OH
H2N
N H
R'
Porfobilingeno
Ncleo de hemoglobina
O N Ketorolac (analgsico)
2
OH
PIRROL, TIOFENO, FURANO
4 Tiofeno 5 S 1 3 2 O O O N O S O N O Sr
2+
Aislado en 1882. Viktor Meyer
O S O N H CH3 Sr
2+
N H Isatina H2SO4c N H O
S O Indofenina N H
O O
Duloxetina (antidepresivo)
O Ranelato de estroncio (agente antiosteoporosis)
Furano 5
4 O 1
3 2 H O THF NO2 O Furfural O HO
HO H O H OH
OH O
Ac. ascrbico
CH3 H3C N
S O Ranitidina
N H
N H
CH3
PIRROL, TIOFENO, FURANO
Heterociclos de cinco miembros, reactividad general
N H Pirrol
S Tiofeno
O Furano
1- Son -excedentes (6 e- para 5 tomos): Sus reacciones ms importantes SE
Posicin 2 X
E+ X + H
E H
3 Formas cannicas: Es preferente
Posicin 3 X
E+ X +
E Slo 2 formas cannicas
a) La SE est favorecida en 2 b) pirrol>>tiofeno, furano Tiofeno especial por orbitales d. Es el ms aromtico. Furano el que menos
PIRROL, TIOFENO, FURANO
2- Los heterociclos de 5 miembros NO reaccionan con E+ por el heterotomo H+ N H N H
+
3- El efecto de los sustituyentes es el mismo que en benceno, pesando mucho la activacin del anillo 4- Furano , el menos aromatico, da reacciones de adicin y apertura, y cicloadiciones de Diels-Alder X+ Z Z + X H Y YH O X H
5- Los heterociclos de 5 miembros NO reaccionan con Nu-, salvo excepciones, sobre todo en tiofeno y furano
PIRROL, TIOFENO, FURANO
Reacciones con electrfilos. 1 Protonacin
Pirrol Tiofeno
H+ N H pKa = -3,8 H H N H
+
Furano
H+ O pKa = approx -10 O
+
H H H H O
+
H+
+ N H H
S Mucho ms estable
H H
Oxonio conjugado
Oxonio no conjugado Muy reactivo
H H
N H
H2O
cation 2H-pirrolio cation 3H-pirrolio Muy reactivo Sin otro Nu H H H+ N H N H
+
Sintesis de 1,4-dicarbonilos
N H
H N N H
H N N H
H N
Polmero
Con otro Nu H H H+ N H HO-NH2 N H
+
H+ H H N H H N OH HN N-OH HO-N N-OH
51%
PIRROL, TIOFENO, FURANO
2. Nitracin
AcO-NO2 N H AcOH, -10C N H + NO2 NO2 N H 4:1 64% S AcO-NO2 AcOH, 0C + S NO2 NO2 AcOS 6:1 70% Pyr O NO2 H AcO O 60% H NO2 O AcO-NO2 O AcOH, 0C
+
H NO2
BF4-NO2+ O BF4O NO2 O
H NO2
BF3 + HF
PIRROL, TIOFENO, FURANO
3- Sulfonacin
N+ O S O O N H
100C
N+ O S O O N H 90% SO3S S SO3O
N+ O S O O O
60% SO310%
-O3S Br Br Br S Br Br -HBr O Br O BrBr H Br 75%
SO3-
4- Halogenacin
Br Br N H Br Br EtOH, 0C N H S Br Br Br O
+
Br H
AcOH Br S
Dificiles de controlar: Pirrol muy reactivo y halogeno no muy desactivante Cl2SO2 N H OC, Et2O N H Cl 80%
CCl4 Br
Br H
Menos reactivo: Ms selectivo
Br
En disolventes alcohlicos RO H OR Mayoritario H
PIRROL, TIOFENO, FURANO
5. Acilacin
O Ac2O N H 200C N H O + CH3 H3C Ac2O O H3C N H CH3 N H S MeCOCl Ph-H, 0C SnCl4 S 80% O CH3 O BF3.Et2O Acido o anhidrido O R
70% CH3 CH3 75%
H3C N H
CH3
COOH S
a)SOCl2 b)SnCl4 S O O
(CX3CO)2O Sin catalizador O
O CX3
CH3 AcOH, refl
NaOH/H2O (Cl3CO)2O N H Et2O, ta N H 79% O Cl3
O N H 70% OH
O OMe 89%
NaOMe/MeOH N H ta
PIRROL, TIOFENO, FURANO
5. Acilacin
Formilacion de Vilsmeier
Es tambien una acilacin (formilacin) pero aplicable a otras amidas
DMF, POCl3 N H
ta
H3C N N H H
CH3
1) DMF, POCl3 S 0C 2) H2O, K2CO3 S 78% H
O O
1) DMF, POCl3 0C 2) H2O, K2CO3 O 76% H
O H2O, K2CO3 N H H 83%
H N N
O Cl P O Cl
+ CH3 N CH3
Especie reactiva form. Vilsmeier
N H
a)POCl3 b) Et3N
N H
47%
10
PIRROL, TIOFENO, FURANO
6. Condensacin con carbonilos. Los hidroxiderivados iniciales no son estables
Con aldehidos H2CO N H K2CO3 aq 5C HO N H pirrol OH HCl 84% 5C H N H N HH H
+
HO N H
CH2
HO
alquilidenpirrolio
H N H NH H N HN
HO N H HCl
OH NH N H N H 61%
porfiringeno -H2
Cloranilo Cl3CH rfl
N NH N 31% porfirina -H2 HN NH
N HN H N -H+ NH
N HN H N
+
N NH -HH N HN
11
PIRROL, TIOFENO, FURANO
6. Condensacin con carbonilos. Los hidroxiderivados iniciales no son estables
Con cetonas O H3C N H CH3 H+ reflujo
+
H3 C H3 C CH3 CH3 N H N N HH C CH H 3 3 N H H3 C H3 C
CH3 N H H N H N CH3 CH3 88% CH3
Pirroles con pos. 5 ocupada EtOOC H3C N H EtOOC MeCHO HCl, EtOH reflujo H3 C N N HHCH H 3 CH3 83 % Dimero COOEt
Test de Ehrlich CH3 H3 C N CH3 H3 C H3C N H O H HCl, EtOH, ta H3C H3C N H
+
CH3 + N CH3 N H CH3 N CH3 90% violeta brillante
H3 C
12
PIRROL, TIOFENO, FURANO
6. Condensacin con carbonilos. Los hidroxiderivados iniciales no son estables
Tiofeno y furano H2CO Me2CO S H+ S
+
CH3 CH3
H+
CH2
Con cetonas: Tetramero H3C H3C S S H3C CH 3 Menos reactivo que pirrol Se detiene en el dimero O
+
CH3 O O O O CH3 CH3 CH3
CH3 CH3 88% H3C H3C
13
PIRROL, TIOFENO, FURANO
7. Condensacin con iminios e iminas.
Reaccion de Mannich H H3C N H H N H CH3 O H3C + N CH3 H N H H3C N CH 3 62% Base de Mannich H3C N CH 3 H3C N CH 3
H H+, ta
calor, 50%
AcOH, 100C, 73%
8. Oxidaciones
Muy reactivos a la oxidacin, el pirrol y furano se degradan con facilidad, tiofeno es resistente. H2O2 N H N H O N H OH N H O
Mas estable
14
PIRROL, TIOFENO, FURANO
9. Sustitucin nuclefila
Los pirroles sencillos NO reaccionan con Nu blandos. Con Nu duros actuan como cidos BuLi N H N Li+ Pirroles N-metalados MeONa MeOH S I Br BrCu 100C MeONa MeOH BrCu 100C S _ S _ RCOCl N R O O No reaccionan por SN
Br
OMe OMe
I
OMe
83%
OMe
88%
Gracias a los orbitales d del S 10. Reacciones de reduccin No reaccionan con hidruros metalicos ni se reducen salvo en condiciones drasticas. Generalmente puede reducirse las cadenas laterales sin problemas
15
PIRROL, TIOFENO, FURANO
11. Cicloadiciones
Reaccion de Diels-Alder Los pirroles sencillos no reaccionan por Diels-Alder
COOEt N H N H S COOEt
COOEt S COOEt
T elevadas y bajos rtos COOEt O O COOEt O S O
COOEt COOEt
N H 10-20%
mCPB
COOEt COOEt
COOEt 15 Kbar N H COOEt COOEt N H COOEt
<70%
Bajas t y rtos altos
Furano: Con mucha facilidad incluso a tr ambiente O O O O Et2O, RT 80% O O O O
16
PIRROL, TIOFENO, FURANO
12. Sntesis de pirroles
1. Sintesis de Paal- Knorr
N H
O O NH3 benceno
H 3C
O O NH3
CH3 reflujo
H 3C
HO N O H2 Cl
CH3
H 3C HO N H
CH3 OH H 3C N H CH3
90%
H 3C
O O
CH3
H 3C
H 2C O O CH3
17
PIRROL, TIOFENO, FURANO
O + N H N _ _ = + NH2 aminocarbonilo O 1,3-dicarbonilo O R OMe CH3 N H R = CH3 60% O O O
2-Sintesis de Knorr
O NH2
O OMe O CH3 R KOH ac o hidroalcoholica O N
O O N H
O 3-Sintesis de Hantzsch N H + + _ _ N _ +
X =
halocarbonilo O OEt CH3 O N H2 OEt H3C N H
NH3 O 1,3-dicarbonilo
O X H3C O O OEt CH3
NH3 ac. t.a. > 80C H2N
O OEt CH3 41%
18
PIRROL, TIOFENO, FURANO
13. Sntesis de tiofenos
1.- 1,4-dicarbonilos + fuente de S _ _ S P2S5 o reactivo de Lawesson = O O MeO P S S Convierte carbonilos en tiocarbonilos S P S OMe
LR Ph O O CH3 Tolueno reflujo S S S S H HS S Ph S CH3 80%
19
PIRROL, TIOFENO, FURANO
2. 1,3-dicarbonilos + mercaptoacetatos _ + S G H H = O O HS G HS COOEt
+ +
G= grupo electronatrayente
R R O O HS
EtO-/EtOH COOEt R O O
R R S COOEt S
R
_O
O H
COOEt
R OH R HO S COOEt R S
R R = CH3 COOEt 45%
HS
COOEt
Na2S
Br
COOEt EtOOC
COOEt
20
PIRROL, TIOFENO, FURANO
Sintesis de Hinsberg
1,2-dicarbonilos + tiodiacetatos + _ G S + _ G
= G
O S
O G
Ph O EtOOC S O
Ph
tBuOK tBuOH
Ph HO EtOOC S
Ph OH COOEt
Ph EtOOC
Ph COOEt
Ph EtOOC Cu 300C
Ph COOH 70%
COOEt 60C
Ph EtOOC
Ph 47%
21
PIRROL, TIOFENO, FURANO
14. Sntesis de furanos
1. Sintesis de Paal- Knorr en medio cido O O O O O H
But O O
TsOH benceno
tBu
reflujo
O O H
HO
But
tBu 80%
2. Sintesis de Feist-Benary O + + O O O Cl H O OEt CH3 NaOH t.a. O CH3 Cl _ O _ = O O Cl halocarbonilo O 1,3-dicarbonilo O HO OEt CH3 O aislable O CH 22 3 70% OEt O OEt O
OH O H
PIRROL, TIOFENO, FURANO
ZOMEPIRAC (ANALGESICO, ANTIINFLAMATORIO)(McNeill)
DE 2 102 746 (McNeil; appl. 21.1.1971; USA-prior. 26.1.1970).
23
PIRROL, TIOFENO, FURANO
TIOCLOMAROL (ANTICOAGULANTE)(LIPHA)
ZA 6 707 267 (Lipha; appl. 7.8.1968; F-prior. 13.11.1967; 13.12.1966).
24
PIRROL, TIOFENO, FURANO
RANITIDINA (ANTIULCEROSO)(GLAXO)
US 4 128 658 (Glaxo; 5.12.1978; GB-prior. 4.8.1976, 6.12.1976, 13.5.1977).
25
You might also like
- Lab Organica 13 - Detergentes y JabonesDocument10 pagesLab Organica 13 - Detergentes y JabonesArmando Ibarra FernandezNo ratings yet
- Pirrol, Furano y Tiofeno.Document106 pagesPirrol, Furano y Tiofeno.Lunnitha CarrilloNo ratings yet
- H06Document13 pagesH06Adrian VargasNo ratings yet
- Fundamentos Sobre Reacciones OrganicasDocument32 pagesFundamentos Sobre Reacciones Organicaschujes274No ratings yet
- Reacciones OrganicasDocument100 pagesReacciones OrganicasEdgar VargasNo ratings yet
- Heterociclicos 2012 Partec PDFDocument24 pagesHeterociclicos 2012 Partec PDFKaterine Quimbayo AgredaNo ratings yet
- Quimica OrganicaDocument111 pagesQuimica OrganicaMarisol Jasso BautistaNo ratings yet
- +apuntes de Quimica Heter.Document21 pages+apuntes de Quimica Heter.Victor OlveraNo ratings yet
- AlcanosDocument11 pagesAlcanosArturo AkimanNo ratings yet
- FenolesDocument14 pagesFenolesalexis diazNo ratings yet
- Resumen HeterociclosDocument9 pagesResumen HeterociclosMANUEL ALEJANDRO MIRANDA MARQUEZNo ratings yet
- Alcoholes II, Éteres y Epóxidos Espectroscopía IR y RMN PDFDocument58 pagesAlcoholes II, Éteres y Epóxidos Espectroscopía IR y RMN PDFE Daniel Zabala100% (1)
- (6.1) Tiofeno 2.1Document8 pages(6.1) Tiofeno 2.1Manuel ZuluagaNo ratings yet
- Evaluacion de FenolDocument20 pagesEvaluacion de FenolTaly CandiaNo ratings yet
- Clase 3Document36 pagesClase 3Estefany MartinezNo ratings yet
- TEMA Nº2-Compuestos HeterociclosDocument11 pagesTEMA Nº2-Compuestos HeterociclosBeatriz CuadrosNo ratings yet
- Practica 6Document10 pagesPractica 6yuzurijaNo ratings yet
- TEMA - 5 - ETERES - Parte IIDocument18 pagesTEMA - 5 - ETERES - Parte IIPablo Matías Silvera QuirogaNo ratings yet
- Quimica OrganicaDocument159 pagesQuimica OrganicaVarg VikernesNo ratings yet
- Tema 2 Heterociclos PentatómicosDocument60 pagesTema 2 Heterociclos PentatómicosCuervo NironacuchanockNo ratings yet
- Síntesis de Heterociclos PentagonalDocument87 pagesSíntesis de Heterociclos PentagonalWilbert Rivera MuñozNo ratings yet
- Mecanismos Funciones OxigenadasDocument29 pagesMecanismos Funciones OxigenadasLeonardo HuertasNo ratings yet
- Heterocilcos de 5 MiembrosDocument67 pagesHeterocilcos de 5 MiembrosDaniel Ryūku NishimuraNo ratings yet
- Reacciones de Compuestos Orgánicos1Document31 pagesReacciones de Compuestos Orgánicos1Juan Carlos Betancur100% (1)
- Reducción de Alcoholes, Compuestos Sulfónicos y EpóxidosDocument6 pagesReducción de Alcoholes, Compuestos Sulfónicos y EpóxidosSilvia Rivera Sivila50% (2)
- Previo 2-NitrotiofenoDocument5 pagesPrevio 2-NitrotiofenoEdgar Armando100% (5)
- Resumen Reacciones Química Orgánica - Condensaciones y MásDocument9 pagesResumen Reacciones Química Orgánica - Condensaciones y MásDana NelumboNo ratings yet
- Eteres 2Document10 pagesEteres 2NellyGarciaSuarezNo ratings yet
- Compuestos HalogenadosDocument21 pagesCompuestos HalogenadosAna EstradaNo ratings yet
- Reacciones de Adicion2Document62 pagesReacciones de Adicion2León Guillermo Mondragón CarbajalNo ratings yet
- Sintesisanillosde5atomos1heteroatomo 10733Document86 pagesSintesisanillosde5atomos1heteroatomo 10733Takeshi Tanohuye TanohuyeNo ratings yet
- Aldehidos y Cetonas 2012-1 PDFDocument64 pagesAldehidos y Cetonas 2012-1 PDFKaterine Quimbayo AgredaNo ratings yet
- Alcoholes II, Éteres y Epóxidos+espectroscDocument54 pagesAlcoholes II, Éteres y Epóxidos+espectroscDiego SuarezNo ratings yet
- ReaccionesHeterociclos 9417Document123 pagesReaccionesHeterociclos 9417Aaron SaavedraNo ratings yet
- Cap 5 Introduccion A Los HeterociclicosDocument48 pagesCap 5 Introduccion A Los Heterociclicosmayra potes100% (1)
- Aldehídos y CetonasDocument11 pagesAldehídos y CetonasTatianaQuintanaNo ratings yet
- 11 UNIDAD XI-Org 2 (Fenoles y Quinonas) 2014Document73 pages11 UNIDAD XI-Org 2 (Fenoles y Quinonas) 2014Jose Jose Jose OmarNo ratings yet
- Sintesis de Heterociclos de Seis MiembrosDocument122 pagesSintesis de Heterociclos de Seis MiembrosMario Leonardo Guevara EscalanteNo ratings yet
- Cap 9. 1,2-AzolesDocument7 pagesCap 9. 1,2-AzolesCesar RodriguezNo ratings yet
- Reducción de Compuestos α.b insat CODocument12 pagesReducción de Compuestos α.b insat COSilvia Rivera SivilaNo ratings yet
- Oxidación de Aldehídos y CetonasDocument7 pagesOxidación de Aldehídos y CetonasWilbert Rivera MuñozNo ratings yet
- Tema 10. Alcoholes PDFDocument41 pagesTema 10. Alcoholes PDFRaquel Aparicio SanchezNo ratings yet
- Problemas Resueltos de QuimicaDocument14 pagesProblemas Resueltos de QuimicasubaruleNo ratings yet
- AldehiDos y CetonasDocument12 pagesAldehiDos y CetonasAndres BogNo ratings yet
- Semana 19Document27 pagesSemana 19Arni Paul Marreros SorianoNo ratings yet