Professional Documents
Culture Documents
Microbiologia Oral Esquema Protocolo 10 - SEMANA API20A
Uploaded by
api-26429188Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Microbiologia Oral Esquema Protocolo 10 - SEMANA API20A
Uploaded by
api-26429188Copyright:
Available Formats
API 20 A
1. Introdução e objectivo do teste
O API 20 A é um sistema padronizado que associa 21 testes bioquímicos que permitem
identificar rápida e facilmente bactérias anaeróbicas. Outros testes, tais como o
crescimento em gelose profunda, o aspecto das colónias, a morfologia celular, a
coloração de Gram… devem ser detectados e integrados no procedimento utilizado para
poder efectuar uma identificação completa. A lista completa das bactérias possíveis de
identificar com este sistema encontra-se no Quadro de identificação no final.
2. Princípio
A galeria API 20 A comporta 20 microtubos que contêm substratos desidratados.
Os microtubos são inoculados com uma suspensão bacteriana que reconstitui os testes.
As reacções produzidas durante o período de incubação traduzem-se por viragens
coloridas espontâneas ou reveladas por adição de reagentes.
A leitura destas reacções é efectuada com o Quadro de Leitura e a identificação obtém-se
com o Catálogo Analítico ou um programa de identificação.
Nota: Composição do meio API A
Tripticase 5,0 g
Extracto de levedura 5,0 g
L-cistina 0,4 g
L-Triptofano 0,2 g
Cloreto de sódio 2,5 g
Hemina (origem suína) 0,005 g
Sulfito do sódio 0,1 g
Água desmineralizada q.b. 1000 ml
pH: 6,9-7,3
3. Reagentes e materiais necessários (mas não são fornecidos
juntamente com o kit API 20 A)
Reagentes:
• Reagentes: BCP
EHR
XYL (Xileno)
• Óleo de parafina
• Escala de McFarland (ponto 4) ou DENSIMAT
• Catálogo Analítico API 20 A ou programa de identificação
• Água oxigenada sol. A 3%
Microbiologia Oral 1/7
Materiais:
• Zaragatoas
• Micropipetas
• Suporte para ampolas
• Suporte de protecção de ampolas
• Jarra de anaerobiose
• Equipamento geral de laboratório de bacteriologia, entre o qual uma lâmpada de
UV
4. Condições de armazenamento
As galerias e os meios devem ser conservados a 2 º - 8 ºC até à data de validade indicada
na embalagem.
5. Colheita e Preparação das amostras
O API 20 A não deve ser utilizado directamente em amostras de origem clínica ou outras.
Os microrganismos a identificar devem primeiro ser isolados num meio de cultura
adaptado segundo as técnicas gerais de bacteriologia.
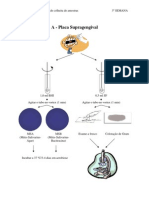
5.1. Preparação do inoculo
• Abrir uma ampola de API 20 A Medium (4 ml) como se demonstra a seguir
na figura 1.
Figura 1. Forma de abrir a ampola.
• Utilizando uma zaragatoa, recolher todas as colónias obtidas em gelose de
sangue em anaerobiose. Utilizar preferencialmente culturas recentes (18-24h).
Verificar bem a pureza da estirpe (eventualmente, efectuar uma subcultura a
partir duma colónia bem isolada).
Microbiologia Oral 2/7
• Preparar uma suspensão bastante densa: Opacidade deve ser igual ou superior
a 3 da escala de McFarland. Esta suspensão deve ser utilizada imediatamente
após a sua preparação.
Nota 1: As bactérias de crescimento lento podem necessitar de várias placas de
subcultura para obter o inoculo com a densidade requerida.
Nota 2: Para manter uma certa anaerobiose, convém evitar introdução de ar durante a
homogeneização do meio.
5.2. Preparação da galeria
• Distribuir cerca de 5 ml de água destilada estéril nos alvéolos (da placa do
fundo) para criar uma atmosfera húmida.
• Colocar a tampa em cima.
• Retirar a galeria da embalagem.
• Colocar a galeria na caixa da embalagem.
5.3. Inoculação da galeria
• Utilizando uma pipeta estéril, inocular a galeria com a suspensão preparada
em API 20 A Medium, evitando a formação de bolhas (inclinar ligeiramente a
caixa de incubação para a frente e colocar a ponta de pipeta de lado na cúpula:
Para o teste GEL – encher tubo e cúpula.
Para o teste IND – encher unicamente o tubo com a suspensão bacteriana e
encher a cúpula com óleo de parafina, para evitar a evaporação do indol
formado.
• Fechar a caixa de incubação.
• Incubar a 36 ºC ± 2 ºC em anaerobiose durante 24 h (± 2h).
• O excesso de API 20 A Medium pode servir para verificar a pureza e
viabilidade da estirpe, inoculando uma gelose em profundidade ou um
conjunto de 2 placas de meio d e cultura, incubadas em anaerobiose e outra
em aerobiose.
6. Leitura e interpretação
6.1. LEITURA DA GALERIA
Muitas bactérias anaeróbicas dão, em 24 h, uma resposta clara e fácil de interpretar, mas
algumas estirpes têm um crescimento lento e são apenas identificáveis após 48 h de
incubação.
• Após incubação, a leitura da galeria deve ser efectuada consultando o quadro
de leitura.
• Anotar na ficha de resultados todas as reacções espontâneas (que não
necessitam de adição de reagentes)
• Revelar os testes que necessitam de adição de reagentes:
O BCP do meio reaccional pode ser descorado por redução. Neste caso,
revelar a reacção de acidificação adicionando 1 gota de reagente BCP a
Microbiologia Oral 3/7
todos os microtubos que contêm hidratos de carbono. Uma cor amarela
ou verde-amarelada indica uma reacção positiva a anotar na ficha de
resultados.
Teste IND: adicionar 1 gota de reagente XYL. Misturar e esperar 2-3-
minutos. Acrescentar 1 gota de reagente EHR. O reagente deve ficar à
superfície da mistura xileno/óleo de parafina ao nível da cúpula (para não
diluir a coloração no microtubo). Ler nos 5 minutos a seguir. Uma cor
vermelha indica uma reacção positiva a anotar na ficha de resultados.
Teste CAT: A produção de catalase é detectada após 30 minutos de
exposição das galerias ao ar livre. Adicionar 2 gotas de H2O2 a 3% num
tubo positivo. O aparecimento de bolhas indica uma reacção positiva a
anotar na ficha de resultados.
QUADRO DE LEITURA
Microbiologia Oral 4/7
6.2. INTERPRETAÇÃO
A identificação é obtida a partir do perfil numérico.
• DETERMINAÇÃO DO PERFIL NUMÉRICO:
Na ficha de resultados, os testes são separados por grupos de três e um valor 1, 2
ou 4 é indicado para cada um.
Adicionando no interior de cada grupo os valores correspondentes às reacções
positivas, obtém-se 7 algarismos que constituem o perfil numérico.
• IDENTIFICAÇÃO:
A identificação pode obter-se a partir da base de dados (V3.0)
* com o Catálogo Analítico:
- pesquisar o perfil numérico na lista dos perfis
* com o programa de identificação:
- introduzir manualmente no teclado o perfil numérico com 8 algarismos.
Microbiologia Oral 5/7
Microbiologia Oral 6/7
QUADRO DE IDENTIFICAÇÃO
% das reacções positivas após 24/48h a 36 ºC ± 2 ºC
Microbiologia Oral 7/7
You might also like
- História da Música na Congregação Cristã no BrasilDocument102 pagesHistória da Música na Congregação Cristã no Brasillinomarrocheli100% (1)
- Introdução A Terapia Cognitivo ComportamentalDocument38 pagesIntrodução A Terapia Cognitivo ComportamentalIana FernandesNo ratings yet
- Código de Ética e CondutaDocument18 pagesCódigo de Ética e CondutaJulia SchiewaldtNo ratings yet
- 8 O Delegado Tatuado - Dudaah FonsecaDocument706 pages8 O Delegado Tatuado - Dudaah FonsecaAnalu75% (4)
- Setembro Amarelo Suicidio Manual para A PrevençãoDocument18 pagesSetembro Amarelo Suicidio Manual para A PrevençãoCPSST100% (1)
- Mistérios do rapé: do feitio aos rituaisDocument11 pagesMistérios do rapé: do feitio aos rituaisMagno KkNo ratings yet
- Microbiologia Oral Microbiologia Oral ApontamentosDocument6 pagesMicrobiologia Oral Microbiologia Oral Apontamentosapi-26429188100% (2)
- Microbiologia Oral Microbiologia Oral ApontamentosDocument6 pagesMicrobiologia Oral Microbiologia Oral Apontamentosapi-26429188100% (2)
- RESUMO Cultura Da ConvergenciaDocument2 pagesRESUMO Cultura Da ConvergenciaNatacha EngelmannNo ratings yet
- Exercícios de Cálculo de MedicaçãoDocument2 pagesExercícios de Cálculo de MedicaçãoPaulo Emilio33% (3)
- Visão 2030 - Nivalde J. de Castro PDFDocument441 pagesVisão 2030 - Nivalde J. de Castro PDFVictor MoraesNo ratings yet
- Microbiologia Oral 3 AULA TPDocument13 pagesMicrobiologia Oral 3 AULA TPapi-26429188100% (1)
- OralDocument54 pagesOralapi-26429188100% (2)
- 2 Frekmicrobiologia2005Document1 page2 Frekmicrobiologia2005api-26429188No ratings yet
- PROGORALDocument36 pagesPROGORALapi-26429188No ratings yet
- Doenças PeriodontaisDocument6 pagesDoenças Periodontaisapi-26429188100% (3)
- Ex Ames 1Document13 pagesEx Ames 1api-26429188No ratings yet
- HepatiteDocument3 pagesHepatiteapi-26429188No ratings yet
- Examemicrobiologiajulho 2005Document1 pageExamemicrobiologiajulho 2005api-26429188No ratings yet
- HepatiteDocument3 pagesHepatiteapi-26429188No ratings yet
- 2 Frekmicrobiologia2005Document1 page2 Frekmicrobiologia2005api-26429188No ratings yet
- FW Micro Oral Micro-2 - FreqDocument1 pageFW Micro Oral Micro-2 - Freqapi-26429188No ratings yet
- Exame de Micro Geral - Fevereiro de 2005 MDDocument8 pagesExame de Micro Geral - Fevereiro de 2005 MDapi-26429188No ratings yet
- Esquema Protocolo 4 SEMANADocument3 pagesEsquema Protocolo 4 SEMANAapi-26429188No ratings yet
- Esquema Protocolo 5 SEMANADocument7 pagesEsquema Protocolo 5 SEMANAapi-26429188No ratings yet
- Microbiologia Oral Esquema Protocolo 10 - SEMANA API20ADocument7 pagesMicrobiologia Oral Esquema Protocolo 10 - SEMANA API20Aapi-26429188No ratings yet
- Exame de Micro - Fev2004Document6 pagesExame de Micro - Fev2004api-26429188No ratings yet
- Escolha Multipla MICRO ORAL 1º Teste PraticoDocument2 pagesEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188No ratings yet
- Escolha Multipla MICRO ORAL 1º Teste PraticoDocument2 pagesEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188No ratings yet
- Esquema - Protocolo 3 SemanaDocument3 pagesEsquema - Protocolo 3 Semanaapi-26429188No ratings yet
- BactériasDocument2 pagesBactériasapi-26429188No ratings yet
- 3 Aula TPDocument23 pages3 Aula TPapi-26429188No ratings yet
- Escolha Multipla MICRO ORAL 1º Teste PraticoDocument2 pagesEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188No ratings yet
- Doenças PeriodontaisDocument6 pagesDoenças Periodontaisapi-26429188100% (3)
- CarieDocument5 pagesCarieapi-26429188No ratings yet
- Doenças PeriodontaisDocument6 pagesDoenças Periodontaisapi-26429188100% (3)
- 2 Freq MicroDocument5 pages2 Freq Microapi-26429188No ratings yet
- 2 Freq MicroDocument5 pages2 Freq Microapi-26429188No ratings yet
- Ensino Fundamental - Matemática e GeometriaDocument6 pagesEnsino Fundamental - Matemática e GeometriaAndressaFragosoNo ratings yet
- Verificação de pilares metálicosDocument147 pagesVerificação de pilares metálicosVictorSoutoSimãoNo ratings yet
- A Escola como Organização PedagógicaDocument12 pagesA Escola como Organização PedagógicaabondioNo ratings yet
- Numeracia e Educação InfantilDocument2 pagesNumeracia e Educação InfantilJuliana MoreiraNo ratings yet
- Histologia HumanaDocument7 pagesHistologia HumanaBruna AliceNo ratings yet
- Aula 2 Modelos Contemporâneos de Gestão 2023 2 ModeloDocument53 pagesAula 2 Modelos Contemporâneos de Gestão 2023 2 Modelogomesdebora771No ratings yet
- Legumes na pressão e receitas levesDocument19 pagesLegumes na pressão e receitas levesLuana Guedes de OliveiraNo ratings yet
- Tutorial Convite CasamentoDocument12 pagesTutorial Convite CasamentofabitomNo ratings yet
- Metabolismo de carboidratos e glicóliseDocument11 pagesMetabolismo de carboidratos e glicóliseGioconda1337No ratings yet
- Oralidade, Mobilidade e Criatividade No Rádio: Quais Os Rumos Na Era Pós-Mídia?Document12 pagesOralidade, Mobilidade e Criatividade No Rádio: Quais Os Rumos Na Era Pós-Mídia?Espaço ExperiênciaNo ratings yet
- CTBConsulta Contribuicoes Aberto V20210701215307Document1 pageCTBConsulta Contribuicoes Aberto V20210701215307Juliano CabralNo ratings yet
- Laneli®: Medley Indústria Farmacêutica Ltda. Polivitamínico e Polimineral Cápsula Gelatinosa MoleDocument7 pagesLaneli®: Medley Indústria Farmacêutica Ltda. Polivitamínico e Polimineral Cápsula Gelatinosa MoleFabiano SoaresNo ratings yet
- Jogo Da Sedução - Desafios Íntimos para CasaisDocument2 pagesJogo Da Sedução - Desafios Íntimos para Casaisbispo.studiomapNo ratings yet
- Métodos de Estudo PDFDocument2 pagesMétodos de Estudo PDFdevanirmirandaestadaNo ratings yet
- Um Encontro Com Robert CooperDocument18 pagesUm Encontro Com Robert CooperFernanda Gusmão LouredoNo ratings yet
- Mapeamento de competências para gestão de capacitaçãoDocument3 pagesMapeamento de competências para gestão de capacitaçãoANILTON SANTOS DE FARIAS JUNIORNo ratings yet
- 06 - PortuguêsDocument43 pages06 - PortuguêsrenatoNo ratings yet
- Tinta líquida epóxi anticorrosiva para proteção de estruturasDocument6 pagesTinta líquida epóxi anticorrosiva para proteção de estruturasDaniela E. WagnerNo ratings yet
- Projeto de sistema de vapor de águaDocument40 pagesProjeto de sistema de vapor de águaJulião Chiziane IINo ratings yet
- MSV-030-PEX - Execução para Teste de TalhaDocument6 pagesMSV-030-PEX - Execução para Teste de TalhaEdison BlNo ratings yet
- O Papel Do Gestor de Recursos Humanos Na Construção Da Responsabilidade Social EmpresarialDocument28 pagesO Papel Do Gestor de Recursos Humanos Na Construção Da Responsabilidade Social EmpresarialQueijariaNo ratings yet