Professional Documents
Culture Documents
Mekanisme Insulin
Uploaded by
Edwin PrakosoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Mekanisme Insulin
Uploaded by
Edwin PrakosoCopyright:
Available Formats
INSULIN : MEKANISME SEKRESI DAN ASPEK METABOLISME
Asman Manaf
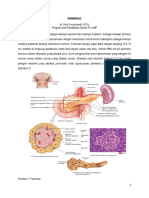
Proses Pembentukan dan Sekresi Insulin Insulin merupakan hormon yang terdiri dari rangkaian asam amino, dihasilkan oleh sel beta kelenjar pankreas. Dalam keadaan normal, bila ada rangsangan pada sel beta, insulin disintesis dan kemudian disekresikan kedalam darah sesuai kebutuhan tubuh untuk keperluan regulasi glukosa darah. Secara fisiologis, regulasi glukosa darah yang baik diatur bersama dengan hormone glukagon yang disekresikan oleh sel alfa kelenjar pankreas. Sintesis insulin dimulai dalam bentuk preproinsulin (precursor hormon insulin) pada retikulum endoplasma sel beta. Dengan bantuan enzim peptidase, preproinsulin mengalami pemecahan sehingga terbentuk proinsulin, yang kemudian dihimpun dalam gelembung-gelembung (secretory vesicles) dalam sel tersebut. Di sini, sekali lagi dengan bantuan enzim peptidase, proinsulin diurai menjadi insulin dan peptida-C (C-peptide) yang keduanya sudah siap untuk disekresikan secara bersamaan melalui membran sel. Mekanism diatas diperlukan bagi berlangsungnya proses metabolisme secara normal, karena fungsi insulin memang sangat dibutuhkan dalam proses utilisasi glukosa yang ada dalam darah. Kadar glukosa darah yang meningkat, merupakan komponen utama yang memberi rangsangan terhadap sel beta dalam memproduksi insulin. Disamping glukosa, beberapa jenis asam amino dan obat-obatan, dapat pula memiliki efek yang sama dalam rangsangan terhadap sel beta. Mengenai bagaimana mekanisme sesungguhnya dari sintesis dan sekresi insulin setelah adanya rangsangan tersebut, merupakan hal yang cukup rumit dan belum sepenuhnya dapat dipahami secara jelas. Diketahui ada beberapa tahapan dalam proses sekresi insulin, setelah adanya rangsangan oleh molekul glukosa. Tahap pertama adalah proses glukosa melewati membrane sel. Untuk dapat melewati membran sel beta dibutuhkan bantuan senyawa lain. Glucose transporter (GLUT) adalah senyawa asam amino yang terdapat di dalam berbagai sel yang berperan dalam proses metabolisme glukosa. Fungsinya sebagai kendaraan pengangkut glukosa masuk dari luar kedalam sel jaringan tubuh. Glucose transporter 2 (GLUT 2) yang terdapat dalam sel beta misalnya, diperlukan dalam proses masuknya glukosa dari dalam darah, melewati membran, ke dalam sel. Proses ini penting bagi tahapan selanjutnya yakni molekul glukosa akan mengalami proses glikolisis dan fosforilasi didalam sel dan kemudian membebaskan molekul ATP. Molekul ATP yang
terbentuk, dibutuhkan untuk tahap selanjutnya yakni proses mengaktifkan penutupan K channel pada membran sel. Penutupan ini berakibat terhambatnya pengeluaran ion K dari dalam sel yang menyebabkan terjadinya tahap depolarisasi membran sel, yang diikuti kemudian oleh tahap pembukaan Ca channel. Keadaan inilah yang memungkinkan masuknya ion Ca sehingga menyebabkan peningkatan kadar ion Ca intrasel. Suasana ini dibutuhkan bagi proses sekresi insulin melalui mekanisme yang cukup rumit dan belum seutuhnya dapat dijelaskan.( Gambar 1 ) Seperti disinggung di atas, terjadinya aktivasi penutupan K channel tidak hanya disebabkan oleh rangsangan ATP hasil proses fosforilasi glukosa intrasel, tapi juga dapat oleh pengaruh beberapa faktor lain termasuk obat-obatan. Namun senyawa obat-obatan tersebut, misalnya obat anti diabetes sulfonil urea, bekerja pada reseptor tersendiri, tidak pada reseptor yang sama dengan
Exocytosis secretory
Granule transport
glukosa,
yang
disebut
sulphonylurea
receptor
(SUR)
pada
membran
sel
beta.
Glucose GLUT-2
K+ channel shut K+
Ca2+ Channel Opens
Insulin Release
Glucose Glucose-6-phosphate ATP Glucose signaling
Insulin + C peptide enzymes Proinsulin preproinsulin Preproinsulin
Cleavage
Depolarization of membrane
B. cell
Gb.1 Mekanisme sekresi insulin pada sel beta akibat stimulasi Glukosa ( Kramer,95 )
Dinamika sekresi insulin Dinamika Sekresi Insulin
Insulin Synthesis
Dalam keadaan fisiologis, insulin disekresikan sesuai dengan kebutuhan tubuh normal oleh sel beta dalam dua fase, sehingga sekresinya berbentuk biphasic. Seperti dikemukakan, sekresi insulin normal yang biphasic ini akan terjadi setelah adanya rangsangan seperti glukosa yang berasal dari makanan atau minuman. Insulin yang dihasilkan ini, berfungsi mengatur regulasi glukosa darah agar selalu dalam batas-batas fisiologis, baik saat puasa maupun setelah mendapat beban. Dengan demikian, kedua fase sekresi insulin yang berlangsung secara sinkron tersebut, menjaga kadar glukosa darah selalu dalam batas-batas normal, sebagai cerminan metabolisme glukosa yang fisiologis.
Sekresi fase 1 (acute insulin secretion responce = AIR) adalah sekresi insulin yang terjadi segera setelah ada rangsangan terhadap sel beta, muncul cepat dan berakhir juga cepat. Sekresi fase 1 (AIR) biasanya mempunyai puncak yang relatif tinggi, karena hal itu memang diperlukan untuk mengantisipasi kadar glukosa darah yang biasanya meningkat tajam, segera setelah makan. Kinerja AIR yang cepat dan adekuat ini sangat penting bagi regulasi glukosa yang normal karena pasa gilirannya berkontribusi besar dalam pengendalian kadar glukosa darah postprandial. Dengan demikian, kehadiran AIR yang normal diperlukan untuk mempertahankan berlangsungnya proses metabolisme glukosa secara fisiologis. AIR yang berlangsung normal, bermanfaat dalam mencegah terjadinya hiperglikemia akut setelah makan atau lonjakan glukosa darah postprandial (postprandial spike) dengan segala akibat yang ditimbulkannya termasuk hiperinsulinemia kompensatif. Selanjutnya, setelah sekresi fase 1 berakhir, muncul sekresi fase 2 (sustained phase, latent phase), dimana sekresi insulin kembali meningkat secara perlahan dan bertahan dalam waktu relatif lebih lama. Setelah berakhirnya fase 1, tugas pengaturan glukosa darah selanjutnya diambil alih oleh sekresi fase 2. Sekresi insulin fase 2 yang berlangsung relatif lebih lama, seberapa tinggi puncaknya (secara kuantitatif) akan ditentukan oleh seberapa besar kadar glukosa darah di akhir fase 1, disamping faktor resistensi insulin. Jadi, terjadi semacam mekanisme penyesuaian dari sekresi fase 2 terhadap kinerja fase 1 sebelumnya. Apabila sekresi fase 1 tidak adekuat, terjadi mekanisme kompensasi dalam bentuk peningkatan sekresi insulin pada fase 2. Peningkatan produksi insulin tersebut pada hakikatnya dimaksudkan memenuhi kebutuhan tubuh agar kadar glukosa darah (postprandial) tetap dalam batas batas normal. Dalam prospektif perjalanan penyakit, fase 2 sekresi insulin akan banyak dipengaruhi oleh fase 1. Pada gambar dibawah ini ( Gb. 2 ) diperlihatkan dinamika sekresi insulin pada keadaan normal, Toleransi Glukosa Terganggu ( Impaired Glucose Tolerance = IGT ), dan Diabetes Mellitus Tipe 2. Biasanya, dengan kinerja fase 1 yang normal, disertai pula oleh aksi insulin yang juga normal di jaringan ( tanpa resistensi insulin ), sekresi fase 2 juga akan berlangsung normal. Dengan demikian tidak dibutuhkan tambahan ( ekstra ) sintesis maupun sekresi insulin pada fase 2 diatas normal untuk dapat mempertahankan keadaan normoglikemia. Ini adalah keadaan fisiologis yang memang ideal karena tanpa peninggian kadar glukosa darah yang dapat memberikan dampak glucotoxicity, juga tanpa hiperinsulinemia dengan berbagai dampak negatifnya.
Intravenous glucose stimulation First-Phase
Second Phase
IGT Normal Type 2DM
Insulin Secretion
Basal
10
15
20
25
30 ( minute )
Gb.2 Dinamika sekresi Insulin setelah beban glukosa intravena pada keadaan normal dan keadaan disfungsi sel beta ( Ward, 84)
Aksi Insulin Insulin mempunyai fungsi penting pada berbagai proses metabolisme dalam tubuh terutama metabolisme karbohidrat. Hormon ini sangat krusial perannya dalam proses utilisasi glukosa oleh hampir seluruh jaringan tubuh, terutama pada otot, lemak, dan hepar. Pada jaringan perifer seperti jaringan otot dan lemak, insulin berikatan dengan sejenis reseptor (insulin receptor substrate = IRS) yang terdapat pada membran sel tersebut. Ikatan antara insulin dan reseptor akan menghasilkan semacam sinyal yang berguna bagi proses regulasi atau metabolisme glukosa didalam sel otot dan lemak, meskipun mekanisme kerja yang sesungguhnya belum begitu jelas. Setelah berikatan, transduksi sinyal berperan dalam meningkatkan kuantitas GLUT-4 (glucose transporter-4) dan selanjutnya juga pada mendorong penempatannya pada membran sel. Proses sintesis dan translokasi GLUT-4 inilah yang bekerja memasukkan glukosa dari ekstra ke intrasel untuk selanjutnya mengalami metabolism (Gb. 3). Untuk mendapatkan proses metabolisme glukosa normal, selain diperlukan mekanisme serta dinamika sekresi yang normal, dibutuhkan pula aksi insulin yang berlangsung normal. Rendahnya sensitivitas atau tingginya resistensi jaringan tubuh terhadap insulin merupakan salah satu faktor etiologi terjadinya diabetes, khususnya diabetes tipe 2. Baik atau buruknya regulasi glukosa darah tidak hanya berkaitan dengan metabolisme glukosa di jaringan perifer, tapi juga di jaringan hepar dimana GLUT-2 berfungsi sebagai kendaraan pengangkut glukosa melewati membrana sel kedalam sel. Dalam hal inilah jaringan hepar ikut
berperan dalam mengatur homeostasis glukosa tubuh. Peninggian kadar glukosa darah puasa, lebih ditentukan oleh peningkatan produksi glukosa secara endogen yang berasal dari proses glukoneogenesis dan glikogenolisis di jaringan hepar. Kedua proses ini berlangsung secara normal pada orang sehat karena dikontrol oleh hormon insulin. Manakala jaringan ( hepar ) resisten terhadap insulin, maka efek inhibisi hormon tersebut terhadap mekanisme produksi glukosa endogen secara berlebihan menjadi tidak lagi optimal. Semakin tinggi tingkat resistensi insulin, semakin rendah kemampuan inhibisinya terhadap proses glikogenolisis dan glukoneogenesis, dan semakin tinggi tingkat produksi glukosa dari hepar.
1. binding ke reseptor, 2. translokasi GLUT 4 ke membran sel, 3. transportasi glukosa meningkat, 4.disosiasi insulin dari reseptor, 5. GLUT 4 kembali menjauhi membran, 6. kembali kesuasana semula.
Gambar. 3. Mekanisme normal dari aksi insulin dalam transport glukosa di jaringan perifer ( Girard, 1995 )
Efek Metabolisme dari Insulin
Gangguan, baik dari produksi maupun aksi insulin, menyebabkan gangguan pada metabolisme glukosa, dengan berbagai dampak yang ditimbulkannya. Pada dasarnya ini bermula dari hambatan dalam utilisasi glukosa yang kemudian diikuti oleh peningkatan kadar glukosa darah. Secara klinis, gangguan tersebut dikenal sebagai gejala diabetes melitus. Pada diabetes melitus tipe 2 (DMT2), yakni jenis diabetes yang paling sering ditemukan, gangguan metabolisme glukosa disebabkan oleh dua faktor utama yakni tidak adekuatnya sekresi insulin (defisiensi insulin) dan kurang sensitifnya jaringan tubuh terhadap insulin (resistensi insulin), disertai oleh faktor lingkungan ( environment ).
Sedangkan pada diabetes tipe 1 (DMT1), gangguan tersebut murni disebabkan defisiensi insulin secara absolut. Gangguan metabolisme glukosa yang terjadi, diawali oleh kelainan pada dinamika sekresi insulin berupa gangguan pada fase 1 sekresi insulin yang tidak sesuai kebutuhan (inadekuat). Defisiensi insulin ini secara langsung menimbulkan dampak buruk terhadap homeostasis glukosa darah. Yang pertama terjadi adalah hiperglikemia akut pascaprandial (HAP) yakni peningkatan kadar glukosa darah segera (10-30 menit) setelah beban glukosa (makan atau minum). Kelainan berupa disfungsi sel beta dan resistensi insulin merupakan faktor etiologi yang bersifat bawaan (genetik). Secara klinis, perjalanan penyakit ini bersifat progressif dan cenderung melibatkan pula gangguan metabolisme lemak ataupun protein. Peningkatan kadar glukosa darah oleh karena utilisasi yang tidak berlangsung sempurna pada gilirannya secara klinis sering memunculkan abnormalitas dari kadar lipid darah. Untuk mendapatkan kadar glukosa yang normal dalam darah diperlukan obat-obatan yang dapat merangsang sel beta untuk peningkatan sekresi insulin ( insulin secretagogue ) atau bila diperlukan secara substitusi insulin, disamping obat-obatan yang berkhasiat menurunkan resistensi insulin ( insulin sensitizer ). Tidak adekuatnya fase 1, yang kemudian diikuti peningkatan kinerja fase 2 sekresi insulin, pada tahap awal belum akan menimbulkan gangguan terhadap kadar glukosa darah. Secara klinis, barulah pada tahap dekompensasi, dapat terdeteksi keadaan yang dinamakan Toleransi Glukosa Terganggu yang disebut juga sebagai prediabetic state. Pada tahap ini mekanisme kompensasi sudah mulai tidak adekuat lagi, tubuh mengalami defisiensi yang mungkin secara relatif, terjadi peningkatan kadar glukosa darah postprandial. Pada toleransi glukosa terganggu (TGT) didapatkan kadar glukosa darah postprandial, atau setelah diberi beban larutan 75 g glukosa dengan Test Toleransi Glukosa Oral ( TTGO ), berkisar diantara 140-200 mg/dl. Juga dinamakan sebagai prediabetes, bila kadar glukosa darah puasa antara 100 126 mg/dl, yang disebut juga sebagai Glukosa Darah Puasa Terganggu ( GDPT ). Keadaan hiperglikemia yang terjadi, baik secara kronis pada tahap diabetes, atau hiperglikemia akut postprandial yang terjadi ber-ulangkali setiap hari sejak tahap TGT, memberi dampak buruk terhadap jaringan yang secara jangka panjang menimbulkan komplikasi kronis dari diabetes.Tingginya kadar glukosa darah (glucotoxicity) yang diikuti oksidatif, dan proses glikosilasi yang meluas. pula oleh dislipidemia
(lipotoxicity) bertanggung jawab terhadap kerusakan jaringan baik secara langsung melalui stres
Resistensi insulin mulai menonjol peranannya semenjak perubahan atau konversi fase TGT menjadi DMT2. Dikatakan bahwa pada saat tersebut faktor resistensi insulin mulai dominan sebagai penyebab hiperglikemia maupun berbagai kerusakan jaringan. Ini terlihat dari kenyataan bahwa pada tahap awal DMT2, meskipun dengan kadar insulin serum yang cukup tinggi, namun hiperglikemia masih dapat terjadi. Kerusakan jaringan yang terjadi, terutama mikrovaskular, meningkat secara tajam pada tahap diabetes, sedangkan gangguan makrovaskular telah muncul semenjak prediabetes. Semakin tingginya tingkat resistensi insulin dapat terlihat pula dari peningkatan kadar glukosa darah puasa maupun postprandial. Sejalan dengan itu, pada hepar semakin tinggi tingkat resistensi insulin, semakin rendah kemampuan inhibisinya terhadap proses glikogenolisis dan glukoneogenesis, menyebabkan semakin tinggi pula tingkat produksi glukosa dari hepar. Jadi, dapat disimpulkan perjalanan penyakit DMT2, pada awalnya ditentukan oleh kinerja fase 1 yang kemudian memberi dampak negatif terhadap kinerja fase 2, dan berakibat langsung terhadap peningkatan kadar glukosa darah (hiperglikemia). Hiperglikemia terjadi tidak hanya disebabkan oleh gangguan sekresi insulin (defisiensi insulin), tapi pada saat bersamaan juga oleh rendahnya respons jaringan tubuh terhadap insulin (resistensi insulin). Gangguan atau pengaruh lingkungan seperti gaya hidup atau obesitas akan mempercepat progresivitas perjalanan penyakit. Gangguan metabolisme glukosa akan berlanjut pada gangguan metabolisme lemak dan protein serta proses kerusakan berbagai jaringan tubuh. Rangkaian kelainan yang dilatarbelakangi oleh resistensi insulin, selain daripada intoleransi terhadap glukosa beserta berbagai akibatnya, sering menimbulkan kumpulan gejala yang dinamakan sindroma metabolik.
REFERENSI Ashcroft FM, Gribble FM, 1999. ATP-sensitive K+ channels and insulin secretion: Their role in health and disease. Diabetologia 42: 903-19. Ashcroft FM, Gribble FM, 1999. Differential sensitivity of beta-cell and extrapancreatic K ATP channels to gliclazide. Diabetologia 42: 845-8. Cerasi E, 2001.The islet in type 2 diabetes: Back to center stage. Diabetes 50: S1-S3. Ceriello A, 2002. The possible role of postprandial hyperglycemia in the pathogenesis of diabetic complications. Diabetologia 42:117-22.
Kramer W, 1995. The molecular interaction of sulphonylureas. DRCP 28: 67 80
Ferrannini E, 1998. Insulin resistance versus insulin deficiency in non insulin dependent diabetes mellitus: Problems and prospects. Endocrine Reviews 19: 477-90. Gerich JE, 1998. The genetic basis of type 2 diabetes mellitus: impaired insulin secretion versus impaired insulin sensitivity. Endocrine Reviews 19: 491-503.
Girard J, 1995. NIDDM and glucose transport in cells. In ( Assan, R, ed )
NIDDM and glucose
transport in cells. Molecular Endocrinology and Development CNRS Meudon, France: 6 16. Kramer W, 1995. The molecular interaction of sulphonylureas. DRCP 28: 67 80
Nielsen MF, Nyholm B, Caumo A, Chandramouli V, Schumann WC, Cobelli C, et al, 2000. Prandial glucose effectiveness and fasting gluconeogenesis in insulin-resistant first-degree relatives of patients with type 2 diabetes. Diabetes 49: 2135-41. Prato SD, 2002. Loss of early insulin secretion leads to postprandial hyperglycaemia. Diabetologia 29: 47-53. Suryohudoyo P, 2000. Ilmu kedokteran molekuler. Ed I, Jakarta: Perpustakaan Nasional, hlm 48-58. Suzuki H, Fukushima M, Usami M, Ikeda M, Taniguchi A, Nakai Y, et al,2003.Factors responsible for development from normal glocose tolerance to isolated postchallenge hyperglycemia. Diabetes Care 26: 1211-5. Tjokroprawiro A, 1999. Diabetes mellitus and syndrome 32 (A step forward to era of globalisation 2003). JSPS-DNC symposium, Surabaya: 1-6. Ward WD, 1984. Pathophysiology of insulin secretion in non insulin dependent diabetes mellitus. Diabetes Care 7 : 491 - 502 Weyer C, Bogardus C, Mort DM, Tataranni PA, Pratley RE, 2000. Insulin resistance and insulin secretory dysfunction are independent predictors of worsening of glucose tolerance during each stage of type 2 diabetes development. Diabetes Care 24: 89-94.
You might also like
- Proses Sekresi InsulinDocument2 pagesProses Sekresi InsulinSulistiyawati Cupliz100% (4)
- GlibenklamidDocument11 pagesGlibenklamidHari SantosoNo ratings yet
- Diabetes dan HipertiroidDocument11 pagesDiabetes dan HipertiroidAyu Annisa100% (1)
- Non BenzodiazepineDocument33 pagesNon BenzodiazepineMasdar Murtada100% (1)
- Glutation PeroksidaseDocument3 pagesGlutation Peroksidasegitantirohman100% (1)
- SGLT 2 InhibitorDocument4 pagesSGLT 2 InhibitorAlimWijayaNo ratings yet
- Farmakokinetik MetforminDocument2 pagesFarmakokinetik MetforminMaylasariNo ratings yet
- Interpretasi Hasil Lab dan GejalaDocument2 pagesInterpretasi Hasil Lab dan GejalaputramwNo ratings yet
- Irama Sirkadian dan Peran MelatoninDocument2 pagesIrama Sirkadian dan Peran MelatoninCindy Ramadhan PutriNo ratings yet
- DETEKSI DINI HIV/AIDSDocument13 pagesDETEKSI DINI HIV/AIDSaryaNo ratings yet
- Obat Anti DiabetesDocument2 pagesObat Anti DiabetesMochi SaturnussNo ratings yet
- Rinitis Alergi Prevalensi dan PatofisiologiDocument4 pagesRinitis Alergi Prevalensi dan PatofisiologiErica FitriNo ratings yet
- InsulinDocument23 pagesInsulinEsi AfriyantiNo ratings yet
- MetforminDocument10 pagesMetforminMeysa Maysa100% (1)
- Sindrom Metabolik 1Document10 pagesSindrom Metabolik 1MentariNo ratings yet
- SISTEM URINARIADocument79 pagesSISTEM URINARIAfarah0001No ratings yet
- Diabetes Mellitus Tipe 2 Dengan Resistensi Insulin, PPT 2003Document46 pagesDiabetes Mellitus Tipe 2 Dengan Resistensi Insulin, PPT 2003Levina AvissaNo ratings yet
- Cara Kerja Sitostatika Dan EfekDocument5 pagesCara Kerja Sitostatika Dan EfekRabbani PasaNo ratings yet
- Vitamin B12Document4 pagesVitamin B12Itsirch AydinNo ratings yet
- Skizofrenia PengobatanDocument23 pagesSkizofrenia PengobatanSulistya NingsihNo ratings yet
- GLIBENCLAMIDEDocument2 pagesGLIBENCLAMIDEdameNo ratings yet
- Rickets & OsteomalasiaDocument26 pagesRickets & OsteomalasiaAnonymous sFBiKFJ3No ratings yet
- Diabetes MelitusDocument26 pagesDiabetes Melitusapoteker muda100% (1)
- CaptoprilDocument5 pagesCaptoprilsantiparamitaNo ratings yet
- Insomnia Primer Definisi Ciri-ciri Jenis Penyebab Gejala Diagnosis TerapiDocument15 pagesInsomnia Primer Definisi Ciri-ciri Jenis Penyebab Gejala Diagnosis TerapiSusasti HasanahNo ratings yet
- Farmakokinetik Dan Farmakodinamik Obat Pada LansiaDocument11 pagesFarmakokinetik Dan Farmakodinamik Obat Pada LansiaLuh Tu PebriyantiNo ratings yet
- ASUHAN KEPERAWATAN PCBDocument30 pagesASUHAN KEPERAWATAN PCBalien exNo ratings yet
- Mekanisme Kerja Hormon InsulinDocument19 pagesMekanisme Kerja Hormon InsulinErvy Tamara50% (4)
- STRES OKSIDATIF DAN ANTIOKSIDAN PADA DIABETESDocument37 pagesSTRES OKSIDATIF DAN ANTIOKSIDAN PADA DIABETESarhiemalizaNo ratings yet
- BAB 4 Pembahasan EpilepsiDocument4 pagesBAB 4 Pembahasan EpilepsirohmaheyNo ratings yet
- FAKTOR RESIKO, MANAJEMEN, KOMPLIKASI, PROGNOSIS HipoglikemiaDocument8 pagesFAKTOR RESIKO, MANAJEMEN, KOMPLIKASI, PROGNOSIS HipoglikemiaFathia Salsabila FakhiraNo ratings yet
- Farmakologi dan pengobatan pada lansiaDocument4 pagesFarmakologi dan pengobatan pada lansiaMuhammad Taufiqul Hadi100% (4)
- Makalah Uji BiokimiaDocument22 pagesMakalah Uji BiokimiaIcha IrzaNo ratings yet
- Makalah Hormon InsulinDocument6 pagesMakalah Hormon InsulinNurrahma Wati100% (1)
- Makalah HipogonadismeDocument15 pagesMakalah HipogonadismeJum Caem50% (2)
- Klasifikasi DMDocument25 pagesKlasifikasi DMAnakNo ratings yet
- PATOFISIOLOGI DM TIPE 1 DAN 2Document2 pagesPATOFISIOLOGI DM TIPE 1 DAN 2Fiddiyah Galuh50% (2)
- Hormon Insulin Dan Reseptor Hormon InsulinDocument3 pagesHormon Insulin Dan Reseptor Hormon InsulinAvenaAthaliaNo ratings yet
- TERAPI OBESITASDocument4 pagesTERAPI OBESITASaditaNo ratings yet
- Penatalaksanaan Malnutrisi-1Document4 pagesPenatalaksanaan Malnutrisi-1Eritia Ekky WahyuningtiasNo ratings yet
- Tugas SP IO - Chapter 31Document46 pagesTugas SP IO - Chapter 31Yus MiaNo ratings yet
- STREPTOMISINDocument5 pagesSTREPTOMISINRahma99No ratings yet
- METABOLISMEDocument19 pagesMETABOLISMEjendy rumraNo ratings yet
- GigantismeDocument16 pagesGigantismeChu Last TreeNo ratings yet
- Siklus CoriDocument2 pagesSiklus CoriYanuar Rasyid MuzzakiNo ratings yet
- Pembahasan Syok Insunlin Padaa Ikan GuppyDocument1 pagePembahasan Syok Insunlin Padaa Ikan GuppyFrengki ChristoriaNo ratings yet
- Hormon PankreasDocument8 pagesHormon PankreasZulfahmi Musllim100% (1)
- Diabetes MelitusDocument32 pagesDiabetes MelitusElizabeth StokesNo ratings yet
- OPTIMASI DMDocument42 pagesOPTIMASI DMJefry HanensiNo ratings yet
- Hormon Insulin Dan GlukagonDocument17 pagesHormon Insulin Dan GlukagonJëłãńğ Bäjăpåņâ75% (4)
- Fisiologi Kelenjar PankreasDocument13 pagesFisiologi Kelenjar PankreasprimaNo ratings yet
- Kelenjar PankreasDocument20 pagesKelenjar PankreasajikwaNo ratings yet
- Biokimia InsulinDocument2 pagesBiokimia InsulinKharisma AlifahNo ratings yet
- Proses Pembentukan Sekresi InsulinDocument40 pagesProses Pembentukan Sekresi InsulinninahNo ratings yet
- Fungsi PankreasDocument5 pagesFungsi PankreasNadia Gina AnggrainiNo ratings yet
- Insulin Mekanisme Sekresi Dan Aspek MetabolismeDocument9 pagesInsulin Mekanisme Sekresi Dan Aspek MetabolismeazuraNo ratings yet
- DMDocument53 pagesDMMohd Hazim Ahmad FuadNo ratings yet
- Gugus Fungsional Berperan DalamDocument9 pagesGugus Fungsional Berperan DalamTessa HarysNo ratings yet
- Hormon Insulin Dan GlukagonDocument13 pagesHormon Insulin Dan GlukagonAinun MardhiyaNo ratings yet
- Fisiologi Dan Biokimia Sistem EndokrinDocument13 pagesFisiologi Dan Biokimia Sistem EndokrindoublejaydNo ratings yet
- CoverDocument2 pagesCoverEdwin PrakosoNo ratings yet
- Doc1 DocxxDocument1 pageDoc1 DocxxEdwin PrakosoNo ratings yet
- Ucapn 1 BulanDocument2 pagesUcapn 1 BulanEdwin PrakosoNo ratings yet
- DefinisiDocument6 pagesDefinisiEdwin PrakosoNo ratings yet
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- KolesterolDocument13 pagesKolesterolEdwin PrakosoNo ratings yet
- Cover LapjagDocument2 pagesCover LapjagEdwin PrakosoNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- TBCDocument14 pagesTBClattedNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- Referat FixDocument28 pagesReferat FixEdwin PrakosoNo ratings yet
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- KolesterolDocument13 pagesKolesterolEdwin PrakosoNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- Sepsis Pada AnakDocument21 pagesSepsis Pada AnakAnjung Sekar Arum100% (1)
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- GliserolDocument9 pagesGliserolEdwin Prakoso100% (1)
- ''Khasiat Dan Manfaat BuahDocument4 pages''Khasiat Dan Manfaat Buaherwin hpNo ratings yet
- Patof MeningitisDocument1 pagePatof MeningitisMita PuspitasariNo ratings yet
- Glukosa KuDocument11 pagesGlukosa KuVita Nyiez AdjahNo ratings yet
- Jika Kita Mencintai SeseorangDocument3 pagesJika Kita Mencintai Seseorangmuhtarom100% (1)
- Diabetes Dalam Kehamilan PDFDocument5 pagesDiabetes Dalam Kehamilan PDFPrayudaApriliaSafitri100% (3)