Professional Documents
Culture Documents
In Mu No
Uploaded by
api-3697245Original Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
In Mu No
Uploaded by
api-3697245Copyright:
Available Formats
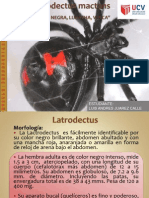
INMUNOLOGÍA HUMANA
Capítulo I: Una visión global de la respuesta inmune
Inmunidad innata: conceptos introductorios. La piel y los epitelios de los aparatos respiratorio, digestivo y
genitourinario representan elementos propios de la inmunidad innata. Contribuyen mediante la producción
de sustancias con actividad microbiostática y microbicida, y de mediadores capaces de inducir y orientar
la respuesta inflamatoria local. Esta, inducida a consecuencia del establecimiento de un foco infeccioso 1º,
involucra diferentes componentes: sistema del complemento, π de fase aguda, IFNs, neutrófilos,
macrófagos y ¢ NK, CD mieloides y plasmocitoides, mastocitos y ¢ NKT. La naturaleza del proceso
condicionará la participación decada uno. El sistema del complemento desempeña un papel destacado
en la inmunidad frente a bacterias extracelulares, sobre todo en relación con las que poseen una
cápsula polisacárida que impide su reconocimiento por las ¢ fagocíticas. La activación del complemento
conduce al depósito de componentes activados sobre la superficie del microorganismo, lo que permite su
reconocimiento por los fagocitos (opsonización). Genera una respuesta inflamatoria mediante la
producción de quimioatractantes capaces de atraer al foco diferentes tipos ¢. Por el contrario, en la
mayoría de las infecciones ocasionadas por bacterias intracelulares o virus, desempeña una función
secundaria. Los macrófagos suelen tener un papel destacado en las infecciones por bacterias
intracelulares. Los IFN de tipo I, las ¢ NK y las CD plasmocitoides constituyen la ppal barrera de
contención durante la infección viral aguda. Los mastocitos y los eosinófilos suelen mediar una
acción relevante frente a numerosas infecciones parasitarias, sobre todo en etapas tempranas. ¿Qué ¢
median la inmunidad innata? Fagocitos, NK, mastocitos, CD y endoteliales. También los queratinocitos de
la piel y los enterocitos del tracto intestinal. Las ¢ de la inmunidad innata reconocen un grupo reducido de
estructuras presentes en los patógenos denominadas “patrones moleculares asociados con los patógenos”
(PMAP), a través de una amplia flia de R llamados “receptores de reconocimiento de patrones” (RRP). La
activación de la inmunidad innata no sólo contribuye a la erradicación del foco infeccioso, sino que
también orienta el curso en el que se desarrollará luego la inmunidad adaptativa. Ella se inicia con la
captura de los Ags microbianos en tejidos periféricos, sobre todo en la piel y las mucosas, por parte de las
CD. Estas capturan el Ag en la periferia, lo procesan y, en respuesta a señales indicativas de estrés tisular,
migran hacia los OLS donde presentan el Ag a los LT CD4+ y T CD8+. Según las señales que haya
recibido la CD podrá activar a los LT en perfiles funcionales diferentes.cada uno de los mecanismos de la
inmunidad innata cuenta con uno o más mecanismos que regulan su actividad, por su enorme potencial
nocivo. Al activarse, los macrófagos producen citocinas inflamatorias, pero también antiinflamatorias que
regulan su activación. Las ¢ NK reciben señales que tienden a inhibir su actividad. La activación del
complemento es controlada por un grupo de π inhibitorias presentes, bajo la forma de R de superficie o de
π solubles.
Inmunidad adaptativa: conceptos introductorios. A diferencia de los elementos ¢ de la inmunidad innata,
que reconocen un < número de motivos conservados (PMAP), los LT y B reconocen motivos particulares
presentes en los patógenos. Existen millones de motivos representados por secuencias aminoacídicas
cortas presentes en las π microbianas. La inmunidad adaptativa emplea como sistema de reconocimiento
un repertorio amplio y variado de R antigénicos distribuidos clonalmente en LT y LB. Es decir,cada clon B o
T reconocerá un único motivo o epitope antigénico a través de su R antigénico (BCR o TCR). Este
amplísimo repertorio linfocitario se desarrolla durante la “ontogenia”, que transcurre para los LT en el timo
y para los LB en la MO y el bazo. Sólo 1 de cada 10 5-106 linfocitos circulantes es capaz de reconocer un
epitope dado, lo que trae 2 problemas: 1) la probabilidad de que un linfocito encuentre a su Ag específico
buscándolo por todo el organismo es realmente remota; 2) aún cuando lo encontrase y se activara, un
sólo linfocito no podría mediar una acción antimicrobiana. A fin de facilitar el encuentro, el linfocito naive o
virgen deberá buscar el Ag sólo en regiones especializadas de los OLS, donde se drenan todos los Ag que
han superado las barreras naturales. En forma cotidiana, los linfocitos naive ingresan en los OLS; si no
encuentran su Ag específico, egresan de ellos, se vuelcan al torrente circulatorio y vuelven a intentarlo
una y otra vez. El LB o T que reconoció a su Ag, se activa y sufre un proceso denominado “expansión
clonal”, donde genera una progenie compuesta de miles de ¢ con idéntica especificidad antigénica. Un
microorganismo suele expresar varios epitopes antigénicos y un epitope particular puede ser reconocido
por más de un clon linfocitario. Al expandirse, una fracción mayoritaria de los integrantes del clon
expandido mediarán funciones efectoras que harán frente al patógeno. Una fracción < se diferenciará a ¢
de memoria, las cuales pueden permanecer por años y permiten una respuesta rápida y eficiente frente a
una reexposición al mismo patógeno. La memoria inmunitaria permite que la inoculación o ingesta de
microorganismos inactivados o atenuados, o de sus componentes, proporcione una inmunidad de larga
duración que, para determinados agentes infecciosos, se extiende durante toda nuestra vida. La
expansión clonal y la memoria inmunitaria representan 2 propiedades esenciales de la
inmunidad adaptativa, no compartidas por la inmunidad innata. A su vez, los RRP están codificados
en la línea germinal, mientras que TCR y BCR no, sino que surgen de rearreglos en las cadenas. Los LT y
B presentan notables diferencias en el modo de reconocer el Ag. Los LB lo reconocen en su conformación
nativa y no requieren la participación de CPA. Los LT no reconocen al Ag nativo. Sólo son capaces de
reconocer péptidos derivados del procesamiento del Ag, presentados por moléculas del CMH de clase I
(para los LT CD8+) y de clase II (para los LT CD4+), expresadas sobre la superficie de las CPA. La
presentación de péptidos antigénicos es, en realidad, la ppal función de las moléculas del CMH I y II. Los
LB son ¢ especializadas en una única función: la producción de Acs, una vez que se han diferenciado en
plasmocitos. Los LT presentan diferentes perfiles fenotípicos y funcionales; en función de la expresión de
las moléculas CD4 y CD8, se distinguen 2 subpoblaciones diferentes: T CD4+ y T CD8+. Los LT CD4+ no
constituyen una población homogénea; hay 3 grupos: Th1, Th2 y TR (reguladores). Los Th1 y Th2 no
provienen de linajes diferentes de T CD4+; se diferencian según el perfil de citocinas presentes en el OLS,
donde las CD activan a los LT naive. La presencia de IL-12 promueve la diferenciación de los LT CD4+ en
un perfil Th1, mientras que la presencia de IL-4 conduce a la diferenciación en un perfil Th2. Las Th2
colaboran con los LB y permiten su correcta activación, expansión y diferenciación a plasmocitos
productores de Acs. Por lo tanto, cumplen un papel central en la respuesta inmune humoral frente a
bacterias extracelulares e infecciones virales. Tienen una función destacada en la inmunidad
antiparasitaria en los tejidos periféricos al inducir la activación de eosinófilos, basófilos y mastocitos. Las
Th1 median la activación de los macrófagos y contribuyen a la activación y expansión de LT CD8+
citotóxicos. Participan así en la inmunidad frente a patógenos intravesiculares, mediante su capacidad
de inducir la activación de los macrófagos y frente a las infecciones virales, por su capacidad de
promover el desarrollo de respuestas T CD8+ citotóxicas. Las ¢ TR cumplen una función central en el
control de la respuesta inmune adaptativa. Existen mecanismos adicionales que controlan la expansión
clonal T a través de π inhibitorias o proapoptóticas.
Capítulo II: Inmunidad innata: barreras naturales, mecanismos de reconocimiento y
sistema del complemento
La inmunidad innata comprende, en 1º lugar, barreras físicas y anatómicas: la piel y los epitelios. La
acción protectora mediada por los epitelios no es de naturaleza pasiva. Si la barrera impuesta por éstos se
supera, se establece en el organismo un foco infeccioso 1º. A fin de hacerle frente, la inmunidad innata
pone en marcha mecanismos ¢ y humorales. La inmunidad innata suele resolver el proceso infeccioso
naciente, o al menos, controlarlo hasta el desarrollo de la respuesta adaptativa.
La piel: epidermis dermis hipodermis (TCS). La epidermis presenta contiene queratinocitos y ¢ de
Langerhans. Los queratinocitos producen queratina, π que otorga resistencia e impermeabilidad a la piel.
Son producidos de manera constante en la piel y migran lentamente hacia la capa superficial de la
epidermis, donde mueren conformando el estrato córneo. La descamación continua contribuye a inhibir la
colonización por microorganismos patógenos. La sequedad relativa de la superficie de la piel, su acidez
(manto ácido, pH 5-6) y la flora cutánea normal contribuyen también a evitar la colonización. La
activación de los queratinocitos puede ser inducida por citocinas inflamatorias y también mediante el
reconocimiento de PMAP por RRP. Al ser activados, los queratinocitos producen IL-1, 6, 7, 8, 10, 12,
15, 18, 20, TNF-α, así como numerosas quimiocinas. Las ¢ de Langerhans son CD que cumplen un
papel crítico en el inicio de la respuesta adaptativa. Se originan de precursores de la MO y poseen alta
capacidad endocítica, lo que les permite tomar muestras de su entorno. Expresan numerosos RRP, R para
diferentes citocinas, como TNF-α e IL-1. El reconocimiento de productos microbianos o de citocinas
inflamatorias induce cambios notables en la fisiología de las CD. Se disocian de los queratinocitos, lo que
les permite migrar hacia los GL a través de los linfáticos aferentes donde presentarán los Ags capturados
y procesados a los LT, para iniciar la respuesta adaptativa.
Mucosas: lindan con ambientes densamente poblados con microorganismos. La producción de linfocitos y
Acs en el intestino supera la producción total del organismo, observación que destaca el papel crítico de la
inmunidad adaptativa en la defensa de las superficies expuestas de los tractos. La continuidad del epitelio
constituye una barrera formidable contra la penetración de los microorganismos y macromoléculas
perjudiciales. El epitelio asociado con las mucosas secreta moco, gel viscoelástico que contiene mucinas.
Estas son péptidos fibrosos largos cubiertos por oligosacáridos. El moco expresa una permeabilidad
selectiva, excluyendo patógenos y toxinas microbianas. Los cilios del epitelio respiratorio barren el moco
pulmonar hacia la faringe y dirigen el material atrapado hacia el estómago, donde patógenos y toxinas se
inactivan con rapidez debido al contenido ácido de las secreciones. La acidez gástrica destruye los
microorganismos atrapados en las secreciones de la nariz, los ojos, la boca y los pulmones. No sólo las
secreciones presentan una alta tasa de recambio, también el propio epitelio. Existen mecanismos
adicionales que contribuyen a la inmunidad en las mucosas. Por ejemplo, la superficie de los enterocitos
está cubierta por el glucocáliz y actúa impidiendo la interacción de los microorganismos con las ¢ del
epitelio. La lactoferrina media una acción antimicrobiana: une hierro, privando a los microorganismos de
éste para su desarrollo. Interactúa con la superficie de bacterias y parásitos, mediando un efecto lítico.
Estimula la actividad antimicrobiana de neutrófilos y macrófagos, y promueve la activación de ¢ NK. La
lisozima ejerce su acción antibacteriana hidrolizando los péptidoglucanos de la pared bacteriana,
rompiendo uniones β1-4 glucosídicas entre el ácido N-acetilmurámico y N-acetil-glucosamina. Activa
autolisinas bacterianas y bloquea la adherencia bacteriana. Las defensinas son péptidos antimicrobianos
con > contenido de arginina y lisina, que les confiere una actividad antimicrobiana de amplio espectro, a
través de la inducción de alteraciones en la permeabilidad de la membrana microbiana. Las aglutininas
son glucoπ cuyos motivos oligosacáridos interactúan con R microbianos, inhibiendo la interacción de los
microorganismos con π presentes en la superficie de las ¢ epiteliales, con lo que dificultan la colonización
de los tractos. Las histatinas son π ricas en histidina, presentes en la saliva, capaces de mediar una
actividad antimicrobiana eficaz. Las secreciones mucosas contienen también > [Acs], fundamentalmente,
IgA secretoria (IgAs). La > parte de la IgAs es producida en el tejido linfoide asociado a mucosas.
Mediante un transporte especializado, alcanza la superficie libre de las ¢ epiteliales: actúa como Ac
neutralizante de diferentes toxinas bacterianas; interactúa con los R de la superficie de los
microorganismos e inhibe la colonización de las mucosas. Las citocinas producidas por las ¢
epiteliales intestinales incluyen: TGF-β, IL-6, 1, 7, 15, GM-CSF; las quimiocinas: IL-8, RANTES,
ENA-78 y MCP-1. La flora microbiana normal que habita en la luz del tubo digestivo, compite por
nutrientes y R presentes en el epitelio que permiten la colonización de las superficies mucosas. Además
produce una amplia variedad de sustancias con actividad antimicrobiana, como AG de cadena corta y
bacteriocinas.
Mecanismos de reconocimiento propios de la inmunidad innata. Los PMAP presentan estructuras químicas
muy diversas, pero comparten 3 características: 1) se encuentran presentes en los microorganismos pero
no en sus huéspedes, 2) son esenciales para la supervivencia o patogenicidad de los microorganismos, 3)
son compartidos por clases enteras de microorganismos.
*RRP: pueden expresarse en la superficie ¢, en compartimientos intracelulares, o ser secretados en los
líquidos corporales.
R tipo Toll (TLR): constituyen una familia de 11 R de membrana caracterizados por la presencia de
un dominio citoplasmático TIR, similar al que expresan los R de IL-1. El TLR4 tiene la capacidad de
reconocer LPS, componentes de la membrana de bacterias gramnegativas. Es capaz también de reconocer
al ácido lipoteicoico, presente en bacterias grampositivas. El LPS es un potente activador de macrófagos y
un agente causal de shock séptico, resultado de la producción sistémica de citocinas inflamatorias, sobre
todo el TNF-α. En la sepsis, la secreción de TNF-α por macrófagos hepáticos y esplénicos ocasiona VD y >
la permeabilidad vascular, con la consecuente disminución del volumen plasmático que culmina en shock.
El TLR2 es el que reconoce > diversidad de ligandos. El TLR3 reconoce ARNdc, s! por diversos virus
durante la infección ¢. El TLR5 reconoce flagelina, una π estructural del flagelo bacteriano. El TLR9
reconoce ADN microbiano; en particular dinucleótidos CpG no metilados, motivos ausentes en los
mamíferos. Se adjudicó al TRL7 la capacidad de reconocer el ARNsc, por lo que podría ser el encargado
de detectar infecciones virales. El reconocimiento de los PMAP por los TLR expresados en ¢ de la
inmunidad innata no induce la fagocitosis, sino que conduce a la activación de vías de señalización que
dan lugar a la producción de mediadores inflamatorios: ERO, NO, péptidos antimicrobianos, quimiocinas,
citocinas y enzimas hidrolíticas. La activación de TLR en las CD induce: 1) su migración desde los tejidos a
los GL, 2) un > en la expresión de las moléculas coE CD80 y CD86 y en las CMH I y II, favoreciendo la
capacidad de la CD de actuar como CPA; 3) la estimulación de diferentes citocinas. En los macrófagos
potencia su actividad fagocítica y microbicida, e induce la producción de quimiocinas y citocinas. En los
neutrófilos, retarda la apoptosis y gatilla la activación de poderosos mecanismos microbicidas.
R lectina de tipo C (RLC): constituyen una extensa familia especializada en el reconocimiento de H
de C presentes en la superficie de los microorganismos. Todos presentan al menos un dominio de
reconocimiento de glúcidos cuya actividad requiere Ca++. Reconocen arreglos espaciales de residuos
manosa, galactosa o fucosa. Los mejor caracterizados son: R de manosa, DC-SIGN, DEC-205, DECTIN-1,
DCAL-1, C-LEC, Langerin. Sus propiedades son: 1) a diferencia de los TLR, los RLC expresados en
macrófagos y CD, al reconocer a sus ligandos, median la internalización de los microorganismos que los
expresan. Esta es seguida por la degradación, procesamiento y presentación de los péptidos; 2) su
activación conduce a la secreción de numerosas quimiocinas y citocinas; 3) algunos son capaces de
reconocer motivos o ligandos expresados en las ¢ del huésped, contradiciendo un requisito para ser RRP;
4) ciertos microorganismos se valen de los RLC a efectos de propagarse en forma acelerada en el
huésped. La endocitosis del HIV mediada a través de DC-SIGN en CD conduce a que la > fracción del HIV
endocitado no sea degradada; es retenida en un compartimiento intracelular durante la migración de las
CD a los OLS. Al interactuar la CD con el LT CD4+, durante la presentación antigénica, expone al HIV
íntegro, facilitando la infección del LT CD4+. Este mecanismo parece ser relevante en la transmisión
heterosexual del HIV.
R Scavenger (SR): de lipoπ modificadas, involucrados en el desarrollo de la aterogénesis. Median el
reconocimiento de microorganismos a través de su interacción con diversos PMAP como Lπ bacterianas,
polirribonucleótidos y ADN microbiano. Se expresan en monocitos, macrófagos y CD. Los más relevantes
son los de la clase A: SR-AI, SR-AII y MARCO.
RRP humorales o solubles: los ppales son: la π de unión a manosa (MBL), ficolinas H y L, π C-
reactiva (PCR) y π surfactantes pulmonares (SP-A y SP-D). Las 3 1º son RRP producidos por el hígado en
etapas tempranas de la infección; SP por las ¢ alveolares tipo II y secretadas sobre el epitelio respiratorio.
MBL y SP pertenecen a la flia de las colectinas, con dominios de reconocimiento tipo lectina-C. Las
colectinas unen manosa, N-acetil-glucosamina, glucosa, L-fucosa, N-acetil-manosamina, pero no
galactosa ni ácido siálico. Estos 2 son azúcares terminales de la mayoría de los H de C presentes en las
¢ de mamíferos, lo que permite el reconocimiento selectivo de H de C microbianos. Tanto la MBL como las
ficolinas, una vez que reconocen a sus ligandos, adquieren la capacidad de activar el complemento por la
VL. La PCR se s! en el hígado durante la respuesta de fase aguda. Su ppal inductor es la IL-6. Une
residuos fosfocolina, presentes en polisacáridos de patógenos. La ppal función es reconocer patógenos y ¢
propias dañadas y mediar su eliminación al inducir la activación del complemento y la fagocitosis.
*R para péptidos formilados (RPF): todas las bacterias producen durante su metabolismo normal,
péptidos N-formilados en metionina. Estos median una actividad quimiotáctica importante sobre los
neutrófilos. Pertenece a la flia 7TMS acoplada a π G reguladoras.
*R para el fragmento Fc de las Ig (RFc): pertenecen a la superflia de las Ig. Existen 6 clases y unen IgA,
G y E; pueden ser además activadores (con motivos ITAM intracitoplasmáticos, intrínsecos al R o
asociados a él, que reclutan kinasas que activan fosforilación); o inhibidores (con motivos ITIM
intracitoplasmáticos, que reclutan fosfatasas e inhiben la activación ¢). El evento crítico en la activación de
los RFc es su microagregación, fenómeno inducido por las Ig que ya hayan interactuado con el Ag y
formado un “complejo inmune” (Ag-Ac). Las Ig presentes bajo la forma de complejos inmunes son
capaces de entrecruzar y activar a los RFc. Su ppal función es desencadenar la fagocitosis de patógenos,
evento crítico para los encapsulados. Cuando el patógeno es demasiado >>, entonces se descargan
gránulos presentes en los eosinófilos, sobre la superficie del agente y se produce la destrucción
extracelular del parásito. Las ¢ infectadas por virus suelen expresar Ags virales, reconocidos por IgG. Esta
¢ infectada puede ser blanco de la CCDA mediada por NK, monocitos y macrófagos. Las ¢ tumorales al
ser reconocidas por IgG, pueden ser también destruidas por CCDA mediada por NK, neutrófilos,
monocitos y macrófagos. Los RFc también median la liberación de quimiocinas, citocinas y mediadores
lipídicos inflamatorios.
*R para componentes del complemento: los patógenos pueden ser reconocidos en forma indirecta cuando
están opsonizados por C3b y/o sus productos de degradación (C3bi, d y dg). Hay 4 clases de R para
estos: CR1 a 4. Excepto para el CR2, su función consiste en mediar la fagocitosis y la destrucción
intracelular de los patógenos. El CR2 forma parte del complejo coR del LB; también se expresa en las CFD
(OLS). Este R les permite a dichas ¢ capturar y retener en su superficie el Ag opsonizado. Durante la
activación del complemento se generan las anafilotoxinas C3a y C5a, que: median la quimiotaxis de
neutrófilos, monocitos y macrófagos- activan respuestas inflamatorias mediadas por éstos, como también
por plaquetas, ¢ endoteliales, eosinófilos y basófilos, mastocitos y ¢ musculares lisas- promueven la
producción de CD y su maduración.
Mecanismos efectores propios de la inmunidad innata: Sistema del Complemento. Componente
humoral de la inmunidad innata. Comprende un grupo de más de 30 π s! en su > parte por los
hepatocitos. Los monocitos, macrófagos tisulares, ¢ endoteliales y epiteliales, representan fuentes
alternativas. Características: a) la > parte de los componentes se encuentran normalmente en forma
inactiva; suelen ser activados por proteólisis, mediada por el componente que lo precede; b) su modo de
activación involucra un mecanismo de amplificación similar al de la coagulación; c) debido a su fuerte
potencial inflamatorio, los eventos centrales en el proceso de activación están bajo el control estricto de
mecanismos reguladores mediados por factores solubles y/o asociados con membranas; d) durante la
activación se forman complejos multimoleculares, a través de la incorporación secuencial de π. Puede
activarse mediante 3 vías: clásica – alterna – de las lectinas. La relevancia de la VA está dada por su
capacidad de ser activada por estructuras presentes en la superficie de los microorganismos. Por lo tanto,
permite al complemento operar en etapas tempranas del proceso infeccioso. La VL es activada por los RRP
solubles: ficolinas H y L, y MBL, s! en > cantidades durante la fase aguda. La VC es activada por Acs IgM,
IgG2 y 3, una vez que interactuaron con el Ag (complejo inmune). Suele actuar en etapas más tardías,
luego de 4 a 7 días, aunque su inducción se de al comienzo del proceso infeccioso. La activación por
cualquiera de las vías conduce a la generación de C3a y C5a, factores que median una notable actividad
quimiotáctica y anafiláctica, y C3b, que funciona como una poderosa opsonina. Conduce también a la
generación del complejo de ataque a la membrana o lítico (CAM: C5-C9), capaz de destruir diferentes ¢ y
microorganismos. Por último, fragmentos provenientes de la degradación de C3b potencian la respuesta
humoral mediada por LB. Entonces, las 4 función básicas del complemento son: 1) producción de
inflamación, 2) opsonización de microorganismos, 3) mediación de un efecto citotóxico directo sobre
diferentes tipos ¢, 4) potenciación de la respuesta B. 1) El objetivo de las respuestas inflamatorias es
reclutar poderosos mecanismos inmunitarios ¢ y humorales en el sitio de lesión, que erradiquen el foco
infeccioso. Aún en ausencia de procesos inflamatorios, tanto los componentes del complemento como las
IgG acceden al compartimiento extravascular. Esto permite contar con una 1º línea de defensa
constitutiva, distribuida en forma homogénea a nivel tisular. La generación de una reacción inflamatoria es
la forma de concentrar en el foco infeccioso componentes humorales con actividad antimicrobiana y
reclutar ¢ inmunes representativas tanto de la inmunidad innata como de la adaptativa. La actividad
inflamatoria es mediada por C3a y C5a, y sus R (7TMS). La actividad quimiotáctica se ejerce sobre
neutrófilos y monocitos, induciendo su reclutamiento en el sitio de lesión. El proceso de activación puede
inducir: la generación de ERO, la liberación de enzimas lisosómicas, el > de la capacidad fagocítica, la
producción de citocinas y quimiocinas, la expresión incrementada de adhesinas y CMH I y II, y la
producción de mediadores lipídicos como LT, PG y PAF. La actividad anafiláctica es responsable de inducir
la activación y desgranulación local de mastocitos ubicados en la vecindad de vasos < y vénulas
poscapilares. Los compuestos liberados (LT, histamina, quimiocinas y citocinas) median un > notable en el
flujo sanguíneo local, en la permeabilidad de la barrera endotelial y en la expresión de adhesinas por ¢
endoteliales. Los cambios inducidos en la microvasculatura facilitan la difusión de π séricas (Ig,
componentes del complemento, π de fase aguda) al sitio de lesión, así como la extravasación de
neutrófilos en fase temprana, y monocitos y linfocitos en estadios más tardíos. La acumulación de líquido
intersticial favorece el movimiento de CD hacia los GLs, contribuyendo a la pronta iniciación de la
respuesta adaptativa. Estos factores actúan también en forma directa sobre las ¢ musculares lisas,
induciendo su contracción y sobre las endoteliales, mediando un > en su permeabilidad y en la expresión
de moléculas de adhesión. 2) C3b facilita la ingesta de microorganismos por ¢ fagocíticas y promueve la
depuración de los complejos inmunes circulantes. Su depósito sobre el patógeno (interacciones
covalentes) marca a la ¢ como extraña y brinda a los fagocitos un motivo adicional de reconocimiento.
Durante un proceso infeccioso, se liberan como Ags solubles, toxinas bacterianas y glucoπ estructurales de
microorganismos. Se unen a Acs IgG específicos y forman complejos inmunes solubles, que deben ser
depurados del torrente circulatorio para evitar su deposición en la membrana basal de los vasos <<. Esta
depuración se realiza en pasos: a) activación de la VC del complemento (generación de C3b e interacción
con grupos químicos expuestos sobre el complejo inmune), b) unión del complejo Ag-Ac al CR1 expresado
en los GR, c) transporte del complejo por los GR al bazo y el hígado, 4) eliminación del complejo unido al
GR por las ¢ de Kupffer y macrófagos esplénicos, 5) endocitosis y degradación de los complejos por las
mismas ¢. 3) El componente C5b, producido por la C5 convertasa, inicia el ensamblado del CAM, que
responde a la estructura C5bC6C7C8C9(n=1-19). Se inserta sobre la diana como una π integral de membrana
y presenta un canal hidrófilo interno, que permite el pasaje libre de st y agua, lo que conduce a la
destrucción de la ¢. 4) CR2 (CD21), CD19 y CD81 se expresan en la membrana del LB conformando el
“complejo coR del LB”. CR2 reconoce fragmentos derivados de la proteólisis del C3b, y CD19 es el
encargado de la transducción de señales conducentes a la activación ¢. Ags recubiertos por esos
productos inducen el entrecruzamiento del complejo trimolecular con el BCR. Este entrecruzamiento
disminuye la [Ag] requerida a efectos de inducir una respuesta 2º eficaz en la producción de Acs
específicos. Además inhibe la apoptosis en el LB. Vía clásica: comienza con la activación de C1: C1q se
une al complejo inmune; se activa C1r y C1s. Este escinde a C4 en C4a (se elimina) y C4b, que se une a
la ¢ diana. Se une C2 y es escindido a C2a (se elimina) y C2b, que se une al complejo formando la
convertasa de C3 de la VC: C4b2b. Esta fragmenta a C3 en C3a y C3b, el cual se une al complejo
formando la convertasa de C5 de la VC: C4b2b3b. Ésta toma a C5 y lo fragmenta en C5a (con C3a
median quimiotaxis y anafilaxia) y C5b, que comienza a formar el CAM. Vía alterna: si ya se activó la VC,
el C3b generado se une al factor B, el cual es clivado por el factor D en Ba (se elimina) y Bb, que se une
formando la convertasa de C3 de la VA: C3bBb. Esta generará más C3b que contribuirá a la
opsonización y reconocimiento del patógeno, al formar la convertasa de C5 de la VA: (C3b)nBb. Si la
VC aún no está activa, C3 es clivado por proteasas o hidrólisis espontánea generando C3b. Existen π
reguladoras que permiten que C3 actúe sobre ¢ extrañas y no propias: el factor H bloquea la formación de
la convertasa de C3 de la VA; el factor I inactiva a C4b y C3b; C1inhibidor inhibe la actividad proteolítica
de C1s; C4BP bloquea la formación de la convertasa de C3 de la VC; CR1 (CD35) inhibe la formación de
ambas convertasas de C3. Vía de las lectinas: MBL al interactuar con los H de C activa un complejo
formado por 2 proteasas: MASP-1 y 2. Estas clivan a C4 y C2, dando lugar a la convertasa de C5 de la VC
(C4b2b3b). El CAM se forma por unión sucesiva de C6, C7, C8 y C9 a C5b. Se genera un poro funcional
que al permitir el libre flujo de agua y st, conduce a un desequilibrio osmótico y a la lisis de la diana.
Deficiencias del complemento: pueden ser congénitas o adquiridas. Dentro de las últimas, las causas
pueden ser: 1) consumo de los componentes por presencia de altos niveles de activadores (complejos
inmunes); 2) deficiencias en las π reguladoras. Las ppales manifestaciones observadas son:
susceptibilidad aumentada a infecciones bacterianas, trastornos reumáticos y angioedema. Los pacientes
deficientes en C3 presentan más infecciones bacterianas, lo que refleja la relevancia de la opsonización en
la defensa contra bacterias encapsuladas. Los pacientes con deficiencia en C1, C4 o C2 suelen manifestar
un aumento moderado de infecciones por bacterias capsulares. Las deficiencias en los componentes
terminales comunes impiden la formación del CAM. Sólo las bacterias gramnegativas son susceptibles a la
acción bactericida del CAM. Las manifestaciones reumatológicas se asocian con el depósito de complejos
inmunes y la generación de lesiones inflamatorias en pacientes deficientes en C1, C4 y C2. La deficiencia
de C1inhibidor es responsable del angioedema hereditario: edema subcutáneo no inflamatorio por
aumento de la permeabilidad endotelial, sobre la piel, el tubo digestivo y las vías respiratorias. La
ausencia de C1inhibidor permite la activación espontánea y persistente de C1, conducente a la escisión de
C4 y C2. El C2a generado se escinde y genera cinina C2, capaz de producir una reacción edematosa y una
s! exagerada de bradicinina, a partir de cininógeno, por acción de la calicreína, regulada por el
C1inhibidor.
Capítulo III: Inmunidad innata: neutrófilos, macrófagos y ¢ NK
Casi todas las ¢ del organismo comparten la capacidad de producir IFN α y β, citocinas de papel
preponderante en el control de las infecciones virales: los hepatocitos, mediante la producción de π de
fase aguda; las ¢ alveolares mediante la producción de SP-A y D; las neuronas, mediante la producción de
diferentes citocinas.
Extravasación leucocitaria: el > de la permeabilidad vascular, producto de la contracción que sufren las ¢
endoteliales de las vénulas poscapilares en respuesta a mediadores como la histamina, produce un escape
del líquido del vaso al tejido subyacente. Esto provoca hemoconcentración, lo que enlentece el flujo
sanguíneo local y en consecuencia, los leucocitos se marginan y pueden contactar con el endotelio. Las
moléculas de adhesión están presentes en la superficie ¢ y median las interacciones cél-cél y ¢-MEC.
Están agrupadas en 5 flias: selectinas (L, P y E), integrinas, moléculas pertenecientes a la superflia de las
Ig, sialomucinas y cadherinas. Las selectinas, reconocen H de C sobre glucoπ de la superficie ¢. La L-
selectina es expresada por leucocitos, la P-selectina se acumula en gránulos de plaquetas y en los cuerpos
de Weibel-Palade de las ¢ endoteliales y se trasloca a la superficie cuando éstas se activan. La expresión
de la E-selectina es inducida en ¢ endoteliales por estímulos inflamatorios, pero se expresa en forma
constitutiva en el endotelio de los < vasos de la piel. Las selectinas contienen un dominio extracelular
lectina-C, que reconoce en el ligando un motivo “sialil Lewis” y residuos tirosina aminoteminales
sulfatados. Por ello los ligandos de las selectinas, las sialomucinas, son moléculas sulfatadas que
presentan oligosacáridos sialilados y fucosilados. El ligando mejor conocido de las selectinas es la
molécula PSGL-1. La L-selectina también reconoce adresinas vasculares, que se expresan en las vénulas
de endotelio alto (HEV) de los OLS. La importancia de una glucosilación adecuada de los ligandos de las
selectinas se torna evidente en los pacientes con “deficiencia de adhesión leucocitaria tipo II” (LAD II). No
pueden incorporar fucosa en los ligandos de las selectinas. Sus leucocitos son incapaces de establecer
interacciones, por lo que sufren infecciones bacterianas recurrentes. Las integrinas son π
heterodiméricas constituidas por una cadena α y una β unidas en forma no covalente. En los leucocitos en
reposo, expresan baja afinidad por sus ligandos; en los activados, sufren un cambio conformacional que
incrementa su afinidad. La superflia de las Ig, incluye numerosas adhesinas: moléculas de adhesión
inter¢ ICAM, VCAM-1, PECAM-1, que son los ligandos de las integrinas. Las cadherinas son las
responsables de mantener la integridad estructural de los tejidos. Se expresan como dímeros y establecen
interacciones homofílicas. Los leucocitos (naturaleza móvil) carecen de cadherinas. Las ¢ de Langerhans sí
expresan cadherinas; éstas las mantienen unidas a los queratinocitos. Las moléculas de adhesión
junto a los quimioatractantes gobiernan la extravasación leucocitaria. Los quimioatractantes son
sustancias que dirigen la migración ¢ a lo largo de un gradiente de concentración que se incrementa hacia
el sitio de producción (foco infeccioso). Incluyen moléculas tan diversas como C5a y C3a, LTB4, PAF,
péptidos formilados y varias quimiocinas. Estas constituyen una superflia de citocinas <<, que dirigen la
migración de distintas poblaciones leucocitarias a los sitios donde desempeñan sus funciones. Participan
además en la organogénesis, la angiogénesis y en la diseminación de metástasis tumorales. Las
quimiocinas se diferencian de las citocinas en que ejercen sus efectos tras interactuar con R
tipo 7TMS. Poseen residuos de cisterna que forman puentes diS; debido a su naturaleza catiónica, una
vez producidas y tras su unión a los proteoglucanos, se inmovilizan sobre MEC o superficies ¢. Esto
permite al leucocito sensar gradientes de quimiocinas sobre un sustrato sólido a lo largo del cual migrar,
mecanismo conocido como haptotaxis. Algunas son s! en condiciones inflamatorias (quimiocinas
inflamatorias), las cuales regulan el tráfico durante la hematopoyesis y la inmunovigilancia de tejidos
periféricos sanos y controlan la organización de los OLS; otras en forma constitutiva (responsables del
control del tráfico linfocitario a los órganos: quimiocinas homeostáticas). También existen quimiocinas
duales.
Cascada de adhesión y extravasación leucocitaria (neutrófilos). El > en la permeabilidad vascular tras el
reconocimiento del patógeno ocasiona la marginación leucocitaria y permite a los neutrófilos tomar
contacto con el endotelio, disminuyendo su velocidad de circulación (contacto mediado x selectinas). Al
comienzo de la respuesta, la histamina liberada por los mastocitos provoca la fusión de los cuerpos de
Weibel-Palade con la membrana endotelial e induce la expresión de la P-selectina en la cara luminal del
endotelio. Los neutrófilos pueden unirse ya que expresan su ligando, el PSGL-1. La adherencia es
reversible y el leucocito se pega y despega a medida que es arrastrado por la corriente sanguínea
(rolling). Conforme progresa la inflamación, los mediadores inflamatorios como el TNF-α y la IL-1,
estimulan la expresión endotelial de E-selectina, la cual soporta el rolling subsecuente. Para que la ¢ se
detenga y pueda extravasarse requiere que las interacciones transitorias de < afinidad (adherencia
débil) sean reemplazadas por interacciones de > afinidad (participarán las integrinas). Los estímulos para
su activación son PAF e IL-8. Una vez activadas, se unen a sus contraR en el endotelio, las moléculas
ICAM-1, ICAM2 y VCAM-1, lo que le permite al neutrófilo dejar de rodar y adherirse en forma estable.
La interacción mediada por integrinas es fuerte pero reversible, indispensable para que se produzca el
pasaje del neutrófilo entre ¢ endoteliales y a través de la membrana basal (diapédesis). El neutrófilo se
deforma, remodela su citoesqueleto y se extiende en un seudópodo para poder penetrar con movimientos
ameboideos. Tras atravesar la lámina basal, el neutrófilo se abre paso en el espacio intersticial siguiendo
gradientes de quimioatractantes.
Granulocitos Neutrófilos: el ciclo de vida transcurre en 3 compartimientos: MO, sangre y tejidos
periféricos. Derivan de stem cells presentes en MO. Maduración (5-7 días): mieloblasto promielocito
mielocito metamielocito neutrófilo maduro. Sólo los primeros 3 poseen capacidad proliferativa. En
sangre se observan 2 pools: el circulante y el marginal (adheridos al endotelio). Acceden a los tejidos
donde sobreviven por 6-48 hs., para perecer luego por apoptosis. Carecen de capacidad para recircular.
Los mecanismos microbiostáticos y/o microbicidas mediados por los granulocitos son numerosos:
Reconocimiento, fagocitosis y destrucción de los microorganismos: al arribar a un foco inflamatorio,
reconocen al microorganismo invasor, se adhieren a él y lo internalizan. El reconocimiento está mediado
por RRP que reconocen PMAP. Los neutrófilos expresan TLR1, 2, 4, 5, 6, 7, 8, 9 y 10, además de RLC.
Para el caso de microorganismos opsonizados, intervienen CR1, 3 y 4 y/o RFc. Además expresan R para
numerosas citocinas y quimiocinas. La unión al microorganismo suele promover en el neutrófilo la
polimerización de actina en la zona subyacente al sitio de contacto, lo que conduce a la extensión de
seudópodos que envuelven la partícula y originan el fagosoma. Al unirse a los lisosomas 1º, se forma el
fagolisosoma. Dentro de éste, el patógeno es sometido a la acción de 2 sistemas citotóxicos: uno
dependiente de la producción de ERO, y otro independiente del O2 mediado por enzimas y sustancias.
Todos los ERO derivan del O2-- e incluyen: H2O2, ClO--, OH·, 1O2·, cloraminas. El proceso conducente a la
generación de ERO se denomina “estallido respiratorio”. La enzima responsable es la NADPH
oxidasa (2O2 + NADPH 2O2-- + NADP+ + 2H+). Los fagocitos contienen gránulos con agentes
antimicrobianos, que son liberados al fagolisosoma durante la fagocitosis, o a la MEC en caso de estímulos
solubles o microorganismos no fagocitables.
*Producción de agentes oxidantes: el O2--, aún cuando es capaz de reaccionar con una amplia variedad de
sustratos biológicos, no cumple un papel relevante como mediador directo del daño oxidativo sobre los
microorganismos debido a su escaso potencial oxidante y a su alta tasa de dismutación a H2O2. Este es un
oxidante muy estable que ejerce efectos tóxicos y actúa sobre diferentes componentes microbianos. No
obstante, las ¢ fagocíticas producen ERO con gran potencial oxidante, entre ellos, los oxidantes
halogenados generados merced a la acción de la MPO, que cataliza la oxidación de haluros (cloruro,
bromuro y yoduro) por el H2O2 y genera aniones hipohalitos. Debido a las > [Cl-]p, el ppal producto es el
hipoclorito, el que gracias a su alta capacidad reactiva, oxida una amplia variedad de moléculas
biológicamente relevantes, como aminas, aa, tioles, tioéteres y hemoπ. El hipoclorito reacciona también
con aminas 1º o 2º, y da lugar a cloraminas. Las mutaciones en cualquiera de los genes que codifican a
los componentes de la NADPH oxidasa dan origen a la enfermedad granulomatosa crónica.
*Mecanismos microbicidas independientes del O2: los gránulos pueden clasificarse en: peroxidasa (+) o
peroxidasa (-). Los primeros son los gránulos azurófilos o 1º, mientras que los segundos incluyen los
gránulos específicos o 2º, y los de gelatinasa o 3º. Los 1º contienen defensinas, lisozima, π > de la
permeabilidad bacteriana, elastasa, catepsina G y esterasas. Los 2º contienen apolactoferrina, π de unión
a B12, activador del plasminógeno, lisozima y colagenasa. Los 3º contienen colagenasa, acetiltransferasa
y lisozima.
Producción de mediadores lipídicos inflamatorios: PG, LT, TX, PAF e hidroperóxidos. Favorecen
el reclutamiento de componentes humorales y ¢, y pueden activar diferentes respuestas inflamatorias en
las ¢ reclutadas.
Producción de citocinas: IL-1, 8, 10, 12 y TNF-α.
Macrófagos. Reconocen a los microorganismos y sus productos por RRP, RFc, CR1, 3 y 4, y R para varias
citocinas y quimiocinas. Se originan de monocitos circulantes que al extravasarse se diferencian a
macrófagos. Establecen poblaciones estables en los diversos tejidos y asumen fenotipos especializados.
Actúan como CPA profesionales. En respuesta al reconocimiento de PMAP o citocinas, producidos por ellos
mismos (autocrino) o por otros tipos ¢, secretan un amplio espectro de citocinas, las cuales se agrupan:
a) las que median la inducción de una respuesta inflamatoria aguda, local y sistémica (IL-1, 6 y TNF-α);
b) las que inducen el reclutamiento de leucocitos en el tejido lesionado y favorecen así el desarrollo de la
respuesta inflamatoria (quimiocinas); c) las que inducen o favorecen la proliferación y/o diferenciación
de precursores leucocitarios en la MO (G, GM y M-CSF); d) las que orientan el curso futuro de la
respuesta inmune adaptativa (IL-12 y 18); e) las que modulan la actividad del macrófago en el foco
inflamatorio (IL-10 y TGF-β). No siempre que un macrófago se activa, pone en marcha la totalidad de los
mecanismos descritos. Según el microambiente en el cual se ha diferenciado, y la naturaleza y tenor de
las señales que percibe, podrá activarse de modos diferentes y manifestar un “perfil funcional singular”.
*Conceptos generales relativos a las citocinas: las citocinas median su actividad a través de la interacción
con R de alta afinidad, expresados por las ¢ diana, entendiendo como tales a todas las ¢ sensibles a la
acción modulatoria de las citocinas. Puede observarse tanto supresión como exacerbación en la
expresión de uno o más genes. Suelen actuar de modo autocrino, uniéndose a R expresados en la ¢ que
las secreta, o de modo paracrino, uniéndose a R en ¢ del entorno inmediato. Las acciones de las citocinas
suelen ser pleiotrópicas y redundantes. El pleiotropismo se refiere a la capacidad de una citocina de
mediar distintas acciones biológicas, actuando sobre diferentes ¢ diana. La redundancia, a la capacidad de
varias citocinas de mediar una misma acción biológica. Suelen observarse efectos sinérgicos y
antagónicos.
*Reclutamiento de monocitos en ausencia y presencia de inflamación: la existencia de poblaciones
estables de macrófagos y CD residentes parece deberse al reclutamiento de monocitos desde sangre
periférica en ausencia de estímulos inflamatorios. Dentro del pool de monocitos de sangre periférica se
pueden distinguir 2 poblaciones: inflamatorios (CD14+) y CD16+. Se propuso que CCL3, y CX 3CL1
mediarían el reclutamiento de monocitos residentes en los tejidos, mientras que CCL2 reclutaría
monocitos en condiciones de inflamación.
Reacción de fase aguda: las acciones inflamatorias locales mediadas por IL-1, 6 y TNF-α se ejercen sobre
las diferentes poblaciones ¢ en el entorno del foco infeccioso. Las acciones inflamatorias sistémicas
mediadas también por ellos se ejercen en 3 niveles diferentes: hepático: inducen la producción de π de
fase aguda; hipotalámico: inducen el > de la tº corporal; MO y pool marginal de neutrófilos: inducen
neutrofilia.
Producción de π de fase aguda: puede también ser inducida por C5a y péptidos N-formilados
bacterianos. Las π o reactantes de fase aguda median mecanismos antimicrobianos poderosos y protegen
al huésped de las acciones perjudiciales asociadas con las reacciones inflamatorias. Comprenden un grupo
de π estructural y funcionalmente diferentes; algunas son los RRP solubles y los componentes B-C3-C5 del
complemento.
Inducción de un aumento de la tº corporal: la inducción de un estado febril es característica de las
infecciones bacterianas. Se ejerce sobre el termostato HT y es mediado por la PGE2. Esto explica la
actividad antipirética de los inhibidores de la vía de la CO (ibuprofeno y aspirina). El > de la tº media un
efecto microbiostático frente a diversos patógenos e inhibe la proliferación microbiana.
Inducción de neutrofilia: una acción se ejerce sobre la MO, que tiende a incrementar la velocidad
de producción de neutrófilos y acelera su diferenciación; la 2º, sobre el pool periférico que induce su
disociación del endotelio e incrementa la [neutrófilos]p.
*Una producción incrementada de la PLA2 genera AA libre. Ello permite la generación de los eicosanoides
(PG, TX y LT). La RFA se asocia también con un > de la producción de factores de la coagulación.
Proteasas generadas durante la coagulación son capaces de activar R endoteliales e inducir la expresión
de moléculas de adhesión y la producción del PAF. Esto favorece la extravasación y activación de
poblaciones leucocitarias. La activación de la coagulación contribuye a contener la diseminación del foco
1º. Entre las π de fase aguda encontramos: ceruloplasmina, capaz de inhibir la acción del O2--; e
inhibidores de proteasas, como α1-antitripsina y α2-macroglobulina.
*Propiedades de las citocinas proinflamatorias: el TNF-α es producido por macrófagos como glucoπ de
membrana. La oligomerización de sus R (TNFRI y TNFRII) pone en marcha la transducción de señales
hacia el interior ¢. Incrementa la expresión de adhesinas y CMH I, y la producción de IL-8; activa la
capacidad microbicida de neutrófilos y macrófagos, aumenta la citotoxicidad de T CD8+, induce la s! de
componentes de la MEC y la proliferación de fibroblastos. La IL-1 es producida en > cantidades por
macrófagos y queratinocitos. La producción de IL-1RA en monocitos/macrófagos es estimulada por LPS y
GM-CSF e IL-4, y mediada por hepatocitos. La IL-6 es producida por macrófagos, CD, endoteliales,
fibroblastos, Th2, LB activos; modula también la respuesta inmune adaptativa y la hematopoyesis.
Promueve la expansión clonal de LB y su diferenciación a plasmocitos productores de Acs; la producción
de IL-4 por ¢ Th2, la actividad citotóxica de LT CD8+, y la proliferación de stem cells.
Los G, GM y M-CSF promueven la proliferación de precursores mieloides y su diferenciación en ¢ maduras.
PDGF, FGF y VEGF tienen participación destaCada en los fenómenos de reparación tisular y angiogénesis.
La IL-15 induce la producción de ¢ NK, NKT y LTγδ+. Las IL-12 y 18, favorecen la diferenciación de los LT
CD4+ en un perfil Th1, especializado en el desarrollo de respuesta inflamatoria. La IL-12 también induce
la producción de IFNγ por ¢ NK. Citocinas antiinflamatorias: IL-10 y el TGF-β. La IL-10 inhibe: la
producción de citocinas proinflamatorias y quimiocinas por macrófagos; expresión de enzimas
inflamatorias, como iNOS y CO 2, expansión de Th1 y producción de IL-2 e IFNγ por los Th1, > de la
expresión de CMH II y de moléculas coE CD80 y CD86 en el macrófago, disminuyendo su capacidad de
actuar como CPA, maduración de CD; e incrementa la producción de π antiinflamatorias. El TGF-β es
capaz de inhibir en el macrófago la producción de citocinas proinflamatorias y quimiocinas, la maduración
de las CD; la diferenciación de los LT CD4+ hacia cualquiera de los 2 perfiles, por bloqueo de la expresión
de FT; también promueve la generación de ¢ TR.
¢ NK. Forman parte de la inmunidad innata y participan en la conformación de una 1º línea de defensa
contra agentes infecciosos. Median poderosos mecanismos microbicidas efectores durante etapas
tempranas. Se destacan en la defensa frente a bacterias y parásitos intracelulares, control de
infecciones virales, eliminación de ¢ tumorales, producción de citocinas y quimiocinas, determinación del
perfil de respuesta adaptativa que se monta contra un patógeno. La actividad citotóxica no requiere una
exposición previa al patógeno. Presentan la capacidad de destruir ¢ recubiertas con Acs IgG específicos
contra epitopes del patógeno. Este mecanismo se denomina citotoxicidad ¢ dependiente de Acs (CCDA) y
es inducido a través de la molécula CD16 expresada por las NK. Constituyen un 10-15% de los linfocitos
circulantes; existen 2 subpoblaciones: CD56dim CD16bright, y CD56bright CD16dim. Las CD56dim median la
actividad citotóxica natural y la CCDA. Las CD56bright producen y secretan diversas citocinas
inmunorreguladoras. La capacidad de mediar una respuesta temprana frente a la infección reside en la
expresión constitutiva de R para numerosas monocinas (citocinas liberadas por monocitos y macrófagos).
En respuesta a IL-12, las CD56bright producen > cantidades de IFNγ, TNF-α y β, IL-10 y 13, y GM-
CSF, mientras que las CD56dim muestran una capacidad productora de citocinas muchísimo <. Las ¢ NK
pueden activarse por varias citocinas: IFN-I, IL-2, 12, 15 y 18. Median su actividad citotóxica por 2
mecanismos: exocitosis o secreción vectorial del contenido de sus gránulos (mecanismo secretorio) o
activación de R de muerte en la ¢ diana (no secretorio). El reconocimiento de la ¢ diana por las NK induce
en éstas últimas la movilización de sus gránulos hacia el sitio de contacto. Este movimiento es guiado por
los microtúbulos que se polimerizan. Los gránulos contienen: granzima B, una serinoproteasa capaz de
activar caspasas, y perforina, una π desestabilizante de membranas, entre otras. La granzima B forma un
complejo con la perforina, el cual contiene serglicina como carrier. Al desgranularse la NK, el complejo se
libera a la zona de contacto cél-cél donde es endocitado por la diana, en > medida por el R de manosa-3-
P (MPR). El pH ácido de estas vacuolas endocíticas induce la activación de las perforinas que ejercen
efectos desestabilizantes sobre la membrana. La granzima B accede al citosol gracias a los poros
formados, activando el sistema de caspasas, verdaderas ejecutoras del programa de apoptosis de la ¢
diana. En el mecanismo de citotoxicidad no secretorio participan miembros de la flia del TNF-α, como el
FasL y el TRAIL. La interacción de FasL (NK activadas) y Fas (CD95, expresada constitutivamente en
linfocitos), induce la apoptosis de la diana: 1) trimerización del Fas sobre la membrana de la diana; 2)
reclutamiento de π adaptadoras al dominio de muerte de Fas, 3) activación de caspasa 8 (vía extrínseca),
4) apoptosis de la diana. Las CD activan a las NK en reposo y promueven su proliferación, la producción
de citocinas (IFNγ) y su actividad citotóxica; estimulación mediada por IL-12 y 15. Al activarse las NK
adquieren la capacidad de modular la funcionalidad y supervivencia de las CD inmaduras. Para ello, las
reconocen y destruyen, y promueven la maduración de CD mediante la producción de IFN-γ y TNF-α.
R de las ¢ NK: pueden ser tanto inhibitorios como estimulatorios. Un patógeno podrá transformar una ¢
del huésped en un blanco de las NK, estimulando la expresión en la diana de ligandos para los R
activadores de NK, o inhibiendo la expresión en la diana de ligandos para los R inhibitorios de las NK. Los
ligandos de R inhibitorios mejor conocidos son las CMH I. Su reconocimiento evitará que las ¢ NK
destruyan ¢ normales. ¢ infectadas o neoplásicas, que suelen expresar niveles < de CMH I
desencadenarán una señalización de < intensidad, lo que permite que prevalezcan las señales de
activación desencadenadas por los R (hipótesis de pérdida de lo propio). Hay 2 flias de R involucrados en
el reconocimiento de CMH I: el complejo de R leucocitarios (LRC), y el complejo de R de NK (NKC).
R KIR: en un mismo individuo, diferentes ¢ NK pueden expresar distintas combinaciones de KIR.
Los genes KIR se expresan como R de simple cadena, presentan 2 o 3 dominios extracelulares tipo Ig, un
segmento transmembrana y una cola citoplasmática. Se expresan también en LT, asignándoles un posible
papel modulatorio de la funcionalidad T. Diferentes individuos poseen un número variable de genes KIR, lo
que constituye una forma de polimorfismo genético. La mayoría de los ligandos se componen de
productos codificados por genes de clase I del CMH.
R LIR: expresados también en monocitos, LB, LT y CD. Reconocen CMH I y median una acción
inhibitoria a través de motivos ITIM presentes en sus dominios citoplasmáticos.
R NKp: R de citotoxicidad natural (NKR). Se expresan exclusivamente en ¢ NK y son estimulantes
de la citotoxicidad.
R de la flia de las lectinas-C: NKG2 y CD94. Se expresan en ¢ NK y en ciertas ¢ T. La subunidad
CD94 es invariable y carece de dominio citoplasmático; la responsable de la transducción es la molécula
NKG2. Los heterodímeros CD94/NKG2A, CD94/C y CD94/E reconocen como ligando a la CMH I. NKG2D
reconoce MICA y MICB (CMH) y π ancladas a restos de glucofosfatidilinositol (ULBP-1, 2, 3).
Señales inhibidoras y activadoras: todos los genes de los R de NK que median funciones inhibitorias
poseen un exón que codifica largas colas citoplasmáticas. Las π codificadas contienen 2 dominios ITIM
responsables de la función inhibitoria. Los R de NK que median funciones de activación, poseen colas
citoplasmáticas cortas, porque tienen un exón que presenta un cambio nucleotídico, que resulta en un
codón stop y la ausencia de motivos ITIM. Las π adaptadoras se caracterizan por poseer en su cola
citoplasmática uno o más dominios activadores ITAM.
NK en el embarazo: representan en los 1º estadios del embarazo, la ppal población de ¢ mononucleares
de la decidua materna. El feto en desarrollo presenta todos los genes CMH paternos, sin embargo la
madre no suele generar una respuesta de rechazo contra él. El contacto entre las ¢ inmunes maternas y
el feto se produce por la sangre materna en contacto con el sincitiotrofoblasto (desprovisto de Ags CMH),
y por la decidua, en contacto con el trofoblasto extravelloso. Cuando se produce el embarazo, la
activación de R inhibitorios en las NK protege al trofoblasto de su potencialidad citotóxica, porque se unen
a sus ligandos específicos (HLA C, G y E). Hacia la semana 20 se completa la invasión del trofoblasto, esto
coincide con la declinación del número de NK en la decidua. Se propuso que la función de las NK se
relaciona con el reconocimiento de las ¢ del trofoblasto y la regulación de su capacidad invasiva. Las NK
median abortos espontáneos recurrentes. La lisis del trofoblasto inducida por éstas y la consiguiente falla
del embarazo parecerían depender de la habilidad de los R NK de reconocer a las CMH I paternas a través
de R de activación.
Capítulo IV: Estructura y función del CMH
El sistema inmune desarrolló mecanismos de detección de fragmentos derivados de los microorganismos.
Estos son péptidos provenientes de la degradación de diferentes π, generados en compartimientos
intracelulares, capturados por moléculas especializadas y presentados al sistema inmune. La presentación
de péptidos microbianos dispara la activación de la respuesta adaptativa y el desarrollo de funciones
efectoras que permitirán la eliminación de los microorganismos y la generación de la memoria
inmunitaria. Entre las π de membrana se destaca un conjunto de glucoπ codificado por un grupo (cluster)
de genes denominado Complejo Mayor de Histocompatibilidad (CMH). Se probó que cepas de ratones se
caracterizaban por aceptar injertos de piel en forma indefinida si provenía de animales de la misma cepa
(injertos o transplantes singénicos) pero no si provenía de una cepa diferente (alogénicos). Este rechazo
se debía a diferencias en una región del genoma (CMH). Los LT requieren para su activación el
reconocimiento simultáneo de fragmentos del Ag (péptidos) junto a moléculas del CMH en la superficie ¢.
La especificidad de un determinado TCR no está dada sólo por el péptido presentado sino también por la
molécula I o II que lo presenta. En el ser humano, el CMH recibe el nombre de “Sistema HLA”, y se ubica
en el brazo corto del cromosoma 6, donde se ubican unos 200 genes. Existen 3 clases de genes del CMH
(I, II y III). Las CMH I y II poseen algunas diferencias < entre sí pero conservan una estructura común de
plegamiento tridimensional. Los 2 dominios más alejados de la membrana se pliegan de tal manera que
crean un surco alargado dentro del cual se aloja un único péptido. Este complejo formado por el péptido y
la molécula del CMH (CMHp) es lo que será reconocido por el TCR. En cuanto a las diferencias, mientras
las de clase I unen péptidos derivados de π s! en el citosol (de la ¢ o de patógenos que se dividen en el
citoplasma), las de clase II unen péptidos derivados de π endocitadas (de la ¢ o de patógenos
extracelulares o que se dividen en vesículas intracelulares). Los complejos CMHp formados por
moléculas I serán reconocidos por TCR de LT citotóxicos (CD8+), mientras que los formados
por moléculas II, serán reconocidos por TCR de LT helpers (CD4+). Para discriminar entre esos
complejos, el TCR requiere la ayuda de coR. Los LT citotóxicos expresan el coR CD8 que reconoce el
complejo CMHp cuando la molécula del CMH es de clase I; en cambio los LT helpers expresan el coR CD4,
que lo reconoce cuando la molécula es II. Existe otro grupo de moléculas diferentes a las moléculas
clásicas de I (Ia); son las moléculas no clásicas o Ib. Las Ia y algunas Ib poseen otra función biológica
relacionada con la protección de las ¢ normales de la citotoxicidad mediada por las ¢ NK. El poligenismo
se refiere a que existen varios genes y moléculas I y II dentro del CMH.cada uno de estos genes es a su
vez polimórfico, es decir que la secuencia de los genes (y de las π) difiere entre los individuos de la
población. Este polimorfismo es la causa de la “histocompatibilidad”. Por otra parte, como individuos
diploides que somos, tenemos un juego de cromosomas maternos y un juego paterno. Paracada uno de
los genes del CMH se expresan tanto el gen materno como el paterno; esta expresión simultánea se
denomina codominancia. Disponer de varios genes, encada individuo de la población, que codifican
moléculas del CMH con capacidad de unir diferentes péptidos, constituye un mecanismo de reaseguro de
que al menos algún péptido derivado de un patógeno será presentado eficientemente por una molécula
del CMH de ese individuo. Aunque existiera un patógeno cuyos péptidos no se unan a las CMH, el
polimorfismo asegura que en otros individuos eso no ocurrirá, porque el conjunto de moléculas que éstos
expresan difiere de las del individuo incapaz de presentar los péptidos del patógeno hipotético.
Moléculas de clase I: son glucoπ de membrana constituidas por 2 cadenas polipeptídicas que se asocian
en forma no covalente. La cadena α se asocia con una β2-microglobulina, está glucosilada y atraviesa la
membrana como una π integral; tiene 3 dominios proteicos globulares: α1, α2 y α3; uno transmembrana
y un C-terminal citoplasmático. La porción más variable del TCR hace contacto con la porción central del
péptido que es la que más sobresale de la molécula. Existen 3 genes de clase I: HLA-A, HLA-B y HLA-C;
se expresan simultáneamente y en forma codominante en la superficie de todas las ¢ nucleadas (excepto
neuronas, GR y sincitiotrofoblasto). Aunque las cadenas α son diferentes, las 3 comparten la misma β2-
microglobulina. Su enorme polimorfismo poblacional determina que la mayoría de los individuos sean
heterocigotos y exhiban en la superficie ¢ 6 productos de clase I diferentes: 2 HLA-A, 2 HLA-B y 2 HLA-C.
La especificidad de la unión del péptido lineal (8-10 aa) a una determinada CMH I está determinada por
las cadenas laterales de los residuos de anclaje del péptido, que interaccionan con los bolsillos B y F de la
CMH I ubicados en la hendidura. Estos bolsillos son 6 en total (A a F). Las consecuencias de este hecho
son que diferentes CMH I (producto de diferentes alelos) tendrán distintas secuencias de aa que tapicen
los bolsillos de unión al péptido. Un alelo HLA dado tendrá la capacidad de unir múltiples péptidos, pero
sólo uno por vez. La bios! de las CMH I ocurre en el REG. El plegamiento correcto requiere también la
unión de un péptido en el surco respectivo. El origen de los péptidos que se incorporan puede ser: a)
degradación de π endógenas; b) de π extrañas o ajenas a la ¢; c) péptidos señal, propios de toda π cuyo
destino sea la secreción o la membrana.
Moléculas de clase II: son glucoπ compuestas de 2 cadenas polipeptídicas α y β unidas en forma no
covalente.cada cadena posee 2 dominios globulares externos (α1, α2, β1 y β2), uno transmembrana y
una cola citoplasmática. Hay 3 grupos de genes que codifican sendas moléculas de clase II: HLA-DR, HLA-
DQ y HLA-DP. Comocada CMH II es en realidad un heterodímero αβ,cada grupo de genes contiene al
menos 1 gen que codifica la cadena α y 1 que codifica la β. Las CMH II se expresan constitutivamente en:
LB, monocitos, CD, de Kupffer, de Langerhans, precursores eritroides, epitelio tímico, LT activados. Su
expresión puede ser inducida en LT, NK, endotelio vascular, queratinocitos, melanocitos, astrocitos y
fibroblastos por IFNγ. Como ocurre para las CMH I, las 3 CMH II cumplen la función de presentación de
péptidos. La mayoría de los individuos exhibe al menos 6 productos de clase II distintos. Las cadenas α
maternas además de asociarse con las β maternas, se asocian con las β paternas y viceversa (fenómeno
de transasociación). Las regiones más polimórficas son los dominios más distales a la membrana. La bios!
y el ensamblado de las cadenas α y β ocurre en el REG. El heterodímero αβ se asocia con la “cadena
invariante” codificada fuera del sistema HLA (cromosoma 5). Las CMH II recién s! van a los endosomas,
donde el pH ácido y ciertas proteasas degradan la cadena invariante. Simultáneamente se produce la
unión de los péptidos y el CMHp migra a la superficie ¢. El origen de los péptidos puede ser: a)
degradación de π normales de la membrana o secretorias, lo que permite que sean endocitadas y sus
péptidos liberados en compartimientos ¢ en los que se produce la carga de las CMH II; b) derivados de π
extrañas provenientes de microorganismos que se alojan en compartimientos endosómicos o
microorganismos directamente fagocitados por la ¢; c) un péptido derivado de la cadena invariante
denominado CLIP, constituye una fracción < del pool de péptidos presentados por las CMH II.
Los ligandos peptídicos alterados (LPA) consisten en péptidos sintéticos casi idénticos a los presentados
naturalmente por las CMH I o II, pero que poseen reemplazados los residuos que contactan con el TCR,
mientras conservan los que les permiten unirse a CMH I o II. Mientras que algunos LPA inducen secreción
de citocinas sin estimular la división ¢, otros inducen en el LT un estado de profunda anergia (falta de
respuesta). Estas respuestas disociadas del TCR según los ligandos reconocidos se relacionan con la
inducción de una fosforilación parcial de kinasas intracelulares que transducen señales hacia el núcleo. La
importancia de estos LPA es que pueden utilizarse en ciertas enfermedades autoinmunes, con el objeto de
modular la activación de los LT autorreactivos.
*Cultivo mixto linfocitario (CML). Si se mezclan ¢ mononucleares de sangre periférica de 2 individuos
histoincompatibles, a lo largo del cultivo, los LT responden con una intensa proliferación y liberación de
citocinas. Esta respuesta alcanza un máximo a los 5/7 días del cultivo y se debe ppalmente a los LT CD4
que reconocen CMH II extrañas, presentes sobre la superficie de ¢ que estimulan (LB, monocitos, CD).
Asimismo, los LT CD8 también se activan por reconocimiento de CMH I extrañas (alogénicas) sobre la
superficie de todas las ¢ estimuladoras. En esta modalidad, ambas poblaciones de linfocitos (de ambos
individuos) responden, por lo que se la denomina “CML bidireccional”. Se utilizó durante mucho tiempo
para analizar la identidad entre un donante y un receptor antes del transplante de órganos.
Organización genética del sistema HLA: se define como “haplotipo HLA” al conjunto de genes de origen
materno o paterno presentes en la región del cromosoma 6.
Loci de clase I: la cadena pesada (α) de HLA-A, B y C está codificada por genes del HLA; en cambio
la β2-mg está codificada por un gen del cromosoma 15. Los genes de clase I constituyen una flia que
posee una secuencia nucleotídica con alta homología: HLA-E, H, G, F, CD1, MICA y MICB. MICA tiene un
patrón de expresión restringido a ¢ de linaje epitelial, fibroblastos, queratinocitos y ¢ endoteliales. Se
induce por estrés, infección con microorganismos intracelulares (virus y bacterias) o por
neotransformación; podría ser una molécula diana durante una reacción de rechazo. Ambos son ligandos
de un R activador de citotoxicidad NK (NKG2D). FcRn: responsable de captar, en la luz intestinal del recién
nacido, las IgG que provienen de la leche materna y transportarla hacia el torrente sanguíneo.
Loci de clase II: genes para HLA-DR, DQ y DP.
Loci de clase III: codifica para moléculas que no cumplen con la función de presentación
antigénica. Se hallan los genes para: TNF-α y β, hsp70; C2, factor B y C4 (complemento), 21-OHasa.
Regulación de la expresión de los genes:
Clase I: se expresan constitutivamente en todos los tejidos. Niveles altos en ¢ linfoides; puede
incrementarse su expresión por IFN I o γ bloqueando la producción de un represor. Regulados por las
regiones promotoras (enhancers A y B, e IRE).
Clase II: se expresan en un número restringido de tejidos y puede inducirse por diversas citocinas,
ppalmente IFNγ. Se encuentran regulados por: regiones promotoras, π reguladoras y factores que no
unen ADN (CIITA).
Las funciones de las CMH I son: presentar péptidos de origen endógeno a LT CD8+ y actuar
como ligandos de R (-) de ¢ NK. La función de las CMH II es presentar péptidos de origen
exógeno o de π de membrana a LT CD4+. El reconocimiento de CMH I y II por el TCR y el coR
respectivo (CD4 o CD8) estabiliza la interacción cél-cél. La microagregación de éstos inducida por la
interacción con el CMHp dispara cascadas de transducción de señales al interior del LT y conduce a la
activación linfocitaria. El sistema de reconocimiento de péptidos presentados por CMH II que se expresan
sólo en ¢ del sistema inmune garantiza que los LT CD4+ monten una respuesta activando macrófagos e
induciendo la producción de Acs por parte de LB sin afectar otros tejidos. En condiciones de expresión
normal de CMH I, la actividad citotóxica de las ¢ NK se mantiene inhibida gracias a su R inhibidor de
citotoxicidad. Sin duda, el polimorfismo del CMH evolucionó con el objeto de contrarrestar la evolución de
los microorganismos, mutando los genes para generar una alta variabilidad en el sitio de unión al péptido,
de manera de anular la posibilidad de los microorganismos de generar variantes cuyos péptidos no sean
presentados por las moléculas del CMH. La diversidad en las CMH I y II trae como consecuencia que la
respuesta inmune mediada por LT sea más amplia. Será entonces ventajoso tener 2 alelos en lugar de 1
paracada locus del CMH (ventaja heterocigota).
HLA y enfermedad: determinados Ags o alelos del HLA podrían conferir susceptibilidad a enfermedades
autoinmunes. El riesgo relativo (RR) indica cuántas veces más riesgo de padecer la enfermedad poseen
los portadores del alelo respecto de los que no lo portan en un determinado grupo étnico. La utilidad de la
tipificación de alelos del HLA es relativa porque muchas de las enfermedades asociadas con el HLA son
multifactoriales. El efecto de los alelos HLA es de baja penetrancia. Para la mayoría de las asociaciones,
los mecanismos postulados son: a) la enfermedad se debe a genes ligados dentro del complejo HLA
(cercanos a un alelo del HLA que confiere susceptibilidad); b) los alelos del HLA desempeñan un papel
importante en la selección tímica, en que sólo determinados alelos permitirán una deleción eficiente de
clones autorreactivos; c) determinados alelos del CMH (que confieren susceptibilidad) codifican moléculas
del CMH capaces de presentar péptidos propios que presentan reacción cruzada con Ags microbianos
(teoría del mimetismo molecular). Ciertos epitopes virales tendrían mimetismo molecular con Ags propios,
lo que podría estimular clones propios autorreactivos y destruir los tejidos del huésped luego de una
infección con el microorganismo en cuestión.
Capítulo V: Reconocimiento antigénico por LT y LB - BCR y TCR.
BCR
Estructura: constituido por una Ig de superficie asociada a un heterodímero Igα-Igβ. Los Acs (Ig)
están constituidos por 4 cadenas peptídicas: 2 pesadas (H) idénticas entre sí, y 2 livianas (L), también
idénticas entre sí. Se unen por puentes diS intercatenarios. Existen 2 tipos de cadenas L: kappa (κ) y
lambda (λ), que difieren en la secuencia aminoacídica carboxiterminal.cada cadena L está formada por 2
dominios: el fragmento N-terminal constituye el dominio variable (VL), y el C-terminal, el dominio
constante (CL), formándose 2 loops o bucles. En las cadenas H se establecen puentes diS intracatenarios,
que conducen a la formación de dominios globulares: variable (VH) y constante (CH). Los dominios N-
terminales (VL y VH) responsables del reconocimiento antigénico, presentan gran variabilidad si se
comparan diferentes Igs. La papaína corta a la IgG en 3 fragmentos, 2 de los cuales denominados Fab,
son idénticos entre sí. En ellos reside la capacidad de reconocimiento antigénico. El 3º fragmento, Fc, es
capaz de unirse a leucocitos. La pepsina escinde el fragmento Fc en piezas < y deja el resto de la
molécula intacta, denominada F(ab’)2, constituida por 2 Fab unidos por puentes diS intercatenarios.
Presenta, por lo tanto, 2 sitios de reconocimiento antigénico. En el dominio VH, se hallan 3 regiones
hipervariables o determinantes de complementariedad (CDR). En la conformación de los Acs, las CDR de
las cadenas H y L se disponen muy próximas entre sí, definiendo así el sitio de reconocimiento antigénico
o “paratope” del Ac. Los H de C que presentan las Ig se localizan fundamentalmente en las cadenas H. El
contenido en H de C varía: 2-4% para IgG, 7-14% para IgA y D, 12% para IgM y E. Los azúcares simples
más frecuentes son: N-acetil-D-glucosamina/galactosamina, ácido N-acetil neuramínico, L-fucosa, D-
galactosa/manosa. Son necesarios a efectos de una óptima interacción de los Acs con los RFc. IgG, E y D
se encuentran como monómeros, IgM como pentámero e IgA como monómero o dímero. Las formas
poliméricas requieren una “cadena J”, s! por el plasmocito. La polimerización de las Ig es importante
en el reconocimiento de epitopes antigénicos expresados en forma repetitiva en la superficie
de los microorganismos. La estructura polimérica le confiere a la IgM una capacidad destacada para
activar la VC del complemento. Los complejos inmunes adquieren la capacidad de activar mecanismos
microbicidas/microbiostáticos mediante la activación del complemento y de respuestas ¢ a través de RFc.
La Ig que forma parte del BCR no lleva a cabo esas funciones, ya que se encuentra anclada en la
membrana, por lo que sólo será capaz de reconocer el Ag específico.
Transducción de la señal: mientras la Ig de superficie es responsable del reconocimiento
antigénico, el heterodímero Igα-Igβ lo es de 2 funciones: el transporte de la Ig a la membrana,
y la transducción de la señal dada por el reconocimiento antigénico al interior del LB. Estas
señales pueden modularse por moléculas asociadas por el BCR. La coagregación del BCR con las
moléculas coR CD19/CD21/CD81, facilita la activación del LB. Su coagregación con el RFcγIIB o el CD22
inhibe las señales (ITIM). El entrecruzamiento del BCR lleva a la activación de los FT NFκB, NFAT y AP1,
capaces de regular la transcripción de diversos genes. El complejo CD19/CD21/CD81 permite la activación
del LB por << [Ag], cuando éste se encuentra opsonizado por complemento. Cuando la opsonización es
por IgG, el reconocimiento del Ag favorece la coagregación del BCR con el RFcγIIB.
TCR
Estructura: compuesto de 2 cadenas que forman un heterodímero anclado a la membrana. Existen
2 formas posibles: una integrada por las cadenas α y β (más abundante en sangre periférica), y otra
integrada por las cadenas γ y δ (piel y mucosas). Todas estas cadenas pertenecen a la superflia de las Ig.
En el extremo N-terminal se hallan los dominios variables Vα y Vβ. La yuxtaposición espacial de éstos
determina el sitio de reconocimiento antigénico del TCR. Los dominios más próximos a la membrana se
conservan (dominios constantes, Cα y Cβ). Un < segmento, similar a la región bisagra de los Acs,
representa el fragmento transmembrana del heterodímero. En éste, las cadenas α y β están unidas
covalentemente por un par de cisteínas. En los dominios Vα y Vβ se distinguen 3 regiones de alta
variabilidad o determinantes de complementariedad: CDR1, 2 y 3.
Transducción de la señal: se lleva a cabo por una molécula asociada con la unidad de
reconocimiento antigénico, en este caso, el complejo CD3, quien tiene además una 2º función, la de
mediar el ensamblado, transporte y estabilización del TCR en la membrana del LT. La asociación TCR-CD3
con las moléculas coR favorece la activación ¢. Los coR son CD4 y CD8, que reconocen porciones
conservadas de CMH II y I respectivamente. Una vez que los LT reconocen al Ag mediante su TCR, los que
puedan activarse y proliferar se diferenciarán a LT efectores, los cuales a diferencia de los LB, NO secretan
el R antigénico. El complejo CD3 está formado por las cadenas γ, δ, ε, que se asocian con la ζ. La unión
de las moléculas del CD3 ocurre en el REG. Las 2 1º están glucosiladas; las otras no. El entrecruzamiento
del TCR también finaliza en la transcripción de genes.
Reconocimiento del Ag por LB y LT: los H de C, lípidos, π y ácidos nucleicos pueden actuar como Ags. Sin
embargo, no todos los Ags poseen capacidad similar para inducir la activación linfocitaria. Los epitopes
pueden involucrar una secuencia lineal continua de aa (epitopes lineales o continuos) o involucrar aa
presentes en localizaciones distantes en la secuencia 1º, pero cercanos en la conformación tridimensional
(discontinuos o conformacionales). La inmunogenicidad de un Ag define una medida de su capacidad
para inducir la activación de LT y/o B. Los haptenos representan sustancias de < PM, que pueden
ser reconocidas por el BCR (por lo tanto son Ags), pero que son incapaces de inducir una respuesta
inmunitaria (no son inmunógenos). Pueden adquirir inmunogenicidad al asociarse covalentemente, con
una molécula transportadora o carrier de > PM. Los péptidos antigénicos presentados por las CMH
constituyen epitopes lineales, que pueden no estar expuestos en la π nativa y exponerse como
consecuencia del procesamiento. Las π, sobre todo las de PM > 4 kDa, constituyen los Ags de >
inmunogenicidad. La presencia de aa aromáticos contribuye a la misma. Los polisacáridos de > PM suelen
actuar también como inmunógenos. Los lípidos y ácidos nucleicos son poco inmunogénicos, pero al
asociarse con π o H de C incrementan su inmunogenicidad.
Generación de diversidad: la generación de los R antigénicos se produce antes del ingreso del Ag, durante
la maduración en la MO y el timo.
De las Igs (BCR): el número total de especificidades de Acs presentes en un individuo se conoce como
repertorio de Acs o Igs. La generación de diversidad se produce por rearreglos o reordenamientos
del ADN que codifican los dominios V de las Ig, durante la maduración de los LB. Esta se
incrementa aún más por el proceso de hipermutación somática que sufren luego los LB maduros
activados. Las cadenas H y L de las Ig están codificadas por distintos genes. Las ¢ cuyos genes de Ig NO
sufren este rearreglo (todas, salvo los LB) poseen los genes de Ig en una “configuración germinal”
mientras que los LB maduros poseen los genes de las Ig rearreglados. Este proceso se conoce como
“recombinación somática”.
Rearreglos de la porción variable de VL y VH: el dominio V de la cadena L está codificado por 2
genes diferentes, VL y JL. El dominio V de la cadena H está codificado por 3 genes: VH, DH y JH. El
proceso de recombinación somática sólo ocurre en fragmentos génicos que se encuentran en el mismo
cromosoma y está guiado por secuencias conservadas de ADN no codificante: secuencias señales de
recombinación (SSR). La unión entre los fragmentos recombinados es imprecisa. El complejo enzimático
que actúa para producir la recombinación V(D)J se llama recombinasa V(D)J. Los productos de los genes
RAG-1 y RAG-2 forman parte de esa recombinasa y sólo se expresan en linfocitos en desarrollo. Estas
enzimas poseen actividad endonucleasa y son las responsables del corte de la cadena de ADN. Por el
contrario, el resto de las enzimas que forman la recombinasa, como la ligasa IV o la ADN-PK, presentan
una expresión ubicua y están involucradas en la reparación, modificación y plegado del ADN. Las enzimas
de reparación del ADN incrementan aún más la diversidad, ya que son capaces de agregar o eliminar
nucleótidos al azar. Los nucleótidos adicionados se llaman P y N. Como el número de nucleótidos
adicionados y eliminados es al azar, se generan frecuentemente π no funcionales. En resumen, la
generación de diversidad en el repertorio de Igs se produce por: a) la existencia de distintos segmentos
VH, DH, JH, VL y JL. Mientras que un LB durante su ontogenia utiliza un determinado conjunto de
segmentos génicos para generar sus dominios V, otro utilizará un conjunto diferente y dará lugar a
diferentes dominios VH y VL; b) la asociación de las cadenas H y L -el paratope del Ac involucra a VL y
VH,cada uno de las cuales se rearregla en forma independiente-; c) la unión imprecisa de los segmentos
génicos, que produce diversidad por la adición y sustracción de nucleótidos; d) la hipermutación somática,
que incrementa el repertorio de Ig luego del reconocimiento antigénico.
*Adición de nucleótidos P y N: las enzimas RAG reconocen las SSR, escinden una de las cadenas de ADN y
dejan extremos 3’-OH libres, que reaccionan con los enlaces fosfodiéster de la otra cadena, sellan la doble
cadena y generan horquillas de ADN. Estas son escindidas nuevamente por las RAG y producen <
secuencias palindrómicas (nucleótidos P). Cuando la enzima TdT está presente, se adicionan nucleótidos
sin templado (nucleótidos N) en los extremos de las cadenas. Luego las cadenas se asocian, los
nucleótidos que no logran aparearse se eliminan por exonucleasas y se repara la doble cadena.
Del TCR: el proceso de recombinación somática, que se produce durante el desarrollo de los LT en el
timo, es similar al que se ha visto para LB en la MO, e involucra SSR y las mismas enzimas responsables
del corte, reparación y modificación del ADN. El TCR también posee nucleótidos P y N adicionados, lo que
incrementa la diversidad del R. Éste NO sufre hipermutación somática.
Capítulo VI: Procesamiento y presentación antigénica a los LT
El procesamiento antigénico se refiere a un proceso que: a) se requiere para la activación T, pero no para
la B; b) involucra la acción de proteasas que escinden a la π antigénica en péptidos <; c) requiere que los
péptidos generados se asocien con CMH I o II; d) requiere que los complejos CMHp se expresen en la
superficie ¢; y e) ocurre en las CPA.
CPA ≠ CPA profesionales: la mayoría de las ¢ del organismo cuentan con una maquinaria proteolítica
adecuada para procesar π, y además expresan CMH I. Por lo tanto podrán actuar como CPA y presentar
péptidos antigénicos. Por el contrario, pocos tipos ¢ expresan CMH II. Las CD, LB y macrófagos pueden
presentar péptidos antigénicos a través de ellas. La capacidad de presentar péptidos a través de estas
CMH II las define como “CPA profesionales”. La alta expresión de CMH II y de moléculas coE confiere a
las CD una capacidad única entre las CPA profesionales: la de activar LT CD4+ vírgenes o naive.
CD: cumplen una función crítica en la inducción y regulación de la respuesta adaptativa. Son producidas
en la MO a partir de progenitores mieloides y linfoides, en respuesta a FC y de diferenciación como el GM-
CSF y el ligando de Flt3. Presentan 2 estadios: inmaduro y maduro. Las CD inmaduras tienen 2 funciones:
a) capturar Ags en los tejidos periféricos y procesarlos; b) sensar las propiedades del fenómeno
inflamatorio en el tejido periférico (inmunovigilancia). Esta ilustra una característica esencial de las CD
que es su plasticidad: las mismas CD, enfrentadas a diferentes procesos, podrán madurar hacia perfiles
diferentes, que difieren en el patrón de citocinas y quimiocinas que producirán y en cómo orientarán el
curso de la respuesta inmune adaptativa hacia un perfil Th1, Th2 o, eventualmente, tolerogénico. Las CD
inmaduras se ubican en los tejidos periféricos, sobre todo la piel y las mucosas. La función esencial de las
CD maduras es activar a los LT naive. Las CD inmaduras endocitan el Ag en la periferia y lo
procesan. Al madurar, en respuesta a la percepción de señales de infección en la periferia,
presentarán los péptidos resultantes del procesamiento antigénico sobre CMH I y II, y
activarán a los LT naive. En respuesta al desarrollo de procesos inflamatorios locales y al > de la
expresión de moléculas de adhesión y a la producción de quimiocinas, los precursores de las CD y las
propias CD circulantes son reclutadas rápidamente en el foco inflamatorio. Las CD inmaduras son capaces
de capturar y procesar Ags con eficacia, pero son malas activadoras de LT naive. La baja expresión de
CMH II se debe a que están secuestradas en los endosomas. Un tipo de CD inmadura es la ¢ de
Langerhans. Las CD inmaduras expresan una extraordinaria actividad endocítica:
Endocitosis de Ags a través de R: las CD inmaduras expresan una amplia variedad de R que
participan en la internalización de Ags: RFc, SR, CR3 y 4, RLC. La internalización mediante RLC conduce a
la presentación de Ags no sólo a través de CMH II sino también de clase I (presentación cruzada).
También expresan el R para α2-microglobulina (CD91), capaz de reconocer e internalizar péptidos
marcados con hsp70 y/o hsp96, provenientes de ¢ necróticas o apoptóticas.
Macropinocitosis: no involucra R y permite la internalización de Ags extracelulares y del MEC, a
través de la proyección de seudópodos y la formación de > vesículas endocíticas. Mientras que en
macrófagos y ¢ epiteliales la actividad macropinocítica debe ser inducida, en las CD se expresa en forma
constitutiva.
El proceso de maduración de CD se caracteriza porque: a) incrementan la expresión del R CCR7 y se
dirigen a los OLS; b) disminuye su capacidad endocítica; c) incrementan la expresión de CD40, 80 y 86;
d) incrementan la expresión de CMH II-péptido. La “migración basal” (en ausencia de estímulos
inflamatorios) estaría involucrada en la inducción de tolerancia periférica a Ags propios. La migración
inducida por estímulos inflamatorios permite el reclutamiento de un gran número de CD maduras en los
GL. Los ligandos de CCR7, CCL19 y 21, se expresan en las ¢ endoteliales linfáticas y en las HEV de las
zonas T de los OLS, donde irán las CD que han iniciado la maduración. La transición de CD inmadura a CD
madura puede inducirse por el reconocimiento de PMAP por TLR. También en respuesta a citocinas y otros
mediadores inflamatorios, como TNF-α, IL-1α y 1β, IFN I, NO y PGE2, o por señales mediadas por
contacto con otras ¢ de la inmunidad innata, como NK, NKT y LTγδ. Las propias T CD4+ y CD8+ pueden
inducir la maduración de las CD mediante: a) interacción de CD40 (CD), con CD40L (LT CD4+ activados);
b) interacciones entre Fas (CD) y FasL (T CD4+ activado); c) acción mediada por el TNF-α y el IFN-γ (LT
CD8+ activados). La extraordinaria capacidad de las CD maduras de actuar como CPA estaría dada por: la
> carga antigénica que incorporaron como CD inmaduras, sus propiedades migratorias, la > expresión de
complejos CMH II-péptido, la estabilidad de éstos en la superficie ¢, la > expresión de moléculas coE, las
citocinas que producen.
CD plasmocitoides: cuando hablamos de CD nos referimos a las CD mieloides identificadas por poseer
CD11c+ y CD123+bajo. La CD plasmocitoides, que difieren notablemente de las mieloides, también
presentan un estadio inmaduro y uno maduro; expresan CD11c - y CD123+alto. Las CDP inmaduras se
ubican en la circulación y en los OLS, y no se detectan en tejidos periféricos; presentan muy escasa
actividad endocítica. La expresión selectiva de TLR9 y TLR7 les permite reconocer con eficacia el ADN y el
ARNsc virales respectivamente, conduciendo a la producción de IFN I. Estos se encuentran como R
intracelular, dado que los virus se comportan como “parásitos” intracelular estrictos. Luego de una
estimulación viral, las CDP expresan una extraordinaria capacidad para secretar cantidades masivas de
IFN I, por lo que representan la fuente ppal de IFN α, β y ω (tipo I) durante la infección viral aguda. Al
activarse, producen cantidades moderadas de TNF-α e IL-6, pero no producen IL-1, 3, 10, 12, 15, 18,
IFNγ ni GM-CSF, citocinas que sí son producidas por las CDM. FlT3 ligando constituye el ppal FC y
diferenciación de las CDP. Después de abandonar la MO, pasan a la circulación para migrar a través de las
HEV a las áreas T de los OLS, al tejido linfoide asociado con las mucosas y a la ZM del bazo. Este circuito
difiere del de las CDM, que ingresan en los OLS por los vasos linfáticos aferentes. Las propiedades
migratorias de las CDP dependen de la expresión de L-selectina y del CCR7. Interactúan así con los
ligandos de L-selectina, expresados sobre las HEV y con las quimiocinas CCL19 y 21, de las HEV y las ¢
estromales de las áreas T. Luego de activarse y producir cantidades masivas de IFN I, tanto en la
circulación como en el OLS, maduran y se reduce su capacidad de secretar IFN. Activan a las NK, inducen
la maduración de CDM y estimulan la funcionalidad de las ¢ B. Podrían madurar por 2 vías: a) mediada
por IFN I y TNF-α, producidos por ellas mismas, han mostrado favorecer la producción de IFNγ e IL-10 en
LT CD4+ y promover su diferenciación en Th1; b) dependiente de la presencia de IL-3, producida por
eosinófilos, basófilos y mastocitos, en respuesta a estímulos como los aportados por una infección
parasitaria. Favorece la producción de IL-4, 5, y 10 en LT CD4+ y promueve su diferenciación a Th2.
Vías de presentación antigénica: son 2, exógena (endocítica) y endógena (biosintética). La endógena
ocurre en el citosol y es mediada por una enzima multicatalítica, el proteosoma, responsable de la
degradación de π presentes en el citosol. Genera péptidos para ser presentados por CMH I a LT CD8+
citotóxicos. La exógena ocurre en los endosomas y es mediada por proteasas que degradan a las π de
este compartimiento. Genera péptidos para ser presentados por CMH II a LT CD4+.
Vía endógena o biosintética: todas las π se s! en el citosol. Las destinadas a la membrana se
translocan al REG. Aquí, deben plegarse antes de ser llevadas a la superficie. Los péptidos presentados
por CMH I provienen de la degradación de π presentes en el citosol. Deben incluirse tanto las provenientes
de patógenos que se replican en el citosol, como las propias de éste. Las ¢ tumorales expresan genes
mutados u oncogenes cuyos productos proteicos también serán procesados por esta vía, y por lo tanto
podrán ser presentados por CMH I. La degradación de π en el citosol la lleva a cabo el proteosoma o
proteasa multicatalítica. Antes de su catabolismo, deben ser modificadas mediante la unión de una o más
copias del polipéptido ubicuitina. Estas π modificadas son reconocidas por el proteosoma, lo que facilita su
degradación. Los péptidos generados en el citosol se translocan al REG. Participan los transportadores
dependientes de ATP, denominados TAP. Se trata de un heterodímero TAP1/TAP2 presente en la
membrana del REG. La ausencia de las TAP se acompaña por la falta de expresión de CMH I. Las CMH I
que fueron s! y translocadas se encuentran en la luz del REG en un estado parcialmente plegado. Se
requiere la unión a un péptido a fin de estabilizarlas y permitir su transporte a la membrana. Los péptidos
translocados dentro del REG se unirán a las CMH I adheridas al TAP. Cuando la cadena α de la CMH I se s!,
se une temporalmente a una chaperona denominada calnexina, que la mantiene parcialmente plegada. Al
unirse con la β2-mg, se forma el heterodímero α:β2 que se disocia de la calnexina y se asocia con un
complejo de π (calreticulina, tapasina, etc.). Se libera y, convenientemente plegada, deja el REG para ser
transportada hacia la membrana. Una vez ensamblada la CMH I junto al péptido, el trímero migra a través
del Golgi a la superficie. La migración es inhibida por la brefeldina A, que no bloquea la vía exógena y
resulta útil en estudios dirigidos a identificar qué vía utiliza un Ag particular. Los péptidos transportados
por TAP, que no se unen a CMH I, vuelven al citosol por transporte dependiente de ATP, pero
independiente de TAP. Las CMH II están en el REG asociadas con la “cadena invariante”, que bloquea el
sitio de unión al péptido. La presentación antigénica a través de la vía biosintética requiere la expresión
coordinada de un grupo de genes que codifican la cadena pesada de las CMH I, las π LMP-2 y 7
involucradas en la degradación proteasómica, y los genes TAP-1 y 2. Ambos son inducibles por IFNγ.
Ciertos virus han desarrollado mecanismos que les permite inhibir la vía endógena (CMV, HIV, herpes
virus, adenovirus).
Vía exógena o endocítica: macromoléculas como nutrientes, FC o Ags extraños son endocitadas a
través de mecanismos dependientes e independientes de R. Las vesículas endocíticas iniciales se fusionan,
acidifican su contenido y modifican su composición enzimática. Dentro de los endosomas y lisosomas, las
π extrañas deben degradarse a péptidos < para poder unirse a las CMH II; esto gracias a proteasas que
se activan a medida que el pH <, e incluyen a las catepsinas B, D y L. Es utilizada para presentar Ags
provenientes de microorganismos extracelulares y para algunos virus envueltos, que ingresan en el
citoplasma luego de transitar por el endosoma. Muchas π de membrana, propias o codificadas por
patógenos intracelulares, también usarán esta vía. Un complejo sistema de endosomas media el
transporte de las CMH II y permite la unión de los péptidos antigénicos a ellas. Los endosomas están
formados por vacuolas y túbulos, y sirven como estaciones intermedias para recuperar y reciclar a los R
de membrana, a través de los “endosomas tempranos”. Poseen un pH moderadamente ácido, que
favorece la separación de los R de sus ligandos. Ya disociados, son colectados en > vacuolas. Los R son
segregados hacia túbulos laterales que permiten su reciclado hacia la membrana. Las vacuolas se disocian
de los túbulos y se desplazan al centro de la ¢. La activación ¢ estimula la formación de los complejos
CMH II-péptido. Estos cambios generan los cuerpos multivesiculares y multilaminares, que constituyen los
“endosomas tardíos”, responsables de acumular la carga endosomal para el transporte al lisosoma. Los
lisosomas representan el destino final para el material internalizado por endocitosis.
*Bios! de CMH II: se produce en el citosol y luego se las transloca al REG. En la luz, se encuentran los
polipéptidos que la ¢ s! y fueron translocados allí, también los péptidos antigénicos generados en el citosol
y transportados por TAP. La cadena invariante se une al heterodímero αβ de clase II y forma trímeros
impidiendo la unión de los péptidos. Durante el ensamblado de este trímero en el REG, sus componentes
están asociados con la calnexina. Una vez formado, el nonámero se separa de la calnexina y es
transportado del REG al compartimiento endocítico. Una 2º función de la cadena invariante es la de dirigir
el transporte adecuado de las CMH II hasta el compartimiento endosómico. El complejo permanece 2-4 hs
allí. Las proteasas de los endosomas desmantelan los nonámeros en 3 dímeros αβ y generan el péptido
derivado de la cadena invariante (degradada por catepsinas): CLIP. Este permanece unido a las CMH II
hasta la interacción con otra CMH II codificada por HLA-DM (pH endosómico <) que conduce a la
disociación de CLIP. Luego de su unión al péptido, la CMH II puede ser transportada hasta la membrana.
Se han definido 2 compartimientos: CIIV, formado por las vesículas encargadas del transporte de las CMH
II desde el compartimiento endocítico tardío hasta la membrana; y MIIC, asociado con las etapas tardías
de la vía endocítica y con los endosomas tardíos, donde se produciría el desplazamiento de CLIP y su
reemplazo por el péptido.
Interacción de ambas vías: el fenómeno de “presentación cruzada” puede involucrar 2
mecanismos: a) la π internalizada accede al citosol, donde es procesada por el proteosoma y translocada
al REG por un mecanismo dependiente de TAP; b) las π antigénicas internalizadas por la vía endocítica son
degradadas por proteasas lisosómicas y los péptidos resultantes se unen a CMH I que reciclan desde la
membrana por la vía endocítica.
Tercera vía: es mediada por moléculas CD1. Su función es presentar glucolípidos derivados de
micobacterias y péptidos hidrófobos, actividad que no media ninguna otra CMH. Estos compuestos son
reconocidos por LT (TCR αβ y γδ) y NKT. CD1b presenta Ags lipídicos de micobacterias, como ácido
micólico, lipoarabidomananos y glucosa monomicolato. CD1c es capaz de presentar lipoarabidomananos;
CD1d es reconocido por linfocitos intraepiteliales del intestino. Una vez ensambladas en el REG, CD1b y
CD1d son transportadas hacia la membrana. Ya allí, CD1b es internalizada a través de vesículas de
clatrina. CD1 posee en su cola citoplasmática la secuencia tirosina-X-X-residuo hidrófobo, que le permite
interactuar con π adaptadoras y llegar a través del endosoma temprano a los lisosomas donde se carga el
Ag lipídico. Luego, CD1b es transportado a la membrana donde podrá presentarlo. CD1c posee también
una cola citoplasmática similar a CD1b, sin embargo, una vez internalizada queda retenida en los
endosomas tempranos y sólo una < fracción alcanza los lisosomas. CD1d tiene un comportamiento similar
a CD1c. CD1a carece de la tirosina en su cola, por lo que su tráfico se restringe a los endosomas que
reciclan desde la membrana.
Capítulo VII: Ontogenia - Generación del repertorio B y T
Los LB y T se originan en la MO a partir de un precursor común, denominado stem cell o ¢ madre
pluripotente hematopoyética (CMPH); éstas tienen la capacidad de autorrenovarse y de generar distintos
tipos ¢. Aparecen en el saco vitelino alrededor de la 3º semana. A medida que el feto se desarrolla,
migran al hígado. Recién al 4º mes de vida fetal la MO representa el sitio donde mayoritariamente ocurre
la hematopoyesis. En los adultos, la mayoría de las CMPH se encuentran en la MO. Sin embargo, tienen la
capacidad de migrar hacia la circulación en < cantidades. A partir de ellas se generan los progenitores
mieloide común (dará lugar a las ¢ de estirpe mieloide), y linfoide (dará lugar a los LB y T). La
señalización a través de un R presente en la membrana de los fosfolípidos, denominado Notch1, induciría
la diferenciación hacia el linaje T, mientras que su ausencia o inhibición favorecería la diferenciación B.
Notch2 sería indispensable para la generación de los BZM. Durante la maduración de los LB y T en MO y
timo, se produce el rearreglo de los genes que codifican los R antigénicos. Si no se completa de manera
exitosa, el linfocito muere por apoptosis. Los linfocitos que logren generar un R antigénico y expresarlo en
la membrana pueden avanzar a la siguiente etapa. El R se evalúa en función de su capacidad de reconocer
Ags propios presentes en el OLP (inducción de tolerancia central). La especificidad y la avidez del R por
esos Ags determinan el camino que seguirá el linfocito: sobrevivir y continuar madurando, o morir por
apoptosis.
Ontogenia B: el desarrollo de las ¢ B depende de la presencia de ¢ estromales en la MO, ya que no sólo
actúan como sostén, sino que s! FC que estimulan su diferenciación y proliferación, como IL-7, SCF y
SDF-1. Los distintos estadios del desarrollo se distinguen por la expresión de las cadenas pesadas (H) y
livianas (L) de las Ig, y por la expresión de determinadas π en su superficie. En el 1º estadio conocido
como pro-B, los linfocitos poseen una capacidad limitada de autorrenovarse. Se produce el rearreglo del
gen que codifica la cadena H de las Ig: 1) se asocian los fragmentos DH-JH (pro-B temprano) en ambos
cromosomas; 2) se produce la unión de un fragmento VH al DH-JH previamente rearreglado. Esta unión
se intenta en un cromosoma y si no es exitosa, se intenta en el 2º (exclusión alélica). La ausencia de
rearreglos exitosos de la cadena H conduce a la apoptosis del LB. En el estadio pre-B se genera el pre-
BCR. Requiere el ensamblado de la cadena H reordenada con una L sustituta. Una vez en la membrana,
ambas cadenas se asocian con el heterodímero IgαIgβ para formar el pre-BCR. Este transduce señales de
supervivencia. Los linfocitos pre-B inician una etapa de proliferación hasta que comienza el
reordenamiento de los genes que codifican la cadena L. Vuelven a expresarse los genes RAG-1 y RAG-2.
Los rearreglos de la porción variable de la cadena L también están gobernados por la exclusión alélica e
involucran la asociación de fragmentos VL y JL. La recombinasa 1º intentará un rearreglo productivo de la
cadena Lκ en un cromosoma y en caso de no lograrlo, intentará en el alelo del otro. Si no son exitosos,
comenzarán los rearreglos de la cadena Lλ. Luego, la cadena L s! se combina con la cadena Hμ. Se
produce así la IgM que, expresada en la membrana junto con el heterodímero IgαIgβ, constituye el BCR
característico del estadio B inmaduro. Una vez que alcanza este estadio, las ¢ se evalúan en función de
su capacidad de reconocer Ags propios presentes en el ambiente de la MO:
Inducción de tolerancia central B: los LB inmaduros que NO reciben señales a través de su BCR
salen de la MO para continuar su maduración. Se induce la disminución en la expresión de las π RAG y el
cese de los reordenamientos. Los LB inmaduros que perciben una señal intensa a través del BCR producen
un entrelazamiento extensivo de éste y mueren por apoptosis en la MO. Los que en la MO entrecrucen
levemente su BCR, por ejemplo, luego de reconocer moléculas solubles, se inactivan y entran en un
estado irreversible de no respuesta (anergia). Estos linfocitos autorreactivos, si bien emigran de la MO, no
son capaces de activarse y mueren pronto. Sólo un < % logra salir hacia el bazo y se denominan LB
transicionales (BTr 1 y 2). Conviven con otras poblaciones de LB ya maduros: B2, B1 y BZM. Los BTr1
provienen de los LB inmaduros y se los puede encontrar en la vaina linfoide periarteriolar (PALP); sufren
un proceso de selección negativa si reciben señales de moléculas propias. Los que sobreviven en el bazo
dan lugar a los BTr2, que se ubican en los folículos esplénicos. Una vez que alcanzan su maduración,
coexpresan BCR de clase IgM e IgD. El factor activador de LB (BAFF) pertenece a la flia del TNF y es
producido en forma constitutiva por monocitos, macrófagos, CD y LT activados. Se une a los LB y es
clave en la inducción de tolerancia y mantenimiento de la homeostasis; parece indispensable para la
transición BTr1 BTr2 LB maduro.
Ontogenia T: el timo está desarrollado por completo al nacer, y la producción de LT alcanza su pico
máximo antes de la pubertad. Luego comienza a involucionar y la producción de LT disminuye. Se postula
que una vez generado el repertorio T, puede mantenerse por proliferación de LT maduros en la periferia.
En los individuos jóvenes el timo contiene un gran número de precursores en una red de ¢ estromales que
genera el microambiente adecuado para la maduración T; numerosos macrófagos y CD importantes en la
selección negativa. Los distintos estadios se distinguen por la expresión de las cadenas del TCR y de π en
su superficie. Los precursores T poseen una capacidad reducida de autorrenovarse. Ingresan desde la
sangre a través del endotelio de vénulas poscapilares. La interacción con las ¢ de la estroma induce su
proliferación. Estos timocitos comienzan a expresar marcadores T, como CD2, pero se denominan doble
negativos (DN) por no expresar CD4 ni CD8. Constituyen el 5% del total de LT del timo. Existen también
en el timo poblaciones de LT maduros que tampoco expresan estos coR: LT que expresan TCRγδ y ¢ NKT.
DN transita por 4 etapas, caracterizadas por la ausencia o presencia de CD44 y CD25. CD44 participaría
en el homing de los precursores T al timo, y CD25 forma parte del R para IL-2. Si bien los DN darán >
lugar a LTαβ, también pueden generar LTγδ. La decisión sobre el linaje se toma en DN3. Los rearreglos de
las cadenas γ, δ y β comienzan en forma simultánea. Un reordenamiento exitoso de γ y δ detiene el
reordenamiento de β y permite la expresión de un TCRγδ. Sin embargo, la mayoría de los timocitos
rearreglan con éxito la β y maduran hacia el linaje Tαβ: se reordenan los fragmentos DB y JB en ambos
cromosomas; se asocia un fragmento Vβ al Dβ-Jβ. Existe exclusión alélica. El reordenamiento exitoso se
visualiza con la expresión en la membrana de la cadena β, junto con una cadena α sustituta y el complejo
CD3, constituyendo el llamado preTCR. Cesa el reordenamiento de la cadena β y disminuye la expresión
de CD25. La expresión en la membrana del preTCR induce la expresión de CD4 y CD8, por lo que entran
en el estadio doble positivo (DP); constituyen el 80% del total de LT del timo. Durante la división ¢, los
genes RAG1 y RAG2 están reprimidos, por lo tanto, la cadena α no se rearregla. Al finalizar, los RAG se
transcriben nuevamente y encada una de las ¢ hijas, que poseen ya las β rearregladas, comienza un
rearreglo independiente de las α. Una vez que se logra un rearreglo productivo de esa cadena, se expresa
en la membrana junto con la β y el CD3, y constituyen el TCR. Los linfocitos continúan siendo inmaduros y
expresan niveles bajos del TCR.
Inducción de tolerancia central T: los mecanismos de control operan analizando la especificidad del
R antigénico generado. Desempeñan un papel crítico las interacciones establecidas entre los TCR de los
timocitos y los complejos péptido propio-CMH propia expresados por ¢ epiteliales, macrófagos y CD del
timo. Las ¢ epiteliales tímicas (CET) actúan como sostén y pueden producir FC y mediadores
quimiotácticos, como IL-7, SCF, SDR-1α y TECK (retiene a los timocitos). A consecuencia de la migración
intratímica que realizan los timocitos durante su maduración, los procesos de selección positiva y negativa
se llevan a cabo por interacción de los timocitos con diferentes tipos ¢. Mientras DN y DP se ubican en el
área cortical, las ¢ SP (CD4 o CD8) lo hacen en la región medular. Distintas quimiocinas, así como π de la
MEC, guían la trayectoria de los timocitos a medida que maduran. Las CET corticales serían las
responsables de la selección positiva, mientras que las CD, macrófagos y CET medulares serían
responsables de la selección negativa.
Selección positiva: El 1º control que sufre el TCR generado se relaciona con su capacidad de interactuar
con las CMH propias. La mayoría de los LT inmaduros poseen TCR incapaces de reconocer péptidos en el
marco de las CMH propias, o capaces de reconocerlos pero con << afinidad, por lo que no serían útiles
para montar una respuesta inmune. Ellas no continúan su desarrollo y mueren en el timo (death by
neglect). Cerca del 96% de los timocitos mueren de esta forma.cada uno de los timocitos capaces de
interactuar con las CMHp del individuo recibirá señales a través de su TCR que, según la afinidad, podrá
llevarlos a sobrevivir y diferenciarse o morir por apoptosis. Cuando la señal se interpreta como apropiada,
el timocito sobrevive. Los GC endógenos, producidos por la estroma tímica, intervendrían tanto en la
inducción de apoptosis como en la selección positiva. La sensibilidad de los timocitos a estos GC es
máxima en DP. Ejercen una presión proapoptótica sobre los timocitos; los cuales deben recibir una señal
que no sea excesivamente alta pero que se halle sobre el umbral por ellos determinado. La selección
positiva determina la funcionalidad del LT: CD4+ o CD8+. Si la señal se genera por interacción con CMH I,
se favorece la supervivencia de los que expresen CD8+. Si es por interacción con CMH II, sobrevivirán los
CD4+. No todas las ¢ seleccionadas positivamente alcanzan la madurez.
Selección negativa: cuando los timocitos reconocen a través de sus TCR CMHp propios con > afinidad,
mueren por apoptosis. Previene que emigren del timo ¢ potencialmente peligrosas ya que podrían
activarse en la periferia y generar respuestas autoinmunes. Sin embargo, es posible que LT autorreactivos
sobrevivan a la selección negativa y logren culminar su maduración por no encontrar a la π propia que son
capaces de reconocer en el ambiente tímico. Estos deben ser controlados en la periferia.
Una vez que los timocitos maduran y superan los controles del timo, emigran como LT maduros. En los
OLS, los que reconozcan péptidos antigénicos presentados por CD podrán activarse, proliferar y
diferenciarse a LT efectores o de memoria. Las ¢ del microambiente tímico son capaces de presentar
numerosas π propias. Las CD y los macrófagos internalizan autoAgs exógenos en forma muy eficiente y
son excelentes CPA de la sangre. Por ellos se las propone como responsables de la inducción de tolerancia
hacia autoAgs hematopoyéticos. Las CET medulares son capaces de presentar una inmensa variedad de
autoAgs presentes en otros tejidos, como insulina, Tg o la MBP. Se las propuso como responsables de la
inducción de tolerancia hacia Ags presentes en tejidos periféricos.
Capítulo IX: Inmunidad mediada por LT
Los LT naive se extravasan en los OLS (GL, bazo y tejido linfático asociado a mucosas) a fin de encontrar
el Ag. Esto depende de la interacción de la L-selectina, expresada por todos los linfocitos naive, con las
sialomucinas GlyCam-1 y CD34 de las HEV de los GLs, y MadCAM-1, de las HEV de las placas de Peyer y
los tejidos linfoides mucosos. Una vez que han ingresado en el área T interactúan con las CD a fin de
sensar en su superficie, la presencia de péptidos antigénicos presentados por CMH. Si reconocen éstos de
modo adecuado, se activan, expanden y diferencian a LT efectores (T CD8+ citotóxicos, Th1 y Th2). Los
péptidos antigénicos que se multiplican en el citosol son acarreados a la superficie de la CPA por CMH I y
presentados a LT CD8+, los que se activan a ¢ T CD8+ citotóxicas. Los que se multiplican en el
compartimiento vesicular o provienen de microorganismos endocitados son acarreados a la superficie de
las CPA por CMH II y presentados a LT CD4+. La activación de los LT CD4+ puede conducir a 2 perfiles:
Th1 y Th2. Los Th1 median el enfrentamiento con patógenos intravesiculares o endocitados al
compartimiento vacuolar e inducen la activación del macrófago. Los Th2 conducen el
enfrentamiento con patógenos extracelulares. Colaboran con los LB y les permiten montar una
respuesta humoral efectiva. Si los LT vírgenes no encuentran el Ag, retornan a la circulación a través de
los linfáticos eferentes y el conducto torácico. Son ¢ de vida media larga y pueden vivir años sin reconocer
su Ag. Por el contrario, los LT efectores son ¢ de vida media corta y, erradicado el proceso infeccioso,
mueren por apoptosis.
Generación de ¢ T efectoras: la respuesta adaptativa NO se inicia en el foco de infección sino en los OLS.
Se concentra allí el Ag llevado por una CD que lo capturó en la periferia, o traído directamente por la linfa.
Las CD poseen > capacidad para interactuar con LT vírgenes, merced a interacciones entre las moléculas
de adhesión, de naturaleza inespecífica. Participan LFA-1, ICAM-3 y CD2, en el linfocito, e ICAM-1 y 2,
LFA-3 y DC-SIGN expresadas en la CD. El objeto de las interacciones es lograr la asociación transitoria de
la CPA y el LT, a fin de que éste sense a través de su TCR y sobre la CPA, péptidos antigénicos
presentados por CMH I o II. Sin embargo, en la mayoría de las ocasiones el reconocimiento no existe y el
LT se libera de la CD a fin de contactar con otras CD. Analizando la zona de contacto entre el LT y la CPA
(CD), las moléculas interactuantes se distribuyen en anillos concéntricos. Los TCR y los péptidos
antigénicos asociados con las CMH ocupan el área central, mientras que las moléculas de adhesión ocupan
el área periférica; se definen así los clusters supramoleculares de activación centrales (c-SMAC) y
periféricos (p-SMAC). Estos se forman después de que se ha iniciado la señalización a través del complejo
TCR-CD3. Esta organización supramolecular constituye la sinapsis inmunitaria. Su formación potenciaría
las señales de activación inducidas a través del TCR, al concentrar las π intracelular que participan en la
señalización. También podría imponer un límite al tiempo durante el cual las vías se mantienen activas, ya
que la agregación extensiva de los TCR, propia del c-SMAC, favorecería la disminución (down regulation)
de los TCR. La activación del LT y su expansión clonal requieren la percepción de 2 señales diferentes:
señal 1, dada por el reconocimiento del péptido antigénico presentado por las CMH a través del TCR.
Involucra el reconocimiento de sitios no polimórficos de las CMH II y I por parte de los coR CD4 y CD8;
señal 2, dadas por moléculas coE expresadas en la CD, que interactúan con sus ligandos, expresados en
el LT. En ausencia de señal 2, la ¢ T no sólo no se activará, sino que entrará en un estado de anergia, que
podrá conducir a su apoptosis. Aún cuando la evada, no podrá activarse en respuesta a contactos futuros
convenientes. Durante el reconocimiento antigénico CD4 o CD8 se unen a sitios invariantes (no
polimórficos) de las CMH II y I. Estas interacciones son necesarias para que los LT CD4+ o CD8+ se
activen de manera adecuada. Las ppales moléculas coE expresadas por las CPA son: B7.1 (CD80) y B7.2
(CD86); ambas son reconocidas por el LT a través de la molécula CD28, expresada en forma constitutiva
por éste. Su entrecruzamiento, inducido por CD80/86, provee una potente señal coE a los LT activados a
través de su TCR. Ello le permite al LT producir IL-2, responsable de la expansión clonal. El R de IL-2
se compone de 3 cadenas α, β y γ. La ¢ T activada (señal 1+2) también s! la cadena α del R de IL-2
(CD25), lo que permite generar en su superficie el R de alta afinidad, que media una respuesta
proliferativa frente a < [IL-2]. De este modo, el clon activado se expande y genera una progenie de 1000-
10000 ¢ en un período de 5 días.cada miembro del clon expresará un TCR idéntico al expresado por la ¢
madre. La activación de CD28 también estimula la s! de la π antiapoptótica Bcl-XL en el LT, promoviendo
la supervivencia de las ¢ que integran el clon expandido. CTLA-4 presenta una homología del 30% con
CD28. Su expresión es inducida luego de activado el LT. Interactúa con CD80/86 pero no produce la
activación del LT, sino la inducción de una poderosa señal inhibitoria. Desplaza a CD28 ya que presenta
una afinidad 20 veces mayor por CD80/86. Al activarse, los LT expresan CD40 y las CPA, CD40L. La
interacción entre ambos media la transducción de señales estimulatorias en el LT e induce en la CPA un >
de CD80/86. Los LT activados, pero no los naive, expresan FasL, y su interacción con Fas conduce a la
activación de las caspasas 8 y 3, lo que dispara la apoptosis. La expansión linfocitaria requiere la
presencia del Ag. Por lo tanto, la eliminación del Ag asociado con la resolución de la infección, redundará
en el cese de la expansión clonal.
Generación de T CD4+ efectoras: Th1 y Th2. Al activarse, los LT se diferencian a ¢ efectoras capaces de
mediar acciones microbiostáticas/microbicidas. La decisión del tipo al cual se van a diferenciar ocurre
durante la expansión clonal. Th1 y Th2 se definen como tales en función del patrón de citocinas que
producen. Las Th1 producen IL-2 e IFNγ; también TNF-α y β. Las Th2 producen IL-4, 5, 6, 9, 10
y 13. Ambas poblaciones pueden producir IL-3 y GM-CSF. La generación de respuestas Th1 y Th2
suele ser mutuamente excluyente, consecuencia de la acción inhibitoria que ejercen el IFNγ sobre
respuestas Th2, y las IL-4 y 10 sobre respuestas Th1. Las Th1 median el desarrollo de una respuesta
inflamatoria en los tejidos periféricos, cuya ¢ efectora ppal es el macrófago activado (inducida por IFNγ).
En los tejidos infectados, el macrófago percibirá además otros estímulos a través de RRP. La activación del
macrófago es esencial en la respuesta contra patógenos presentes en su compartimiento vacuolar.
Favorecen también el desarrollo de respuestas T CD8+ citotóxicas y la activación de ¢ NK a través de IL-2
e IFNγ. La función central de las Th2 es colaborar con los LB en los OLS a fin de permitirles montar una
producción efectiva de Acs de isotipos IgG, A y E. Por lo tanto, cumplen un papel ppal en la inmunidad
frente a bacterias y parásitos extracelulares. Si bien los Acs restringen su campo de acción al espacio
extracelular, en éste pueden neutralizar a los virus producidos por las ¢ infectadas y controlar la
expansión del proceso infeccioso. En los tejidos periféricos tienen capacidad de secretar citocinas
activadoras de eosinófilos y mastocitos. Los LT, al activarse, pierden la expresión de L-selectina, por lo que
una vez que emigren no reingresarán en los OLS. Th1 y 2 se reclutan en forma selectiva, de acuerdo con
la naturaleza del proceso infeccioso en curso. Th1 (pero no Th2) expresan CCR5 y CXCR3, que unen
quimiocinas inflamatorias, producidas por ¢ endoteliales, epiteliales y leucocitos. Se caracterizan por
expresar > [] de ligandos de E y P-selectinas. Los LT al activarse pierden la expresión del CCR7, R que
reconoce quimiocinas producidas en el área T de los OLS. Los LT colaboradores expresan CXCR5, que
reconoce CXCL13, producida en los folículos linfoides, traccionándolos. Las Th2 incrementan la expresión
de CCR3, R para eotaxina (CCL11). La producción de eotaxina en los tejidos es estimulada por citocinas
del perfil Th2. Se expresa en eosinófilos y mastocitos; participa en el reclutamiento de eosinófilos en
las mucosas de las vías aéreas y el tubo digestivo, asociado con respuestas antiparasitarias y alergia. Los
LT efectores, tanto Th1 como Th2, deberán reconocer en la periferia nuevamente el mismo
CMHp que reconocieron originalmente en el OLS. Pero al activarse en la periferia ya no requieren la
percepción de señales coE. Ello explica que los LT CD4+ puedan activarse por macrófagos y LB, y
eventualmente por ¢ parenquimatosas que expresen CMH II. Las IL-12, 18, 23 y 27 son las encargadas
de orientar la diferenciación hacia Th1. La IL-12 es producida por macrófagos y CD activadas, y ejerce
sus efectos a través del R de alta afinidad expresado en LT activados. Las Th2 pierden la expresión de su
R. También estimula la proliferación de LT CD4+; actúa además como FC para las NK. El R de IL-12
señaliza a través de la vía JAK/STAT e involucra a STAT1, 3 y 4. La IL-18 incrementa en los T CD4+ la s!
de IFNγ. La IL-23 es secretada por CD activadas y estimula la producción de IFNγ y la expansión clonal.
La IL-27 comparte las actividades mediadas por IL-12. El IFNγ es también producido por NK, LT CD8+
y LTγδ, y es el ppal activador de los macrófagos. La IL-4 producida por las NKT es quien induce la
diferenciación a Th2. Las NKT son LT ya que expresan un TCR, pero expresan también marcadores
propios de las NK, como CD161. Su TCR NO interactúa con péptidos presentados sino que reconoce
glucolípidos presentados por CD1d. Se encuentran en sangre periférica, en OLS y en otros órganos como
el hígado. Según el modo en el cual se activen pueden producir citocinas asociadas a Th1 (IFNγ y
TNF) o a Th2 (IL-4 y 13).
Activación de LT CD8+ citotóxicos: requiere de 2 señales: reconocimiento antigénico por el TCR y
percepción de señales coE. El tenor de coestimulación requerido es > que el de un LT CD4+ virgen. A
través de su interacción con T CD4+ específicas para el Ag, la CD incrementa la expresión de moléculas
coE. En consecuencia, la T CD4+ expresa más CD40L, que interactúa con CD40 en la CD y se incrementa
la expresión de CD80/86. Aún cuando la coestimulación resulte suficiente, se requiere la colaboración de
las T CD4+ para generar y mantener las CD8+ de memoria. Las T CD8+ desempeñan un papel central en
la inmunidad antiviral y participan en la respuesta inmune contra ciertas bacterias y parásitos
intracelulares. La inmunidad conferida por las T CD8+ se ejerce: destruyendo ¢ infectadas
(citotoxicidad) y produciendo un amplio grupo de citocinas y quimiocinas.
Citotoxicidad: la activación, expansión clonal y diferenciación a T ci.totóxicos se completa 5 días luego de
encontrar el Ag. Durante este período, las T CD8+ s! granzimas y perforinas. Los LT CD8+ efectores
abandonan el OLS y se dirigen a los tejidos inflamados, en busca de ¢ infectadas por el patógeno que dio
lugar a su activación. Los LT citotóxicos contactan con las ¢ del tejido, infectadas o no, a través de
interacciones no específicas. Participan LFA-1, ICAM-1 y 2. Esta interacción es transitoria, a menos que el
LT reconozca el péptido antigénico presentado por CMH I. En ese caso, se produce un cambio en la
afinidad de LFA-1 por su ligando, que tiene como consecuencia la estabilización de la unión entre el LT
citotóxico y la ¢ diana. Pueden destruir a las diana: mediante la liberación de granzimas y perforinas, o a
través del sistema FasL/Fas. Una vez que descargó el contenido de sus gránulos sobre la membrana de la
diana, se separa de ésta y puede volver a reconocer y matar otras ¢ infectadas. Las ¢ pueden morir de 2
maneras: el daño inducido por agentes químicos o físicos, como el calor excesivo, la falta de O2 o el daño
de la membrana ¢ mediado por el CAM (complemento), provoca la desintegración o necrosis ¢, que
conduce a la liberación del contenido intracelular a la MEC. Esto suele originar consecuencias perjudiciales
para el tejido normal y promover reacciones inflamatorias. La otra forma es la apoptosis donde, en
condiciones fisiológicas, ciertas ¢ del organismo están programadas para morir. La vía extrínseca es
disparada por R, como el Fas que expresan dominio de muerte. La vía intrínseca es inducida por agentes
capaces de alterar la permeabilidad de las membranas mitocondriales, lo que conduce a la liberación al
citosol de agentes proapoptóticos, como el citocromo C. Independientemente de la vía, las ¢ que transitan
este proceso expresarán en la cara externa de su membrana fosfatidilserina, que es reconocida por
macrófagos, CD y otras ¢. Ello conduce a la fagocitosis de las ¢ apoptóticas. Los mecanismos citotóxicos
conducen a la apoptosis de la diana y no a su necrosis. Los LT CD8+ efectores no requieren señal 2
(como sí los naive) para activarse. Les permite destruir ¢ parenquimatosas infectadas, que no expresan
moléculas coE. Los LT CD8+ producen IFNγ y TNF-α. El IFNγ actúa directamente inhibiendo la
replicación viral e incrementando la expresión de CMH I, facilitando el reconocimiento del péptido. Cumple
un papel crucial en la activación de macrófagos y en la promoción de diferenciación a Th1.
Capítulo X: Inmunidad mediada por LB
Existen 3 poblaciones de LB: B2 (“LB”), B1 y B de la zona marginal del bazo (BZM). La población B2 es la
más abundante en la circulación sanguínea y en los OLS. Los plasmocitos derivados de los LB2 son los
encargados de producir Acs contra Ags proteicos. Requieren no sólo reconocer el Ag a través de la Ig de
superficie, sino también recibir señales coE por LTh2 que reconocen en los B2 al péptido antigénico unido
a CMH II. Las otras 2 poblaciones de LB pueden diferenciarse y producir Acs sin necesidad de recibir
señales de los LTh2. Ambos (B1 y BZM) cumplen un papel relevante en la defensa contra bacterias
encapsuladas.
Linfocitos B1: son las 1º ¢ B que se generan durante el desarrollo embrionario y el hígado fetal es
su ppal productor. Prevalecen en las cavidades peritoneal y pleural; son capaces de autorrenovarse
localmente, es decir, expandirse sin necesidad de contactar con Ags foráneos. CXCL3 cumple un papel
fundamental en su migración y homing; se expresa en las ¢ de las cavidades pleural y peritoneal, en
particular en macrófagos y ¢ del omento. Pueden abandonar las cavidades corporales utilizando la red de
linfáticos del omento y el diafragma, y regresar nuevamente desde la sangre atravesando los capilares
sanguíneos presentes en los agregados linfoides del omento, sitios de tráfico leucocitario activo. Poseen
un patrón de migración propio y expresan en la superficie altos niveles de IgM (Acs naturales) y bajos de
IgD. La ppal función de los B1 es la producción de Acs dirigidos contra Ags bacterianos no
proteicos, como polisacáridos, fosfatidilcolina y LPS. A estos Ags se los denomina “Ags T
independientes de tipo 2” (TI-2) y se caracterizan por presentar epitopes repetidos con capacidad de
inducir un entrecruzamiento marcado del BCR. Esto conduce a su activación, sin colaboración de Th2. Esta
activación no es suficiente para que los B1 se diferencien a ¢ productoras de Acs. Es necesario que
reciban señales (aún no identificadas) por parte de los LT. Las CD también son capaces de promover la
activación de los B1. ¿Qué determina que los B1 adquieran un repertorio que les permita interactuar
preferentemente con Ag TI-2? En el hígado fetal, los precursores B utilizan durante el reordenamiento
V(D)J los genes VH más próximos a la región J. Además, no se producen inserciones de nucleótidos sin
templado, ya que la TdT no se expresa en el feto. Participan también en la depuración de ¢ apoptóticas y
en la vigilancia inmunitaria contra los tumores. Los B1 producen Acs naturales al ser activados por
estímulos poco conocidos y se diferencian a plasmocitos en respuesta al reconocimiento de Ags
polisacáridos, lipídicos y proteicos. También secretan IgA, G2 y < G1. Gran parte de la IgAs presente en
las mucosas resulta de la activación de B1 por bacterias comensales. Los plasmocitos responsables de su
secreción provienen de los B1 de la cavidad peritoneal. Estos migran al GL mesentérico donde proliferan y
se diferencian a plasmocitos, para dirigirse a los tejidos linfáticos asociados con mucosas. Los B2
producen IgG (no IgA) sérica contra bacterias comensales en respuesta al ingreso de éstas en la
circulación.
Linfocitos BZM: están especialmente adaptados para producir > cantidades de IgM específica en los
1º 3-4 días luego de la estimulación antigénica. La arquitectura de la ZM reduce el flujo sanguíneo y
permite un contacto íntimo entre los Ags y las ¢ efectoras. La situación central del bazo en el sistema
circulatorio posibilita que los BZM sean de los 1º en entrar en contacto con los Ags que circulan por la
sangre. Una vez activados, se convierten rápidamente en plasmoblastos y se dirigen a la periferia de la
lámina periarterial linfática donde proliferan activamente formando focos de ¢ plasmáticas, encargadas de
secretar los 1º IgM. El complemento y sus R representan un papel crucial en la activación de los BZM. En
ausencia de C3, los BZM no pueden unirse al Ag de manera eficiente, lo que produce una fuerte reducción
de los niveles de Acs específicos contra polisacáridos. Los niños < 2 años tienen escasa respuesta a las
infecciones por bacterias encapsuladas; la incapacidad para producir Acs antipolisacáridos bacterianos
parece radicar en la inmadurez de los BZM, que expresan muy bajos niveles de CR2 (C21).
Los B1 y BZM son cruciales entonces, como 1º línea de defensa antibacteriana. Los B1 son ideales
para responder a patógenos que ingresan a través del intestino o las vías respiratorias; los BZM
responden eficientemente contra patógenos que se hallan en la sangre. Representan un puente entre la
inmunidad innata y la adaptativa.
Activación de LB: el 1º paso consiste en el reconocimiento del Ag por parte de la Ig de superficie del BCR.
Tiene 2 consecuencias: a) transduce señales de activación al interior del LB; b) media la endocitosis del
Ag y su procesamiento por la vía exógena. Se expresan sobre la superficie del LB con CMH II, péptidos
derivados del Ag que serán reconocidos por Th2 específicos. Es necesaria una 2º señal proveniente del
Th2 específico: Colaboración T-B: los LB y Th2 deben reconocer epitopes antigénicos en el mismo Ag
(reconocimiento ligado). No significa que reconozcan el mismo epitope; pero es crucial que el péptido
provenga del mismo Ag para que la 2º señal se genere sobre el LB que ha endocitado el Ag y no sobre
otro. El reconocimiento por parte del TCR del péptido, induce en el Th2 la expresión de CD40L. Esta
reconoce en la membrana del LB a CD40. La unión permite la entrada del LB que ha reconocido al Ag en
el ciclo ¢. Es necesario también que los Th2 secreten IL-4, la cual interactúa con R del LB.
Formación del centro germinal: los LB naive que ingresan en el GL atravesando las HEV son atraídos hacia
los folículos 1º por CXCL3, secretada por las CFD. Cuando un LB naive entra en contacto con el Ag a
través de su BCR, aumenta la expresión de CCR7, específico para CCL19 y 21, predominantes en la zona
paracortical T del GL e inicia la migración hacia esa región. En ausencia de IL-12, los LT que se activaron
en respuesta al Ag presentado por las CPA se diferencian a Th2 y migran hacia el borde del folículo. Allí
interactúan con los LB específicos, se produce la colaboración T-B y ambas poblaciones proliferan durante
varios días. Algunos de los LB abandonan este 1º foco de proliferación y se dirigen a la médula del GL
diferenciándose en plasmocitos, que producen los 1º Acs IgM. Otros migran hacia el interior del folículo 1º
atraídos por CXCL3. Una vez en el folículo, los LB siguen proliferando y dan lugar al centro germinal
(CG). A estos LB proliferantes se los llama centroblastos. Desplazan a los LB en reposo que conforman el
folículo, los cuales se disponen formando la zona del manto alrededor del núcleo de ¢ proliferantes. Los
CG se desarrollan 1 semana después de la estimulación antigénica. Están compuestos por centroblastos
(zona oscura), LT CD4+ y CFD. Los LT CD4+ foliculares no se polarizan en Th1/2 y pueden secretar IL-4 o
IFNγ. En el CG, los genes que codifican las cadenas H y L de la Ig sufren modificaciones (hipermutación
somática y cambio de isotipo) que darán como resultado la producción de Acs de > afinidad por el Ag y de
isotipo diferente a IgM.
Hipermutación somática (HS): es un mecanismo por el cual la porción variable de las cadenas H y L de las
Igs sufren mutaciones puntuales con una alta tasa. Luego decada mitosis, las ¢ hijas expresan porciones
V(D)J diferentes del LB que les dio origen. Constituye la base molecular de un proceso muy ventajoso: la
generación de Acs de mayor afinidad a medida que progresa la respuesta humoral (maduración de
afinidad). Involucra la ruptura de las hebras de ADN y la incorporación de “errores” durante la
reparación. Ocurre luego del contacto con el Ag, a diferencia de la recombinación somática que tiene lugar
durante la maduración de LB en MO. Los centrocitos expresan en su membrana Ig mutadas. Como se
producen al azar, muchas son perjudiciales. Otras < la capacidad de reconocimiento del epitope
antigénico. En el CG se encuentran muchos macrófagos encargados de fagocitar a los centrocitos
apoptóticos. Algunas mutaciones van a > la afinidad de la Ig por el Ag y serán los LB que han sufrido
éstas, los que sean seleccionados en el CG. Los centrocitos están programados para morir por apoptosis
en un tiempo corto, a menos que reciban señales de supervivencia enviadas por Th2 específicos. Los
centrocitos pueden unirse directamente con un Ag que se encuentre en forma soluble. Si el Ag forma un
complejo inmune, se une a la superficie de la CFD a través de R para complemento o RFc. El centrocito
podrá reconocer al Ag sobre la superficie de la CFD, y deberá “arrancárselo” a fin de endocitarlo y
presentarlo a los Th2. Las señales de supervivencia involucran el aumento de la expresión de moléculas
antiapoptóticas de la flia Bcl-2, en particular de Bcl-xL, y de la π Fas complejada con cFLIPL (impide
activar a la caspasa 8). Si el centrocito no logra interactuar con el T CD4+, cFLIPL se degrada y se activa
la caspasa.
Cambio (switch) de isotipo de Ig: se produce en el CG y depende de la interacción CD40-CD40L, y las
citocinas liberadas por Th2. A medida que se resuelve la infección, el CG se hace cada vez menor hasta
volverse indistinguible. Ocurre luego del contacto antigénico. Los 1º Acs producidos en una respuesta
humoral son siempre IgM, pero a medida que progresa la respuesta comienzan a observarse Acs de igual
especificidad pero de distintos isotipos. Es consecuencia de la asociación de la porción VDJ de la cadena H
con una porción constante diferente de la cadena μ. Las regiones de switch son imprescindibles para que
se produzca la recombinación del ADN. Con respecto a la enzima “citidina desaminasa inducida por
activación” (AID), su deficiencia no sólo bloquea por completo el cambio de isotipo de Ig, sino también la
HS. Es capaz de modificar el ARN al convertir la citidina en uracilo por desaminación (edición del ARN). La
desaminación del ARNm por la AID daría como resultado una π que rompe el ADN reclutando luego el
sistema de reparación que incorpora “errores”.
Diferenciación de centrocitos a LB de memoria o plasmocitos: los centrocitos que han sobrevivido al
proceso de selección dan lugar a 2 tipos de ¢: plasmoblastos, que abandonan el CG para completar su
diferenciación a ¢ plasmáticas productoras de Igs de > afinidad, y LB de memoria. En la decisión inciden
varios factores: a) la afinidad del BCR por el Ag; los centrocitos que expresen R de > afinidad tenderán a
diferenciarse a plasmoblastos; b) durante la colaboración T-B, las señales transducidas en el LB a través
de CD40 favorecen la diferenciación a un fenotipo de memoria. Las transducidas a través de Ox40L
(ligando de Ox40 en LT) favorece la diferenciación a un fenotipo plasmocítico; c) mientras que la IL-10
favorece la diferenciación a ¢ plasmática, la IL-4 favorece la diferenciación a ¢ de memoria. La expresión
del FT Blimp-1 es suficiente para inducir la diferenciación en plasmocito secretor de Ig. En la membrana
del plasmocito desaparecen las moléculas responsables de la activación antigénica, como BCR, CD19, 21 y
22, CMH II. A su vez, experimentan un > notable en la relación citoplasma/núcleo, dado que deben s! >
cantidades de Ig, presentando un REG prominente y vacuolas secretorias. La reexposición al Ag induce
una rápida y masiva expansión clonal de los LB de memoria, generándose entre 8 y 10 veces > número
de plasmocitos que en la respuesta 1º. Los LB de memoria expresan BCR de > afinidad por el Ag como
consecuencia de su paso por el CG y niveles incrementados de CMH II. Si los niveles de Acs en circulación
son suficientemente altos, el reingreso del Ag no genera una respuesta 2º, ya que los Acs son capaces de
neutralizarlo favoreciendo su inmediata depuración por el sistema mononuclear fagocítico. Si no son
suficientes, los LB de memoria que expresen BCR de > afinidad son los 1º en ser activados.
En el hombre, alrededor del 40% de los LB circulantes suelen ser de memoria, ya que expresan CD27 y
poseen Ig de superficie con su porción variable hipermutada. Sin embargo, casi la mitad de éstos
expresan IgM y D, es decir, no sufrieron cambio de isotipo. A su vez, éstos comparten el fenotipo y la
expresión génica de los BZM. Por ende, se puede pensar que el proceso de HS que sufren los BZM es
anterior al encuentro con el Ag (se da durante la ontogenia) y tiene como objetivo generar > diversidad
de Ig. Esta hipótesis se basa en la presencia de BZM en pacientes con síndrome de hiperIgM, los
cuales no pueden formar CG, y en la HS de los BZM de niños < 2 años, los cuales no podrían montar una
respuesta contra Ags TI-2.
Acs: isotipos: la IgM representa un papel central en los mecanismos de defensa en el compartimiento
vascular, gracias a su estructura polimérica, que le otorga > capacidad para actuar como Ac neutralizante
y para activar la VC del complemento. La IgG actúa tanto en el compartimiento vascular como en el
extravascular; tiene capacidad de funcionar como Ac neutralizante y activador de respuestas inflamatorias
poderosas, y de activación de respuestas ¢ a través de los RFc expresados en los leucocitos. Representa
una 1º línea de defensa en el recién nacido, ya que es la única Ig capaz de atravesar la placenta. Todas
las subclases de IgG excepto la IgG4, pueden activar la VC del complemento. La IgA, bajo la forma
secretoria (IgAs) cumple un papel fundamental en los mecanismos de defensa antimicrobianos operativos
en las mucosas, donde actúa como Ac neutralizante. La IgE participa en el desarrollo de fenómenos de
alergia y anafilaxia, y cumple una función importante en el control de la funcionalidad de la barrera
endotelial, merced a su capacidad de inducir la activación de los mastocitos mediante el RFcεI. Los sitios
ppales donde se activa la respuesta humoral en el intestino son las placas de Peyer y los GL mesentéricos.
Tanto las PP como los folículos linfoides aislados están compuestos de un epitelio que contiene ¢ M,
encargadas de ingresar los Ags desde la luz intestinal y provocar la activación de los LB. Si se trata de Ags
T dependientes, los LB recibirán colaboración de Th2 específicos, dando lugar a CG, en los que los LB
sufren HS y cambio de isotipo a IgA. Los LB IgA+ migran a los GL mesentéricos y a la lámina propia,
donde diferenciados en plasmocitos, secretan > cantidades de IgA específicos. Las CD activadas por LPS,
IFNγ o IFNα, > la expresión de BAFF. Al unirse éste al R del LB, se transmiten señales de activación las
que producen la inducción de la AID. En presencia de TGF-β, esta interacción LB-CD, independiente de
CD40-CD40L, favorece el cambio de isotipo a IgA. A fin de llegar a su lugar de acción, la IgA debe
atravesar el epitelio. El dímero se une a un R expresado en la superficie basolateral del epitelio,
denominada “poli-Ig”. El complejo es internalizado y transportado hacia la superficie apical en una
vesícula de transporte (transcitosis). A nivel apical, el poli-Ig se escinde por proteasas y libera la región
extracelular, que permanece asociada con la IgA. Este componente adicional, denominado “componente
secretorio”, parecería proteger al Ac de las proteasas. La IgA NO activa la VC del complemento; es
capaz de activar respuestas inflamatorias en leucocitos PMN, monocitos y macrófagos, a través de los
RFcα, siempre que haya interactuado con el Ag. La IgD se expresa junto con la IgM, sobre los LB
maduros donde actúa como R antigénico. Se desconoce su función.
Interacción Ag-Ac: involucra enlaces no covalentes y constituye una reacción reversible. Intervienen
fuerzas electroestáticas, hidrófobas, ptes de H y de Van der Waals. Los complejos inmunes, sobre todo los
formados por IgG, son reconocidos por macrófagos presentes en el hígado, bazo y pulmones a través de
los RFcγ. La disposición de los fragmentos Fc, particularmente su cercanía espacial, les permite activar el
C1q y microagregar los RFc.
Acs monoclonales: la respuesta fisiológica al ingreso de un Ag es siempre policlonal, ya que, aún cuando
se trate de un único epitope, es muy probable que haya más de un clon de LB con capacidad para
reconocerlo. El fundamento de la técnica de producción de Acs monoclonales consiste en fusionar ¢ de
mieloma de ratón con LB de un ratón inmunizado con el Ag de interés. Los híbridos resultantes proliferan
indefinidamente y secretan Acs específicos hacia el Ag empleado en la inmunización. La ingeniería
genética de Acs permite transplantar las regiones CDR del Ac monoclonal murino a una Ig humana. De
este modo, los Acs producidos preservarán su especificidad original disminuyendo su inmunogenicidad.
Capítulo XI: Tráfico linfocitario
Los linfocitos nativos, una vez maduros, pasan a la circulación sanguínea, para extravasarse en los OLS.
Si no encuentran a su Ag específico en estos órganos, retornan a la circulación sanguínea a través de los
vasos linfáticos eferentes y el conducto torácico. En menos de ½ hora, volverán a extravasarse en un
nuevo OLS.
Los plasmoblastos pueden diferenciarse localmente en células plasmáticas sésiles, que permanecen en el
OLS o pueden abandonarlo a través del linfático eferente y por el conducto torácico ingresar en el torrente
sanguíneo para poblar sitios distantes, como la MO, la piel y las mucosas. Los LB de memoria también
sufrirán recirculación entre la sangre, el OLS y la linfa.
La linfa. Los capilares de la mayoría de los tejidos son permeables, por lo que en un adulto saludable,
aproximadamente 20 litros de líquido pobre en π permea diariamente al espacio extravascular. Alrededor
del 90% de éste es reabsorbido localmente, mientras que los 2 litros restantes retornan a la circulación a
través de una red intrincada de vasos linfáticos. Estos contienen válvulas que sólo permiten el flujo
unidireccional de la linfa a trvés de los GL hacia el corazón. Los pequeños vasos linfáticos colectan la linfa
intersticial, encauzándola sucesivamente hacia vasos de mayor tamaño, para derramar su contenido a
través del conducto torácico en la vena subclavia izquierda. La linfa proveniente de sectores ubicados por
encima del diafragma retorna a la circulación a través del conducto broncomediastinal o el tronco linfático
derecho.
El reconocimiento por parte de las CD de citocinas inflamatorias como el TNF-α y la IL-1, producidas por
los macrófagos activados, mastocitos y queratinocitos en respuesta a la infección, estimula su migración a
los GL locales. En ausencia de inflamación, los precursores de las células de Langerhans (CD) son
reclutados gracias a la producción de la quimiocina CCL20 por los queratinocitos. En condiciones
inflamatorias, IL-1 y TNF-α incrementan marcadamente la producción de CCL20, estimulando el rápido
reclutamiento de un mayor número de CD. Un mayor reclutamiento de precursores permitiría entonces,
compensar la pérdida de CD ocasionada por su emigración a los ganglios drenantes.
A diferencia de las CD, el ingreso de los linfocitos en los OLS ocurre a través de vénulas poscapilares
denominadas “vénulas de endotelio alto” o HEV. Estas expresan moléculas de adhesión y quimiocinas que
no son expresadas en otros endotelios, en particular, sialomucinas sulfatadas y sialiladas. Las moléculas
expresadas por el linfocito se llaman “receptores de homing”, dado que son las que dirigen al linfocito al
sitio donde debe extravasarse. A excepción del bazo, todos los OLS contienen HEV, por lo general ubicadas
en las áreas paracorticales o áreas T de los OLS. El bazo no requiere mecanismos de adhesión, pero sí
requiere la participación de quimiocinas para que los linfocitos se localicen adecuadamente.
Cascada de extravasación linfocitaria: el proceso de migración sitio específico, también denominado
“homing”, está determinado por el patrón de expresión de moléculas de adhesión y de R de quimiocinas
en el linfocito y la expresión de sus contraR y quimiocinas en el tejido. Los pasos incluyen: rolling –
adherencia estable – transmigración. El rolling involucra la interacción de la L-selectina, expresada por
todos los linfocitos vírgenes (R de homing), con las adresinas vasculares (sialomucinas) endoteliales. El
siguiente paso, la adherencia estable, requiere que el linfocito reciba antes una señal que le permita
activar a sus integrinas. Esta señal es mediada por las quimiocinas CCL19 y CCL21. La CCL21 (SLC) es
producida por las células endoteliales de las HEV y suele ser exocitada e inmovilizada en su cara luminal
por unión a los GAGs. La CCL19 es producida por CD y estromales del área T y transportada por
transcitosis a la cara luminal de las HEV donde también se inmoviliza. El R para éstas, el CCR7, es
expresado constitutivamente por los linfocitos vírgenes. La integrina que media la adherencia estable del
linfocito es LFA-1, que reconoce a sus ligandos ICAM-1 y 2 expresados en el endotelio vascular. En los
tejidos linfoides asociados con el intestino, el reclutamiento linfocitario depende de la expresión de la
integrina α4β7 sobre el linfocito y MadCAM-1 sobre el endotelio, las cuales median el rolling y la adherencia
estable. La migración transendotelial y el pasaje por la membrana basal de la HEV constituyen el último
paso. El evento crítico es la modulación de la adhesividad del linfocito. Dentro del OLS, los LT se
distribuyen en el área paracortical colocalizándose con las células interdigitadas dendríticas. El linfocito se
une transitoriamente a las CPA, lo cual detiene su migración. Esta unión involucra integrinas. Si no
encuentra a su Ag, se separa de la CPA. En las pocas ocasiones en que lo encuentra, el reconocimiento
antigénico induce un cambio conformacional en la integrina LFA-1 que aumenta la afinidad por sus
ligandos y la unión entre ambas células se estabiliza. Esta interacción se mantiene al menos durante 15
hs. Los LT activados en el área paracortical se diferencian a células efectoras. Las Th1 migran a los
tejidos periféricos. Las Th2 podrán migrar tanto a los tejidos periféricos, para contribuir a eliminar
patógenos mediante la producción de citocinas, como colaborar con las células B en el mismo GL. Los
linfocitos con tropismo por la piel expresan el ligando de la E-selectina endotelial llamado CLA, y el CCR4,
que reconoce CCL17 sobre el endotelio vascular de la piel, mientras que los que tienen tropismo por la
mucosa intestinal, expresan la integrina α4β7 que reconocerá MadCAM-1 sobre sus células endoteliales.
Sólo los LT que coexpresen α4β7 y CCR9 se extravasarán en el intestino delgado, pues serán los que
tengan la capacidad de responder a CCL25, expresada por células epiteliales del ID. El sitio donde ocurre
la activación linfocitaria determina el patrón de expresión de R de homing, y como consecuencia, instruye
a las células efectoras sobre dónde encontrar a su Ag específico en los tejidos periféricos.
Con respecto a los LT de memoria, los TMC conservan la expresión de L-selectina y CCR7, y presentan un
perfil fenotípico más similar a los nativos. Recirculan, vía sangre OLS linfa conducto torácico
sangre, y son centinelas de tejidos linfoides. Los TME no expresan L-selectina ni CCR7 y como
consecuencia, no pueden ingresar en los OLS. Recirculan, vía sangre tejidos extralinfoides periféricos
vasos linfáticos aferentes OLS linfático eferente conducto torácico sangre.
El reclutamiento de linfocitos B2 involucra los mismos R de homing que los LT. No obstante, además de
CCL19 y 21, las quimiocinas CXCL13 y CXCL12, ligandos de CXCR5 y CXCR4, respectivamente, participan
en la activación de las integrinas que median la adherencia estable. Los LB vírgenes expresan altos niveles
de CXCR5 y bajos de CCR7. Si los LB extravasados no contactan con su Ag en ese OLS, lo abandonan por
el linfático eferente. Los que sí contactan con él, incrementan la expresión de CCR7. La expresión de éste
dirige a los LB primados por el Ag hacia el área T, donde las quimiocinas CCL21 y 19 están siendo
producidas, y se encuentran con los LTh2. En el borde del folículo tiene lugar la colaboración T-B, lo que
conduce a las células B a dividirse y genera un foco 1º de proliferación. Los LB de memoria que han
sufrido switch isotípico a IgG o A, reexpresan CCR7, CCR6, CXCR5 y CXCR4 y utilizan estos R para
recircular. Los plasmoblastos, en cambio, son incapaces de responder a las quimiocinas propias
de los OLS, ausencia que facilitaría su salida de éstos. Abandonan el CG y vía linfático eferente y
conducto torácico, pasan a la circulación para poblar sitios distantes, donde se diferencian a plasmocitos
productores de Acs. Una fracción importante de los plasmoblastos migra a la MO, atraída por CXCL12. Allí
se diferencian a plasmocitos.
La inmunización oral conduce a la producción de IgA específica, tanto en la mucosa intestinal como en las
glándulas salivales, mamarias y del tracto respiratorio, mientras que la inmunización intranasal conduce a
una producción de IgA restringida a las mucosas del tracto aéreo y digestivo superior, y tracto urogenital.
Es probable entonces que la expresión de CCR10 y de α4β1 por los plasmoblastos IgA inducidos en los
tejidos linfoideos del tracto aéreo y digestivo, por inmunización intranasal, medie el tráfico a tejidos que
expresen VCAM-1 y CCL28, como los tractos respiratorio y urogenital, pero no el tracto intestinal. La
expresión conjunta de CCR9, CCR10, α4β7 y α4β1 por plasmoblastos IgA derivados de la inmunización oral
podría mediar la migración a sitios donde se exprese CCL28 o CCL25 (ligando del CCR9) junto con
MadCAM-1 o VCAM-1. Tal es el caso de todos los tejidos mucosos.
Capítulo XIII: Regulación de la respuesta inmune: tolerancia y homeostasis
A un ratón perteneciente a una cepa A se le implantaron antes de su nacimiento, ¢ alogénicas
provenientes de un ratón B. Cuando el ratón A alcanzó el estado adulto, aceptó (no rechazó) el injerto de
piel proveniente de la cepa B. La supresión de la reacción de rechazo fue específica: aceptaba el injerto
proveniente de B pero no el de C. La adquisición de tolerancia requirió que las ¢ B se implanten en A
antes de que el sistema inmune de A madure (antes del nacimiento), y la interacción de las ¢ inmunes
inmaduras de A con ¢ B. La administración de ¢ no tolerizadas fue capaz de romper el estado de
tolerancia. La tolerancia inmunitaria se define como la falta de respuesta inmune a un Ag,
provocada por la exposición anterior a ése.
Tolerancia central B y T: en el estadio B inmaduro se induce la tolerancia central frente a Ags propios. Los
LB inmaduros que no reciben señal a través de su BCR (no reconocen Ags propios), emigran con éxito de
la MO para culminar su maduración en el bazo. Los que sí reconocen Ags propios son silenciados. Los que
perciban una señal antigénica de > intensidad morirán por apoptosis; los que perciban una señal
moderada entrarán en un estado de anergia. Estos últimos, si bien emigran de la MO no serán capaces de
activarse y morirán pronto. No todos los Ags propios pueden alcanzar la MO a fin de protagonizar la
inducción de tolerancia central B. Por lo tanto, un grupo importante de LB que emigran de la MO expresan
BCR capaces de reconocer moléculas propias. Estas ¢ son controladas mediante mecanismos de tolerancia
periférica, a fin de evitar respuestas autoinmunes. La exposición de LB inmaduros a Ags propios se
traduce también en el silenciamiento de los linfocitos que los han reconocido. En el timo, los LT que
reconozcan Ags propios con mucha afinidad generarán a través de su TCR señales de > intensidad que
conducirán a su muerte (selección -). Un grupo importante de clones potencialmente autorreactivos podrá
escapar a la inducción de tolerancia central.
Tolerancia periférica en los LT: normalmente, estos clones se encuentran silenciados, pero la inmunización
en presencia de un adyuvante desencadena su activación, expansión y la respuesta autoinmune. Existiría
un mecanismo periférico de deleción clonal, por fuera de los OLP que permitiría el silenciamiento
definitivo de clones autorreactivos. Existen sitios inmunológicamente privilegiados en la capacidad de
aceptar alotrasplantes sin generar rechazo. Ejs. son la cámara anterior del ojo, el cerebro y los testículos.
Los Ags localizados en estos sitios sí acceden a los OLS y son presentados a los LT. Sin embargo, la
presentación antigénica no induce respuestas T efectoras, sino la tolerancia. Se observó que la
presentación de éstos se asocia con la producción de TGF-β, un inmunosupresor.
Con respecto a las ¢ TR, su depleción conduce a enfermedades autoinmunes; anormalidades genéticas
resultantes en un defecto de las TR constituyen la causa 1º de enfermedades autoinmunes. Estas ¢
desempeñan un papel central en la regulación de la respuesta inmune antimicrobiana y antitumoral, al
inhibir la activación y expansión de Th1, Th2 y T CD8+. Las TR naturales expresan CD4+ CD25+ y
FOXP3; las inducibles incluyen las tipo I y las Th3.
TR naturales: en la sangre periférica representan un 10% de los LT CD4+. Desempeñan un papel
central en el mantenimiento de la tolerancia a lo propio. Las T CD4+ adquieren la CD25 en el timo,
durante el estadio SP. La expansión de LT se atribuye a una función no redundante de la IL-2, que es la de
inducir una señal esencial para la generación de TR. Expresan constitutivamente CD62L, CD103, CD152,
el R inducible por GC y el CCR4. El FOXP3 es un gen que codifica a la escurfina, un represor de la
transcripción y regulador de la activación de los LT. Son producidas en el timo y emigran como una
población T madura. Expresan R de quimiocinas y moléculas de adhesión que les permiten acceder a OLS
y también a tejidos inflamados. En diferentes tipos de neoplasias, se demostró un > número de LT
CD4+CD25+. Inhiben la activación, expansión y producción de citocinas por Th1, 2 y T CD8+. A fin de
ejercer su actividad supresora, deben ser estimuladas a través de su TCR pero requieren << [Ag]. Utilizan
3 mecanismos: a) liberación de citocinas supresoras, IL-10 y TGF-β; b) inducción de una señal inhibitoria
directa sobre T CD4+ y CD8+; c) inhibición de la actividad CPA por parte de las CD.
TR inducibles de tipo 1: también inhiben la activación, expansión y producción de citocinas por
Th1, 2 y T CD8+. A diferencia de las TR CD4+CD25+, no provienen de un linaje desarrollado en el timo,
sino que adquieren su perfil supresor luego de activarse por el Ag en los OLS. Producen IL-10 y TGF-β,
no así IL-12. Su inducción es dirigida por CD semimaduras presentes en los OLS.
TR inducibles tipo Th3: la administración de un Ag por vía oral o la estimulación in vitro de ¢ T
CD4+CD25+ en presencia de TGF-β, induce la generación de T CD4+ productoras de TGF-β (¢ Th3).
Controlan la respuesta T dirigida contra componentes de la flora comensal. El TGF-β ejerce su
actividad supresora inhibiendo la diferenciación de LT CD4+ y CD8+ naive en ¢ efectoras y suprimiendo la
actividad de éstas, cuando ya se han diferenciado; bloqueando la expresión de los FT Gata-3 y T-bet, e
inhibiendo la funcionalidad de las CD.
CD tolerogénicas: al arribar a los OLS, la presentación de los Ags podrá conducir al desarrollo de
una respuesta inmune vigorosa o a la tolerización del clon que ha reconocido al Ag. Esto dependerá de la
historia de la CD en el tejido, sobre todo de las señales percibidas o no, a través de R responsables de
desencadenar la maduración de las CD. Al llegar a los OLS, las CD maduras activan a las T CD4+ y guían
su diferenciación. Por el contrario, en ausencia de señales inflamatorias, una población de CD iniciará
su migración a los OLS donde residirán como CD semimaduras o en estado estacionario. Expresan niveles
reducidos de CD40, 80/86, baja producción de IL-12 y alta de IL-10; provienen de los tejidos y se dirigen
por vía linfática hacia el área paracortical de los OLS, sin alcanzar su madurez. Al contrario, las CD que
migran desde los tejidos inflamados reconocen a través de su TLR componentes microbianos; en
consecuencia maduran y producen citocinas, entre ellas la IL-6, capaz de bloquear la acción
inhibitoria mediada por las TR. La presentación antigénica por parte de estas CD conduciría al
silenciamiento, transitorio o permanente, del clon activado. La presentación de Ags propios por CD
inmaduras parece ser fundamental en el mantenimiento de la tolerancia a autoAgs. Una vez en el GL, las
CD semimaduras, porespuestadoras de autoAgs captados en periferia, podrán provocar la deleción o la
anergia de los LT específicos. También son capaces de inducir la diferenciación en TR I o Th3. Otra forma
de inducción de tolerancia se relaciona con la capacidad de las CD de secretar indolamina 2,3-dioxigenasa
(IDO), responsable de la degradación del triptófano. Las CD maduras que expresan IDO poseen una
notoria capacidad para suprimir respuestas T in vivo e in vitro. La inducción de IDO puede ser motorizada
por el entrecruzamiento de CD80/86. La capacidad inmunoestimuladora de la CD es también inhibida por
IL-10. Otros factores que afectan son los GC y el TGF-β.
Tolerancia periférica en los LB: los BCR de los BTr1 sufren un proceso de selección (-) si reciben señales
por reconocer moléculas propias en el bazo. Así los LB autorreactivos que sobrevivieron a la inducción de
tolerancia central en la MO no continuarán su desarrollo. Los sobrevivientes darán lugar a los BTr2, que se
ubican en los folículos esplénicos. Para que esta población alcance el estadio B maduro es necesaria la
percepción de señales de supervivencia a través del BCR. BAFF representa un factor indispensable para la
normal transición de los BTr1 a BTr2 y su posterior transición a B maduros. Su producción en niveles
elevados parecería ser central en el desarrollo de diferentes manifestaciones de autoinmunidad, al
favorecer la supervivencia, activación y expansión de clones autorreactivos presentes en periferia. Los LB
capaces de reconocer autoAgs que hayan escapado a los mecanismos de deleción propios de la tolerancia
central, podrían madurar sin convertirse en peligrosos, ya que no contarían con LT autorreactivos que
puedan colaborar con ellos para su expansión y diferenciación.
Homeostasis de la respuesta inmune antimicrobiana: hay que tener en cuenta la magnitud de la
expansión clonal que se produce en una respuesta inmune convencional. Frente a ciertas infecciones
virales, cerca del 50% del total de LT CD8+ en periferia son reactivos frente a alguno de los epitopes
virales. No todos los individuos responderán del mismo modo frente a un Ag particular; la capacidad de
respuesta dependerá de su haplotipo y del repertorio B y T que exprese. Los individuos que expresan baja
capacidad de responder a un Ag particular, son denominados “bajos respondedores” sólo en relación al Ag
analizado. La eliminación del Ag priva a las T efectoras de señales coE y citocinas, y conduce a una rápida
pérdida en la expresión de π antiapoptóticas.
Tolerancia oral: constituye un modelo de tolerancia inducida por la entrada de un Ag por vía oral, lo que
genera en los LT un estado de falta de respuesta o tolerancia sistémica Ag-específica. Diversos factores,
como el tipo de alimentación y las características de la flora comensal, afectan la inducción de tolerancia
oral. Sin embargo, el factor crítico parece estar dado por la dosis y el protocolo de administración del Ag.
Mecanismos involucrados en la tolerancia sistémica:
*Deleción clonal: por Ags administrados en >> dosis
*Anergia clonal: cuando el LT recibe sólo la señal 1
*Inducción de TR: las CD de las PP y de la lámina propia, al capturar el Ag y no percibir señales
inflamatorias, migrarían a los OLS como CD semimaduras, induciendo la diferenciación en un perfil TR.
Capítulo XIV: Memoria inmunitaria
Se define como la capacidad de recordar una infección pasada, por Acs circulantes que persisten en el
tiempo, y por LB y T de memoria. Los LB de memoria, como consecuencia de haber sufrido el cambio de
isotipo, pueden expresar IgG, E o A (los LB vírgenes, sólo IgD o M). Los LT vírgenes expresan una
isoforma de CD45, la CD45RA; mientras que la mayoría de los LT luego de su activación (T efectores o de
memoria), expresan la isoforma CD45RO. La memoria de la inmunidad humoral se asienta en ¢
plasmáticas de larga vida media, productoras de Acs; y LB de memoria, que constituyen el reservorio para
la generación rápida de ¢ plasmáticas.
Memoria de LB: el número de ¢ B de memoria es estable y se mantiene gracias a una respuesta
proliferativa homeostática (menos de una división al mes) que no requiere la reexposición al Ag. A
diferencia de las ¢ B de memoria, las plasmáticas han sufrido una diferenciación terminal y no pueden ser
estimuladas por Ags, ya sea para dividirse o para incrementar la producción de Acs. Hay 2 poblaciones de
¢ plasmáticas: una de vida media corta, que produce Acs inmediatamente después de la exposición
antigénica, y otra de vida media larga (3-4 meses). Después de una infección, la producción de Acs por
las CP en los OLS alcanza su pico hacia el final de la 2º semana, para declinar luego en las 2-4 semanas
siguientes. // En el hombre, los niveles de Acs se mantienen en forma estable en ausencia de
inmunizaciones adicionales o de reexposición al virus. Hay 2 posibilidades que lo explican: una, que las ¢
plasmáticas tuvieran una vida media extremadamente larga, y otra, que se produzca la diferenciación
continua de LB de memoria a ¢ plasmáticas de vida media larga. La activación bystandard de ¢ B de
memoria se produciría a consecuencia de una infección no relacionada. Citocinas generadas durante el
desarrollo de la respuesta inmune contra Ags no relacionados con aquellos que indujeron la producción de
éstas ¢ B de memoria, podrían estimular su diferenciación a ¢ plasmáticas de vida media larga. Con
respecto al tamaño del pool de LB de memoria y al tiempo que se mantienen, hay 2 patrones de
respuestas: 1) la vacuna induce una producción de Acs prolongada y estable en el tiempo (viruela, polio,
fiebre amarilla), b) la vacuna induce niveles de Acs que declinan después de algunos años (hepatitis B y
ántrax). Los LB de memoria específicos para un Ag pueden ser identificados en sangre humana por la
técnica ELISPOT.
Memoria de LT: el número de T CD4+ y CD8+ de memoria se mantiene en función de una proliferación
homeostática que tiende a reemplazar las ¢ que mueren. Comprenden 2 poblaciones: LT de memoria
efectores (TME) y centrales (TMC). Los TME expresan un patrón de moléculas de adhesión y R de quimiocinas
que les permiten ingresar en los tejidos periféricos. Al ser activados, secretan rápidamente las citocinas
efectoras (IL-2, 4 y/o IFNγ). Los TMC expresan > niveles de CD62L y CCR7, que les permite ingresar en el
área T de los OLS. Poseen > capacidad de proliferación frente a la reestimulación antigénica en relación
con los TME. Aún en ausencia de colaboración T CD4+, los T CD8+ naive pueden activarse, expandirse y
generar una respuesta 1º, pero la generación de memoria T CD8 se ve comprometida. La preservación en
el tiempo de la memoria T CD8+ es dependiente de IL-7 y 15, y de la expresión de sus R.
Mientras la memoria de ¢ T declina en forma paulatina (vida media: 8-15 años), la respuesta de Acs se
mantiene constante por 75 años o más.
Capítulo XV: Inmunidad antiviral
Los virus son agentes infecciosos capaces de infectar al hombre, los animales, las plantas e incluso, las
bacterias y los hongos. Carecen de maquinaria biosintética propia, por lo tanto son parásitos intracelulares
estrictos; poseen un mecanismo de replicación diferente del empleado por otros microorganismos; su
estructura comprende ácidos nucleicos (ADN, ARN o ambos) protegidos por una cubierta proteica
denominada cápside, y en algunos casos una envoltura lipídica obtenida de las membranas de la ¢
hospedadora; poseen un tamaño pequeño, de 20 a 300 nm. Han evolucionado para transferir su material
genético entre ¢ y codificar información suficiente que les permita su propagación continua.
Ciclo de replicación viral: el 1º de los pasos es la adsorción, que involucra la interacción de ligandos
virales con R ¢. Distintas moléculas de la superficie ¢ pueden servir como R. El paso siguiente es la
penetración seguida del desnudamiento (liberación del ácido nucleico viral). La penetración puede
ocurrir por diversos mecanismos: los virus desnudos, por endocitosis, traslocación o pasaje directo de su
ácido nucleico a través de la membrana; los virus envueltos, por fusión de la membrana con la envoltura
viral o por endocitosis. Luego, comienza la s! de π virales por la maquinaria biosintética de la ¢. Algunas
participan en la replicación de los genomas progenie y otras conforman la estructura del virus. La mayoría
de los virus con genoma de ADN replican en el núcleo; los que poseen ARN, lo hacen en el citoplasma.
Una vez producido el ensamblaje de los genomas progenie y las π estructurales, ocurre la liberación del
virus desde la ¢. Sucede por brotación de los virus de la membrana o mediante la lisis ¢. Los virus
pueden inducir diferentes efectos sobre las ¢ que infectan, aún cuando NO se repliquen. El daño ¢ puede
ser inducido por el propio virus (daño directo) o por el sistema inmune en respuesta a la infección (daño
indirecto). El daño directo involucra la alteración de procesos esenciales como: s! de π, de ADN-ARN y/o
transporte vesicular, inducción o inhibición de la apoptosis; inducción de la permeabilidad de la
membrana. Grandes cantidades de componentes virales que se acumulan en la ¢ -sobre todo de la
cápside-, suelen resultar tóxicos. Algunos virus que expresan sus π en la membrana pueden causar fusión
¢. El daño indirecto está mediado por: T CD8+, T CD4+, Acs.
Modelos de infección: la infección aguda se caracteriza por la rápida producción de virus infeccioso
seguida de una rápida resolución de la infección por el hospedador. Un ejemplo es la gripe producida por
el virus influenza. En una infección persistente el virus puede ser producido en forma continua o
intermitente por meses o años. Se clasifican en: crónicas (producción continua), latentes (producción
intermitente), lentas (contacto inicial >> tiempo síntomas), o transformantes (alteran mecanismos
reguladores del crecimiento ¢).
Inmunidad innata: los ppales efectores son los IFN tipo I y las ¢ NK. La presencia de ARNdc y otros Ags
virales disparan, en el sitio de infección, la producción de los IFN α y β. Las ¢ NK pueden inducir la
apoptosis de ¢ infectadas. Al ser estimuladas por los IFN I, secretan IFNγ, que cumple un papel
importante en el desarrollo y la modulación de la respuesta adaptativa. La respuesta innata se pone en
marcha por el reconocimiento de componentes virales por RRP: TLR o RLC. La activación de los TLR
desencadena una cascada de señalización que culmina con la activación de FT como NFκB, AP-1 y P38 o
en la inducción de factores reguladores de IFN (IRF), que disparan la transcripción de genes que
participan en la respuesta antiviral. El ARNdc es un intermediario replicativo de diversos virus y es el
PMAP más estudiado, TLR3 es su R. Su expresión aumenta en macrófagos, CD y epiteliales en respuesta a
infecciones virales, a la presencia de IFN I y al agregado de un análogo del ARNdc. La ppal función del
TLR3 es desencadenar la producción de IFNβ. Induce, además, la maduración de CD. Algunos TLR (4
y 7) pueden reconocer Ags virales no considerados PMAP. Algunos RLC son empleados por ciertos virus
para infectar ¢ y diseminarse. En momentos tempranos, las NK tienden a limitar la expansión viral
mientras se desarrolla la respuesta adaptativa. Muchos virus, luego de infectar una ¢, inducen una
disminución de la expresión de CMH I; lo que les permite escapar a la acción citotóxica de los LT CD8+.
Además, al ser las CMH I el ppal ligando de los R (-) de las NK, su baja expresión podría convertir a las ¢
infectadas en blancos de la acción citotóxica de las NK. Otro mecanismo por el cual las ¢ infectadas
pueden transformarse en blancos de NK es > la expresión de ligandos endógenos para R (+) como MICA.
Las infecciones virales inducen la producción de citocinas que modulan la actividad citotóxica de las NK,
así como su capacidad de producir IFNγ. Se destaca la actividad estimuladora mediada por IL-12
producida por macrófagos y CD activadas. Los IFN se producen en grandes cantidades luego de una
infección viral e inhiben la replicación en la ¢ infectada y en sus vecinas. Presentan un amplio espectro de
actividades biológicas: crecimiento ¢, diferenciación, apoptosis, respuesta innata y adaptativa. Pertenecen
a una flia multigénica de citocinas; se los agrupa en IFN tipo I (α, β y ω; median en forma directa una
poderosa acción antiviral), e IFN tipo II (IFNγ, modulador de la inmunidad innata y adaptativa). La
mayoría de las ¢ infectadas con virus s! IFN α/β. El IFNγ es s! por NK, Th1 y T CD8+. La
expresión de la PK dependiente de ARNdc (PKR) es inducida por los IFN α/β. Su activación lleva al
bloqueo de la s! de π y a la inhibición de la replicación viral, por fosforilación del eIF-2α. Los IFN α/β
modulan la funcionalidad de ¢ inmunes; promueven: la activación de NK, la diferenciación en Th1, la
activación de T CD8+, el > de la expresión de CMH I y II, facilitando la presentación antigénica. Las CDP
son las > productoras de IFN I. Estos también actúan como un factor que promueve la supervivencia
de las propias CDP.
Inmunidad adaptativa: los componentes críticos en la respuesta antiviral son los T CD8+ citotóxicos y
los Acs neutralizantes. Los virus pueden inducir la maduración de las CD en diferentes formas:
infectándolas, interactuando con R como TLR, o induciendo la liberación de citocinas por ¢ del tejido
infectado (IFN I o TNF-α). La presentación de péptidos virales a los LT naive por las CD es crítico en la
inmunidad antiviral, ya que de ello depende la generación de Acs específicos. La presentación cruzada por
CD se describió para diversos virus; para los que no infectan CD, o aquellos que afectan su capacidad
presentadora, sería la vía ppal implicada en la activación de LT CD8+. El tenor de moléculas coE
expresadas por las CD maduras presentes en los OLS en la mayoría de las infecciones virales resulta
insuficiente. Las CD podrán incrementar la expresión a través de su interacción con las T CD4+
específicas. A pocos días de comenzado el proceso infeccioso, ya pueden detectarse los 1º T CD8+
citotóxicos específicos en el foco. Las ¢ infectadas procesan los Ags por la vía endógena y presentan los
péptidos a través de CMH I. Los T CD8+ que llegan al foco vuelven a reconocer los péptidos para los
cuales son específicos sus TCR. Esta interacción, que no requiere moléculas coE, dispara la activación de
los mecanismos citotóxicos del T CD8+. Ello conduce a la apoptosis de la ¢ infectada y a su eliminación
por fagocitos. Luego, los LT efectores migran al bazo donde continúan proliferando, lo que provoca un 2º
pico de expansión de los T CD8+ específicos 2 días más tarde. Éstos pueden mediar una acción antiviral
sin inducir la apoptosis, mediante la producción de citocinas como IFNγ y TNF-α. // Los Ags virales en su
forma nativa, son reconocidos por el BCR de los LB vírgenes en los OLS. En las infecciones localizadas, los
Ags llegan a los GL por vía linfática, favorecidos por el edema desarrollado en el foco. En el caso de
infecciones diseminadas, también acceden al bazo. Los LB activados se expanden clonalmente, se
diferencian a plasmocitos y comienzan a s! IgM específica; mientras que otros participan en la formación
del CG. Los procesos que ocurren en él son dependientes de la colaboración Th2. Muchos virus pueden en
una 1º fase inducir una respuesta “T independiente” humoral que no requiere la colaboración Th2.
Algunos Acs pueden unirse al virus de forma tal que impiden la infección de ¢ susceptibles y por lo tanto,
la producción de progenie viral. Este proceso se denomina neutralización y es la función efectora más
importante de los Acs en la reacción antiviral. Pueden actuar de diferentes formas, los mecanismos mejor
caracterizados son los que evitan el contacto entre los ligandos expresados por el virus y sus R de
entrada, expresados por la ¢ diana. Los mecanismos de acción son: a) utilizar un Ac para bloquear el sitio
de unión del virus en el R ¢; b) Acs contra el ligando viral para la molécula coR que permite la fusión de
membranas; c) Acs reactivos contra ciertos componentes del virus pueden retrasar o impedir su ingreso
en el citosol, lo que conduce a su degradación en los lisosomas, y evita la infección ¢; d) para los virus
que acceden al citosol directamente, su redireccionamiento al endosoma impide la infección, por la
degradación de los componentes virales. Además de neutralizar, la unión de Acs a un virus puede acelerar
la eliminación mediante la interacción con RFcγ en fagocitos o favorecer la captura del virus por CD o
macrófagos, promoviendo la presentación de Ags virales a LT.
A la resolución del proceso infeccioso le sigue un período de silenciamiento asociado con la disminución de
la frecuencia de ¢ efectoras y la generación de memoria imnunitaria. La mayoría de los linfocitos efectores
muere por apoptosis; sin embargo, algunos permanecen viables durante años.
Mecanismos de evasión de la respuesta inmune:
a) interferencia en la actividad mediada por citocinas
1) evasión del sistema IFN: la mayoría de los virus codifican π antagonistas de los IFN
-producción de π homólogas al R de los IFN I
-inhibición de las vías de señalización
-antagonistas de productos de genes inducidos por IFN I
2) interferencia con otras citocinas
-al inhibir la producción de citocinas
-al codificar π homólogas de R de citocinas
-al codificar π homólogas de citocinas
b) inhibición de la actividad de las ¢ NK: algunos virus producen π homólogas a las CMH I, mediando el
silenciamiento de la actividad NK
c) interferencia en la expresión y función de las CMH: los virus desarrollan estrategias a fin de reducir la
expresión de CMH I y II, e inhiben la capacidad ¢ de presentar péptidos a LT.
d) disminución de la expresión de CD4, mediando su endocitosis (Nef) e induciendo su degradación
proteasómica (Vpu)
e) interferencia viral en la apoptosis: como algunos virus pueden inducirla en la ¢ diana, productos de
genes virales, con el fin de subsistir, actúan inhibiéndola a nivel de:
-los R de muerte
-las caspasas
-homólogos de Bcl-2
f) infección en sitios privilegiados “ocultos” a la respuesta inmune: infección latente, por ej, en neuronas
de ganglios sensoriales. Hay situaciones capaces de promover la reactivación viral: luz UV, tratamiento
con GC, estrés, etc. El virus reactivado alcanza las ¢ epiteliales por la vía axonal, donde es controlado por
la respuesta adaptativa.
g) producción de análogos de RFcγ y retención, a través de ellos, de virus infecciosos por CFD, las cuales
retienen los complejos Ag-Ac en los folículos del OLS.
h) variación antigénica: los virus pueden mutar las secuencias que codifican los epitopes reconocidos por
LT. La pérdida de estos epitopes haría que los LT efectores y de memoria no reconozcan las nuevas
variantes virales que no los expresen. Las mutantes virales pueden aparecer luego de la eliminación del
virus salvaje por el sistema inmune. Pueden también mutar las secuencias que codifican los epitopes
reconocidos por los LB, lo que lleva a que los Acs ya producidos se muestren incapaces de reconocer los
epitopes que originalmente indujeron la activación B. El virus influenza, posee un genoma de ARN
segmentado en 8 fragmentos y 2 glucoπ: hemaglutinina (HA) y neuraminidasa (NA), expresadas en la
envoltura viral, responsables de la unión del virus a los R ¢. La variación antigénica en éste caso puede
suceder por 2 mecanismos: cambios menores (drift), o mayores (shift). Los cambios menores se
producen por errores de la polimerasa viral, que no tiene actividad correctora. Los mayores, se deben a la
adquisición de nuevas π expresadas en la envoltura viral, por la segmentación del genoma, que permite la
reasociación de segmentos de distintos virus luego de la coinfección. Suele ocurrir en hospedadores no
humanos, sobre todo aves y cerdos. El virus humano podría infectar cerdos en el marco de una
coinfección con el virus aviario. Esta posibilitaría la reasociación de fragmentos genómicos de ambos virus.
Los nuevos virus muestran cambios notables en sus π de superficie y no son reconocidos por las ¢ de
memoria. Suelen provocar epidemias y pandemias graves. La recombinación es otro mecanismo que
genera variación antigénica. Puede ocurrir cuando la polimerasa cambia los moldes (copy choice) durante
la replicación, común en virus de ARN.
i) evasión del complemento: las π homólogas al RFcγ interactúan con el Fc de IgGs que han reconocido
epitopes virales y pueden bloquear los sitios reconocidos por el C1q de la VC, e inhibir su activación. Otros
virus producen π reguladoras de la actividad del complemento.
Capítulo XVI: Inmunidad antiparasitaria
Los parásitos se clasifican en protozoos y helmintos. Los protozoos son microorganismos uni¢
mayoritariamente intracelular. Los helmintos son parásitos multi¢ extracelular. Comparten características
biológicas: a) ciclos de vida complejos, con estadios en los cuales cambian su morfología, composición
antigénica y tropismo tisular; b) cronicidad de las infecciones que producen, ya que pueden permanecer
en el hospedador meses, años o toda la vida; c) algunas infecciones parasitarias pueden presentarse en
forma asintomática durante un período prolongado en el cual el agente infeccioso continúa replicándose.
Inmunidad innata
Mecanismos humorales: la VA del complemento funciona como 1º línea de defensa contra
parásitos extracelulares. Su activación induce una reacción inflamatoria local, favorece la fagocitosis de los
parásitos opsonizados y a través del CAM, induce la destrucción del patógeno. Los parásitos suelen
expresar en su superficie residuos manosa, que al ser reconocidos por la MBL (lectina que une manosa)
inician la VL del complemento. Existen otros factores solubles que actúan como 1º barrera, y son los
factores líticos específicos para tripanosomas (TFL); su actividad peroxidasa sugeriría que la lisis estaría
mediada por daño oxidativo.
Mecanismos ¢: la fagocitosis por macrófagos participa en la 1º línea de defensa contra los
protozoos. Los parásitos son captados por estas ¢, a menudo como consecuencia de la opsonización por
complemento, pero también por su interacción con otros R, como RLC. Dentro de los macrófagos, los
parásitos deben enfrentarse a la hostilidad que representa el estallido respiratorio y el microambiente de
los lisosomas. El > tamaño de los helmintos impide que sean fagocitados, pero los macrófagos pueden
intervenir en su destrucción cuando son activados por mediadores generados por la inmunidad adaptativa.
Los eosinófilos, que con frecuencia se acumulan en tejidos luego de su infección por helmintos,
intervendrían en la erradicación a través de la liberación de sus gránulos (π tóxicas) y la producción de
IRO (CCDA). El número y la capacidad citotóxica de las NK se incrementan en infecciones parasitarias. Al
ser activadas por IL-12 producen > cantidades de IFNγ y TNF-α, que actúan de modo sinérgico sobre los
macrófagos incrementando su potencialidad microbicida. Las NK pueden ejercer su acción antiparasitaria
por mecanismos clásicos de citotoxicidad. Las ¢ NKT y los LT con TCRγδ también pueden secretar citocinas
y mediar una respuesta rápida frente a las infecciones parasitarias.
*En los protozoos, los lípidos de anclaje del tipo glucosilfosfatidilinositol (GPI) constituyen un grupo
importante de PMAP. TLR2 podrían ser los RRP involucrados en el reconocimiento de GPI y en la vía de
señalización. TLR4 contribuye al control de la infección. En el helmintos, el reconocimiento de PMAP
estaría mediado por un R diferente de los TLR. Muchos gusanos poseen π altamente glucosiladas; éstas
cadenas disparan la respuesta innata. Los parásitos, como las bacterias, activan a las CPA.
Inmunidad adaptativa
Parásitos intracelulares: en relación con los mecanismos efectores mediados por T CD4+, la
secreción de citocinas cumple un papel esencial en la activación de las ¢ efectoras y/o infectadas y la
eliminación del parásito. El IFNγ induce la expresión de iNOS y la generación subsecuente de IRN por las
¢ infectadas. Los LT CD8+ son importantes para el control de infecciones en las cuales el parásito infecta
¢ no fagocíticas que expresan sólo CMH I. Parecen ser clave en la adquisición de resistencia frente a las
reinfecciones. Destruyen a las ¢ infectadas, incapaces de eliminar el parásito (Fas/FasL); permitirían la
liberación de los parásitos y su captura por ¢ fagocíticas profesionales. Los parásitos intracelulares
presentan etapas extracelulares breves, durante los períodos iniciales de la infección y al intentar invadir
nuevas ¢. En estos períodos, son susceptibles al ataque de los Acs que restringen la infección al favorecer
la captura de microorganismos por ¢ fagocíticas y /o bloquear la invasión de nuevas ¢.
Parásitos extracelulares: las estrategias son: muerte directa por mediadores tóxicos – inducción de
alteraciones en la migración parasitaria – expulsión de los parásitos de los tejidos hospedadores –
inhibición de la producción de huevos. La resistencia frente a los helmintos intestinales se correlaciona con
la capacidad de montar una respuesta Th2, mientras que la polarización a Th1 tiene efectos perjudiciales
para el hospedador. La pérdida del fenotipo resistente se acompaña por la inducción de una respuesta Th1
con producción de IFNγ e IgG2a y la inhibición de la respuesta Th2 (IgE e IgG1, eosinofilia y
mastocitosis controlada por IL-3, 4, 5, 9 o 10). Las IL-4 y 13 promueven la expulsión de los parásitos
gastrointestinales actuando sobre ¢ no linfoides, como las de la musculatura lisa intestinal, promoviendo
su contractilidad. Inducirían la hiperplasia de las ¢ de Globet, una mayor producción de moco, y cambios
en la permeabilidad del epitelio intestinal y en los procesos de absorción y secreción. La importancia de
los Acs en el control de estas infecciones ha sido evidenciada por la capacidad para transferir, mediante
suero inmune, inmunidad protectora. Como no suelen producirse niveles suficientemente altos de Acs
hasta ingresar en etapas tardías, contribuirían ppalmente a la protección frente a las reinfecciones. Un
mecanismo importante residiría en la activación de los mastocitos por los RFcεII y γ, inducida por IgE y G,
que ya hayan interactuado con Ags parasitarios. Los Acs cooperarían con eosinófilos y macrófagos en el
control de la infección mediante la CCDA.
*Mecanismos que regulan la polarización Th1/Th2: las infecciones por helmintos suelen disparar una
fuerte respuesta Th2, asociada con niveles elevados de IgE, eosinófilos y mastocitos en sangre y tejidos
afectados. La mayoría de los protozoos intracelulares inducen respuestas de tipo Th1. En la infección
experimental por Leishmania (protozoo), se relaciona un perfil Th1 (IL-12) con la resistencia a la
infección, y un perfil Th2 (IL-4, 10 y 13) con la susceptibilidad a la misma.
Mecanismos de evasión de la respuesta inmune:
a) Evasión del reconocimiento específico, por Acs o LT
- ocupando espacios donde los Acs o LT no tengan acceso
- enmascarándose o cubriéndose con Ags del hospedador (mimetismo)
- liberando de sus superficies los Ags blancos de la respuesta inmune
b) Supresión de la respuesta inmune: codificando π homólogas a citocinas humanas
c) Variación antigénica
d) Alteración de una presentación antigénica adecuada: inhibidores de cisteinproteasas, pueden bloquear
a la papaína y a endopeptidasas, involucradas en la vía exógena; inhibición del STAT-1, lleva a la
disminución de la expresión de CMH
f) Resistencia al ataque del complemento
g) Control de la disponibilidad, número y función de las ¢ efectoras inmunes: inducción de apoptosis de
linfocitos – inhibición de la actividad citotóxica de neutrófilos – etc.
h) Mediados por T supresoras: la presencia de LT CD4+ CD25+ podría ser explotada por el parásito a fin
de prolongar su supervivencia.
i) Otros mecanismos: ciertos parásitos pueden activar a los linfocitos en forma inespecífica y producir una
activación policlonal vigorosa que involucra linfocitos con diferentes especificidades. Algunos serán
reactivos contra el agente infeccioso, pero otros podrán ser autorreactivos y/o específicos para Ags no
relacionados.
Inmunopatología inducida por infecciones parasitarias: se originan en una respuesta inmune del
hospedador inapropiada, excesiva y/o no debidamente regulada. Varias moléculas efectoras, sobre todo
las asociadas con Th1, pueden ser dañinas si son producidas por mucho tiempo, en exceso o en el lugar
no apropiado. Incluyen NO, IFNγ, TNF-α, IRO e IL-1 (operan de modo sinérgico). También la respuesta
Th2 puede ser nociva: una fuerte respuesta de Acs puede conducir a la formación de niveles > de
complejos inmunes y a lesiones tisulares asociadas con su depósito.
Capítulo XVII: Inmunidad antibacteriana
Desde su nacimiento, el hombre presenta una flora bacteriana diversa asociada con la piel y las mucosas,
denominada “flora microbiana normal”, estable y que posee géneros específicos relacionados concada
región del cuerpo. La flora normal ocupa sitios de adherencia bacteriana. En su ausencia, la adherencia de
la flora patógena se favorece. Las bacterias de la flora normal producen bacteriocinas, π que inhiben el
crecimiento o destruyen bacterias patógenas. Producen también una > variedad de metabolitos con
propiedades antibacterianas, como ciertos AG (lactato y propionato) y peróxidos.
Inmunidad innata: las bacterias son incapaces de penetrar la piel intacta debido a las características de
este epitelio. Los queratinocitos producen queratina, sustancia de difícil degradación para la mayoría de
los microorganismos. La descamación del epitelio permite la eliminación mecánica de las bacterias
adheridas. El crecimiento de la mayoría de las bacterias patógenas es inhibido también por los bajos
valores de pH (~5) y de humedad de la superficie de la piel, ya que éstas suelen adaptarse mejor a un
medio con pH neutro y > tenor de humedad. Los folículos pilosos, sebáceos y glándulas sudoríparas
generan “huecos” que pueden ser utilizados por las bacterias como entrada para la colonización de los
tejidos. Para evitarlo, estas hendiduras están protegidas por lípidos que median un efecto tóxico sobre las
bacterias, y por la lisozima, capaz de degradar el peptidoglucano de la pared bacteriana. Los sistemas
respiratorio, gastrointestinal y urogenital están expuestos constantemente al ambiente exterior y a
cuerpos extraños (alimentos, partículas de polvo, etc.). En el tracto gastrointestinal, el moco representa
una barrera importante. Como se genera en forma constante, su exceso se expulsa y con él las bacterias
atrapadas. Además contiene π con función bactericida, como lisozima y lactoferrina. La IgAs del moco, se
une a los patógenos mediante su fragmento F(ab)2. y por su porción Fc puede interactuar con el moco. En
las vías aéreas, las bacterias pueden adherirse y ser eliminadas por el movimiento de los cilios. La tos y el
estornudo constituyen mecanismos adicionales de eliminación. Las vías aéreas inferiores se encuentran
protegidas por moco, lisozima, Acs secretados y ¢ fagocíticas. En el aparato urogenital, la orina arrastra
bacterias capaces de adherirse a las mucosas, mientras que su pH ácido tiende a mantener la vejiga y la
uretra libres de microorganismos. En el epitelio vaginal, la flora normal (Lactobacillus acidophilus),
produce metabolitos ácidos (lactato), que previenen su colonización por bacterias patógenas. En las
trompas de Falopio se produce moco y los cilios lo expulsan constantemente. La conjuntiva del ojo está
casi libre de microorganismos, ya que el parpadeo, la secreción de lágrimas y la > [lisozima] inhiben la
colonización. Ya en el tejido subepitelial, el patógeno deberá enfrentarse a mecanismos antibacterianos
que se expresan en forma constitutiva, como los mediados por el complemento, ¢ fagocíticas,
proteasas y Acs naturales. Se requiere la inducción de una respuesta inflamatoria, cuyo objetivo
central es el reclutamiento en el sitio de lesión de elementos ¢ y humorales capaces de erradicar el foco
infeccioso.
En relación al reconocimiento de PMAP por RRP, los PMAP bacterianos más conocidos son: LPS,
peptidoglucano, ácidos lipoteicoicos, mananos, ADN bacteriano, ARNdc y glucanos. Los RRP pueden ser:
secretados (liberados como moléculas solubles, se unen a las paredes microbianas y funcionan como
opsoninas; MBL), endocíticos (en la superficie de fagocitos y CD, favorecen el ingreso del patógeno; RLC),
o de señalización (activan vías transduccionales que inducen la expresión de genes; TLR). Tanto el LPS de
las bacterias gramnegativas como los ácidos teicoicos de las grampositivas, activan la VA del
complemento y pueden activar la VL. C5a y C3a median la respuesta inflamatoria al activar PMN,
monocitos, macrófagos, CD, eosinófilos, mastocitos, endoteliales y musculares lisas. Las ¢ fagocíticas
internalizan el patógeno opsonizado y las vesículas que los contienen (fagosomas) se fusionan con los
lisosomas para formar los fagolisosomas. Se forman IRO, y a través de éstos, y de enzimas y péptidos
antimicrobianos, la bacteria se destruye. En las 1º etapas las NK inducen la lisis de las ¢ infectadas
mediante sus sistemas citotóxicos: granzimas/perforinas y Fas/FasL.
Inmunidad adaptativa: CD y macrófagos parecen tener papeles complementarios en la inmunidad
antibacteriana. Al reconocer a su Ag específico sobre los macrófagos infectados, las Th1 los activan y les
permiten destruir la bacteria intracelular. Algunos Ags pueden activar a los LB en forma directa, sin
requerir la colaboración Th2; se los denomina “Ags T independientes”, de tipo 1: capaces de inducir la
proliferación y la diferenciación de > número de clones B, sin importar su especificidad; es decir, producen
una activación policlonal (LPS); de tipo 2: polisacáridos que poseen estructuras muy repetitivas. Las
respuestas B son específicas y proveen una respuesta rápida contra bacterias extracelulares
recubiertas por cápsulas polisacáridas que les permiten evadir su ingestión por fagocitos. La respuesta B
frente a los Ags de tipo 2 conduce a la producción rápida de Acs, que actúan opsonizando a las bacterias y
promoviendo su ingestión y destrucción por fagocitos. Estos Ags producen IgM y en < medida, IgG.
Respuesta inmune frente a bacterias extracelulares: Streptococcus pneumoniae. Provocan enfermedad
por 2 mecanismos: a) inducen un fenómeno inflamatorio en el foco infeccioso, que conduce a la
destrucción del tejido; b) mediante la acción de toxinas liberadas por ellas. Se requiere la producción de
Acs, los cuales pueden actuar neutralizando las toxinas producidas u opsonizando a las bacterias para
facilitar su fagocitosis: IgG podrá inducir la fagocitosis a través de los RFcγ; y ambos (IgG y M) luego de
interactuar con la bacteria, podrán activar la VC del complemento generando C3b.
Respuesta inmune contra bacterias intracelulares: Mycobacterium tuberculosis. Infecta fundamentalmente
a macrófagos. Luego de la infección, un << % de individuos desarrolla tuberculosis 1º, mientras que la
mayoría puede controlar la infección y permanecer en un estado de latencia, que puede persistir durante
toda la vida del hospedador y no evidenciar síntomas clínicos. La reactivación ocurre en un 5-10% de las
personas infectadas y puede asociarse con inmunosupresión inducida. Una vez inhalada, la bacteria
alcanza los alvéolos pulmonares, donde se replica dentro de los macrófagos residentes. Al ppio, éstos son
incapaces de eliminarla, lo cual permite establecer un foco pulmonar infeccioso. Durante los estadios
tempranos, los macrófagos infectados comienzan a secretar citocinas proinflamatorias como IL-1, 6, 12
y TNF-α, así como quimiocinas, las cuales reclutan neutrófilos, monocitos, LB y LT. Las ¢ reclutadas
forman el granuloma, estructura organizada compuesta de macrófagos, localizados centralmente,
rodeados por LT y B. Este ayuda a contener y prevenir la diseminación de la infección. Productos
asociados con la pared de la micobacteria (lipomananos, fosfatidilinositol manósidos) son reconocidos por
el TLR2 del macrófago. La unión induce una cascada de señalización que lleva a s! TNF-α, IL-8 y 12, y a la
secreción de ON. La infección induce un patrón complejo de activación en el macrófago que involucra
también a TLR4, CR1, 3, 4 y SR-A. Los Ags de micobacterias son presentados por CMH I y II, y también
por CD1, para Ags lipídicos y fosfatidilinositol manósidos, activando LT restringidos a CD1, que s! IFNγ y
son citotóxicos para macrófagos infectados. M. tuberculosis disminuye la expresión de CD80, afectando la
presentación antigénica. Su eliminación depende del éxito de la interacción entre macrófagos infectados y
Th1 (productores de IFNγ). Las citocinas Th2 inhiben la producción de IFNγ y la activación de los
macrófagos. Los LT CD8+ tienen una participación importante en la fase crónica de la infección. Pueden
funcionar como un recurso adicional para la producción de citocinas Th1 o pueden eliminar macrófagos
infectados. Antes que aparezca la respuesta adaptativa, las NK son las ppales productoras de IFNγ, ya
sea en respuesta a IL-12 o directamente, por exposición a la micobacteria.
Respuesta inmune contra una bacteria extra e intracelular: Bordetella Pertussis. La infección producida
por esta bacteria gramnegativa causa tos convulsa, una enfermedad severa que afecta a los niños, cuyas
complicaciones pueden incluir convulsiones, encefalopatía, daño cerebral permanente y muerte. Esta
bacteria produce toxinas (toxina pertussis, citotoxina traqueal) y AC, y presenta LPS. Produce otros
factores de patogenicidad, como la hemaglutinina filamentosa y la pertactina. Posee fimbrias que
contribuyen a su supervivencia en el tracto respiratorio, al mediar su adherencia a ¢ epiteliales,
macrófagos y neutrófilos. No sólo se multiplica extracelularmente, sino que también es fagocitada por
macrófagos, en los cuales puede sobrevivir. Los Acs pueden neutralizar a las toxinas bacterianas e inducir
la fagocitosis a través de los RFcγ expresados por macrófagos y neutrófilos, o inhibir la unión de las
bacterias extracelulares al epitelio respiratorio. La fagocitosis de B. pertussis por neutrófilos es
estrictamente dependiente de la opsonización por Acs IgG. Es sensible a la muerte por activación de la VA
del complemento y por Acs anti-LPS. La capacidad bactericida de Acs anti-LPS es inducida por la VC del
complemento. La infección en humanos induce la producción de IgAs que inhibe la adherencia de la
bacteria. La infección por B. pertussis tiene una fase intracelular. Esta localización dual es compatible con
la observación de que se necesita la inducción de una respuesta inmune humoral y ¢ a fin de erradicarla.
La infección induce LT específicos para distintos Ags de B. pertussis, que producen un perfil de citocinas
Th1 característico. Esta respuesta Th1 resulta importante en la protección contra infecciones posteriores.
La infección induce una respuesta Th1 sistémica que puede detectarse en las ¢ mononucleares de la
sangre periférica durante la fase convaleciente de la tos convulsa en los niños.
Mecanismos de evasión a la respuesta inmune:
a) evasión del complemento: la cápsula y la presencia de la gruesa capa de peptidoglucano que poseen
las bacterias grampositivas inhiben el ensamblado del CAM.
b) variación antigénica: en la cápsula bacteriana de bacterias grampositivas y negativas. Modificaciones
en el LPS bacteriano alteran su inmunogenicidad; también en π de superficie asociadas con la pared ¢, de
la membrana externa y lipoproteínas de superficie.
c) producción de enzimas: proteasa de IgA
d) TLR: la lipoproteína de M. tuberculosis inhibe el > de expresión de CMH II y de RFcγI, luego de su
reconocimiento por TLR2. También algunas bacterias lo usan para inducir la liberación de IL-10.
e) manipulación de los ligandos de TLR: producen un lípido A del LPS que posee una capacidad reducida
para estimular respuestas inflamatorias eficaces contra el patógeno.
f) evasión de la fagocitosis y destrucción por fagocitos: M. tuberculosis muestra una > supervivencia
luego de su unión a CR1. Las cepas virulentas son resistentes a los efectos del anión peroxinitrito (NO +
O2·-). Detiene la maduración de fagosomas y mantiene un ambiente propicio para su persistencia,
alterando la composición proteica.
g) modulación del procesamiento y presentación antigénica: algunas bacterias inhiben la expresión de
CMH I o II e inducen su secuestro intracelular mediante la secreción de proteasas que degradan FT
requeridos para la s! de esas moléculas.
h) modulación del procesamiento y presentación mediante CD1: M. tuberculosis disminuye la expresión de
CD1 en las CD.
i) efectos (-) sobre LT: en macrófagos, las micobacterias inducen la producción de IL-10 y TGF-β.
Capítulo XVIII: Inmunodeficiencias
IDP: reconocidas como un grupo heterogéneo y poco frecuente de enfermedades genéticas. Dado que son
poco frecuentes, en todos los casos deben tenerse en cuenta otras causas predisponentes de infecciones
recidivantes; entre éstas: enfermedades metabólicas, malformaciones estructurales, y tratamiento con
inmunosupresores. Las infecciones pueden ser tanto la causa como la consecuencia de una ID, y
constituyen una manifestación clínica fundamental. Están representadas por alteraciones cuantitativas y/o
cualitativas que comprometen en forma individual o combinada a los componentes del sistema inmune:
sistemas B o humoral, T o celular, fagocítico y complemento. Como son enfermedades congénitas o
hereditarias, sus manifestaciones clínicas se presentan temprano en la infancia. La > incidencia en
varones se explica porque un grupo de éstas tiene una transmisión ligada al cromosoma X. La repetición
de infecciones en un mismo sitio es sugestiva de alteraciones locorregionales más que de ID. El tipo de
gérmenes prevalecientes encada paciente guarda relación con el tipo de ID que éste padece. Las ID
humorales desarrollan prevalentemente infecciones bacterianas y por ciertos virus, y no fúngicas o
parasitarias. El aparato respiratorio y sus anexos son los más comprometidos. Los pacientes son
propensos a padecer sinusitis, otitis supuradas, bronquitis y neumonías. Las infecciones recidivantes del
parénquima pulmonar suelen conducir al desarrollo de bronquiectasia. Otras localizaciones son el aparato
digestivo, la piel y el SNC. La diarrea crónica y la malabsorción pueden producir retraso pondoestatural.
La diseminación de las infecciones (sepsis) es frecuente. La deficiencia en ¢ TR parece asociarse con el
desarrollo de enfermedades autoinmunes o neoplásicas observado en pacientes con IDP.
Laboratorio: los estudios se agrupan en 2 niveles de complejidad: el 1º nivel incluye estudios cuantitativos
y funcionales de screening o tamizaje. Corresponden a análisis sencillos con los cuales es posible definir el
tipo y grado de ID, así como orientar la conducta terapéutica: determinación de niveles séricos de Igs,
recuento de LB por CF, búsqueda de Acs preexistentes en respuesta a vacunas o infecciones previas,
hemograma con recuento y fórmula, determinación de la expresión de marcadores T por CF, pruebas de
hipersensibilidad retardada a Ags, estudio de mecanismos microbicidas O2-dependientes (NBT, DHR,
quimioluminiscencia), análisis de expresión de moléculas de adhesión, expresión de moléculas de linaje
NK, determinación cuantitativa de C3, C4 y C1 estearasa; actividad lítica del complemento. Los estudios
del 2º nivel son más complejos: determinación de Acs antineumocócico en respuesta a la inmunización
activa, cuantificación por CF de expresión de CD27 e IgD en LB; determinación de subclases de Igs;
búsqueda de mutaciones en genes responsables de inducir una IDP de Acs; respuesta proliferativa a
mitógenos y a Ags; determinación de citocinas, estudios de actividad enzimática; análisis de mutaciones
genéticas, determinación cuantitativa y funcional de los restantes componentes e inhibidores del
complemento; estudios de leucotaxis, determinación de actividad bactericida, evaluación de la vía de
señalización del IFNγ, actividad citolítica sobre ¢ K562, etc.
Clasificación de las IDP:
Deficiencia de la respuesta adaptativa: involucra defectos moleculares que determinan frenos en la
diferenciación de los LT, B o ambos. La clasificación tiene en cuenta la fase efectora de la respuesta
inmune que se halla afectada:
a) ID con deficiencias de Acs: agammaglobulinemia ligada al sexo – síndrome de hiper IgM – deleciones
que afectan genes que codifican las cadenas H de las Igs – mutaciones en la cadena κ – deficiencia
selectiva de subclases de IgG, con/sin deficiencia de IgA – deficiencia de Acs con niveles normales de Igs
– ID común variable – deficiencia de IgA – hipogammaglobulinemia transitoria de la infancia–
agammaglobulinemia autosómica recesiva.
Agammaglobulinemia ligada al sexo (ALX, enfermedad de Bruton): se debe a mutaciones en el gen
BTK ubicado en el brazo largo del cromosoma X, que se expresa en todas las ¢ mieloides y del linaje B,
con excepción de las ¢ plasmáticas, los LT y las NKT. Esta enzima posee homología con la flia Src de TK.
Participan en la transducción intracelular de señales fosforilando residuos tirosina en π citoplasmáticas y
de membrana. La π Btk interviene en distintos pasos madurativos del LB, en especial en la expansión de
los precursores pre-B. También participan en la supervivencia y activación de los LB maduros. Es común
encontrar en MO más de un 80% de L pro-B, junto con << pre-B, cuando normalmente, no deberían
superar el 20%. Pueden presentar hasta un 2% de LB en sangre periférica, con fenotipo funcionalmente
inmaduro (CD38+ e IgM+), lo que implica que, aún pudiendo sobrepasar el estadio pre-B, no pueden
alcanzar un estadio B maduro funcional. El freno observado en la MO se asocia con la depleción de los
folículos linfoides y CG, lo cual determina la ausencia de GL palpables o amígdalas palatinas visibles. Se
presenta sólo en los varones, y sus manifestaciones clínicas comienzan a desarrollarse entre los 9-12
meses de vida. Las infecciones que sufren suelen ser bacterianas: sinusitis, otitis, bronquitis, neumonías
y, en ocasiones, formas más graves, como meningitis y sepsis. El pronóstico es bueno si se hace un
diagnóstico precoz y se instituye tratamiento preventivo de las infecciones recurrentes con
gammaglobulina IV.
b) ID combinadas:
Severa T (-) B (+): ligada al X (cadena γc) o autosómica recesiva (JAK3)
Severa T (-) B (-): deficiencia de RAG1/RAG2, deficiencia de Artemis, ADA, disgenesia reticular
Severa T (+) B (-) : sme de Ommen, deficiencia de cadena α del R de IL-2
Deficiencia de PNP, CMH II, CD3, ZAP-70, TAP1/TAP2
Constituyen un conjunto de smes de transmisión genética autósomica recesiva o ligada al sexo, que se
presentan en los 1º meses de vida y que, de no ser enérgicamente tratados, llevan a una muerte
temprana. Las formas clásicas o típicas se presentan con una importante linfopenia T,
agammaglobulinemia y ausencia de función inmune celular y humoral. Las mutaciones en la cadena γ
común (γc) constituyen el 50% de los casos de IDCS. Ésta forma parte de los R para: IL-2, 4, 7, 9, 15 y
21. La deficiencia de respuesta a IL-7 en pacientes con mutaciones en γc desempeñaría un papel crítico
en la proliferación temprana y la supervivencia de LT inmaduros en el timo. Los niños con mutaciones en
γc tienen un timo escaso o nulamente desarrollado, sin diferenciación corticomedular y con escasez de
precursores linfoides y de corpúsculos de Hassal. Los LB, a pesar de no estar disminuidos, son
funcionalmente anormales al ser incapaces de concretar el cambio isotípico de las Igs. Jak3 es la TK
asociada con la γc y de ella depende la transducción de señales de los R que comparten esta cadena. Por
lo tanto, pacientes con mutaciones del gen Jak3 comparten el mismo fenotipo que los deficientes en γc.
La IDCS ligada al X, T (-) NK (-) B (+) constituye prácticamente el otro 50%. Suelen presentarse con:
infecciones graves por gérmenes saprófitos (Candida) – diseminación hematógena de agentes vaccinales
(BCG) – ocasionalmente desarrollan “injerto contra el huésped maternofetal”. En éste ultimo, las ¢
inmunocompetentes maternas transferidas al niño en el parto reconocen a éste como extraño y
reaccionan contra sus Ags HLA. 3 condiciones tienen que darse para su desarrollo: donante
inmunocompetente (madre) – receptor inmunodeficiente (niño con IDCS) – diferencias entre sus HLA. El
diagnóstico de IDCS ligada al sexo se basa en: ausencia de LT [T (-) NK (-)], presencia de LB [B (+)],
respuesta proliferativa deficiente en el cultivo de linfocitos frente a mitógenos o Ags. El trasplante de
precursores hematopoyéticos y la terapia génica son las opciones terapéuticas para estos pacientes. Las
formas atípicas o no clásicas de IDCS pueden presentarse con recuentos de linfocitos normales y grados
variables de hipogammaglobulinemia, deficiencia de expresión de CMH I o II. Como los LB y los monocitos
expresan estas moléculas en forma constitutiva, la falta de expresión, aún luego de estimulación in vitro
con IFNγ permite el diagnóstico de esta IDP. El número de LT totales es normal, con < LT CD4. La falta de
CMH II en el timo lleva a un defecto en la selección (+). El defecto molecular se localiza en moléculas que,
al unirse al promotor del gen, regulan su transcripción. Los linfocitos de estos individuos conservan la
capacidad de mediar una respuesta proliferativa frente a los mitógenos.
c) Smes bien definidos: de Wiskott-Aldrich, de DiGeorge, ataxia telangiectasia, ID con síndrome
linfoproliferativo (p. ej. deficiencias en la vía Fas)
Síndrome de Wiskott-Aldrich: trastorno recesivo ligado al X, caracterizado por trombocitopenia,
eccema, función inadecuada de ¢ T y B, y aumento de la sensibilidad a las infecciones virales, bacterianas
y fúngicas y al cáncer.
Ataxia telangiectasia: enfermedad genética infrecuente que afecta al metabolismo de las
inmunoglobulinas y que se transmite con carácter autosómico recesivo. Suele comenzar en la infancia y
progresa lentamente, produciéndose una degeneración cerebelosa progresiva, con infecciones
sinopulmonares recurrentes. Las telangiectasias son más llamativas en la piel y en las conjuntivas.
Síndrome de DiGeorge: también conocido como CATCH 22, es causado por una deleción en el brazo
largo del cromosoma 22, que afecta varios genes simultáneamente (síndrome de genes contiguos).
Genera: defecto en la embriogénesis de los arcos faríngeos 3º y 4º (hipoplasia o aplasia tímica y
paratiroidea) – compromiso del 6º arco (cardiopatías congénitas conotroncales) – afectación de los arcos
1º y 2º (anomalías faciales: micrognatia, hipertelorismo ocular e implantación baja de los pabellones
auriculares). El compromiso inmunitario no siempre está presente. A los pacientes que lo presentan se los
llama “DiGeorge completos”: linfopenia de T CD4+, respuesta proliferativa deficiente frente a mitógenos y
aumento de LB en sangre periférica.
Deficiencias de la respuesta innata
a) Deficiencias del complemento
1) de C1, C4 y C2 (VC). Suelen asociarse con enfermedades autoinmunes (lupus eritematoso sistémico,
glomerulonefritis o vasculitis cutáneas), y con menor frecuencia, con > susceptibilidad a padecer
infecciones por cocos grampositivos (estrepto y estafilo).
2) de C3. Infecciones por cocos grampositivos y, con < frecuencia, enfermedades autoinmunes
3) de los componentes de la VFC (C5 a 9) y de las pp que regulan el complemento: factor I, H y
properdina. Predisposición para infecciones por Neisseria meningiditis.
4) de C1inhibidor. Su deficiencia genera angioedema hereditario: enfermedad autosómica dominante
caracterizada por la activación espontánea del complemento. Origina un edema que no se acompaña por
enrojecimiento, calor o prurito. Los sitios comprometidos con > frecuencia son las extremidades, la cara,
el intestino y la epiglotis. El hallazgo de niveles normales de CH50 y AP50 permite descartar todas las
deficiencias 1º del complemento. Estas enfermedades –salvo el angioedema, y la deficiencia de
properdina (recesiva ligada al X)- se transmiten en forma autósomica recesiva y puede detectarse al
portador heterocigoto porque su suero contiene el 50% de los niveles normales del componente deficiente
(haploinsuficiencia).
b) Deficiencias de los fagocitos: neutropenia congénita severa, neutropenia cíclica, deficiencia de
moléculas de adhesión tipo I o II (LAD), síndrome de Chediak-Higashi, deficiencia de gránulos específicos,
síndrome de Schwachman-Diamond, enfermedad granulomatosa crónica (ligada al X o autosómica
recesiva), deficiencia de G6PDH, deficiencia de MPO, deficiencias de la vía del IFNγ/IL-12
Pueden clasificarse en cuantitativas o funcionales. Entre las 1º, están las neutropenias, 1º o 2º. Las 1º
son excepcionales y suelen obedecer a deficiencias de producción en la MO. Las 2º son mucho más
frecuentes y su origen puede reconocerse en la presencia de infecciones (freno en MO). Las enfermedades
linfoproliferativas, con/sin invasión de la MO, el tratamiento con citostáticos o la presencia de Acs
antineutrófilos son otras causas de neutropenia 2º. Las deficiencias funcionales incluyen diversos
síndromes: a) falta de respuesta a estímulos leucocitarios cuya consecuencia es una alteración en la
movilidad o adherencia de las ¢ fagocíticas; b) incapacidad de ingerir microorganismos o de lisarlos por
alteraciones en las vías dependientes o independientes del O2.
LAD: trastorno congénito autosómico causado por una molécula de integrina (CD18) defectuosa que es
importante para la adhesión celular. Este defecto origina que los neutrófilos sean inmóviles e incapaces de
realizar la fagocitosis. Los pacientes con LAD tienen infecciones bacterianas recurrentes y dificultad en la
cicatrización de heridas, lo que puede conducir a necrosis y gangrena.
Enfermedad granulomatosa crónica: una deficiencia en el sistema NADPH oxidasa origina la
incapacidad de generar IRO. Este complejo enzimático está constituido por componentes de membrana
(gp91phox + p22phox= citocromo b558), y citosólicos (p47phox, p67phox, p40 y Rac). La activación química o la
fagocitosis promueven la translocación de los componentes citosólicos a la membrana de los fagocitos
donde se ensambla el sistema NADPH oxidasa. Las mutaciones en el gp91 phox generan una enfermedad
ligada al sexo que corresponde a los 2/3 de los casos de EGC. El 1/3 restante corresponde a la suma de
las mutaciones de las otras 3 subunidades, que dan lugar a formas recesivas. La manifestación clínica es
la infección recidivante de la piel y del TCS y pulmonar causada por gérmenes catalasa+. Es frecuente la
formación de granulomas en las vísceras. Las manifestaciones clínicas suelen ser de comienzo temprano.
Antibióticos, antifúngicos e IFNγ subcutáneo conforman la tríada sobre la que descansa la profilaxis de
estos pacientes. El diagnóstico se centra en determinar si las ¢ fagocíticas son capaces de mediar el
estallido respiratorio; a través de la reducción del colorante nitroblue tetrazolium (NBT) y la oxidación de
la dihidrorodamina (DHR) por CF.
ID asociadas o 2º a otros smes congénitos o hereditarios
a) Asociadas con inestabilidad cromosómica o defectos en la reparación del ADN, defectos cromosómicos,
esqueléticos, dermatológicos o metabólicos
b) Otros defectos: sme de hiper IgE, candidiasis mucocutánea crónica con poliendrocrinopatía y displasia
ectodérmica autoinmune (APECED), y síndrome de desregulación inmune con poliendocrinopatía y
enteropatía ligado al X (IPEX).
Tratamiento de las IDP:
-Tratamiento sustitutivo con gammaglobulina: para deficiencias de la inmunidad humoral. Se da GGIV o
IM. Se intenta reponer la función de los Acs y no la cantidad de Igs deficitarias.
-Transplante de precursores hematopoyéticos: para las IDCS
-Tratamiento con citocinas y otros inmunomoduladores: para ID que comprometen a los fagocitos
IDS o adquiridas: son mucho más frecuentes y pueden agruparse en: a) asociadas o consecuencia de
enfermedades capaces de alterar el sistema inmune de manera cuali/cuantitativa; b) provocadas por el
uso de citostáticos e inmunosupresores. En relación con las 1º, una de las causas más frecuentes de IDS
en la infancia en nuestro medio es la desnutrición caloricoproteica, que determina alteraciones en la
respuesta inmune ¢. Las infecciones recidivantes son la mayor causa de morbimortalidad en estos
pacientes. Los tumores malignos en etapa avanzada y las enfermedades linfoproliferativas suelen
asociarse con ID. Las leucemias linfáticas crónicas suelen presentar hipogammaglobulinemia, que se
acompaña por una deficiencia de la respuesta humoral e infecciones recidivantes causadas por gérmenes
encapsulados. Los pacientes con linfoma de Hodgkin presentan alteraciones en la respuesta ¢. Las
enfermedades asociadas con pérdida de pp conducen a IDS humorales (síndrome nefrótico o enteropatías
perdedoras de π). Distintas infecciones, en especial virales, como sarampión, CMV, hepatitis virales,
mononucleosis infecciosa o rubéola, producen alteraciones de la respuesta inmune que posibilitan el
desarrollo de infecciones por otros microorganismos. Ejs: IDS a esplenectomía. En relación a las 2º, se
usan citostáticos e inmunosupresores para el tratamiento de tumores malignos, enfermedades
autoinmunes o como forma de prevenir el rechazo de un órgano transplantado. Los fármacos utilizados
son citotóxicos para los linfocitos y fagocitos maduros, y para sus precursores. La quimioterapia se
acompaña siempre por un período de ID con mayor riesgo de morbimortalidad por infecciones. La
ciclosporina A produce inmunosupresión inhibiendo la transcripción del gen que codifica la IL-2, afectando
ppalmente a los LT.
HIV: cualquier ¢ que exprese CD4 es pasible de ser infectada por este virus. Esto incluye, además de los T
CD4+, a algunos macrófagos y ¢ gliales. La caída del número de LT CD4+ es un marcador, junto con el
desarrollo de síntomas propios de la progresión de la enfermedad. Las ¢ TR CD4+ CD25+, al modular la
respuesta de los T CD4+ a los Ags del HIV, limitarían la activación de estas ¢ y en consecuencia, la
replicación del virus en ellas.
Capítulo XIX: Hipersensibilidad
Las reacciones de hipersensibilidad son trastornos causados por una disfunción en la regulación del
sistema inmune. Incluyen: a) enfermedades autoinmunes, en las cuales la respuesta está dirigida contra
Ags propios, y b) respuestas carentes de una regulación adecuada contra Ags foráneos, las cuales se
tratarán en este capítulo.
Hipersensibilidad de tipo I: son reacciones mediadas por IgE, denominadas “reacciones alérgicas”. Se
caracterizan por montar una respuesta inmune contra un Ag inocuo que produce daño tisular. Un individuo
que ha producido Acs IgE frente a un Ag inocuo, o alergeno, al encontrarse nuevamente con él, induce
la activación del mastocito residente en el tejido expuesto, lo que desencadena una cascada de eventos
característica de los procesos alérgicos. Se manifiesta con inflamación tisular y disfunción orgánica. Los
individuos atópicos presentan una predisposición para producir IgE en respuesta a diferentes Ags
ambientales. Desarrollan una o más enfermedades de esa naturaleza: rinitis alérgica, asma alérgica,
eccema atópico, entre otras. Los Ags ambientales que selectivamente evocan una respuesta inmune de
tipo Th2 con producción de IgE suelen definirse como alergenos: son π de < PM, poseen actividad
enzimática (casi siempre son proteasas), presentan alta solubilidad y estabilidad, son capaces de
desencadenar reacciones de hipersensibilidad I, aún en < [ ]. Como suelen ser π ambientales, los órganos
afectados con > frecuencia son la piel y los tractos respiratorio y gastrointestinal. Los alergenos más
comunes provienen de ácaros, pelo de gato, árboles, gramíneas, polen, látex y maní. Todos los individuos
están expuestos en forma permanente a éstos y normalmente responden generando una respuesta
inmunitaria caracterizada por la producción de < tenores de IgG1 y 4, asociada con el desarrollo de una
respuesta Th1. En cambio, las personas atópicas generan una respuesta caracterizada por producción de
IgE alergenoespecífica. En la fase temprana o reacción alérgica aguda, el ppal efector es el mastocito; se
observan en la piel máculas/pápulas eritematosas y prurito; en las vías aéreas superiores, congestión
nasal y rinorrea acuosa, y en las inferiores, broncoespasmo. La fase tardía presenta su máxima expresión
6-9 horas después de la exposición al alergeno, para luego resolverse lentamente, aunque puede
perpetuarse provocando inflamaciones crónicas. Las ppales ¢ efectoras son eosinófilos y Th2. Las
manifestaciones son: edema indurado y eritema en piel, congestión con bloqueo nasal y BC en vías aéreas
superiores e inferiores. Ante el 1º contacto con el alergeno, el individuo atópico desarrolla una secuencia
de eventos que genera un estado de sensibilización. El alergeno es capturado, procesado y transportado
por las CD al GL donde es presentado a los LT CD4+, lo que induce una respuesta Th2 que conduce a la
producción de IgE específica. La IgE difunde y se une a través de sus R a basófilos y mastocitos tisulares.
Ante una nueva exposición al alergeno, éste se une a la IgE presente sobre basófilos y mastocitos. Se
induce el entrecruzamiento del R (es importante que el alergeno sea polivalente) y ésto desencadena una
cascada de señales intracelulares que culmina con la liberación de mediadores preformados almacenados
en los gránulos, y neosintetizados. Al activarse, el mastocito libera citocinas, quimiocinas e histamina;
mediadores lipídicos (LTs y PGs), y PAF, que alteran la homeostasis del órgano diana. Son responsables de
inducir: contracción del músculo liso bronquial e intestinal, VD, aumento de la permeabilidad vascular e
hipersecreción de moco. Los mastocitos también expresan triptasa, una proteasa neutra que activa R
ubicados en la superficie de las ¢ endoteliales y epiteliales, e induce una amplificación de la reacción
inflamatoria. Una de las características de la fase tardía y de la inflamación crónica es la acumulación de
eosinófilos en el órgano diana. Según el tejido se manifestarán diferencias en el reclutamiento de
poblaciones leucocitarias. Citocinas producidas por las Th2 (IL-4, 5, 9 y 13), junto con otros mediadores,
serían los responsables de perpetuar la respuesta inflamatoria.
Mastocitos: se diferencian de CMHP CD34+ bajo la influencia de IL-3 y SCF en MO. El SCF es producido
por ¢ estromales. Sus precursores migran a los tejidos donde son retenidos para culminar su
diferenciación a expensas de FC locales. Suelen ubicarse en la mucosa y submucosa de los tractos
gastrointestinal y respiratorio, en la piel y los OL. Pueden estar asociados a mucosas (triptasa+) o al TC
(triptasa+ quimasa+). [Los basófilos se diferencian a partir de precursores bajo la influencia de IL-3, 5
y GM-CSF. TGF-β, en presencia de IL-3, favorece la diferenciación a basófilos]. Expresan el RFcεI en
forma constitutiva, y pueden ser activados por la unión del Ag a la IgE asociada con éste R. Hay 2 tipos de
R para el Fc de la IgE: RFcεI (> afinidad) y II (< afinidad). El RFcεI es el responsable de mediar los
efectos biológicos de la IgE en reacciones de hipersensibilidad I. La forma clásica es un tetrámero αβγ2: α
es responsable de unir a la IgE; β, de incrementar la estabilidad de la unión e inducir una amplificación en
la cascada de señalización; y γ, de activar las cascadas. La interacción de IgE con RFcεI, en ausencia del
Ag, y por lo tanto en ausencia de agregación de los RFcεI, promueve la supervivencia de los mastocitos, e
incrementa la expansión de los RFcεI. Los mastocitos pueden ser activados directamente por numerosas
sustancias biológicas: neuropéptidos, quimiocinas, C5a. Macrófagos, LT, eosinófilos y mastocitos liberan
neurotrofinas, como la neurotrofina-3 o el NGF, que estimulan la liberación de neuropéptidos por las
terminaciones nerviosas sensitivas y las ¢ inflamatorias. Estos neuropéptidos, como sustancia P,
neurocinina A, SST y VIP, median acciones características de las reacciones alérgicas: VD, >
permeabilidad vascular, hiperreactividad bronquial e hipersecreción de moco. Producen además la
activación de los mastocitos de la mucosa bronquial, con la consecuente liberación de histamina. El
entrecruzamiento del R también activa a la AC, induciendo aumento del AMPc, que activa a a la PKA. Esta
inhibe la desgranulación del mastocito constituyendo un feedback (-) de relevancia farmacológica. Así,
epinefrina o agonistas β2-adrenérgicos inducen la activación de la AC, en tanto que la teofilina inhibe a las
fosfodiesterasas. Los R inhibitorios se expresan en mastocitos, basófilos y eosinófilos. Entre ellos se
destaca el RFcγIIB.
Mediadores liberados:
Histamina: la ppal fuente son mastocitos y basófilos. Induce la contracción del ML bronquial e
intestinal, pero relaja el ML vascular. Dilata los vasos sanguíneos de < calibre, lo que se manifiesta por
hiperemia, disminución de la RPT e hipotensión arterial. Induce un > de la permeabilidad capilar, con la
consecuente formación de edemas. Estimula terminaciones nerviosas de diverso tipo, lo que desencadena
prurito y dolor. Es un estímulo eficaz para la secreción de ácido en el estómago mediante la activación de
los R H2. Si se inyecta en la dermis desencadena una “respuesta triple”, que consiste en: a) una zona de
rubor alrededor del sitio de inyección, de escasos mm de diámetro, que surge en segundos, consecuencia
de la VD directa inducida; b) hiperemia intensa o eritema, de 1 cm de diámetro, que surge más
lentamente y es 2º a la estimulación de los reflejos axónicos; c) una roncha o pápula, que ocupa el mismo
área que el eritema, y se observa luego de 2’, consecuencia de la formación del edema. Puede ejercer
diversas funciones inmunorreguladoras, según el subtipo de R y el tejido involucrados; puede suprimir
ciertas respuestas inmunes, a través del RH2, o activar otras, por medio del H1. La acción de la histamina
afectaría el balance Th1/Th2: los Th1 expresan predominantemente el H1 en tanto que los Th2 muestran
H2. La estimulación del H1 favorece la diferenciación de T CD4+ en Th1, en tanto que la estimulación
del H2 promueve su diferenciación a un perfil tolerogénico (TR). Induce la producción de IL-8 por ¢
endoteliales y contribuye a la progresión local de la respuesta alérgica a través de la inducción de IL-1α,
IL-1β, IL-6 y RANTES. En monocitos estimulados por productos bacterianos, inhibe la producción de IL-1 y
12, y TNF-α, pero incrementa la secreción de IL-10 y 1α, a través de la estimulación del H2. Induce la
maduración de las CD, que median preferencialmente la inducción de respuestas Th2. RH1 y 3 median la
polimerización de actina y estimulan la migración de CD inmaduras. En las CD, por medio de RH2,
estimula la secreción de IL-10 e inhibe la de IL-12.
Mediadores lipídicos: derivados del metabolismo del AA, que se generan a través de la vía de la CO y
la LO. La PGD2 induce VD y BC, y promueve la quimiotaxis de los neutrófilos. El LTB4 y sus productos de
degradación –LTD4 y E4- se unen a R sobre las ¢ del ML y producen BC persistente. Estimulan la
secreción de moco y aumentan la permeabilidad vascular. El PAF tiene importante efecto BC, incrementa
la permeabilidad vascular y ejerce un efecto quimiotáctico sobre neutrófilos, eosinófilos y monocitos.
Proteasas neutras y proteoglucanos: las proteasas neutras de serina son las más abundantes en los
gránulos del mastocito, entre las que se destaca la triptasa. La presencia de triptasa en los líquidos
biológicos se interpreta como un marcador de activación del mastocito. Funciones: escisión de fibrinógeno
y activación de colagenasa; inducción autocrina de la liberación de histamina, activación de eosinófilos e
inducción de la producción de IL-8 y 6, estimulación de la proliferación de fibroblastos. Los gránulos de los
mastocitos también poseen carboxipeptidasa A, catepsina G e hidrolasas ácidas. Estas cumplen un papel
relevante en la remodelación tisular. Los basófilos contienen la MBP, encontrada también en eosinófilos.
Mastocitos y basófilos producen proteoglucanos, como CS, mientras que la heparina es producida sólo por
mastocitos.
Citocinas: IL-1, 3, 4, 5, 6, 8, 10, 13, 15, 16, TNF-α, TGF-β, quimiocinas, GM-CSF, VEGF, PDGF.
Eosinófilos: se diferencian en la MO a partir de CMHP y comparten luego un precursor común con el
basófilo. Las citocinas que desempeñan un papel importante en su desarrollo son IL-3, 5 y GM-CSF. La
IL-5 es la responsable de su liberación de la MO a la periferia. Suelen ubicarse en piel y mucosas, y
cumplen un papel relevante en el desarrollo de procesos alérgicos, ya que producen daño al epitelio
respiratorio y al ML bronquial y potencian la reacción inflamatoria local. El rolling es mediado por la
interacción de P-selectina con su ligando PSGL-1. La exposición a diversos quimioatractantes incrementa
la afinidad de la integrina VLA-4 por VCAM-1, expresada en el endotelio, lo que permite la adherencia
estable y luego la extravasación. Los quimioatractantes para eosinófilos son: LTB4, PAF, MCP-3, 4, MIP-1α
e IL-16; ninguno es selectivo. Las quimiocinas eotaxina-1, 2 y 3 son relativamente específicas e
interactúan con CCR3. Una vez que el eosinófilo accede al tejido inflamado, puede permanecer allí por
períodos prolongados, donde pone en juego un conjunto de mecanismos promotores de la inflamación.
Sus gránulos contienen MBP, π catiónica del eosinófilo, neurotoxina y peroxidasa. Al liberarse, la π
catiónica actúa sobre ¢ del entorno e induce la formación de poros que alteran la permeabilidad de la
membrana ¢ y conducen a su muerte. La MBP incrementa la reactividad del ML tras inducir la disfunción
del R muscarínico M2 y desencadena la desgranulación de mastocitos y basófilos. Los eosinófilos
contribuyen también a la lesión tisular mediante la producción de ERO generados por el estallido
respiratorio. Producen LTs, lipoxinas, PAF, citocinas y quimiocinas.
Papel de las ¢ TR: los procesos alérgicos se asociarían con un defecto en la actividad supresora ejercida
por ¢ TR sobre el desarrollo de respuestas Th2. Normalmente estas ¢ desempeñarían un papel importante
en los mecanismos tolerogénicos frente a los alergenos. La tolerancia periférica frente a alergenos
ambientales sería mediada por deleción o anergia clonal de las T alergenoespecíficas, y/o la actividad
supresora mediada por las TR.
Factores genéticos: los trastornos alérgicos parecen estar influidos por polimorfismos en varios locus
genéticos. La predisposición a producir IgE específicos para alergenos se asocia con alelos particulares del
CMH. Las técnicas utilizadas incluyen: a) aproximación a genes candidatos, mediante la búsqueda de
polimorfismos en genes conocidos y b) clonación posicional, que relaciona la herencia de una región
cromosómica con la de una enfermedad.
Enfermedades alérgicas:
Anafilaxia: reacción alérgica severa ocasionada por la liberación sistémica de histamina y otros
mediadores farmacológicos. Ciertos alergenos, en especial los provenientes de fármacos, látex, venenos
de insectos y alimentos (maní, nueces, legumbres, chocolate, huevo, pescados, lácteos) pueden inducir
una respuesta de hipersensibilidad de tipo I y ocasionar shock anafiláctico. Los alergenos que ingresan en
la sangre inducen la activación de mastocitos asociados con el TC en todo el organismo, lo que provoca la
liberación sistémica de mediadores y anafilaxia. Si se administra por vía subcutánea, activa los mastocitos
del TC local y ocasiona una reacción localizada; si ingresa por vía inhalatoria o por la mucosa
gastrointestinal, induce la activación de mastocitos asociados con la mucosa, lo que provoca la
contracción del ML bronquial y el aumento de la secreción de moco o la contracción del ML intestinal y
vómitos, respectivamente. Las manifestaciones son: hipotensión o shock 2º a VD sistémica; distrés
respiratorio, broncoespasmo severo y edema laríngeo; contracción muscular uterina y gastrointestinal;
urticaria y angioedema. Se determina la presencia de triptasa sérica para diagnosticar reacciones
anafilácticas recientes o 2º a la activación sistémica de los mastocitos. Inmediatamente después de una
reacción anafiláctica sistémica, el paciente no responde a las pruebas de alergia cutánea debido a la
depleción masiva de los gránulos de los mastocitos (taquifilaxia), durante 72-96 hs. Este síndrome
puede ser fatal, pero si se administra precozmente epinefrina, ésta revierte las acciones mediadas por la
histamina en minutos. Deben indicarse antihistamínicos y GC IV, y una enérgica reposición de líquidos.
Superado el cuadro agudo, puede iniciarse la terapia de desensibilización.
Alergia a la penicilina: es una pequeña molécula que posee un anillo betalactámico altamente reactivo,
que reacciona con grupos amino de las π del huésped y se comporta como un hapteno. Estas π propias
modificadas por la penicilina (Ags) pueden provocar una respuesta Th2 en individuos susceptibles. Cuando
la penicilina reingresa a la sangre, en un alérgico sensibilizado, los conjugados π propia-penicilina inducen
el entrecruzamiento de IgE desgranulación de los mastocitos asociados con el TC shock anafiláctico.
Alergias alimentarias: la ingestión de alergenos en individuos atópicos sensibilizados puede conducir al
shock anafiláctico, caracterizado por hipotensión arterial, con colapso circulatorio.
Eccema o dermatitis atópica: inflamación crónica y recidivante de la piel relacionada en el 60% de los
casos con manifestaciones respiratorias. Suele asociarse con IgE sérica aumentada, pruebas cutáneas (+)
para diversos alergenos y eosinofilia. En las lesiones agudas, se observa en la epidermis ¢ de Langerhans
que exhiben IgE, y LT dispersos; en la dermis hay infiltrado perivascular de LT CD4+ y mastocitos. En las
lesiones crónicas, las ¢ de Langerhans presentan > densidad de IgE y en el infiltrado dérmico predominan
macrófagos y eosinófilos. El rash persistente es 2º a una respuesta inflamatoria crónica similar a la
observada en la pared bronquial de los pacientes asmáticos.
Rinitis alérgica: se caracteriza por prurito y congestión nasal, rinorrea y paroxismos de estornudos.
Suele asociarse con irritación ocular, eccema atópico y síntomas en las vías respiratorias bajas, como
sibilancias o tos crónica. La mucosa nasal está inflamada y edematosa. Se desencadena tras la exposición
a alergenos ambientales. La fisiopatología implica la activación de mastocitos asociados con la mucosa
nasal, que al contactar con aeroalergenos, difunden a través de ella. Los mediadores inflamatorios
inducen la formación de edema local y congestión, la irritación de la mucosa y la secreción nasal rica en
eosinófilos. El tratamiento consiste en evitar el contacto con el alergeno, en la administración de
medicación antialérgica y en la inmunoterapia. Los medicamentos son antihistamínicos y anticolinérgicos
para disminuir síntomas, y corticoides tópicos para suprimir la inflamación.
Asma: trastorno inflamatorio crónico de la vía aérea. Sus características ppales son limitación y
obstrucción al flujo aéreo en grado variable, edema persistente, hiperreactividad bronquial, inflamación de
la vía aérea con infiltración crónica por eosinófilos y linfocitos, producción excesiva de moco e IgE sérica
elevada; denudación del epitelio bronquial, depósitos de fibras colágenas por debajo de la membrana
basal, y desgranulación de mastocitos. Clínicamente, se caracteriza por sensación de falta de aire,
episodios recurrentes de sibilancias y tos, y dificultad respiratoria, con exacerbaciones durante la noche y
las 1º horas del día. Hay precipitantes inespecíficos como: infecciones de las vías aéreas superiores,
rinitis, sinusitis, humo de tabaco, estrés, cambios climáticos, ejercicio, que pueden desencadenar una
crisis asmática. Los alergenos inhalados son capturados por las CD inmaduras de la mucosa bronquial, son
procesados y presentados a LT CD4+. Ante un 2º contacto, se precipita la obstrucción aguda de la vía
aérea, tras desencadenarse la liberación de histamina y LTs, constrictores del ML bronquial. Esta fase
temprana de la reacción se resuelve en 1 hora y se caracteriza por BC y edema de la mucosa bronquial. 6
a 9 hs después se inicia la fase tardía, caracterizada por obstrucción al flujo aéreo, a consecuencia de la
liberación de citocinas y quimiocinas por mastocitos, macrófagos, CD y epiteliales, que promueven la
amplificación y cronicidad de la reacción inflamatoria e inducen el reclutamiento de linfocitos y eosinófilos
en la mucosa bronquial. IL-13 sería necesaria y suficiente para la expresión de un fenotipo asmático.
Pruebas de alergia cutáneas: consisten en inocular, por esta vía, extractos de alergenos conocidos. En el
sitio de la inoculación se produce una pápula pruriginosa localizada, con máxima expresión a los 15-20’ de
la inyección. 1º se realiza una prueba epicutánea (prick test), y luego pruebas intradérmicas sólo con los
alergenos que NO indujeron reacción tras su inoculación epicutánea.
Terapéutica antialérgica: A) prevenir el contacto con el alergeno evita las manifestaciones clínicas pero no
reduce la sensibilidad subyacente a él. B) la terapia farmacológica contrarresta los efectos de los
mediadores inflamatorios. Se indican: inhibidores de la liberación de mediadores por los mastocitos:
cromoglicato de sodio – inhibidores de la acción de los mediadores liberados: antihistamínicos,
antagonistas de R de LT e inhibidores de la 5-LO – reversión de las respuestas inflamatorias en los tejidos
afectados: GC, anticolinérgicos y simpaticomiméticos: epinefrina. C) inmunoterapia (terapia de
desensibilización): el tratamiento de la atopía mediante la inyección subcutánea repetida de extractos del
alergeno en bajas dosis es eficaz para reducir o eliminar los síntomas y signos. Se indica a pacientes con
rinitis o conjuntivitis alérgicas severas, con escasa respuesta a la farmacoterapia.
Hipersensibilidad de tipo II: las respuestas citotóxicas son mediadas, por Acs IgG o M, que reconocen
Ags presentes en la superficie ¢ o en la MEC. El mecanismo efector es mediado por el complemento y ¢
que expresan RFcγ: neutrófilos, macrófagos, mastocitos y NK. Ejemplos son las diversas citopenias
inducidas por Acs: eritroblastosis fetal por incompatibilidad Rh, la anemia hemolítica por incompatibilidad
AB0 y la asociada con administración de fármacos como quinidina (antiarrítmico), penicilina (antibiótico) o
metildopa (antihipertensivo). Pueden también asociarse con el desarrollo de glomerulonefritis, vasculitis y
lesiones articulares.
Incompatibilidad AB0: el sistema AB0 involucra 3 alelos diferentes, A, B y 0. Los individuos que expresan
en la superficie de los GR el alelo A presentan Acs anti-B; los que tienen B, Acs anti-A, y los que expresan
A y B, no presentan Acs contra A o B. Los que expresan 0, Acs anti-A y anti-B. Estos Acs naturales son
IgM, y se generarían contra Ags presentes en la cápsula de bacterias gramnegativas de la flora intestinal y
reaccionarían en forma cruzada con los Ags del grupo AB0. Durante una transfusión sanguínea de GR no
compatibles, éstos se recubren con IgM y ocasionan una rápida lisis intravascular mediada por el
complemento. El otro grupo antigénico es el Ag D del grupo Rh. Los individuos que no expresan éste se
denominan Rh-. Estos no expresan Acs anti-Rh. Si un individuo cuyos GR no expresan el Ag D es
transfundido con sangre de Rh+, el receptor generará Acs IgG anti-D que pueden causar la destrucción de
los GR Rh+ en transfusiones posteriores.
Eritroblastosis fetal: enfermedad hemolítica por incompatibilidad Rh fetomaterna. Se caracteriza por
anemia hemolítica variable, según el nivel de destrucción globular y de la eritropoyesis compensatoria. Se
observa eritropoyesis exagerada, por la rápida proliferación de precursores eritroides en hígado, bazo y
MO, en respuesta a la anemia, con liberación de formas inmaduras a la sangre. La hiperbilirrubinemia 2º
al proceso hemolítico puede ocasionar daño neurológico en el recién nacido (kernicterus). No es
infrecuente que durante el trabajo de parto, cierto volumen de sangre escape de la circulación fetal hacia
la materna. Si el feto es Rh+ y la madre es Rh-, ésta se sensibilizará y desarrollará Acs contra el Ag D. En
un embarazo posterior, si el feto fuera Rh+, los Acs IgG maternos (anti-D) podrán atravesar la placenta y
opsonizar los GR fetales. Estos serían eliminados de la circulación por el sistema mononuclear fagocítico.
Esta IgG unida a la superficie del GR no puede activar la VC del complemento, ya que la densidad de los
Ags D sobre los GR es baja e incapaz de activar el C1q. Los Acs anti-D no aglutinan in vitro con GR Rh+
por la baja densidad de Ags D. La aglutinación puede inducirse mediante el añadido del suero de Coombs
(anti-IgG humano). La prueba de Coombs directa detecta los IgG unidos a la superficie ¢, en este caso,
GR fetales. Si a éstos se los incuba con el suero de Coombs, se producirá su aglutinación sólo si poseen
Acs maternos en su superficie. La prueba de Coombs indirecta permite detectar Acs anti-Rh en suero
materno, a fin de determinar si se ha sensibilizado frente al Ag D. Se realiza incubando GR que expresan
Ag D (Rh+) con el suero materno sospechoso. La enfermedad hemolítica puede prevenirse mediante la
inmunización pasiva de la madre con un concentrado de IgGs purificadas que reaccionan con el Ag D (Ig
anti-D: 1 vial de 300 μg IM). Deben recibirla en la semana 28 y dentro de las 72 hs del parto. La Ig
administrada induce la eliminación de los GR Rh+ fetales presentes en la circulación materna.
Hipersensibilidad de tipo III: se caracteriza por el depósito de complejos inmunes en el tejido
afectado. Estos sólo causan enfermedad cuando su producción es excesiva o su depuración está
disminuida. Los complejos con > potencial patogénico son los formados por IgG. Los sitios donde se
producen los depósitos son los < vasos y los capilares glomerulares y sinoviales. Una reacción de
hipersensibilidad III localizada puede desencadenarse en los individuos sensibilizados por un 1º exposición
al Ag. Cuando éste accede al organismo, interactúa con la IgG formando complejos inmunes. Estos se
depositan e interactúan con los RFcγ presentes en mastocitos y otras poblaciones leucocitarias, lo que
desencadena una reacción inflamatoria local caracterizada por un infiltrado ¢ con predominio de PMN
(reacción de Arthus). Los complejos pueden también activar el complemento, estimulando la producción
de C5a, quien contribuye a amplificar la reacción inflamatoria. Las reacciones de hipersensibilidad III
sistémicas (enfermedad del suero) se originan tras inyectar >> [Ag]. Se utilizaba el suero de caballo
proveniente de animales previamente inmunizados con veneno de serpiente, como fuente de Acs
neutralizantes en la inmunización pasiva de pacientes que sufrieron mordeduras de serpientes. Se observa
también tras la administración de globulina antilinfocitaria (inmunosupresora en transplantados),
estreptocinasa (agente trombolítico en IAM); sin embargo la causa más frecuente es la administración IV
de penicilina. La enfermedad del suero se manifiesta entre 7 y 10 días después de la administración del
Ag, tiempo requerido para la inducción de una respuesta humoral. Se presenta con temblores, fiebre, rash
cutáneo, urticaria, artritis y tal vez, glomerulonefritis. La formación de los complejos conduce a la
depuración antigénica, por lo cual tiene un curso autolimitado.
Hipersensibilidad de tipo IV: a diferencia de las I, II y III, ésta está mediada por LT. Subyacen a todas
las entidades en las cuales el daño tisular es mediado por una respuesta Th1. Pueden clasificarse en 2
grupos según el mecanismo involucrado: aquellas en las que el daño es inducido por una respuesta
inflamatoria mediada por Th1 y macrófagos activos; y aquellas mediadas por LT CD8+ citotóxicos. Pueden
desencadenarse por π extrañas o haptenos, como moléculas pequeñas o metales, que se conjugan con π
propias.
Prueba de la tuberculina (de Mantoux): para determinar si un individuo ha estado en contacto con M.
tuberculosis. El PPD se compone de una mezcla compleja de péptidos y carbohidratos derivados de M.
tuberculosis. Cuando se lo inyecta por vía subcutánea, se produce una reacción inflamatoria local mediada
por Th1 en individuos expuestos antes al patógeno, por vacunación con BCG o por infección. Las CPA
endocitan y procesan los Ags, para luego presentarlos con CMH II. Los Th1 efectores, que infiltran el sitio
de inoculación, se activan y producen IFNγ, responsable de activar al macrófago. Las citocinas y
quimiocinas liberadas aumentan la permeabilidad vascular y promueven la formación de edema y el
reclutamiento de diferentes poblaciones, con el desarrollo consecuente de una reacción inflamatoria.
Hipersensibilidad o dermatitis por contacto: los Ags ingresan en la piel por 1º vez. Son captados por las ¢
de Langerhans en la epidermis y presentados a LT naive en el GL, lo que lleva a la generación de LT CD4+
y CD8+ efectores. Ante un 2º contacto, los LT efectores son reclutados en la piel en el sitio de contacto y
expresan CLA (Ag asociado con linfocitos cutáneos), que interactúa con la E-selectina del endotelio,
subyacente al tejido inflamado, lo que permite su extravasación. Estas reacciones se desarrollan al entrar
la piel en contacto con sustancias tales como componentes de tinturas, cosméticos, alhajas, calzados,
venenos y vegetales. A menudo se trata de haptenos, que pueden penetrar fácilmente la piel. Suelen
observarse flictenas (ampollas), necrosis tisular local y destrucción de la MEC. El eritema asociado con el
rash es 2º a una VD importante.
You might also like
- Inmunologia-Apunte El VikingoDocument52 pagesInmunologia-Apunte El Vikingoapuntesdelcev100% (4)
- Anatomia Semana 2Document28 pagesAnatomia Semana 2EdduMedinaChumacero0% (1)
- Sindrome de Lesh NyhanDocument10 pagesSindrome de Lesh NyhanBirzabit Dominguez LopezNo ratings yet
- Interaccion de Los Filamentos de Actina (Diapositivas)Document12 pagesInteraccion de Los Filamentos de Actina (Diapositivas)Jhusleidy España ArroyoNo ratings yet
- Capitulo 14 GuytonDocument29 pagesCapitulo 14 GuytonMaridiose Ruiz Barrera100% (2)
- Anatomia Oido InternoDocument19 pagesAnatomia Oido InternoMaría Florencia Arenas Moisan100% (1)
- Conducto ToracicoDocument19 pagesConducto ToracicoPilar_OHNo ratings yet
- MESENTERIODocument8 pagesMESENTERIOIuri Ricardo LauricioNo ratings yet
- Ciclo MenstrualDocument9 pagesCiclo MenstrualRossana Elizabeth Romero UrbinaNo ratings yet
- Senescencia Lesiones de AlmacenamientoDocument6 pagesSenescencia Lesiones de Almacenamientocatalina AlcarazNo ratings yet
- Cortes Transversales TalloDocument6 pagesCortes Transversales TalloCaballero Herrera Alison YisselNo ratings yet
- Fisiologia MezquitaDocument15 pagesFisiologia MezquitaRolandito Anchapuri CNo ratings yet
- Pelvis EspinozaDocument131 pagesPelvis EspinozaRenzo RiveraNo ratings yet
- InframesocolicoDocument5 pagesInframesocolicoYsangela Bravo100% (1)
- Repaso Fisiología RenalDocument7 pagesRepaso Fisiología Renalkarla7barrenecheaNo ratings yet
- Programa Gasometria PDFDocument60 pagesPrograma Gasometria PDFRemigio EduardoNo ratings yet
- Ruta de La Vida 4 DemorasDocument44 pagesRuta de La Vida 4 DemorasMario Fernando Villota Esparza0% (1)
- Cuadro de ViscerasDocument3 pagesCuadro de ViscerasDaniel Alfaro100% (1)
- RectoDocument4 pagesRectoflorenciaNo ratings yet
- Aplasia MedularDocument27 pagesAplasia MedularBelu Jofre100% (1)
- Embriologia de Los Genitales Femeninos - CompressDocument4 pagesEmbriologia de Los Genitales Femeninos - CompressErwin Yapuchura Apaza100% (1)
- Resumen Del Capítulo 52Document9 pagesResumen Del Capítulo 52BRUNA COSTA DA SILVANo ratings yet
- Fisiopatología Del DolorDocument4 pagesFisiopatología Del DolorLubego870% (1)
- 6.-Síndrome Nefrótico y NefríticoDocument15 pages6.-Síndrome Nefrótico y NefríticoMelissaVallejosGavilan100% (1)
- El Sistema Renina Angiotensina Aldosterona. Pedraza Soto Gabriela AlejandraDocument3 pagesEl Sistema Renina Angiotensina Aldosterona. Pedraza Soto Gabriela AlejandraGabriela Alejandra Pedraza SotoNo ratings yet
- Cuestionario 5° - Anemia MegaloblásticaDocument3 pagesCuestionario 5° - Anemia MegaloblásticaLiliana MoránNo ratings yet
- Reporte QuirurgicoDocument2 pagesReporte QuirurgicoCintia FloresNo ratings yet
- Conducto ToracicoDocument6 pagesConducto ToracicoClaudia LeónNo ratings yet
- Examen 2do Pato PrevioDocument42 pagesExamen 2do Pato PrevioMaximiliano Cortes Tapia100% (1)
- Practica Fisiologia 1Document9 pagesPractica Fisiologia 1Carlos Elias Mancilla SanchezNo ratings yet
- Gestación en Útero Didelfo - Reporte de Un CasoDocument5 pagesGestación en Útero Didelfo - Reporte de Un CasoLuis Romero ObregónNo ratings yet
- Integrador Rezegados Morfofisiologia 1 23 10 2017Document6 pagesIntegrador Rezegados Morfofisiologia 1 23 10 2017Richard SalazarNo ratings yet
- Artitris GotosaDocument25 pagesArtitris GotosaJonh FavioNo ratings yet
- Triangulo de CalotDocument6 pagesTriangulo de CalotDaisuke0% (1)
- Histologia Sistema CirculatorioDocument11 pagesHistologia Sistema Circulatoriokelvin Tapulllima PashanasiNo ratings yet
- Aponeurosis El AntebrazoDocument12 pagesAponeurosis El AntebrazoVictor DelgadoNo ratings yet
- 02 Cuello Parietal PDFDocument14 pages02 Cuello Parietal PDFMilagros Blas PizarroNo ratings yet
- Examen Fisico Del Sistema OstiomioarticularDocument29 pagesExamen Fisico Del Sistema OstiomioarticularSteven Santiago Rozo CarvajalNo ratings yet
- 2da Semana de DesarrolloDocument6 pages2da Semana de Desarrolloraul escobarNo ratings yet
- Tiroides Origen y Desarrollo EmbrionarioDocument4 pagesTiroides Origen y Desarrollo EmbrionarioJohanna Falconi100% (1)
- Inspeccion de ToraxDocument27 pagesInspeccion de Toraxgabrielaindira1991No ratings yet
- G.P. Diagnóstico Por Imágenes 2023-IDocument36 pagesG.P. Diagnóstico Por Imágenes 2023-ICamille KirschbaumNo ratings yet
- Latrodectus Mactans ExposicionDocument28 pagesLatrodectus Mactans ExposicionAndres Juarez Calle100% (1)
- Arterias Del TroncoDocument27 pagesArterias Del TroncoJoSy CaStilloNo ratings yet
- Diabetes 1690427Document50 pagesDiabetes 1690427camundongoNo ratings yet
- Capítulo 33 EritrocitosDocument8 pagesCapítulo 33 EritrocitosAurora CastilloNo ratings yet
- Guia de Practica Patologia 2021-IiDocument65 pagesGuia de Practica Patologia 2021-IiGuianela Polo0% (1)
- Guia para VenopuncionDocument7 pagesGuia para VenopuncionPedro Felipe Moreno CarvajalNo ratings yet
- Bazo AnatomiaDocument5 pagesBazo AnatomiaGabriel Vergara GayossoNo ratings yet
- Funcion HepaticaDocument11 pagesFuncion HepaticaCarla Ayala AguirreNo ratings yet
- INMUNOLOGÍA HUMANA (Resumen Geffner Mancia)Document50 pagesINMUNOLOGÍA HUMANA (Resumen Geffner Mancia)Daniela Benedetti100% (1)
- Inmunologia Humana Resumen Completo Catedra 1Document52 pagesInmunologia Humana Resumen Completo Catedra 1Sebastián AgudeloNo ratings yet
- T1 Sistema InmuneDocument16 pagesT1 Sistema InmuneNerea Lazaro GarciaNo ratings yet
- $RUQPFIFDocument41 pages$RUQPFIFKarina Assis Sabay de souzaNo ratings yet
- Resumen de Los Capitulos de Inmunología de Faimboin 1 13 y 21Document133 pagesResumen de Los Capitulos de Inmunología de Faimboin 1 13 y 21Manuel SantellánNo ratings yet
- Seminario de Inmunidad PDFDocument6 pagesSeminario de Inmunidad PDFCharliton FerreiraNo ratings yet
- 7 Sistema LinfáticoDocument62 pages7 Sistema Linfáticoclarisa94No ratings yet
- Inmunidad Antiviral.Document5 pagesInmunidad Antiviral.Mariela Rojas TarazonaNo ratings yet
- Inmunidad Frente A Parásitos. K.C.R - C.M.CDocument4 pagesInmunidad Frente A Parásitos. K.C.R - C.M.CKahina CastilloNo ratings yet
- ARTRITISDocument9 pagesARTRITISYurem Rafael Quisbert PañuniNo ratings yet
- Agua MagnetizadaDocument21 pagesAgua MagnetizadaMarco Antonio Wong Moreno100% (1)
- Productos Quimicos Industriales Peligrosos Nte Inen 2288Document45 pagesProductos Quimicos Industriales Peligrosos Nte Inen 2288Antonio Achig100% (1)
- A Propósito de Un Caso de PoliotiaDocument2 pagesA Propósito de Un Caso de PoliotiaCarolina CruzNo ratings yet
- Antiinflamatorios1farmaco 140815001403 Phpapp01Document83 pagesAntiinflamatorios1farmaco 140815001403 Phpapp01Alvaro GaldosNo ratings yet
- Información Del Subgrupo 2 InmunologiaDocument10 pagesInformación Del Subgrupo 2 Inmunologiadiana ordoñezNo ratings yet
- Foro de Debate y Argumentacion-Bioquímica USSDocument9 pagesForo de Debate y Argumentacion-Bioquímica USSNERLY JASSELY SANCHEZ CERNA100% (1)
- Terminologia Medica CosmiatricaDocument46 pagesTerminologia Medica CosmiatricaNayla Alejandra Alcantara Salvador76% (17)
- Semiologia Medica 1Document5 pagesSemiologia Medica 1GCanisNo ratings yet
- ND Lezza Duran Dieta AntiinflamatoriaDocument4 pagesND Lezza Duran Dieta AntiinflamatoriaAle DuranNo ratings yet
- Primera Clase Ortopedia y TraumatologíaDocument6 pagesPrimera Clase Ortopedia y TraumatologíaLuciano Sepúlveda LazoNo ratings yet
- Glosario Medicina LegalDocument3 pagesGlosario Medicina LegalJimmy Zuluaga BarriosNo ratings yet
- Terapia Vocal en Pctes ExtubadoDocument22 pagesTerapia Vocal en Pctes Extubadodayllyn iglesiasNo ratings yet
- Efecto Antiinflamatorio y Antioxidante de Los Flavonoides de Las Hojas de Jungia Rugosa Less (Matico de Puna) en Un Modelo Experimental en RatasDocument7 pagesEfecto Antiinflamatorio y Antioxidante de Los Flavonoides de Las Hojas de Jungia Rugosa Less (Matico de Puna) en Un Modelo Experimental en RatasYelsin AlarconNo ratings yet
- Tejido Conectivo o ConjuntivoDocument3 pagesTejido Conectivo o ConjuntivoBrayan TDNo ratings yet
- 7-Reparación Ósea, Implantes y Patologías AsociadasDocument8 pages7-Reparación Ósea, Implantes y Patologías AsociadasWen HPNo ratings yet
- Tejido ConjuntivoDocument123 pagesTejido ConjuntivoBrayan Chopra100% (1)
- 2020-1cicatrizacion de Heridas y Respuesta de Los TejidosDocument24 pages2020-1cicatrizacion de Heridas y Respuesta de Los Tejidosnaty yepesNo ratings yet
- INFLAMACIÓN ExpoDocument23 pagesINFLAMACIÓN ExpoJordan Alexander DávilaNo ratings yet
- Hidroxido de Calcio Su UsoDocument48 pagesHidroxido de Calcio Su UsoXcexarx Xalinaxflorex100% (2)
- Inflamacion y TegumentarioDocument15 pagesInflamacion y TegumentarioVinicio MendozaNo ratings yet
- Artropatías InflamatoriasDocument76 pagesArtropatías InflamatoriasJennifer FuentesNo ratings yet
- Opioides y El Sistema InmuneDocument6 pagesOpioides y El Sistema Inmunedaniel_jose_skateNo ratings yet
- Patología de Los Ganglios Linfáticos y LinfocitosDocument3 pagesPatología de Los Ganglios Linfáticos y LinfocitosMatameloca Yaa100% (1)
- Angiostrongylus Cantonensis - Sub Grupo 2Document30 pagesAngiostrongylus Cantonensis - Sub Grupo 2María José MartínezNo ratings yet
- Hipoacusia Neurosensorial Súbita, El Gran Dilema de La Otorrinolaringología - Una Revisión de La LiteraturaDocument22 pagesHipoacusia Neurosensorial Súbita, El Gran Dilema de La Otorrinolaringología - Una Revisión de La LiteraturaCristhel AriasNo ratings yet
- ¿Por Qué Me Duele?: Reflexiones de Un Médico Sobre El Dolor, AneeshSinglaDocument27 pages¿Por Qué Me Duele?: Reflexiones de Un Médico Sobre El Dolor, AneeshSinglaKailas Editorial100% (1)
- MastoiditisDocument2 pagesMastoiditisLorena AimaraNo ratings yet
- Cascada de La InflamaciónDocument2 pagesCascada de La InflamaciónFer Villaseñor100% (1)
- Reumatología 2015Document372 pagesReumatología 2015Beatriz VallarinoNo ratings yet