Professional Documents
Culture Documents
Laporan Sifat Unsur Kimia
Uploaded by
nishiuraholicCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Laporan Sifat Unsur Kimia
Uploaded by
nishiuraholicCopyright:
Available Formats
BAB 1 PENDAHULUAN
1.1
Latar Belakang Sekitar 90 jenis unsur terdapat di alam, sisanya merupakan unsur buatan. Sebagian dari unsur tersebut terdapat sebagai unsur bebas, tetapi lebih banyak yang berupa senyawa. Unsure-unsur gas mulia (helium, neon, argon, krypton, xenon, dan radon) terdapat sebagai unsur bebas. Tidak ditemukan satupun senyawa alami dari unsure gas mulia. Beberapa unsur logam, yaitu emas, platina, perak, dan tembaga, juga ditemukan dalam bentuk bebas, disamping sebagai senyawa. Begitu juga dengan beberapa unsure non logam, yaitu oksigen, nitrogen, belerang, dan karbon. Berbagai jenis unsure kita gunakan dalam kehidupan seharihari maupun dalam industri. Penggunaan suatu unsure kita gunakan dalam kehidupan sehari-hari maupun dalam industri. Penggunaan suatu unsure bergantung pada sifat-sifat istimewa dari unsure tersebut. Kita menggunakan tembaga sebagai tembaga sebagai kabel listrik, karena tembaga mempunyai daya hantar yang baik, tahan karat, dan tersedia dalam jumlah yang memadai. Kita menggunakan aluminium untuk badan pesawat terbang karena ringan dan tahan karat. Seperti yang telah disebutkan diatas, penggunaan suatu unsure didasarkan pada sifat-sifat dari unsure tersebut. Kita membedakan sifat-sifat dari unsur atas sifat fisis dan sifat kimia. Sifat fisis menyangkut penampilan (seperti wujud, kekerasan, warna, bau, dan rasa), serta sifat-sifat yang tidak melibatkan pengubahan unsure itu 103
menjadi zat lain (seperti jari-jari atom, titik leleh, titik didih, dan kalor jenis). Sifat kimia berkaitan dengan reaksi-reaksi yang dapat dialami oleh zat itu, seperti kereaktifan, daya oksidasi, daya reduksi, sifat asam, dan sifat basa. Sehingga dari percobaaan ini mahasiswa dapat mengambil manfaat bahwa dengan mengetahui sifat-sifat unsur kimia, mahasiswa dapat mengetahui penggunaannya terutama bagi kehidupan seharihari. 1.2 Tujuan Mengetahui reaksi antara logam K dengan H2O. Mengetahui reaksi antara logam Mg dengan H2O. Mengetahui reaksi antara CaCl2 dan BaCl2 dengan larutan H2SO4. Mengetahui reaksi antara larutan CaCl2 dan BaCl2 dengan larutan NaOH.
104
BAB 2 TINJAUAN PUSTAKA 2.1 Logam Alkali Logam alkali tanah adalah unsure-unsur golongan I A (kecuali hydrogen), yaitu litium, nat, rubidium, sesium, dan fransium. Kata alkali berasal dari bahasa Arab yang berarti abu. Air abu bersifat basa. Oleh karena logam-logam golonan I A membentuk basa-basa kuat yang larut dalam air, maka disebut logam alkali. a Sifat fisis Beberapa data fisis logam alkali : Sifat Nomor atom Konfigurasi elektron Jari-jari atom Jari-jari ion Titik cair Titik didih Rapatan Energi pengionan (tingkat pertama) (tingkat kedua) keelektronegatifan Kekerasan Litium 3 (He) 2s 1,57 0,60 181 1347 0,53 520 7298 1,0 0,6 Natrium 11 (Ne)3s 1,86 0,95 97,8 883 0,97 496 4562 0,9 0,4 Kalium 19 (Ar) 4s 2,31 1,33 63,6 774 0,86 419 3051 0,8 0,5 Rubidium 37 (Kr) 5s 2,44 1,48 38,9 688 1,53 403 2632 0,8 0,3 Sesium 55 (Xe) 6s 2,62 1,69 28,4 678 1,88 376 2420 0,7 0,3
105
Daya hantar listrik Warna nyala Potensial reduksi standar
17,4 Merahtua 3,04
35,2 kuning 2,71
23,1 ungu 2,92
13,0 Merahbiru 2,92
8,1 biru 2,92
Seperti dapat dilihat pada tabel diatas, kecenderungan sifat logam alkali sangat beraturan. Dari atas kebawah, jari-jari atom, dan massa jenis (rapatan) bertambah, sedangkan titik cair dan titik didih berkurang. Sementara itu, energi pengionan dan keelektronegatifan berkurang. Potensial electrode (besaran yang menggambarkan daya reduksi dalam larutan), dari atas ke bawah cenderung bertambah, kecuali litium. Litium ternyata mempunyai potensial electrode yang paling besar. Hal ini merupakan penyimpangan sebagaimana sering diperlihatkan oleh unsure-unsur periode kedua. Seperti pernah disebutkan, penyimpangan itu berkaitan dengan kecilnya volum atom unsure periode kedua tersebut. Dalam banyak hal, litium lebih mirip dengan magnesium dari golongan II A. hubungan seperti itu disebut hubungan diagonal. Hubungan diagonal juga diperlihatkan oleh berilium yang mirip dengan aluminium dan boron yang mirip dengan silicon. Li Na Be Mg B Al C Si
b Sifat kimia Logam alkali merupakan golongan logam yang paling reaktif. Kereaktifan meningkat dari atas ke bawah (dari litium ke fransium). Kereaktifan logam alkali berkaitan dengan energi ionisasinya yang
106
rendah, sehingga mudah melepaskan electron. Hamper semua senyawa logam alkali bersifat ionic dan mudah larut dalam air. c Reaksi-reaksi logam alkali 1) Reaksi dengan air Semua logam alkali bereaksi dengan air membentuk basa dan gas hydrogen. Litium bereaksi agak pelan, sedangkan natrium bereaksi hebat. Kalium, rubidium, dan sesium meledak jika dimasukkan ke dalam air. 2L + 2H2O 2 LOH + H2 (L=logam alkali) Oleh karena reaksi itu sangat eksoterm, maka gas hirogen yang terbentuk segera terbakar. Janganlah sekali-sekali memegang logam alkali, karena logam itu dapat bereaksi dengan air pada tangan yang dapat menimbulkan api atau ledakan. 2) Reaksi dengan hydrogen Jika dipanaskan, logam alkali dapat bereaksi dengan gas hydrogen membentuk hibrida, suatu senyawa ion yang hidrogennya membentuk hibrida, suatu senyawa ion yang hidrogennya mempunyai bilangan oksidasi -1. 2L + H2 2LH 3) Reaksi dengan oksigen Logam alkali terbakar dalam oksigen membentuk oksida, peroksida, atau superoksida. 4L + O2 2L2O (L=logam alkali) Jika oksigen berlebihan, natrium dapat membentuk peroksida. 2Na + O2 Na2O2 Kalium, rubidium, dan sesium dapat membentuk superoksida dalam oksigen berlebihan :
107
L + O2 LO2 Oleh Karena sangat mudah bereaksi dengan air dan oksigen, maka logam alkali biasanya disimpan dalam cairan yang inert misalnya minyak tanah (kerosin) atau dalam botol yang diisolasi. Walaupun demikian, permukaan logam itu sedikit demi sedikit bereaksi juga. Logam kalium yang telah disimpan lama akan ditutupi lapisan peroksida. Memotong logam kalium yang sudah tertutup lapisan peroksida harus dilakukan dengan hati-hati karena mata pisau dapat menekan lapisan peroksida sehingga masuk ke dalam lapisan kalium dan menimbulkan reaksi eksoterm. KO2+ 3K 2K2O Kalor yang dibebaskan reaksi itu dapat mendidihkan kalium yang segera bereaksi dengan oksigen atau uap air diudara, yang dapat menimbulkan ledakan. 4) Reaksi dengan halogen Logam alkali bereaksi hebat dengan halogen membentuk garam halide. 2L + X2 2LX Natrium cair terbakar dalam gas klorin menghasilkan nyala berwarna kuning khas logam natrium. 2.2 Logam Alkali Tanah Logam alkali tanah meliputi berilium, magnesium, kalsium, strontium, barium, dan radium. Dalam system periodic, keenam unsure itu terletak pada golongan II A. logam alkali tanah juga membentuk basa, tetapi lebih lemah dari logam alkali. Berbeda dengan golongan I A, senyawa dari logam golongan II A umum,nya ditemukan dalam
108
tanah berupa senyawa tak larut. Oleh karena itu disebut logam alkali tanah (alkaline earth metal). a Sifat-sifat fisis logam alkali tanah sifat Nomor atom Konfigurasi elektron Titik cair Titk didih Rapatan Energi pengionan Tinkat pertama Tingkat kedua Tingkat ketiga Keelektronegatifan Potensial reduksi standar Jari-jari atom Jari-jari ion Kekerasan Daya hantar listrik Warna nyala Be 4 [He] 2s 1278 2970 1,85 899 1757 14848 1,5 -1,70 1,11 0,30 5 8,8 Tidak ada Mg 12 [Ne] 3s 649 1090 1,74 738 1451 7733 1,2 -2,38 1,60 0,65 2,0 36,3 Tidak ada Ca 20 [Ar] 4s 839 1484 1,54 590 1145 4912 1,0 -2,76 1,97 0,99 1,5 35,2 Jingga merah Sr 38 [Kr] 5s 769 1384 2,6 590 1064 4210 1,0 -2,89 2,15 1,13 1,8 7,0 Merah Ba 56 [Xe] 6s 725 1640 3,51 503 965 3430 0,9 -2,90 2,17 1,35 2 hijau
Dari berilium ke barium jari-jari atom meningkat secara beraturan. Pertambahan jari-jari menyebabkan penurunan energi pengionan dan keelektronegatifan. Potensial electrode juga meningkat dari kalsium ke barium, akan tetapi berilium menunjukkan penyimpangan karena potensial elektrodenya relative kecil. Hal itu disebabkan energi ionisasi berilium (tingkat pertama dan tingkat kedua) relative besar. Titik cair dan titik didih cenderung menurun dari atas ke bawah. Sifat-sifat fisis, seperti titik cair, rapatan, dan kekerasan, logam alkali tanah lebih besar jika dibandingkan dengan 109
logam alkali seperiode. Hal itu disebabkan logam alkali tanah mempunyai 2 elektron valensi sehingga ikatan logamnya lebih kuat. b Sifat-sifat kimia Kereaktifan logam alkali tanah meningkat dari berilium ke barium. Fakta ini sesuai dengan yang diharapkan. Oleh karena dari berilium ke barium jari-jari atom bertambah besar sehingga energi ionisasi serta keelektronegatifan berkurang. Akibatnya, kecenderungan untuk melepas electron membentuk senyawa ion makin besar. Semua senyawa dari kalsium, strontium, dan barium, yaitu logam alkali tanah yang bagian bawah, berbentuk senyawa ion, tetapi magnesium membentuk beberapa senyawa kovalen sedangkan senyawa-senyawa berilium bersifat kovalen. Sifat logam alkali tanah bermiripan dengan logam alkali, tetapi logam alkali tanah kurang reaktif dari logam alkali seperiode. Jadi, berilium kurang reaktif dibandingkan terhadap litium, magnesium kurang reaktif dibandingkan terhadap natrium, dan seterusnya. Hal itu disebabkan jari-jari atom logam alkali tanah lebih kecil sehingga energi pengionan lebih besar. Lagipula logam alkali tanah mempunayi 2 elektron valensi, sedangkan logam alkali hanya satu. Kereaktifan kalsium, strontium, dan barium tidak terlalu berbeda dari logam alkali, tetapi berilium dan magnesium jauh kurang aktif. c Reaksi-reaksi logam alkali tanah 1) Reaksi dengan air Kalsium, strontium, dan barium bereaksi baik dengan air membentuk basa dan gas hydrogen, magnesium bereaksi sangat lambat dengan air dingin dan sedikit lebih baik dengan air panas, sedangkan berilium tidak bereaksi. Ca + 2H2O Ca (OH)2 + H2
110
2) Reaksi dengan udara Semua logam alkali tanah terkorosi terus-menerus di udara membentuk oksida, hidroksida atau karbonat, kecuali berilium dan magnesium. Berilium dan magnesium juga bereaksi dengan oksigen di udara, tetapi lapisan oksida yang terbentuk melekat kuat pada permukaan logam sehingga menghambat korosi berlanjut. Apabila dipanaskan kuat, semua logam alkali tanah, termasuk berilium dan magnesium, terbakar di udara membentuk oksida dan nitride. 2 M + O2 2 MO 3 M + N2 M3N2 (M=Logam alkali tanah) 3) Reaksi dengan halogen (X2) Semua logam alkali tanah bereaksi dengan halogen membentuk garam halide. M + X2 MX2 Lelehan halide dari berilium mempunyai daya hantar listrik yang buruk. Hal itu menunjukkan bahwa halide berilium bersifat kovalen. 4) Reaksi dengan adam dan basa Semua logam alkali tanah bereaksi dengan asam kuat (seperti HCl) membentuk garam dan gas hydrogen. Reaksi makin hebat dari Be ke Ba. M + 2 HCl MCl2 + H2 Be juga bereaksi dengan basa kuat, membentuk Be(OH)4 dan gas H2 : Be + 2NaOH + 2H2O Na2Be(OH) 4 + H2
111
BAB 3 METODOLOGI PERCOBAAN
3.1
Alat dan Bahan Alat Tabung reaksi Gelas kimia Bunsen Penjepit tabung Pipet tetes Pinset Rak tabung reaksi Pipet volume 1 mL Bahan Logam kalium Pita Mg Indikator PP Larutan CaCl2 0,5 M Larutan BaCl2 0,5 M Larutan H2SO4 0,5 M Larutan NaOH 0,5 M
112
H2O 3.2 Prosedur Percobaan a Disiapkan tabung reaksi yang berisi 2 mL H2O. Dimasukkan logam Mg Diamati dan diperhatikan reaksi yang terjadi (ditandai dengan adanya gelembung-gelembung gas). Dipanaskan hingga terjadi reaksi. Ditambahkan 1 tetes Indikator PP. Diamati perubahan warna yang terjadi. b Disiapkan gelas kimia yang berisi 10 mL H2O Dimasukkan logam kalium. Diamati reaksi yang terjadi. Ditambahkan 2 tetes indicator PP. Diamati perubahan warna yang terjadi. 3.2.2 Kelarutan Garam Sulfat Disiapkan 2 tabung reaksi. Diisi masing-masing tabung reaksi berturut-turut dengan CaCl2 dan BaCl2 dengan volume masing-masing 1 mL. Ditambahkan 1 mL larutan H2SO4 0,5 M ke dalam masing-masing tabung reaksi. Diamati endapan yang terbentuk (bandingkan endapan yang ada pada setiap tabung reaksi). 3.2.3 Kelarutan Garam Hidroksida Disiapkan 2 tabung reaksi. Diisi masing-masing tabung reaksi dengan 1 mL CaCl2 dan BaCl2.
3.2.1 Reaktifitas Unsur
113
Ditambahkan 1 mL larutan NaOH 0,5 M. Diamati endapan yang terbentuk (bandingkan endapan yang ada pada setiap tabung reaksi).
BAB 4 HASIL DAN PEMBAHASAN
4.1
Hasil dan Pengamatan + air dingin Tidak terjadi reaksi Terjadi K reaksi dipanaskan Terjadi reaksi Pengamatan Terbentuk gelembung-gelembung gas. Dan setelah ditetesi indicator PP berwarna ungu muda Terjadi ledakan kecil dan mengeluarkan percik api berwarna ungu. Setelah ditetesi indicator PP berwarna ungu tua
4.1.1 Reaktifitas unsur Unsur Mg
4.1.2 Kelarutan Garam Sulfat Larutan CaCl2 + H2SO4 Sedikit endapan Banyak BaCl2 endapan Keterangan Tidak larut sempurna dan membentuk endapan berwarna putih susu. Tidak larut sempurna dan membentuk endapan berwarna putih susu yang lebih banyak
114
4.1.3 Kelarutan Garam Hidroksida Larutan CaCl2 BaCl2 + NaOH Banyak endapan Sedikit endapan Keterangan Membentuk larutan koloid dengan endapan berwarna putih susu. Membentuk larutan koloid dengan sedikit endapan berwarna putih susu.
4.2
Pembahasan Dari atas ke bawah suatu unsure logam dalam satu golongan, ukuran atomnya semakin besar menyebabkan energi ionisasinya semakin kecil, sehingga makin mudah melepaskan electron. Semakin mudah melepaskan electron, makin mudah bereaksi, makin reaktif. Dari kiri ke kanan dalam satu periode, ukuran atonya semakin kecil menyebabkan energi ionisasinya semakin kecil, sehingga makin sulit melepaskan electron. Makin sulit melepaskan electron, makin sulit bereaksi, makin tidak reaktif. Beberapa data fisis logam alkali adalah sebagai berikut.
Sifat Nomor atom Konfigurasi electron Jari-jari atom Jari-jari ion Titik cair Titik didih Rapatan Energi pengionan (tingkat pertama) (tingkat kedua) Keelektronegatifan Kekerasan
Litium 3 [He] 2s 1,52 0,60 181 1347 0,53 520 7298 1,0 0,6
Natrium 11 [Ne] 3s 1,86 0,95 97,8 883 0,97 469 4562 0,9 0,4
Kalium 19 [Ar] 4s 2,31 1,33 63,6 774 0,86 419 3051 0,8 0,5
Rubidium 37 [Kr] 5s 2,44 1,48 38,9 688 1,53 403 2632 0,8 0,3
Sesium 55 [Xe] 6s 2,62 1,69 28,4 678 1,88 376 2420 0,7 0,3
115
Daya hantar listrik Warna nyala Potensial reduksi standar
17,4 Merahtua 3,04
35,2 kuning 2,71
23,1 ungu 2,92
13,0 Merahbiru 2,92
8,1 Biru 2,92
Seperti dapat dilihat pada tabel di atas, kecenderungan sifat logam alkali sangat beraturan. Dari atas ke bawah, jari-jari atom, dan massa jenis (rapatan) bertambah, sedangkan titik cair dan titik didih berkurang. Potensial electrode (besaran yang menggambarkan daya reduksi dalam larutan), dari atas ke bawah cenderung bertambah, kecuali litium. Litium ternyata mempunyai potensial electrode yang paling besar. Hal ini merupakan penyimpangan sebagaimana sering diperlihatkan oleh unsur-unsur periode kedua. Seperti pernah disebutkan, penyimpangan itu berkaitan dengan kecilnya volum atau unsure periode kedua tersebut. Logam alkali merupakan golongan logam yang paling reaktif. Kereaktifan meningkat dari atas ke bawah (dari litium ke fransium). Kereaktifan logam alkali berkaitan dengan energi ionisasinya yang rendah, sehingga mudah melepas electron. Hampir semua senyawa logam alkali bersifat ionic dan mudah larut dalam air. Beberapa data fisis logam alkali tanah : Sifat Nomor atom Konfigurasi electron Titik cair Titik didih Rapatan Energi pengionan Tingkat pertama Tingkat kedua Tingkat ketiga Be 4 [He] 2s 1278 2970 1,85 899 1757 14848 Mg 12 [Ne] 3s 649 1090 1,74 738 1451 7733 Ca 20 [Ar] 4s 839 1484 1,54 590 1145 4912 Sr 38 [Kr] 5s 769 1384 2,6 590 1064 4210 Ba 56 [Xe] 6s 725 1640 3,51 503 965 3430
116
Keelektronegatifan Potensial reduksi standar Jari-jari atom Jari-jari ion Kekerasan Daya hantar listrik
1,5 -1,70 1,11 0,30 5 8,8
1,2 -2,38 1,60 0,65 2,0 36,3
1,0 -2,76 1,97 0,99 1,5 35,2
1,0 -2,89 2,15 1,13 1,8 7,0
0,9 -2,90 2,17 1,35 2 -
Dari berilium ke barium jari-jari atom meningkat secara beraturan. Pertambahan jari-jari atom menyebabkan penurunan energi pengionan dan keelektronegatifan. Potensial electrode juga meningkat dari kalsium ke barium, akan tetapi berilium menunjukkan penyimpangan karena potensial elektrodenya relative kecil. Hal; itu disebabkan energi ionisasi berilium (tingkat pertama + tingkat kedua) yang relative besar. Titik cair dan titik didih cenderung menurun dari atas ke bawah. Sifat-sifat fisis,seperti titik cair, rapatan, dan kekerasan, logam alkali tanah lebih besar jika dibandingkan dengan logam alkali seperiode. Hal itu disebabkan logam alkali tanah mempunyai 2 elektron valensi sehingga ikatan logamnya lebih kuat. Kereaktifan logam alkali tanah meningkat dari berilium ke barium. Fakta ini sesuai dengan yang diharapkan. Oleh karena dari berilium ke barium jari-jari atom bertambah besar sehingga eneregi ionisasi serta keelektronegatifan berkurang. Akibatnya, kecenderungan untuk melepas electron membentuk senyawa ion makin besar. Semua senyawa dari kalsium, strontium, dan barium, yaitu logam alkali tanah yang bagian bawah, terbentuk senyawa ion, tetapi magnesium membentuk beberapa senyawa kovalen sedangkan senyawa-senyawa berilium bersifat kovalen.
117
Reaksi-reaksi berikut.
yang
terjadi
dalam
percobaan
ini
untuk
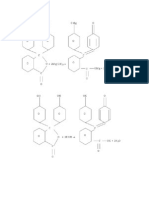
mengetahui reaktifitas unsure golongan I A dan II A adalah sebagai Mg + 2H2O Mg(OH) 2 + H2 2K + 2H2O 2KOH + H2 PP + KOH merah muda/lembayung Reaksi-reaksi yang terjadi dalam percobaan ini untuk mengetahui kelarutan garam sulfat adalah sebagai berikut. CaCl2 + H2SO4 CaSO4 + 2HCl BaCl2 + 2H2O BaSO4 + 2HCl Reaksi-reaksi yang terjadi dalam percobaan ini untuk mengetahui kelarutan garam hidroksida adalah sebagai berikut. CaCl2 + 2NaOH 2NaCl + Ca(OH) 2 BaCl2 + 2NaOH 2NaCl + Ca(OH) 2 BaCl2 + 2NaOH 2NaCl + Ba(OH) 2 Trayek perubahan indicator PP adalah 8,3-10,0. Indikator PP tidak berwarna dalam larutan yang memiliki rentang pH sampai dengan 8,3-10. Indikator PP tidak berwarna dalam larutan yang memiliki rentang pH sampai dengan 8,3 dan berwarna merah dari pH = 10, dan dalam larutan yang pH-nya antara 8,3-10, warna indicator PP adalah kombinasi dari kedua warna tersebut yaitu berubah dari tidak berwarna menjadi ungu kemudian menjadi merah. Indikator PP yaitu zat warna yang akan menghasilkan warna berbeda dalam larutan basa dan asam. Sehingga fungsi dari indicator PP yaitu untuk membedakan suatu larutan bersifat asam, bersifat basa atau bersifat netral dengan penunjukkan warna yang berbeda. Dalam percobaan ini, reaksi antara logam K dengan H 2O menimbulkan suatu ledakan kecil dan mengeluarkan percik api
118
berwarna ungu. Hal ini terjadi karena reaksi ini sangat eksoterm , sehingga gas hydrogen yang terbentuk akan segera terbakar. Setelah ditetesi indicator PP berwarna ungu tua yang menandakan bahwa reaksi antara logam K dengan H2O membentuk basa. Reaksi antara logam Mg dengan H2O menimbulkan gelembunggelembung gas yaitu berupa gas H2 hasil reaksi. Berbeda dengan logam K yang menghasilkan gas H2 yang langsung terbakar, logam Mg hanya menghasilkan gas H2 berupa gelembung-gelembung gas, hal ini dikarenakan logam alkali tanah kurang reaktif dari logam alkali yang disebabkan jari-jari atom logam alkali tanah lebih kecil sehingga pengionan lebih besar. Lagi pula logam alkali tanah mempunyai 2 elektron valensi, sedangkan alkali hanya satu sehingga logam alkali tanah kurang reaktif dibandingkan logam alkali. Hal ini juga berpengaruh terhadap pembentukan basa pada saat bereaksi. Setelah ditetesi indicator PP ternyata berwarna ungu muda yang menandakan pembentukan basa pada logam alkali tanah lebih lemah daripada logam alkali. Reaksi antara larutan CaCl2 dengan H2SO4 menghasilkan CaSO4 berupa endapan dalam jumlah sedikit. Sedangkan reaksi antara larutan BaCl2 dengan H2SO4 menghasilkan BaSO4 berupa endapan dalam jumlah yang lebih banyak. Hal ini dikarenakan oleh kelarutan senyawa sulfat (SO4) semakin ke bawah semakin kecil; atau semakin susah larut sehingga pada reaksi antara CaCl 2 dengan H2SO4 menghasilkan lebih sedikit endapan dibandingkan reaksi antara BaCl2 dengan H2SO4. Reaksi antara larutan CaCl2 dengan NaOH menghasilkan endapan dalam jumlah yang banyak. Sedangkan reaksi antara larutan BaCl2 dengan NaOH menghasilkan endapan dalam jumlah yang lebih sedikit. Hal ini dikarenakan oleh kelarutan hidroksida (OH) makinke 119
bawah dalam satu golongan semakin besar atau semakin mudah larut sehingga pada reaksi antara CaCl2 dengan NaOH menghasilkan lebih banyak endapan dibandingkan reaksi antara BaCl2 dengan NaOH.
BAB 5 PENUTUP 5.1 Kesimpulan Reaksi antara logam K dengan H2O menghasilkan basa kuat atau KOH dan gas hydrogen atau H2 yang segera terbakar sehingga menimbulkan ledakan kecil. Reaksi antara logam Mg dengan H2O menghasilkan basa atau Mg(OH) 2 dan gas hydrogen atau H2 berupa gelembung-gelembung gas. Reaksi antara larutan CaCl2 dengan H2SO4 menghasilkan HCl dan endapan CaSO4 dalam jumlah yang sedikit. Sedangkan reaksi antara larutan BaCl2 dengan H2SO4 menghasilkan HCl dan endapan BaSO4 dalam jumlah yang banyak. Reaksi antara larutan CaCl2 dengan NaOH menghasilkan Ca(OH)2 dan endapan NaCl dalam jumlah yang banyak. Sedangkan reaksi antara larutan BaCl2 dengan NaOH menghasilkan Ba(OH)2 dan endapan NaCl dalam jumlah yang sedikit. 5.2 Saran Percobaan yang dilakukan tidak hanya terbatas CaCl2 dan BaCl2 tetapi yang lain juga agar lebih banyak perbandingkan sehingga lebih terlihat
120
sifat-sifat unsurnya dan pemahaman praktikan lebih jauh. Larutan yang dapat dicoba antara lain MgCl2 dan SrCl2.
DAFTAR PUSTAKA Basri, Sursani. 1996. Kamus Kimia. Bhineka Cipta ; Jakarta. Syukri. 1991. Kimia Dasar I. ITB ; Bandung. Tresna, sastrawijaya. 1994. Kimia Dasar II. Universitas Terbuka Depdikbud ; Jakarta.
Samarinda, 12 November 2008 Mengetahui, Asisten, Praktikan
Siti Nurhidayati 05.54453.01866.08
M. Natsir Eka 0809045031
121
You might also like
- Hanna - Sifat Sifat UnsurDocument13 pagesHanna - Sifat Sifat Unsurwidji3No ratings yet
- Laporan Praktikum 4 Sifat UnsurDocument15 pagesLaporan Praktikum 4 Sifat UnsurRachmaNo ratings yet
- Laporan Praktikum Kimia Dasar Sifat UnsurDocument28 pagesLaporan Praktikum Kimia Dasar Sifat UnsurSiti Aras Ainun100% (2)
- Reviuw Kimia 3Document8 pagesReviuw Kimia 3Frna AprNo ratings yet
- Tugas Pekan 6Document3 pagesTugas Pekan 6dian permatasNo ratings yet
- Bagan Ikatan KimiaDocument2 pagesBagan Ikatan KimiaKhaeria UdluwiyahNo ratings yet
- Laporan Praktikum 2 - H041211029Document20 pagesLaporan Praktikum 2 - H041211029Marwah Rifdah AfifahNo ratings yet
- Sifat Sifat Unsur ADocument19 pagesSifat Sifat Unsur ARavenNo ratings yet
- Alkali Dan Alkali TanahDocument16 pagesAlkali Dan Alkali TanahRina Dwismar100% (1)
- Putri Amalia Febriani Syahrir - c031201020 - Tugas Pekan 2Document21 pagesPutri Amalia Febriani Syahrir - c031201020 - Tugas Pekan 2Putri Amalia Febriani SyahrirNo ratings yet
- LaporanPraktikum - KECEPATAN REAKSI - M021201048-1Document16 pagesLaporanPraktikum - KECEPATAN REAKSI - M021201048-1romeo pasauNo ratings yet
- Percobaan Sifat-Sifat UnsurDocument11 pagesPercobaan Sifat-Sifat UnsurImma HayasukiNo ratings yet
- 5 FluidaDocument32 pages5 FluidaFionikaNo ratings yet
- Sifat-Sifat UnsurDocument22 pagesSifat-Sifat UnsurcindyNo ratings yet
- Laporan KimiaDocument20 pagesLaporan KimiaNur RahmawatiNo ratings yet
- Tugas Kelompok 2 LarutanDocument15 pagesTugas Kelompok 2 Larutannur anisa panusuNo ratings yet
- Tugas 5 LARUTAN G031201050 PDFDocument12 pagesTugas 5 LARUTAN G031201050 PDFSandi KurniantoNo ratings yet
- EVUL ARDIANSYAH - M021201029 - Laporan Praktikum IKATAN KIMIADocument12 pagesEVUL ARDIANSYAH - M021201029 - Laporan Praktikum IKATAN KIMIAMuhammad Farhan AlimuddinNo ratings yet
- Laporan Kimia-Kecepatan ReaksiDocument23 pagesLaporan Kimia-Kecepatan ReaksiFyrdhaFhywilNo ratings yet
- Laporan Sifat-Sifat Unsur 3Document29 pagesLaporan Sifat-Sifat Unsur 3Bakhitah NurulNo ratings yet
- Kimia Dasar Kelompok 7 - Tugas Modul 4Document14 pagesKimia Dasar Kelompok 7 - Tugas Modul 4Muhammad FurqoanNo ratings yet
- Jurnal Ikatan Kimia - Muhammad Syauqi - M011201240 - Kehutanan - E-2Document7 pagesJurnal Ikatan Kimia - Muhammad Syauqi - M011201240 - Kehutanan - E-2MawarNo ratings yet
- Muhammad Ilham - Kimdas Pekan2Document6 pagesMuhammad Ilham - Kimdas Pekan2Andi Ahmad FaizNo ratings yet
- Rangkuman Kimia Karbon M Rafi KamilDocument8 pagesRangkuman Kimia Karbon M Rafi KamilRafi Kamil F0% (1)
- Sifat Sifat UnsurDocument18 pagesSifat Sifat UnsurChuu WiNo ratings yet
- Elektrokimia Kel 1Document36 pagesElektrokimia Kel 1Rohima HandayaniNo ratings yet
- Laporan Praktikum 5Document27 pagesLaporan Praktikum 5Frna AprNo ratings yet
- LAPORAN 1 Kimia Dasar UnjaDocument20 pagesLAPORAN 1 Kimia Dasar UnjaWahyuni Teresia SijabatNo ratings yet
- Stoikeometri UnhasDocument27 pagesStoikeometri UnhasFirman MuhNo ratings yet
- Tugas 2 Kimia Dasar Dosen Pengampu: Dr. Rugaiyah Andi Arfah, M.SiDocument8 pagesTugas 2 Kimia Dasar Dosen Pengampu: Dr. Rugaiyah Andi Arfah, M.SiAndi Erisya Magfirah AsnawiNo ratings yet
- Laporan Ikatan KimiaDocument3 pagesLaporan Ikatan KimiaGaluh Ayudian PratiwiNo ratings yet
- Laporan Kimia Dasar 6Document15 pagesLaporan Kimia Dasar 6Restu DermawanNo ratings yet
- Kecepatan ReaksiDocument11 pagesKecepatan ReaksiGunNo ratings yet
- Laporan Praktikum Sifat Sifat Unsur KimiaDocument17 pagesLaporan Praktikum Sifat Sifat Unsur KimiaDwiiputriiNo ratings yet
- TP7 - PE-B - 101320076 - Marcella Agatha Nathania RDocument6 pagesTP7 - PE-B - 101320076 - Marcella Agatha Nathania Ragatha cellaNo ratings yet
- Tugas Pekan 4 Kimia - StoikiometriDocument11 pagesTugas Pekan 4 Kimia - Stoikiometri07.Amelia FebrianiNo ratings yet
- Stoikiometri Dan Variasi KontinyuDocument13 pagesStoikiometri Dan Variasi KontinyuZia UlfahNo ratings yet
- Sifat Sifat UnsurDocument10 pagesSifat Sifat UnsurAdam Nur AhmadNo ratings yet
- Percobaan 3Document22 pagesPercobaan 3Maskar93No ratings yet
- Bahan Diskusi KelasDocument15 pagesBahan Diskusi KelasNurul Fitri Rasyid100% (2)
- Laporan Sifat Sifat Senyawa Organik Terbaru-2Document31 pagesLaporan Sifat Sifat Senyawa Organik Terbaru-2Nurazizah SoorayaNo ratings yet
- Jawaban Kimia Bab 10Document11 pagesJawaban Kimia Bab 10Mining100% (1)
- Laporan Praktikum Kimia DasarDocument9 pagesLaporan Praktikum Kimia DasarWardah FaizahNo ratings yet
- Tinjauan Pustaka ReaksiDocument5 pagesTinjauan Pustaka ReaksiFianti DamayantiNo ratings yet
- Potensial Sel Dan Deret ElektromotifDocument6 pagesPotensial Sel Dan Deret ElektromotifTubagus SinggihNo ratings yet
- Kesetimbangan Asam BasaDocument15 pagesKesetimbangan Asam BasafitriaNo ratings yet
- Laporan Akhir (Gravimetri)Document17 pagesLaporan Akhir (Gravimetri)FahrunNisaNo ratings yet
- Tugas Modul 3 - Yoga FadilahDocument12 pagesTugas Modul 3 - Yoga FadilahJoshua MeloNo ratings yet
- Praktikum 2 Revisi-1Document7 pagesPraktikum 2 Revisi-1LeonNo ratings yet
- Laporan Ikatan KimiaDocument18 pagesLaporan Ikatan KimiaFitria Istikomah DewiNo ratings yet
- Jurnal Kesetimbangan Asam Basa Aulia Rahma - G041211002Document17 pagesJurnal Kesetimbangan Asam Basa Aulia Rahma - G041211002Aulia RahmaNo ratings yet
- AlkoholDocument10 pagesAlkoholAinindhita DevindaNo ratings yet
- Laporan6 - Cut Mauliditya - H061211064Document19 pagesLaporan6 - Cut Mauliditya - H061211064Punten BuuNo ratings yet
- Jurnal Praktikum Kimia Dasar Sifat-Sifat Senyawa OrganikDocument6 pagesJurnal Praktikum Kimia Dasar Sifat-Sifat Senyawa Organikputri rfaaNo ratings yet
- O HorizonDocument2 pagesO HorizonBadruddin BustaminNo ratings yet
- Kimia 4Document7 pagesKimia 4Reza FahlepiNo ratings yet
- Alkali Dan Alkali TanahDocument18 pagesAlkali Dan Alkali TanahAyu FadhilahNo ratings yet
- Alkali Dan Alkali TanahDocument21 pagesAlkali Dan Alkali Tanah31. Rose DianaNo ratings yet
- Materi CBRDocument7 pagesMateri CBRDian CandraNo ratings yet
- Logam AlkaliDocument31 pagesLogam Alkalicuco alayNo ratings yet
- ApdDocument4 pagesApdAswarNo ratings yet
- Lembar Pengesahan Asli Aswar Universitas AnDocument6 pagesLembar Pengesahan Asli Aswar Universitas AnAswarNo ratings yet
- Lembar Pengesahan Asli Aswar Universitas MulawarmanDocument1 pageLembar Pengesahan Asli Aswar Universitas MulawarmanAswarNo ratings yet
- Bab 1 & 2 Pengukuran Tidak LangsungDocument10 pagesBab 1 & 2 Pengukuran Tidak LangsungAswar100% (2)
- Laporan Pemisahan Dan PemurnianDocument18 pagesLaporan Pemisahan Dan PemurnianAswar100% (1)
- Laporan Pembuatan Larutan AswarDocument20 pagesLaporan Pembuatan Larutan AswarAswar89% (27)
- Laporan KromatografiDocument18 pagesLaporan KromatografiAswar100% (1)
- Pasal-Pasal PKNDocument7 pagesPasal-Pasal PKNAswar50% (2)
- Indikator PPDocument1 pageIndikator PPAswarNo ratings yet
- Laporan Gabungan Kimia Dasar 1 Kelompok 1BDocument116 pagesLaporan Gabungan Kimia Dasar 1 Kelompok 1BAswarNo ratings yet
- Pembuatan LarutanDocument19 pagesPembuatan LarutanAswar100% (2)
- Laporan Laju ReaksiDocument20 pagesLaporan Laju ReaksiAswar86% (14)
- Laporan Praktikum StoikiometriDocument21 pagesLaporan Praktikum StoikiometriAswar0% (1)
- Praktikum KromatografiDocument26 pagesPraktikum KromatografiAswarNo ratings yet
- Pemisahan Dan PemurnianDocument20 pagesPemisahan Dan PemurnianAswar100% (3)