Professional Documents
Culture Documents
Teoria de Bohr
Uploaded by
guidoshOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Teoria de Bohr
Uploaded by
guidoshCopyright:
Available Formats
Niels Henrick David Bohr Fsico dans. Considerado como una de las figuras ms deslumbrantes de la Fsica contempornea.
Bohr unifico la idea del tomo nuclear de Rutherford con las ideas de una nueva rama de la Ciencia: la Fsica Cuntica. As, en 1913 formul una hiptesis sobre la estructura atmica en la que estableci tres postulados:
I.-El electrn no puede girar en cualquier rbita, sino slo en un cierto nmero de rbitas estables. En el modelo de Rutherford se aceptaba un nmero infinito de rbitas.
II.- Cuando el electrn gira en estas rbitas no emite energa. III.- Cuando un tomo estable sufre una interaccin, como puede ser el impacto de un electrn o el choque con otro tomo, uno de sus electrones puede pasar a otra rbita estable o ser arrancado del tomo.
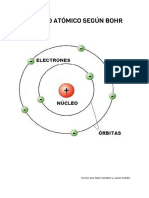
Los estados de energa del tomo de hidrgeno Un estado basal se le conoce cuando un electrn est en una rbita de ms alta energa (menos negativa) n=2 o ms; decimos que el tomo est en un estado excitado. (Fig.I). El modelo del tomo de Bohr tambin inclua la idea de que los electrones se mostraban en orbitas circulares, pero impona restricciones rigurosas: el nico electrn el tomo de hidrogeno podra estar localizada solo en ciertas orbitas.
Fig.I Ilustracin de los estados de energa del hidrogeno
Cuando la luz emitida por un gas se hace pasar a travs de un prisma o de una rejilla de difraccin, se forma un conjunto de lneas brillantes de colores que recibe el nombre de espectro de lneas.
En 1912 & 1913 el fsico dans, Niels Bohr hizo una gran contribucin a los conocimientos, en rpida expansin, de la estructura atmica. Sus investigaciones lo llevaron a suponer que los electrones de un tomo se encuentran en regiones especficas a varias distancias del ncleo.
Bohr supuso que los electrones tienen varias energas posibles que corresponden a diversas rbitas posibles. Bohr tambin afirm que cuando un tomo de hidrgeno absorbe uno o ms cuantos de energa, su electrn salta a un nivel de mayor energa. Bohr pudo explicar el espectro de lneas de hidrogeno de esta forma, existen varios niveles de energa y el menor de ellos se le conoce como estado fundamental.
Niels Bohr contribuy en gran parte a nuestro conocimiento de la estructura atmica: 1) Al sugerir los niveles cuantizados de energa de los electrones.
2) Al demostrar que el espectro de lneas se debe a la radiacin de pequeos incrementos de energa (los cuantos de Planck), y sin embargo los clculos de Bohr no tuvieron xito para tomos ms pesados.
El fsico Niels Bohr ofrece una explicacin del espectro de lneas del tomo de hidrgeno, no puede explicar los espectros de otros tomos. Adems, describir un electrn meramente como una partcula pequea que da vueltas en torno al ncleo presenta un problema.
El modelo de Bohr slo fue un importante paso en el camino hacia el desarrollo de un modelo ms completo. Lo ms importante del modelo de Bohr es que introduce dos ideas fundamentales: (1) Los electrones slo existen en ciertos niveles discretos de energa, que se describen con nmeros cunticos. (2) En el movimiento de un electrn de un nivel a otro interviene energa (Fig.II).
Fig.II Ilustracin del modelo de Bohr
Modelo atmico de Thompson que supona el electrn incrustado en una masa positiva " ... como las ciruelas en un pudding ..." El modelo atmico de Rutherford describa el tomo como un ncleo positivo y una corteza electrnica.
Modelo atmico de Bohr basado en las llamadas rbitas estacionarias
Modelo atmico de Schrdinger que identifica los niveles energticos del tomo con modos de vibracin.
Insuficiencias del modelo de Bohr. a) El modelo de Bohr permiti explicar adecuadamente el espectro del tomo de hidrgeno, pero fallaba al intentar aplicarlo a tomos poli electrnicos y al intentar justificar el enlace qumico.
b) Adems, los postulados de Bohr suponan una mezcla un tanto confusa de mecnica clsica y mecnica cuntica.
c) El modelo no consigue explicar cmo los tomos individuales obran recprocamente con otros tomos para formar los agregados de la sustancia.
You might also like
- Modelo Atomico de Bohr QuimicaDocument8 pagesModelo Atomico de Bohr Quimica2024139001No ratings yet
- Modelo Atómico de Niels Bohr Modelo BohrDocument4 pagesModelo Atómico de Niels Bohr Modelo BohrChristian Antonio Cosme MontanNo ratings yet
- Modelo Atómico de Bohr Experimento UnpDocument6 pagesModelo Atómico de Bohr Experimento UnpMorella LizanaNo ratings yet
- BohrDocument2 pagesBohr⃝⃤ Alan CastroNo ratings yet
- Modelo Atómico Según Niels BohrDocument7 pagesModelo Atómico Según Niels BohrWorh FalexNo ratings yet
- Ensayo Teoria de Bohr BelenDocument12 pagesEnsayo Teoria de Bohr BelenBelen Estefania Ramos OtegaNo ratings yet
- Modelo Atomico de BohrDocument3 pagesModelo Atomico de BohrOmar SilveiraNo ratings yet
- Atomo de BorhDocument3 pagesAtomo de Borhhaciel esauNo ratings yet
- Modelo Atomico de BohrDocument4 pagesModelo Atomico de BohrGerson MaravillaNo ratings yet
- Cont. Átomo Después de Leer y Analizar Responde Las Siguientes Preguntas de La Pág. 193-195. 1Document3 pagesCont. Átomo Después de Leer y Analizar Responde Las Siguientes Preguntas de La Pág. 193-195. 1Isabella SaranteNo ratings yet
- Tarea 1.1 Pachay Lucas Edwin Jahir Ing. ElectricaDocument2 pagesTarea 1.1 Pachay Lucas Edwin Jahir Ing. ElectricaRoger AllsterNo ratings yet
- DocumentoDocument1 pageDocumentoeliassantostorres70No ratings yet
- FísicaDocument6 pagesFísicaDanielNo ratings yet
- Modelo Atómico de Niels BohrDocument2 pagesModelo Atómico de Niels BohrRenato Flores ChavezNo ratings yet
- La Teoría de Bohr Del Átomo de HidrógenoDocument1 pageLa Teoría de Bohr Del Átomo de Hidrógenoadangarcia9125No ratings yet
- Modelo Atomico de BorhDocument14 pagesModelo Atomico de BorhArtijopa JatpNo ratings yet
- Atomo BohrDocument1 pageAtomo BohrMiguel Josue LpNo ratings yet
- Modelo Atómico de BohrDocument8 pagesModelo Atómico de BohrSaban EstuardoNo ratings yet
- Quimica - BorradorDocument4 pagesQuimica - BorradorSophia JImenez RangelNo ratings yet
- Postulados de BohrDocument13 pagesPostulados de Bohrrehira kohakuNo ratings yet
- Triptico Del Atomo de BohrDocument2 pagesTriptico Del Atomo de BohrKathy Gutierrez Aguirre78% (9)
- Modelo de Bohr y Prop. ÁtomoDocument9 pagesModelo de Bohr y Prop. ÁtomoJuan DelgadoNo ratings yet
- Modelos AtómicosDocument5 pagesModelos AtómicosDiana RojasNo ratings yet
- Modelo de BohrDocument13 pagesModelo de BohrIngrid Danae SánchezNo ratings yet
- Información Del Modelo de BohrDocument5 pagesInformación Del Modelo de BohrlusmihcNo ratings yet
- Niels Bohr PresentacionDocument13 pagesNiels Bohr PresentacionAlonso CastroNo ratings yet
- Modelo Atomico BorhDocument5 pagesModelo Atomico BorhAlexander BorbonioNo ratings yet
- Informe FisicaDocument3 pagesInforme Fisicaxiomara velasquezNo ratings yet
- Modelos AtomicosDocument3 pagesModelos Atomicosjulio fragoso0% (1)
- Modelo Atomico de BohrDocument10 pagesModelo Atomico de BohrMelani PeraltaNo ratings yet
- Niels BohrDocument8 pagesNiels BohrEscobar Feliciano Alexander HeberNo ratings yet
- Modelo Atómico de BohrDocument6 pagesModelo Atómico de BohrJulián Valencia MogollonNo ratings yet
- La Teoría de Bohr - CyTDocument1 pageLa Teoría de Bohr - CyTAriana Rivas MontesNo ratings yet
- Modelo Atomico de BorhDocument2 pagesModelo Atomico de BorhvictorNo ratings yet
- Quimica 1Document5 pagesQuimica 1Andres CodenaNo ratings yet
- Modelo Atómico de BohrDocument3 pagesModelo Atómico de BohrEnyorlinRoa100% (1)
- Modelo Atomico de BorhDocument2 pagesModelo Atomico de Borhvictor Escobar100% (2)
- Niels BohrDocument2 pagesNiels Bohracz89193No ratings yet
- El ÁtomoDocument6 pagesEl ÁtomoJhenny ZarateNo ratings yet
- Modelo Atómico Según BohrDocument9 pagesModelo Atómico Según BohrEfectoDMENo ratings yet
- Modelo Atómico de BohrDocument4 pagesModelo Atómico de BohrcarlosNo ratings yet
- BohrDocument4 pagesBohrArmando DiazNo ratings yet
- Teoría Atómica de BohrDocument5 pagesTeoría Atómica de BohrCarlos Alamilla RamosNo ratings yet
- Modelo Atómico de BohrDocument8 pagesModelo Atómico de BohrwillNo ratings yet
- Historia de La Teoría AtómicaDocument41 pagesHistoria de La Teoría Atómicamaverick666990% (1)
- Ex PosiciónDocument14 pagesEx PosiciónErick Vargas ToalaNo ratings yet
- Concepciones Del Átomo y AutoresDocument5 pagesConcepciones Del Átomo y Autorespepe suarezNo ratings yet
- Modelos de Bohr y Rutherford Equipo 3Document8 pagesModelos de Bohr y Rutherford Equipo 3RAUL FERNANDO PALESTINO PEREZNo ratings yet
- Modelo Atómico de BohrDocument3 pagesModelo Atómico de BohrHanamichi Ordnajela López AlcaláNo ratings yet
- Modelo Atomico de BohorDocument12 pagesModelo Atomico de BohorSAMINo ratings yet
- Qué Es El Modelo Atómico de BohrDocument3 pagesQué Es El Modelo Atómico de BohrCesar Ramirez JimenezNo ratings yet
- Biografía de Niels Bohr QuimicaDocument4 pagesBiografía de Niels Bohr QuimicaCorina OnofreNo ratings yet
- Modelo Atómico de BorhDocument17 pagesModelo Atómico de BorhAlejandro Guevara LópezNo ratings yet
- Modelo Atomico de RutherfordDocument7 pagesModelo Atomico de RutherfordAlejandro122009No ratings yet
- Modelos AtomicosDocument4 pagesModelos AtomicosLissette Espinoza MoralesNo ratings yet
- Modelo Moderno Del ÁtomoDocument2 pagesModelo Moderno Del ÁtomoNataly PérezNo ratings yet
- Modelo Atómico de BohrDocument1 pageModelo Atómico de BohrJORDI CHICAIZANo ratings yet
- Speech Modelo Atómico de BohrDocument2 pagesSpeech Modelo Atómico de BohrIsa RoblesNo ratings yet
- Modelo Atómico de BohrDocument3 pagesModelo Atómico de Bohrdccg1112No ratings yet
- FotoresistenciaDocument23 pagesFotoresistenciaCrisMaxDig100% (1)
- Configuracion Del Servidor y FTPDocument26 pagesConfiguracion Del Servidor y FTPCrisMaxDigNo ratings yet
- Unidad 3 Resumen de Analisis Del ProyectoDocument6 pagesUnidad 3 Resumen de Analisis Del ProyectoCrisMaxDigNo ratings yet
- Ensayo de La Pelicula Inteligencia ArtificialDocument7 pagesEnsayo de La Pelicula Inteligencia ArtificialCrisMaxDig33% (6)
- 5.2 Herramientas CaseDocument10 pages5.2 Herramientas CaseCrisMaxDigNo ratings yet
- Metricas Del Software Que Trabajan Con La ISO!!Document9 pagesMetricas Del Software Que Trabajan Con La ISO!!CrisMaxDigNo ratings yet
- Herramienta Case Power ArchitectDocument7 pagesHerramienta Case Power ArchitectCrisMaxDigNo ratings yet
- Ensayo 3.1 Paradigmas de La Ingeneria Del SoftwareDocument10 pagesEnsayo 3.1 Paradigmas de La Ingeneria Del SoftwareCrisMaxDig0% (1)
- Variables Aletorias ContinuasDocument19 pagesVariables Aletorias ContinuasCrisMaxDig57% (7)
- Exposicion de Formatos Graficos de AlmacenamientoDocument16 pagesExposicion de Formatos Graficos de AlmacenamientoCrisMaxDigNo ratings yet
- Formulaciones de Leyes Gauss y CoulombDocument17 pagesFormulaciones de Leyes Gauss y CoulombCrisMaxDigNo ratings yet
- Historia Del ProcesadorDocument20 pagesHistoria Del ProcesadorMax Luviano89% (18)
- 1.3.1lenguaje Natural y ArtificialDocument9 pages1.3.1lenguaje Natural y ArtificialCrisMaxDig100% (1)
- Las Megatendencias y Los Agronegocios en México (VCT)Document73 pagesLas Megatendencias y Los Agronegocios en México (VCT)CrisMaxDig100% (2)
- Biografia by ArquimedesDocument12 pagesBiografia by ArquimedesCrisMaxDigNo ratings yet
- Escuela Colombiana de Ingeniería Julio GaravitoDocument13 pagesEscuela Colombiana de Ingeniería Julio GaravitoLaura Sofia Perez CorreaNo ratings yet
- Emayn Ficha Tecnica Az 1Document2 pagesEmayn Ficha Tecnica Az 1Jerson Ramos HuertaNo ratings yet
- Cálculo Del Cortante BasalDocument9 pagesCálculo Del Cortante BasalCarlos Osmel GuevaraNo ratings yet
- Practica 21Document7 pagesPractica 21GerardoNo ratings yet
- Herramientas para La Nanofabricación - 2016Document12 pagesHerramientas para La Nanofabricación - 2016ManuelGarcíaNo ratings yet
- Reporte Practica Uno - Circuitos Logicos - AdcDocument6 pagesReporte Practica Uno - Circuitos Logicos - AdcsmoutheeNo ratings yet
- Analisis de Puestos Corregido.Document25 pagesAnalisis de Puestos Corregido.Willson Javier Gandoy VazquezNo ratings yet
- Semana #03Document265 pagesSemana #03Tony Xavier Hancco SucariNo ratings yet
- M1a-Lecturas Seleccionadas 2021Document58 pagesM1a-Lecturas Seleccionadas 2021Tolero VLNo ratings yet
- Proyecto PDSDocument22 pagesProyecto PDSMaom OsorioNo ratings yet
- SimbolosDocument25 pagesSimbolosAlfredo CarrozNo ratings yet
- B 8041 DFF 5Document5 pagesB 8041 DFF 5Johan carlos Tahua cordovaNo ratings yet
- Deber 5 - Integrales Dobles - InvestigacionDocument4 pagesDeber 5 - Integrales Dobles - InvestigacionDomenica Plaza AlvarezNo ratings yet
- SECADODocument9 pagesSECADOEliel ChavezNo ratings yet
- Verificaciones y Mediciones Del Block de MotorDocument5 pagesVerificaciones y Mediciones Del Block de MotorLuis Camaño100% (1)
- Madrid 2002 PDFDocument2 pagesMadrid 2002 PDFmirandomirando44No ratings yet
- Identidades Trigonométricas - Wikipedia, La Enciclopedia LibreDocument8 pagesIdentidades Trigonométricas - Wikipedia, La Enciclopedia LibreGustavo MayenNo ratings yet
- Proyecto Energia EolicaDocument8 pagesProyecto Energia EolicaPedro Torres50% (2)
- Integral Indefinida Cambio VariableDocument4 pagesIntegral Indefinida Cambio VariableCesaromar RuedaNo ratings yet
- La Correcta Ejecucion de La MusculacionDocument35 pagesLa Correcta Ejecucion de La MusculacionEduardo Perez MojicaNo ratings yet
- Taller Separacion y PurificacionDocument5 pagesTaller Separacion y PurificacionDIEGO FERNEY NAVARRETE VASQUEZNo ratings yet
- Resistencia Soldadura FCAWDocument264 pagesResistencia Soldadura FCAWmtjavierNo ratings yet
- Deshidratación de Gas Natural Con Destino A GNLDocument19 pagesDeshidratación de Gas Natural Con Destino A GNLOrlando CastiblancoNo ratings yet
- Documento 5Document3 pagesDocumento 5Guido ZuccarelliNo ratings yet
- Cuaderno Ejercicios FDocument126 pagesCuaderno Ejercicios FZucy SalgadoNo ratings yet
- Exam en 1Document3 pagesExam en 1Cintli Lara MaryNo ratings yet
- Por Qué Es Importante La Flexibilidad en La DanzaDocument5 pagesPor Qué Es Importante La Flexibilidad en La DanzaEjal Alar GómezNo ratings yet
- Aplicaciones Ecuaciones DiferencialesDocument19 pagesAplicaciones Ecuaciones DiferencialesRubenNo ratings yet
- 1 ConfortDocument7 pages1 ConfortAngeleZz GaRziiaNo ratings yet
- Metodo de Minimos CuadradosDocument9 pagesMetodo de Minimos CuadradosAbran Marco Alcoser MirandaNo ratings yet