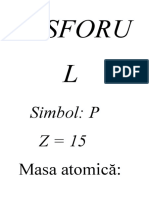Professional Documents
Culture Documents
Fosfor
Uploaded by
Alexandra CismasCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Fosfor
Uploaded by
Alexandra CismasCopyright:
Available Formats
POpA aNDra
andra_lorena2003@yahoo.com
Scoala Mihai Voda
Clasa a 8 a B
EleMetuL CHimiC fOsfor Este alCatuit Din
TotalItatea AtoMILor De FOsFor
SImbOL Chimic:P
AtOmul de Fosfor:
Fosforul nu poate exista liber n natur deoarece are
o mare afinitate pentru oxigen. Se gsete numai sub
form de compui, mai ales fosfai. Principalul
mineral care conine fosfor este apatita. Totodat se
afl n corpul plantelor i animalelor sub form de
combinaii anorganice(carapacea scoicilor, oasele
vertebratelor) i sub form de compui
organici(snge, creier, pr, fibre musculare,
glbenu de ou, lapte).
Fosforul
In anul 1669, un negustor de chimicale din Hamburg, fost militar si apoi medic, pe nume Hennig
Brand, era si el printre pasionatii cercetarilor alchimice cautand, ca si sutele de predecesori ai sai,
"piatra filozofala" si "elixirul vietii". Astfel, el s-a gandit sa caute "piatra filozofala" chiar in omul
insusi, realizand urmatorul experiment: a fiert urina umana in absenta aerului -o idee cu adevarat
geniala- si a distilat in prezenta nisipului zeci de litri, poate sute pana ce lichidul ramas s-a concentrat,
a devenit siropos, iar dupa ce l-a lasat sa se raceasca si a facut sa patrunda aer in retorta de distilare
spre marea lui surpriza, a aparut o luminozitate deosebita, pe care a numit-o "focul rece". Aceasta
descoperire a lui Brand era cea mai spectaculoasa din toata perioada alchimica. Simbolul P este
atribuit fosforului dupa numele elementului in limba greaca "phosphoros", care inseamna purtator de
lumina (o varietate a fosforului este fosforescenta, emite lumina). Etimologie: phos=lumina, pherein=a
purta.
Primele chibrituri contineau in gamalia lor fosfor alb si se aprindeau prin frecare pe o suprafata
aspra. Acestea au fost abandonate din cauza toxicitatii lor si inlocuite cu chibrituri suedeze care au
gamalia formata din clorat de potasiu si sulfura de antimoniu, usor inflamabile; se aprind prin frecare
pe o pasta continand fosfor rosu.
Fosforul nu poate exista liber in natura deoarece are o mare afinitate pentru oxigen. Se gaseste
numai sub forma de compusi (organici si anorganici), mai ales fosfati. Principalul mineral continand
fosfor este apatita, care, sub actiunea lenta a agentilor atmosferici, se transforma in fosforite si se
gaseste in scoarta Pamantului. Fosforul se afla in corpul plantelor si animalelor sub forma de
combinatii anorganice (carapacea scoicilor, oasele vertebratelor) si sub forma de compusi organici
(sange, creier, par, fibre musculare, galbenus de ou, varza, conopida, lapte, branzeturi).
In industrie, fosforul se prepara din fosfat de calciu prin calcinare (incalzire la 1000C) cu dioxid
de siliciu si carbune.
Fosforul apare in mai multe modificatii alotrope fundamentale, datorita numarului diferit de
atomi din molecule. Cele mai importante si mai frecvente forme alotropice ale fosforului sunt fosforul
alb si fosforul rosu.
Spre deosebire de celelalte forme alotrope, fosforul alb este mult mai
reactiv. Se aprinde uor n aer i arde cu flacr glbuie, formnd
pentaoxidul de fosfor(P
2
O
5
), formula molecular corect fiind P
4
O
10
:P
4
+
5 O
2EXCES
P
4
O
10
. Datorit uurinei de aprindere, fosforul alb se
pstreaz sub ap.Acesta lumineaz verzui i foarte slab n ntuneric, n
prezena oxigenului din aer i a umiditii. Fenomenul este cauzat de
oxidarea produilor inferiori de oxidare ai fosforului(P
2
O
5
P
4
O
10
),
fenomen numit chimioluminiscen. Cu F, Cl, si Br reacioneaz cu
aprindere sau explozie, iar cu I mai lent:P
4
+ 6 Cl
2
4PCl
3
; P
4
+
10Cl
2
4PCl
5
Are o combinaie lent cu S la temperatura camerei i energic la
temperatur ridicat:P
4
+6S2P
2
S
3
; P
4
+10S2P
2
S
5
Reacia fosforului cu metale conduce spre formarea fosfurilor:P
4
+
6Mg2Mg
3
P
2
Reacia cu vaporii de ap formeaz acid fosforic i hidrogen la
temperatur mai mare de 250C:8P+32H
2
O8H
3
PO
4
+5H
2
-rol fiziologic: Fosforul alb, fiind solubil in grasimi, este foarte
otravitor. Avand afinitate mare pentru oxigen determina disparitia
acestuia din sange, iar introdus in stomac produce varsaturi cu dureri
mari si moarte. Ca antidot se recomanda oxid de magneziu, sulfat de
cupru si altele;
-fiind otravitor, fosforul se foloseste in cantitati mici la obtinerea
antidaunatorilor pentru starpirea sobolanilor;
-in metalurgie, fosforul alb se adauga in unele aliaje anticorozive;
-se foloseste la fabricarea:
-acidului fosforic si a ingrasamintelor cu fosfor (folosite in agricultura);
-pastei de pe cutiile de chibrituri;
-halogenilor de fosfor si a unor coloranti organici;
-fosforul rosu se foloseste in pirotehnie (industria explozibililor);
-in organismul uman fosforul ajuta, alaturi de calciu la formarea si
intarirea oaselor, a dintilor, a unghiilor; de asemenea, are un rol
important in contractia musculara si in functiile sistemului nervos
Proprietati fizice:
Fosforul in stare solida este incolor , transparent, acid si moale. Prin sublimare din solutii de sulfura
de carbon fosforul se depune in stare cristalina. Fosforul este aproape insolubil in apa si alcool si putin
solubil in glicerina, acid acetic, mai solubil in eter si foarte solubil in disulfura de carbon. Cu razele X
s-a confirmat faptul ca la temperatura obisnuita el cristalizeaza in sistemul cubic. Fosforul alb se
topeste intre44 si 44,20C iar densitatea lichidului fiind de 1,745 la 440 si 1,4850 la temperatura de
fierbere. La temperatura camerei , presiunea de vapori este mare, motiv pentru care poate fi usor
distilat la 1000C cu vapori de apa.
Proprietati chimice:
Reactia fosforului cu metalele si nemetalele conduce la patru tipuri de compusi: 1. Fosfine volatile.
Acestea sunt compusi de tip molecular. 2. Fosfine ionice. Acest tip de fosfine se formeaza cu metalele
alkaline, alcalino-pamantoase. 3. Fosfine covalente. 4. Fosfine de tip metallic. Acesta prezinta duritate,
luciu metalic, insolubil in apa, conductibilitate electrica. Fosforul alb reactoneaza cu aproape toate
nemetalele. Deoarece se oxideaza foarte usor, fosforul se taie la apa. Fosforul arde in oxygen lent sau
aprinzandu-se la circa 450C. In exces de fosfor se formeaza pentaoxide de difosfor. Fosforul alb se
combina lent cu sulful la temperatura ordinara, violent de cald si explozibil la temperatura mai inalta.
Fosforul alb se combina cu majoritatea metalelor. Incalzit pe o placa de platina o strapunge din cauza
formarii unor fosfuri solubile. Aurul si argintul absorb vaporii de fosfor sub punctul lor de topire si ii
cedeazala racier producand fenomenul rosaj la solidificare.
O bagheta de fosfor alb introdusa intr-o solutie de sulfat de cupru , acopera rapid cu un strat rosu de
cupru metalic. Fosforul reduce o solutie de azotat de argint. Cu acidul clorhidric la 2000C formeaza ,
in tub uscat hidrogenul fosforat de azotat de argint. Cu acidul clorhidric la 2000C formeaza, in tub
uscat hidrogenul fosforat iar cu acizii bronhidrici si iodhidrici, saruri de fosfoniu.
Stare naturala :
Fosforul nu exista liber in natura datorita afinitatii
sale pentru oxigen dar exista un numar mare de
fosfati. Fosforul considerat inainte ca un difosfat
tricalcic, Ca
3
(PO
4
)
2
este un amestec de hidrohil-
apatita Ca
3
(PO
4
)
2
* Ca(PO)
2
si carbonato-apatita.
Are culoarea cenusie, galbuie sau uneori neagra
care indica prezenta substantelor bituminoase. Cel
mai important mineral fiind apatita. Exista un
numar foarte mare de zacaminte fosfatice
calcaroase in Suedia , Norvegia , Australia ,
Ungaria , Belgia , Franta , Spania, U.R.S.S ,
Fosforul alb
Fosforul alb in stare solida si lichida are
molecula formata din patru atomi de fosfor
uniti intre ei prin covalente, care ocupa
varfurile unui tetraedru regulat. Unghiurile de
valenta de 60 sunt mici si indica o tensionare
considerabila a moleculei, ceea ce este in
concordanta cu marea reactivitate a fosforului
alb. In cristal, moleculele de fosfor sunt unite
prin forte slabe de tip Van der Waals, care
explica unele proprietati ale fosforului alb.
Fosforul
Simbol: P; Z = 15; Masa atomica: 0,974
Stare naturala. Fosforul nu exista liber in natura din cauza afinitatii sale pentru oxigen. Exista insa, un numar mare de
fosfati. Fosforitul, considerat inainte ca un difosfat tricalcic, Ca3(PO4)2 este un amestec de hidroxil apatita 3Ca3(PO4)2
Ca(HCO3)OH. Are o culoare cenusie, galbuie sau uneori neagra, care indica prezenta substantelor bituminoase.
Fosfatii naturali se
clasifica in trei categorii:
Fosforiti adica fosfati impari de origine minerala;
Guanoul, care provine din putrefactiile dijectiilor si a cadavrelor pasarilor marine;
Caprolitele, de origine animala provenite din
excrementele unor reptile.
Nu exista pamant arabil care sa contina acid
fosforic. Recoltele succesive saracesc solul. Din plante
, fosforul trece la animale si la om. Acidul fosforic exista in roci in cantitate mica. in cuptoarele inalte, fosforul pus in
libertate, modifica proprietatile produselor. Unii carbuni, petrolul, apa de mare, grindina pot contine fosfor. Parul,
ghearele, dintii si in special oasele vertebratelor contin fosfor sub forma de carbonato apatita. Urina contine fosfat 2-
3g/l. Nucleina, lecitina din creier, fict contin mult fosfor.
Obtinere:
Fosforul se obtine numai industrial din oasele animalelor sau din fosfatii minerali. Oasele contin 25-30% oseina; 52-68%
Ca3(PO4)2; 0-2% Mg3(PO4)2; 2-10% CaCO3 si alte saruri pana la 2%.
Prin procedeul chimistilor francezi, se distruge oslina arzand oasele la rosu viu. Cenusa este pulverizata. Ea contine 40%
P2O5 si alti oxizi de la, Fe, Al. Cenusa amestecata cu apa calda se trateaza cu acid sulfuric si se filtreaza sulfatul de calciu:
Ca3(PO4)2 + 2H2SO4 = 2CaSO4 + CaH4(PO4)2
Lichidul evaporat la consistenta siropoasa este amestecat cu carbune si calcinat pentru a transforma difosfatul
tetrahidrocalcic in dimetafosfat de calciu:
CaH4(PO4)2 = Ca(PO3)2 + 2H2O
Distilarea fosforului incepe la 750C si se termina la 1200C:
3Ca(PO3)2 + 10C = P4 + Ca3(PO4)2 + 10CO
2Ca(PO3)2 + 5C = P2 + Ca2P2O7 + 5CO
Vaporii se condenseaza in apa.
You might also like
- Fosforul PDocument19 pagesFosforul PEne Violeta Alina100% (1)
- FosforulDocument2 pagesFosforulNicholas Owens67% (3)
- HalogeniiDocument10 pagesHalogeniiAnca-Alina BujenitaNo ratings yet
- Agrochimie Curs 1Document29 pagesAgrochimie Curs 1Sebastian NechiforNo ratings yet
- Creat de Mine Fierul Și Compușii AcestuiaDocument28 pagesCreat de Mine Fierul Și Compușii AcestuiaIris Munteanu100% (1)
- Grupa A III-aDocument4 pagesGrupa A III-aChiper Zaharia DanielaNo ratings yet
- Stiinta SoluluiDocument111 pagesStiinta SoluluiLidia TironNo ratings yet
- Acidul SULFURICDocument6 pagesAcidul SULFURICCorcodel AdelinaNo ratings yet
- LICURICIDocument1 pageLICURICIEmanuel DragomirescuNo ratings yet
- Faza de Lumina A FotDocument22 pagesFaza de Lumina A FotIorgu GeorgianNo ratings yet
- HPLCDocument29 pagesHPLCPLESCARODICANo ratings yet
- Efectele Poluarii Mediului ÎnconjuratorDocument6 pagesEfectele Poluarii Mediului ÎnconjuratorAndreiClaudiuPaulNo ratings yet
- Chimie Generala CHI-FMIDocument97 pagesChimie Generala CHI-FMIIlenuca Sacalas100% (1)
- Principiu: Extragerea Lipidelor Se Face La Cald, in Aparatul Descrierea Aparatului Soxhlet: Aparatul Este Alcatuit DinDocument7 pagesPrincipiu: Extragerea Lipidelor Se Face La Cald, in Aparatul Descrierea Aparatului Soxhlet: Aparatul Este Alcatuit DinTudor VataNo ratings yet
- Recuperarea Aurului Din PCBDocument8 pagesRecuperarea Aurului Din PCBMyrat Myrat100% (2)
- C1. Notiuni Introductive. Clasificare SoluriDocument24 pagesC1. Notiuni Introductive. Clasificare SoluriCîrîc DanielNo ratings yet
- Curs 1 Reactii AnaliticeDocument44 pagesCurs 1 Reactii AnaliticeAnaUlpeNo ratings yet
- Compusi OrganometaliciDocument5 pagesCompusi OrganometaliciGeorgescu AndreeaNo ratings yet
- SulfulDocument14 pagesSulfulDaniela Lazăr100% (1)
- 5 Hidrocarburi Aromatice Polinucleare 2015-02-24 VFDocument71 pages5 Hidrocarburi Aromatice Polinucleare 2015-02-24 VFVasiloni Ioan PaulNo ratings yet
- Color AntiDocument5 pagesColor AnticristiiugaNo ratings yet
- Clorul Si Compusii LuiDocument16 pagesClorul Si Compusii LuiAdrian RoscaNo ratings yet
- Tutunul-Proiect ApssDocument13 pagesTutunul-Proiect ApssAndrei TutunaruNo ratings yet
- TaxonomieDocument25 pagesTaxonomieAndrei CherecheșuNo ratings yet
- Coada CaluluiDocument2 pagesCoada CaluluiDan DanutNo ratings yet
- Pile ElectrochimiceDocument3 pagesPile ElectrochimiceChirtibus SasaNo ratings yet
- Acidul FormicDocument14 pagesAcidul FormiclarisaNo ratings yet
- Curs Membrane StructuraDocument10 pagesCurs Membrane StructuraTeoFefe100% (1)
- Poluanti Organici PersistentiDocument45 pagesPoluanti Organici PersistentiDobrutchi VeronicaNo ratings yet
- CarbuniDocument11 pagesCarbuniCrăciun Andreea MariaNo ratings yet
- NichelDocument7 pagesNichelcsekearianaNo ratings yet
- Prezentare SodiuDocument8 pagesPrezentare SodiuAndreea CarmenNo ratings yet
- AGROCHIMIEDocument11 pagesAGROCHIMIEOana BanuNo ratings yet
- Vegetatia. Proiect GeografieDocument18 pagesVegetatia. Proiect GeografieCazan AdyNo ratings yet
- BiomurileDocument20 pagesBiomurileLili FokshaNo ratings yet
- Acid SulfuricDocument13 pagesAcid SulfuricGeorgiana Leontescu100% (1)
- Prezentare La CobaltDocument19 pagesPrezentare La CobaltMarina PanainteNo ratings yet
- Alcaloizi Info NetDocument7 pagesAlcaloizi Info NetlicuseaNo ratings yet
- BiologieDocument10 pagesBiologieAlina GurandaNo ratings yet
- PL Tox C V - Plante FotosensibilizanteDocument17 pagesPL Tox C V - Plante FotosensibilizanteSzobolai ZsoltNo ratings yet
- Clorul Si Compusii LuiDocument14 pagesClorul Si Compusii LuiCristian MihaiNo ratings yet
- 93 - 190 - Compusi AzotatiDocument98 pages93 - 190 - Compusi AzotatiBoblea LaviniaNo ratings yet
- Compozitia Aerului AtmosfericDocument6 pagesCompozitia Aerului Atmosfericcercel63No ratings yet
- Referat Pigmentii NaturaliDocument4 pagesReferat Pigmentii NaturalicristinamihailovNo ratings yet
- CAPITOLUL 2-Structura SubstantelorDocument51 pagesCAPITOLUL 2-Structura SubstantelorMatei SilviuNo ratings yet
- Curs 3Document26 pagesCurs 3Stefan FarcasNo ratings yet
- Coloranti ChinoniciDocument42 pagesColoranti ChinoniciXiusha MalunovaNo ratings yet
- Unitatea Si Diversitatea Lumii ViiDocument3 pagesUnitatea Si Diversitatea Lumii ViiSimona Maria DobrinNo ratings yet
- MusetelulDocument29 pagesMusetelulmihaela schimiNo ratings yet
- Proiect de Lunga DurataDocument4 pagesProiect de Lunga DurataVadimMorariNo ratings yet
- Actiunea Metalelor Grele AsupraDocument34 pagesActiunea Metalelor Grele AsupraSvetlana BlajaNo ratings yet
- Obtinerea Cuprului Si Problemele de Mediu IntalniteDocument35 pagesObtinerea Cuprului Si Problemele de Mediu IntalniteBlasciuc Chirosca GabrielaNo ratings yet
- Ingrasaminte MineraleDocument10 pagesIngrasaminte MineraleMaria MagdalenaNo ratings yet
- PDFDocument73 pagesPDFIoana MateeaNo ratings yet
- FosfOr (76543464567)Document9 pagesFosfOr (76543464567)Dumitru BuzduganNo ratings yet
- Fosforul FinalDocument4 pagesFosforul Finalpetreionutz87No ratings yet
- FosforulDocument6 pagesFosforultobi92100% (3)
- Acidul FosforicDocument9 pagesAcidul Fosforicdiana fenichiuNo ratings yet
- FOSFORULDocument6 pagesFOSFORULvioletabadanNo ratings yet
- Fosforul PDocument12 pagesFosforul Pnicucazacu0% (1)
- Ravas 1Document1 pageRavas 1Alexandra CismasNo ratings yet
- Lista Mortilor de Razboi - Cimitirul Eroilor Din Stary Krim, UcrainaDocument7 pagesLista Mortilor de Razboi - Cimitirul Eroilor Din Stary Krim, UcrainaAlexandra CismasNo ratings yet
- Manual PharmecDocument45 pagesManual PharmecEmm100% (8)
- New Microsoft Word DocumentDocument9 pagesNew Microsoft Word DocumentAlexandra CismasNo ratings yet
- ZaharDocument2 pagesZaharAlexandra CismasNo ratings yet
- Teste Grila Chimie Analitica 2010 2011 Sem 1 UnlockedDocument130 pagesTeste Grila Chimie Analitica 2010 2011 Sem 1 UnlockedAlexandra CismasNo ratings yet
- Lycopodium ClavatumDocument5 pagesLycopodium ClavatumAlexandra CismasNo ratings yet
- Administrarea Medicamentelor-Suport CursDocument44 pagesAdministrarea Medicamentelor-Suport CursCaciuc DanielaNo ratings yet
- DicotiledonateDocument67 pagesDicotiledonateDavid KamalNo ratings yet
- Document ZahDocument1 pageDocument ZahAlexandra CismasNo ratings yet
- Citeste Azi, Nu MaineDocument50 pagesCiteste Azi, Nu Mainelidia_nNo ratings yet
- Metode CalorimetriceDocument4 pagesMetode CalorimetriceAnette Ciordaș100% (1)
- Tesuturi CLSF, Origine, DefinDocument36 pagesTesuturi CLSF, Origine, DefinAlexandra CismasNo ratings yet
- Model Matematica Profil PedagogicDocument1 pageModel Matematica Profil PedagogicIoana NicolescuNo ratings yet
- Administrarea Medicamentelor-Suport CursDocument44 pagesAdministrarea Medicamentelor-Suport CursCaciuc DanielaNo ratings yet
- Matematica M Pedagogic 2014 SubiecteDocument1 pageMatematica M Pedagogic 2014 SubiecteRaluca Pantazi100% (1)
- LP 5 Calcul IndicatoriDocument16 pagesLP 5 Calcul IndicatoriAlexandra CismasNo ratings yet
- Grupa VIIIA - Gazele RareDocument16 pagesGrupa VIIIA - Gazele RareAlexandra CismasNo ratings yet
- 3 Curs Vacuole Incl Ergastice Perete CelDocument31 pages3 Curs Vacuole Incl Ergastice Perete CelAlexandra CismasNo ratings yet
- Anatomia Sistemului DigestivDocument7 pagesAnatomia Sistemului DigestivAdriana BarbutaNo ratings yet
- HidrogenulDocument26 pagesHidrogenulSabina BadeaNo ratings yet
- COM 2013 325 RO ACTE FDocument6 pagesCOM 2013 325 RO ACTE FAlexandra CismasNo ratings yet
- Acidul ClorhidricDocument2 pagesAcidul ClorhidricAlexandra CismasNo ratings yet
- Grupa VA (15) (P, As, SB, Bi)Document62 pagesGrupa VA (15) (P, As, SB, Bi)Alexandra CismasNo ratings yet
- Curs05 06Document86 pagesCurs05 06Alexandra CismasNo ratings yet
- PlumbulDocument8 pagesPlumbulAlexandra CismasNo ratings yet
- AP Resp Fose NazaleDocument20 pagesAP Resp Fose NazaleAlexandra CismasNo ratings yet
- Elementele Chimice Din Organismul UmanDocument20 pagesElementele Chimice Din Organismul UmanElena Ap50% (4)
- CALCIUDocument10 pagesCALCIUAlexandra CismasNo ratings yet