Professional Documents
Culture Documents
CONMINUCION
Uploaded by
Erick DavilaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
CONMINUCION
Uploaded by
Erick DavilaCopyright:
Available Formats
1.
CONMINUCION
Desde los primeros aos de la aplicacin industrial de los procesos de conminucin al
campo de beneficio de minerales, se pudo constatar la relevancia del consumo de energa
especfica como parmetro controlante en la reduccin de tamao y granulometra final del
producto, para cada etapa de conminucin. En trminos generales, la energa consumida en
los procesos de chancado, molienda/clasificacin y remolienda, se encuentra
estrechamente relacionada con el grado de reduccin de tamao alcanzado por las
partculas en la correspondiente etapa de conminucin. Sin embargo, estudios han
demostrado que gran parte de la energa mecnica suministrada a un proceso de
conminucin, se consume en vencer resistencias nocivas tales como:
Deformaciones elsticas de las partculas antes de romperse.
Deformaciones plsticas de las partculas, que originan la fragmentacin de las mismas.
Friccin entre las partculas.
Vencer inercia de las piezas de la mquina.
Deformaciones elsticas de la mquina.
Produccin de ruido, calor y vibracin de la instalacin.
Generacin de electricidad.
Roce entre partculas y piezas de la mquina.
Prdidas de eficiencia en la transmisin de energa elctrica y mecnica.
De lo anterior, se pone en relieve la necesidad de establecer correlaciones confiables entre
la energa especfica [kWh/ton] consumida en un proceso de conminucin y la
correspondiente reduccin de tamao alcanzada en dicho proceso. En este sentido se han
propuesto 3 grandes teoras, las que a continuacin se describen.
Figura 1: Variacin del tamao del mineral.
2. LIXIVIACION
Los procesos hidrometalrgicos para la disolucin (lixiviacin) de cobre se utilizan sobre
todo en minerales que contienen xidos de cobre, de baja ley y/o complejos, y en menor
escala o para tratar concentrados
desulfuros.Los minerales de xidos de cobre pueden lixiviarse por diversosmtodos (in situ
en las minas, en terreros, en montones, o en tanques) dado que el cobre pasa fcilmente a
la solucin. Los reactivos lixiviantes ms utilizados son cidos diluidos (sulfrico
principalmente, Clorhdrico
ntrico ocasionalmente), o bien soluciones alcalinas amoniacales decarbonato de amonio.
Cuando se utiliza un cido diluido la reaccin qumica que ocurre durante el proceso de
lixiviacin de malaquita es(por ejemplo para cido sulfrico):
Cu
2
(OH)
2
CO
3 (s)
+ 2H
2
SO
4(acu)
2CuSO
4 (acu)+
CO2
(g)
+ 3H2O
(L)
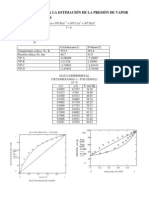
Para estudiar el avance de esta reaccin qumica en el laboratorio, es necesario estimar las
concentraciones de las diferentes especies. La concentracin de Cu 2+ en una disolucin
acuosa puede determinarse mediante la comparacin colorimtrica.
3. CALCINACION
La calcinacin es el proceso de calentar una sustancia a temperatura elevada, (temperatura
de descomposicin), para provocar la descomposicin trmica o un cambio de estado en su
constitucin fsica o qumica. El proceso, que suele llevarse a cabo en
largos hornos cilndricos, tiene a menudo el efecto de volver frgiles las sustancias.
Los objetivos de la calcinacin suelen ser:
Eliminar el agua, presente como humedad absorbida, agua de cristalizacin o agua de
constitucin rtica (como en la conversin del hidrxido frrico en xido frrico);
Eliminar el dixido de carbono (como en la calcinacin de la piedra caliza en cal en
un horno de cal), el dixido de azufre u otro compuestos orgnicos voltiles;
Para oxidar (calcinacin oxidante) una parte o toda la sustancia (usado comnmente
para convertir menas sulfurosas a xidos en el primer paso de recuperacin de metales
como el zinc, el plomo y el cobre);
Para reducir (calcinacin reductora) metales a partir de sus menas (fundicin).
Hay unas pocas finalidades ms para las que se emplea la calcinacin en casos especiales
(por ejemplo, el carbn animal). Puede llegar a una temperatura mxima de 1200 C. Su
numeracin para aumentar su temperatura depende de 10-10. Para proteccin y cuidado
no se debe tomar la muestra directamente con las manos.
Las reacciones de calcinacin pueden incluir disociacin trmica, incluyendo la destilacin
destructiva de los compuestos orgnicos (es decir, calentar un material rico en carbonoen
ausencia de aire u oxgeno, para producir slidos, lquidos y gases). Ejemplos de otras
reacciones de calcinacin son la concentracin de almina calentando bauxita, cambios de
estado polimrficos como la conversin de anatasio en rutilo, y
las recristalizaciones trmicas como la desvitrificacin del cristal. Se suelen someter a
procesos de calcinacin materiales como los fosfatos, la almina, el carbonato de
manganeso, el coque de petrleo y la magnesita marina.
El cobre se puede partir de un mineral llamado malaquita Cu
2
CO
3
(OH)
2
que es un hidroxi
carbonato de cobre.
Se calienta el mineral triturado o el Carbonato de cobre en polvo.
Se recomienda colocar 1g en una tira de papel de asbesto y colocarla sobre la tela de
asbesto en el soporte universal y calentar hasta un cambio de color.
Cu
2
CO
3
(OH)
2
CuO + H
2
O + CO
2
Al trmino el mineral del calentamiento quedar de color negro.
4. MALAQUITA
La malaquita es considerada como una piedra semipreciosa. Es un mineral considerado dentro del
grupo de los carbonatos. La mayor parte de los carbonatos son insolubles en agua y forman parte
de las rocas, de ah que la malaquita sea considerada dentro de los carbonatos.
El nombre malaquita se deriva del latn malachites, que hace alusin al color verde que
caracteriza a este mineral. Suele formarse en zonas donde se da el fenmeno de la oxidacin de
sulfuros de cobre que suelen estar enclavados en rocas calizas.
Por lo regular, junto con la malaquita se forman otros minerales como la cuprita u xido de cobre,
la azurita, la limonita entre otros.Tambin se puede formar en masas botroidales, estalactitas o
costras de dbil coloracin. Se forman con una estructura fibrosa o en capas concntricas, en
contadas ocasiones se forma como cristal.
Caractersticas fsicas de la malaquita
- Dureza de nivel 3.5 a 4, lo que lo coloca como un mineral semiduro.
- Color verde
- Su brillo puede ser ms bien mate, vtreo o sedoso.
- Tiene una densidad de 4g/cm3, por lo que se le considera como un mineral pesado.
- Suele reaccionar con cido clorhdrico, produciendo una solucin de color verde.
- Es un mineral efervescente.
- Existen varias formas para identificar a la malaquita, una de ellas es a travs de su color verde
caracterstico, otra es su asociacin con la azurita.
- Tambin se le puede diferenciar por el color de su raya en comparacin con otros minerales de
color verde.
Usos de la malaquita
Por su color verde, que est relacionado con la inteligencia, la malaquita ha sido una piedra muy
valorada en la indumentaria de reyes y nobles, as como en la decoracin de grandes palacios.
Sin embargo, en la actualidad tiene usos como:
- Piedra ornamental
- Lminas pulidas
- Fabricacin de mesas
- Produccin de pinturas
- Bisutera
- Terapia mineral
- Talismn
- Suprime sntomas del embarazo como mareos y vmito.
- Reduccin de riesgos de hemorragia.
- Carga, para dar volumen, textura, acabado y para reducir costos en la fabricacin de piezas de
resina polister.
You might also like
- IPERC-Identificación de PeligrosDocument44 pagesIPERC-Identificación de PeligrosErick DavilaNo ratings yet
- NTP 350,037-2007 EXTINTORES PORTÁTILES SOBRE RUEDAS DE POLVO QUIMICO SECO Requisitos 2a Ed PDFDocument59 pagesNTP 350,037-2007 EXTINTORES PORTÁTILES SOBRE RUEDAS DE POLVO QUIMICO SECO Requisitos 2a Ed PDFPercy Mamani Sucasaca100% (1)
- Captafaros InvDocument22 pagesCaptafaros InvErick DavilaNo ratings yet
- Parte II - Plan de Desvío de Tránsito Av. Sta RosaDocument27 pagesParte II - Plan de Desvío de Tránsito Av. Sta RosaErick DavilaNo ratings yet
- Parte ExperimentalDocument3 pagesParte ExperimentalErick DavilaNo ratings yet
- Cunetas 01.09.2014 InvDocument269 pagesCunetas 01.09.2014 InvErick DavilaNo ratings yet
- Cunetas 01.09.2014 InvDocument269 pagesCunetas 01.09.2014 InvErick DavilaNo ratings yet
- Arg Covid 19 2020 05 26 Ipc PDFDocument55 pagesArg Covid 19 2020 05 26 Ipc PDFThiago ED0% (1)
- Gibas 23.08.2014 InvDocument7 pagesGibas 23.08.2014 InvErick DavilaNo ratings yet
- Captafaros InvDocument22 pagesCaptafaros InvErick DavilaNo ratings yet
- Captafaros InvDocument22 pagesCaptafaros InvErick DavilaNo ratings yet
- Harina de PapaDocument7 pagesHarina de PapaFredy CconzaNo ratings yet
- Gibas 23.08.2014 InvDocument7 pagesGibas 23.08.2014 InvErick DavilaNo ratings yet
- Ala PucallpaDocument3 pagesAla PucallpaErick DavilaNo ratings yet
- NTP 350,043!1!2011 EXTINTORES PORTATILES Selección, Distribución, Inspección, Mantenimiento, Recarga y Prueba Hidrostática 3a EdDocument147 pagesNTP 350,043!1!2011 EXTINTORES PORTATILES Selección, Distribución, Inspección, Mantenimiento, Recarga y Prueba Hidrostática 3a EdSeguridadMinera100% (1)
- Laboratorio DifusionDocument17 pagesLaboratorio DifusionErick Davila100% (1)
- Trabajo Final de Simulacion de Descarga de TanquesDocument34 pagesTrabajo Final de Simulacion de Descarga de TanquesErick DavilaNo ratings yet
- Bbalance Economico Proyectos FinalDocument8 pagesBbalance Economico Proyectos FinalErick DavilaNo ratings yet
- Lab - Difusión Molecular en Una Película Porosa en Líquidos para Los Sistemas KOH-AguaDocument31 pagesLab - Difusión Molecular en Una Película Porosa en Líquidos para Los Sistemas KOH-AguaErick DavilaNo ratings yet
- PapaDocument164 pagesPapaErick DavilaNo ratings yet
- Estudio de MercadoDocument2 pagesEstudio de MercadoErick DavilaNo ratings yet
- Perfil de Proyecto 2diapos FinalesDocument19 pagesPerfil de Proyecto 2diapos FinalesErick DavilaNo ratings yet
- Diapositivas Difusion MolecularDocument30 pagesDiapositivas Difusion MolecularErick DavilaNo ratings yet
- 1532Document5 pages1532Erick DavilaNo ratings yet
- Data para Ciclohexano ToluenoDocument1 pageData para Ciclohexano ToluenoErick DavilaNo ratings yet
- Circulo de Deming PersonalDocument2 pagesCirculo de Deming PersonalErick DavilaNo ratings yet
- Lesionologia en Acc de Transito - PDF Versión 1Document26 pagesLesionologia en Acc de Transito - PDF Versión 1Jose Jauregui MonteroNo ratings yet
- Manual HaccpDocument123 pagesManual HaccpGustavo EstebanNo ratings yet
- Propagacion Por Yema AxilarDocument2 pagesPropagacion Por Yema AxilarJavier RamirezNo ratings yet
- Compuestos AromaticosDocument28 pagesCompuestos AromaticosvictoriaNo ratings yet
- HotPro ManualDocument12 pagesHotPro ManualRicardo VargasNo ratings yet
- Suicidio y Depresión en Adolescentes: Una Revisión de La LiteraturaDocument12 pagesSuicidio y Depresión en Adolescentes: Una Revisión de La LiteraturaFraga DavidNo ratings yet
- Caso Practico Mina LeonDocument10 pagesCaso Practico Mina LeonAdalgiza Mendoza RodriguezNo ratings yet
- Proyecto de InvestigaciónDocument60 pagesProyecto de InvestigaciónSara GacharnáNo ratings yet
- Entrevista psicológica: preguntas y respuestasDocument7 pagesEntrevista psicológica: preguntas y respuestasAdriGBNo ratings yet
- TécnicaDocument30 pagesTécnicaTomas Pereira SalvadorNo ratings yet
- Poliamor y Celos, Lara CarterDocument121 pagesPoliamor y Celos, Lara CarterReclutamiento Regional100% (1)
- Clasificacion Quimica de Los MineralesDocument8 pagesClasificacion Quimica de Los MineraleskandyyNo ratings yet
- Actividad de Aprendizaje II EJERCICIO TECNICAS DE CONTABILIDADDocument3 pagesActividad de Aprendizaje II EJERCICIO TECNICAS DE CONTABILIDADYAMIL RODRIGUEZNo ratings yet
- Guia de Trabajo Informacion ExplicitaDocument4 pagesGuia de Trabajo Informacion ExplicitaJennifer Torres Valenzuela100% (1)
- Lluvia de IdeasDocument2 pagesLluvia de Ideasleovanis pastranaNo ratings yet
- Aplicación de Métodos Combinados para ElDocument341 pagesAplicación de Métodos Combinados para ElJaime Alberto Sanchez CardonaNo ratings yet
- Amalgama Dental PDFDocument16 pagesAmalgama Dental PDFJose Francisco Canizalez HenryNo ratings yet
- Cambio ClimaticoDocument8 pagesCambio ClimaticoMh LizNo ratings yet
- Salfa-Form Eco RevdfmDocument82 pagesSalfa-Form Eco RevdfmMelissa HicksNo ratings yet
- 1ic131 - Resumen - Grupo 6Document10 pages1ic131 - Resumen - Grupo 6Joel Lee DelgadoNo ratings yet
- Simulacion Sin Test PDFDocument46 pagesSimulacion Sin Test PDFFernanda ÁvilaNo ratings yet
- Estudios Generales: Universidad Nacional Mayor de San MarcosDocument3 pagesEstudios Generales: Universidad Nacional Mayor de San Marcospersona desconocidaNo ratings yet
- Prueba de Hipotesis 1Document30 pagesPrueba de Hipotesis 1Paul SánchezNo ratings yet
- Migración Dental Fisiológica y Su Importancia para El Desarrollo de La OculusiónDocument9 pagesMigración Dental Fisiológica y Su Importancia para El Desarrollo de La OculusiónLiceth Herrera MartinezNo ratings yet
- El decálogo del buen pobreDocument4 pagesEl decálogo del buen pobreVolatile SlothNo ratings yet
- ¿Por Qué Dios Permite El Sufrimiento?Document27 pages¿Por Qué Dios Permite El Sufrimiento?United Church of God88% (8)
- Material Hereditario Grado 9noveno Primer PeriodoDocument52 pagesMaterial Hereditario Grado 9noveno Primer Periodorosangela mendoza duarteNo ratings yet
- NATACIONDocument34 pagesNATACIONLUDYS MANOSALVA QUINTERONo ratings yet
- Clase #8 - Transfusiones en Cirugia (Dr. Burgos)Document35 pagesClase #8 - Transfusiones en Cirugia (Dr. Burgos)Ana Luisa Tacanga RodriguezNo ratings yet
- Prueba Quinto Básico Historia Zonas Naturales ChileDocument6 pagesPrueba Quinto Básico Historia Zonas Naturales ChileKatheryn Canales100% (1)