Professional Documents
Culture Documents
Introduccion A La Termotecnia
Uploaded by
Bernardo DelgadoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Introduccion A La Termotecnia
Uploaded by
Bernardo DelgadoCopyright:
Available Formats
1ema 01.
ConcepLos lundamenLales
1ermodlnmlca y 1ermoLecnla
!"#$%&'$($ *+,"-"(+. /0+12
3+4+,0$"2 *5 67,+. 8+#+9$'
:$,'29 ;5 8+"+(2 <9=7>$"+.
u1C. uL lnCLnlL8lA LLLC18lCA ? LnL8CL1lCA
LsLe Lema se publlca ba[o Llcencla:
Creauve Commons 8?-nC-SA 3.0
T1.- CONCEPTOS FUNDAMENTALES
TERMODINMICA Y TERMOTECNIA (GIE y GIEA)
T 01.- Conceptos Fundamentales
Objetivos:
El primer tema de este bloque est destinado a introducir al estudiante en
algunos de los conceptos y definiciones fundamentales de aplicacin en los
siguientes temas dedicados a la Termodinmica
T1.- CONCEPTOS FUNDAMENTALES
1.- Introduccin (I)
1.- Introduccin
2.- Sistema Termodinmico
3.- Propiedades de un Sistema
4.- Procesos y Cambios de Estado
5.- Ecuaciones de Estado
Termodinmica procede del griego therme (calor) y dynamis (fuerza)
Termotecnia es la rama de la ciencia tecnolgica que se ocupa del control
industrial de las aplicaciones del calor
En Termodinmica lo usual es trabajar con fluidos compresibles
(gases y vapores)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
INGENIERIA
Elctrica
Trmica
Mecnica
Electrnica
Procesos Estruc.
Termodinmica
Termodinmica
Tcnica
Termodinmica
Qumica
Procesos
Termodinmicos
Sistemas y
Dispositivos
Termotecnia
M. Fluidos
1.- Introduccin (II)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
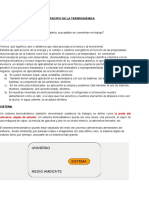
1.- Sistema Termodinmico (I)
SISTEMA
FRONTERA
ENTORNO
Sistema: parte de materia o regin sobre la que se fija el estudio
Frontera: lmites de un sistema
Entorno, Ambiente o Medio Circundante: materia o regin que rodea al sistema
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
1.- Sistema Termodinmico (II)
No intercambian materia con el entorno
Si intercambian materia
No intercambian con el entorno ni materia, ni energa
Paredes rgidas, adiabticas e impermeables
No cumplen las condiciones anteriores
Macroscpicamente homogneos
Isotrpicos
Sin carga elctrica
Qumicamente inertes
No estn sometidos a campos elctricos, magnticos,
ni gravitatorios
No presentan efectos de borde
No cumplen las condiciones anteriores
S
I
S
T
E
M
A
S
Aislados
No aislados
Simples
Compuestos
Cerrados
Abiertos
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Sistemas Cerrados
su masa no vara
ej: interior de un cilindro
Sistemas Abiertos
una masa fluye en un volumen
ej turbina de vapor
1.- Sistema Termodinmico (III)
gas
F
P
atm
. S
P . S
Volumen de control
continuamente atravesado por una masa
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
1.- Sistema Termodinmico (IV)
F
R
O
N
T
ER
AS
Rgidas
Mviles
No dejan pasar el calor
Permiten el paso del calor
Adiabticas
Diatrmanas
Permiten el paso de sustancias
Permeables
Impermeables
Semipermeables
No permiten el paso de sustancias
Permiten el paso de sustancias hacia un
slo lado de la pared
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
1.- Sistema Termodinmico (V)
Un sistema es adiabtico cuando sus fronteras lo son, esto es independiente
de si el sistema es abierto o cerrado
Paredes Adiabticas, trmicamente aisladas, no permiten paso del calor
Sistema Adiabtico (trmicamente aislado) sin aporte ni extraccin de calor
Las clasificaciones por Sistemas y Fronteras son independientes
Si p
a
> p
b
Se mueve hasta
p
a
= p
b
Sistema A Sistema B
p
B
p
A
Paredes elsticas, con movimiento (cilindros, mbolos o membranas)
Paredes inelsticas, sin movimiento
Embolo
Sistema A Sistema B
p
B
p
A
Membrana
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Entorno
Sistema
Abierto
Calor
Materia
Trabajo
Sistema
Aislado
Sistema
Cerrado
Calor
Trabajo
Sistema
Adiabtico
Materia
Trabajo
Turbina
Embolo
Turbina aislada
1.- Sistema Termodinmico (VI)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
1.- Sistema Termodinmico (VII)
Sistema en Equilibrio Termodinmico: las variables termodinmicas son
uniformes en todo el sistema
Temperatura
Presin
Composicin Qumica
Equilibrio trmico (= T)
Equilibrio mecnico (= p)
Equilibrio qumico (= comp.)
Entorno
Tiempo de Relajacin: el que tarda un sistema, fuera de
su estado de equilibrio, en regresar a
l
El calor se transmite del sistema de mayor al de menor T
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Principio Cero de la Termodinmica: los sistemas tienden de forma
natural al equilibrio trmico
Equilibrio
trmico
Sistema 1
Sistema 2
Sistema 3
Equilibrio
trmico
Equilibrio
trmico
Entorno
1.- Sistema Termodinmico (VIII)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Las de carcter universal son:
Presin
Temperatura
Las propiedades estn relacionadas, si se conocen algunas, las otras
quedan determinadas
Otras:
El volumen especfico
La viscosidad
La Termodinmica aade:
La energa interna
La entalpa
La entropa,
2.- Propiedades de un Sistema (I)
Ec. estado
Propiedades Termodinmicas: son las magnitudes fsicas que describen
el estado de un sistema termodinmico
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
2.- Propiedades de un Sistema (II)
Excepto la temperatura, T; t es el tiempo
X
1
X
2
Se divide el sistema en dos partes
por una superficie imaginaria
Propiedad Extensiva Y: Y = Y
1
+ Y
2
Propiedad Intensiva X: X = X
1
= X
2
Energa
Masa
Volumen
Presin
Temperatura
Densidad,
Intensivas: no dependen de la masa en la que se considera
Se nombran con letras minsculas
M = M
1
+ M
2
T = T
1
= T
2
Extensivas: dependen de la masa en la que se considera
Se nombrarn con letras maysculas
Y
2
Y
1
Especficas: relativizan las Extensivas
dividiendo por la masa
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (I)
Cuando un sistema pasa de un estado a otro, la variacin de sus
propiedades slo depende del estado inicial y final, y no de las
situaciones intermedias
La Ec de Estado relaciona las propiedades en cada punto
Aire a 20C y 1 bar
Santander
Aire a 35C y 0,9 bar
Madrid
Lo traslado a
Lleno un globo
de aire
Alcanza las propiedades de
Independientemente
del camino recorrido
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (II)
La Expansin de un sistema (aumento de volumen) sucede cuando la
fuerza interior es mayor que la fuerza exterior
F
p
int
.S
p
atm
.S
p
int
.S
F
p
atm
.S
Exp.
Lo contraro a una expansin es una Compresin (disminucin del
volumen), sucede cuando la fuerza exterior es mayor a la interior
Comp.
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (III)
Expansin / Compresin Resistida cuando F
int
! F
ext
los estados intermedios son de equilibrio
Expansin / Compresin Libre cuando F
int
>>> F
ext
los estado intermedios no son de equilibrio
Un Sistema cerrado est en Equilibrio cuando el valor de sus
propiedades es idntico en todos sus puntos
Cuando un sistema cambia de un estado en equilibrio a otro tambin en
equilibrio, los estados intermedios pueden ser, o no, de equilibrio
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (IV)
No Equilibrio
Equilibrio
p
int
.S
p
atm
.S
F
p
int
.S
p
atm
.S
Peso
p
int
.S
p
int
.S
! Pesos"0
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (V)
El Calentamiento o Enfriamiento de un sistema se puede considerar
como una sucesin de estados en equilibrio
La Mezcla de Sistemas no se puede
considerar como una sucesin de
estados en equilibrio
Toda la masa se calienta
Uniformemente (a la vez)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
3.- Procesos de cambio de Estado (VI)
Transformaciones Termodinmicas: sucesin de estados por los que
pasa un sistema cuando se le somete a un cambio
Calentar agua de 0 a 50C; calentar de 0 a 80 y enfriarlo a 50;
Para que haya Transformaciones Termodinmicas es preciso que se
produzca intercambio de energa con el medio exterior
La transformacin se puede realizar de diferentes modos, cada uno de
ellos es un Proceso Termodinmico
Calentar con agua caliente, calentar con una resistencia elctrica,
Diagrama de Estado es cualquier representacin de dos propiedades
Termodinmicas de un sistema, un ejemplo tpico es el diagrama p-v
0C 10C 50C 0C 80C 50C
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
La representacin de una Transformacin en un Diagrama de Estado:
Si los estados intermedios son de equilibrio, una lnea
Si los estados intermedios no lo son, recta con trazo discontinuo
3.- Procesos de cambio de Estado (VII)
El trabajo depende del
camino recorrido
Lo traslado a
Lleno un globo
de aire
Alcanza las propiedades de
Independientemente
del camino recorrido
Pero el trabajo para alcanzar las condiciones si depende del camino recorrido
V
P
V
1
V
2
1
2
P
1
P
2
V
P
V
1
V
2
1
2
P
1
P
2
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
En las mquinas trmicas un sistema evoluciona a
travs de una serie de transformaciones que se
acaban cerrando formando un Ciclo Termodinmico
3.- Procesos de cambio de Estado (VIII)
Conocer el Ciclo implica que las transformaciones
sean conocidas (estados intermedios)
Para conocer el trabajo desarrollado en el ciclo hay que aproximar las
transformaciones reales por transformaciones tericas (conocidas)
Lo traslado a
Lleno un globo
de aire
Alcanza las propiedades de
Independientemente
del camino recorrido
En la vida real, aun por la misma carretera, no se conoce con exactitud el
camino recorrido, por lo que se ofrece una distancia recorrida media
V
P
V
1
P
1
1
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Isocora a volumen constante (v = cte)
se calienta o enfra con lmites inelsticos
Isbaras, a presin constante (p = cte),
se calienta o enfra con lmites elsticos
3.- Procesos de cambio de Estado (IX)
V
P
V = cte
p = cte
T, p
Peso)
p
int
.S
Transformaciones bsicas son: (I)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
" : exponente adiabtico:
1,66 en gases monoatmicos
1,40 en gases biatmicos
1,33 en gases triatmicos
Politrpicas, son las transformaciones reales
(p v
n
= cte)
n : exponente politrpico:
-Iscoras, n = #
-Isbaras, n = 0
-Isotermas, n = 1
-Adiabticas, n = "
3.- Procesos de cambio de Estado (X)
! aire
! es el exponente adiabtico, f(T),
No es el peso especfico
Isotermas, a temperatura constante (T = cte)
Transformaciones bsicas son: (II)
Adiabticas o isoentrpicas, sin transferencia
de calor, adems no debe existir aporte de calor
por rozamiento interno (p v
"
= cte)
V
P
T= p.V = cte
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
En una expansin adiabtica (isoentrpica) T $
En una compresin adiabtica T %
Si se tienen dos puntos de una politrpica se puede determinar el exponente:
n se calcula:
3.- Procesos de cambio de Estado (XI)
V
P
T
a
S (Q=0)
T
b
>T
a
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
- Iscoras, n = #
- Isbaras, n = 0
- Isotermas, n = 1
- Adiabticas, n = "
3.- Procesos de cambio de Estado (XII)
" : exponente adiabtico:
1,66 en gases 1at
1,40 en gases 2 at
1,33 en gases 3 at
R en los gases ideales
R referido a la masa molecular del gas, M
Sustancia
M
(kg/kmol)
R
(J/kg K)
H
2
2,016 4124,4
O
2
32 259,83
H
2
O 18,016 461,52
C 12,011 692,26
Isoterma en un gas ideal
(hiprbolas equilteras)
V
P
n = " (s = cte)
n = 1 (T = cte)
n = 0 (p =cte)
n = -1
n = # (v = cte)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
La relacin entre T y p:
La relacin entre T y volumen:
3.- Procesos de cambio de Estado (XIII)
Politrpica en un gas ideal
La relacin entre p y v:
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Analizar dimensionalmente las expresiones:
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Una sustancia pura puede estar en tres
estados, y puede cambiar de uno a otro:
slido (S)
lquido (L)
gaseoso o vapor (V)
Los cambios de fase se pueden
representar en un diagrama
Curvas de fusin, vaporizacin o
sublimacin
Las curvas convergen en el pto triple
4.- Ecuaciones de Estado (I)
P
r
e
s
i
n
Tc
p =cte
S
-
L
S
S-V
Lquido
V
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
T 01.- CONCEPTOS FUNDAMENTALES
4.- Ecuaciones de Estado (II)
P
r
e
s
i
n
A
B
C
D
E
F
G
A
B
C
D
E
F
G
A
B
C
D
E
F
G
A
B
C
D
E
F
G
H
H
H
H
T
P
T
V
P
V
T
-
V
T1.- CONCEPTOS FUNDAMENTALES
V
P
Tc
Pto. Cto.
T>Tc
T<Tc
L-V
L
G
V
4.- Ecuaciones de Estado (III)
El cambio de lquido a gas se puede
realizar:
Progresivamente, pasando por una fase
de vapor hmedo
Instantaneamente, de lquido a gas
El paso progresivo atraviesa la zona de
vapor hmedo, que est limitada por las
curvas de:
lquido saturado y
vapor saturado
Los ciclos de algunas mquinas trabajan en la zona de vapor hmedo
(turbinas de vapor, o las de refrigeracin por compresin, )
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Se llama vapor sobrecalentado o
vapor recalentado a la fase en la que
a T cte se puede llegar a condensar
V
P
Tc
Pto. Cto.
T>Tc
T<Tc
L-V
L
G
V
4.- Ecuaciones de Estado (IV)
Se llama gas a la fase que no se
puede licuar sin bajar la temperatura.
Los motores de combustin y las turbinas
de gas trabajan en esta zona
La Isoterma Crtica, marca una
diferencia entre la zona de vapor
sobrecalentado y de gas
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
4.- Ecuaciones de Estado (V)
Tabla con las
propiedades
del lquido
Tablas con las
propiedades
del vapor
Vapor hmedo:
V
T
Vapor
Liq.
Vapor hmedo
Liq. Sat.
Vap. Sat.
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
4.- Ecuaciones de Estado (VI)
Propiedades del agua lquida
Temperatura
(C)
Densidad
& (kg/m
3
)
Calor Especfico
c
p
(J/kgC)
Conductiv.
trmica
k (W/mC)
Visc. dinm.
'.10
6
(N.seg/m
2
)
Visc. cinem.
(.10
6
(m
2
/seg)
0 999,9 4226 0,558 1794 1,789
20 998,2 4182 0,597 1004 1,006
40 992,3 4178 0,633 653,0 0,658
60 983,2 4181 0,658 470,0 0,478
80 971,8 4194 0,673 353,7 0,364
100 958,4 4211 0,682 281,0 0,294
140 926,1 4279 0,687 198,2 0,214
180 887,0 4413 0,678 153,5 0,173
220 840,5 4606 0,656 126,0 0,150
260 784,0 4944 0,614 107,5 0,137
300 712,5 6594 0,543 94,1 0,132
Ojo al 10
6
" a 300C = 94,1 x 10
-6
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
4.- Ecuaciones de Estado (VII)
Propiedades del agua saturada (lquido-vapor)
Volumen especifico Energa interna Entalpa Entropa
m
3
/ kg kJ / kg kJ / kg kJ / kg K
Liquido Vapor Liquido Vapor Liquido Vapor Vapor Liquido Vapor
Temp, Presin sat, sat, sat, sat, sat, vaporiz, sat, sat, sat,
C bar v
f
x 10
3
v
g
u
f
U
g
h
f
h
fg
h
g
s
f
s
g
,01 0,00611 1,0002 206,136 0,00 2375,3 0,01 2501,3 2501,4 0,0000 9,1562
10 0,01228 1,0004 106,379 42,00 2389,2 42,01 2477,7 2519,8 0,1510 8,9008
20 0,02339 1,0018 57,791 83,95 2402,9 83,96 2454,1 2538,1 0,2966 8,6672
30 0,04246 1,0043 32,894 125,78 2416,6 125,79 2430,5 2556,3 0,4369 8,4533
50 0,1235 1,0121 12,032 209,32 2443,5 209,33 2382,7 2592,1 0,7038 8,0763
100 1,014 1,0435 1,673 418,94 2506,5 419,04 2257,0 2676,1 1,3069 7,3549
200 15,54 1,1565 0,1274 850,65 2595,3 852,45 1940,7 2793,2 2,3309 6,4323
374,14 220,9 3,155 0,003155 2029,6 2029,6 2099,3 0 2099,3 4,4298 4,4298
-
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
4.- Ecuaciones de Estado (VIII)
Propiedades del vapor seco
T v u h s
C m
3
/kg kJ / kg kJ / kg kJ / kg K
p = 1,0 bar = 0,10 MPa
(Tsat = 99,63C)
Sat 1,694 2506,1 2675,5 7,3594
100 1,696 2506,7 2676,2 7,3614
120 1,793 2537,3 2716,6 7,4668
160 1,984 2597,8 2796,2 7,6597
200 2,172 2658,1 2875,3 7,8343
280 2,546 2779,6 3034,2 8,1445
320 2,732 2841,5 3114,6 8,2849
360 2,917 2904,2 3195,9 8,4175
400 3,103 2967,9 3278,2 8,5435
500 3,565 3131,6 3488,1 8,8342
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
Sustancia
T
k
(C)
p
k
(bar)
&
k
(kg/m
3
)
O
2
-118,4 50,8 410
H
2
O 347,15 221,2 310
CO -140,2 35 301
NH
3
132,3 112,8 235
En los Gases Reales la
ecuacin de estado es:
Z el factor de compresin (1 en los ideales)
A altas T se comportan como ideales
Se llaman Magnitudes Reducidas a los
valores del un estado divididos por los del
punto crtico
4.- Ecuaciones de Estado (IX)
T 01.- CONCEPTOS FUNDAMENTALES
T1.- CONCEPTOS FUNDAMENTALES
En Termodinmica la T se expresa en grados Kelvin:
Se trabaja con las presiones absolutas en Pa
Por ltimo, MUCHO OJO A
Si se quisiera trabajar en C:
Si se quisiera trabajar en bar:
Ningn libro de Termo lo hace
T 01.- CONCEPTOS FUNDAMENTALES
You might also like
- Termodinámica fundamentalesDocument29 pagesTermodinámica fundamentalesalvin875No ratings yet
- Conceptos Funadamentales de TermodinamicaDocument30 pagesConceptos Funadamentales de TermodinamicaKermic García CabezaNo ratings yet
- Ingeniería Térmica Conceptos FundamentalesDocument8 pagesIngeniería Térmica Conceptos FundamentalesJOSE ESCOBAR HERRERANo ratings yet
- Tema 6-IntroducciónDocument24 pagesTema 6-IntroducciónBuake PerezaNo ratings yet
- TTC1 IntroDocument27 pagesTTC1 Introlucia lopez lopezNo ratings yet
- Termodinámica Ingeniería Industrial Profesor: Sr. Diego Lois S. Ingeniero Civil de Industrias PUCDocument34 pagesTermodinámica Ingeniería Industrial Profesor: Sr. Diego Lois S. Ingeniero Civil de Industrias PUCMauricio AvilaNo ratings yet
- T02 TrabajoDocument45 pagesT02 TrabajoKaren MesaNo ratings yet
- Termodinámica: Conceptos básicos y primeras leyesDocument125 pagesTermodinámica: Conceptos básicos y primeras leyesMaximiliano GuerreroNo ratings yet
- Termodinámica Capítulo 1Document38 pagesTermodinámica Capítulo 1Ignacio MoránNo ratings yet
- TM V2201 M02 TrabajoDocument45 pagesTM V2201 M02 TrabajoLuis Jose Parra MolinaNo ratings yet
- Tema 1Document9 pagesTema 1marta nieto criadoNo ratings yet
- Clase 1 Termo Uni-2018Document37 pagesClase 1 Termo Uni-2018JEANCARLOCGNo ratings yet
- TEMA 1. Conceptos TermodinámicaDocument23 pagesTEMA 1. Conceptos TermodinámicaDveLópezNo ratings yet
- 01 Conceotos BasicosDocument14 pages01 Conceotos BasicosPablo GonzálezNo ratings yet
- Termodinamica I - Unidad 1Document32 pagesTermodinamica I - Unidad 1Jorge VargasNo ratings yet
- 02temperatura y GasesDocument25 pages02temperatura y GaseszzAndreszzNo ratings yet
- Guia de Estudio TermodinamicaDocument39 pagesGuia de Estudio TermodinamicaRember PeñaNo ratings yet
- Primer Principio de La TermodinámicaDocument33 pagesPrimer Principio de La TermodinámicaEmily Yael Amaro SanchezNo ratings yet
- Termodinamica Primera LeyDocument23 pagesTermodinamica Primera LeySaul Percy Centeno GomezNo ratings yet
- TERMODINAMICA - Introuccion A Manifestaciones D EnergiaDocument61 pagesTERMODINAMICA - Introuccion A Manifestaciones D EnergiaGustavoAraujoNo ratings yet
- Documento 3Document7 pagesDocumento 3DavidNo ratings yet
- 3.2interacciones de ClorDocument21 pages3.2interacciones de Clorabrova123No ratings yet
- Introducción a la Fisicoquímica y sus Conceptos BásicosDocument45 pagesIntroducción a la Fisicoquímica y sus Conceptos BásicosCristhian FGNo ratings yet
- Guía de estudio Termodinámica: conceptos, leyes y ejerciciosDocument40 pagesGuía de estudio Termodinámica: conceptos, leyes y ejerciciosKlinsmann DiegoNo ratings yet
- Termo 1º BacDocument17 pagesTermo 1º BacMiguel El RuSsNo ratings yet
- Primera Ley de La TermodinmicaDocument91 pagesPrimera Ley de La TermodinmicaJuan Antonio CarlosNo ratings yet
- Tema1 IntroducciónDocument10 pagesTema1 IntroducciónanfosellNo ratings yet
- SESION 0 6-Primera Ley-18.2Document31 pagesSESION 0 6-Primera Ley-18.2Rony Obregon ArellanNo ratings yet
- 1 Introducción FISICOQUÍMICADocument46 pages1 Introducción FISICOQUÍMICAalexander50% (2)
- Termodinámica 2023Document37 pagesTermodinámica 2023El PomberoNo ratings yet
- Termodinámica Aplicada. 2° CLASE 2020-2Document21 pagesTermodinámica Aplicada. 2° CLASE 2020-2VALERIA NAYELI JORDÁN CERVANTESNo ratings yet
- Guia de Termodinámica IDocument39 pagesGuia de Termodinámica IPedro MorenoNo ratings yet
- Tema 3 QUÍMICA - Leccion - 3Document46 pagesTema 3 QUÍMICA - Leccion - 3Natalia Guisasola BlancoNo ratings yet
- Termodinamica 1Document16 pagesTermodinamica 1Marivel FloresNo ratings yet
- Introducción y Conceptos Básicos - PPT (Inganieria Termica) ChikilinDocument28 pagesIntroducción y Conceptos Básicos - PPT (Inganieria Termica) ChikilinAlcides Hermoza MejiaNo ratings yet
- FS-1112 Resúmen de Termodinámica PDFDocument18 pagesFS-1112 Resúmen de Termodinámica PDFDaniel VelaNo ratings yet
- Unidad II TermodinamicaDocument13 pagesUnidad II TermodinamicaalbertNo ratings yet
- Termodinámica química principiosDocument49 pagesTermodinámica química principiosDANIEL AARON HUARHUA LOPEZNo ratings yet
- Apuntes PPQ 2021Document63 pagesApuntes PPQ 2021Martin Balladares OrellanaNo ratings yet
- TermodinámicaDocument23 pagesTermodinámicaWilmar Villalva CañaviNo ratings yet
- Termodinamica # 2 - 1 - 3 - 1 - 2Document30 pagesTermodinamica # 2 - 1 - 3 - 1 - 2Rosario Gutierrez CelisNo ratings yet
- Principios de TermodinámicaDocument31 pagesPrincipios de TermodinámicaDylan SuarezNo ratings yet
- Termodinamica - Grupo 5Document19 pagesTermodinamica - Grupo 5Marko Nick Elizalde MenaNo ratings yet
- Termodinámica Curs 2014Document51 pagesTermodinámica Curs 2014Carme Ávila BusquetsNo ratings yet
- Física 11 GUÍA DE TRABAJO Y ENTREGABLE Sem 7 A 9 Periodo 2Document8 pagesFísica 11 GUÍA DE TRABAJO Y ENTREGABLE Sem 7 A 9 Periodo 2Jostin NaviaNo ratings yet
- Termodinámica: Conceptos básicos de sistemas, procesos y leyesDocument8 pagesTermodinámica: Conceptos básicos de sistemas, procesos y leyesArian Alejandra Becerra RodriguezNo ratings yet
- Tema1-conceptos_basicosDocument16 pagesTema1-conceptos_basicosPol MadoNo ratings yet
- Ucci - Termo 02 - 2018-22Document57 pagesUcci - Termo 02 - 2018-22Kukin Erik Usquiano Uscuvilca100% (1)
- Termo 2006Document4 pagesTermo 2006gsl-5No ratings yet
- Termodinamica BasicaDocument16 pagesTermodinamica BasicaJony LópezNo ratings yet
- Clase Unidad 1-1 2023Document26 pagesClase Unidad 1-1 2023Clau AvendañoNo ratings yet
- Termodinamica # 2 - 1 - 3Document30 pagesTermodinamica # 2 - 1 - 3JOSE LUIS QUISPE GARAYNo ratings yet
- Quimca I-Cap.2Document52 pagesQuimca I-Cap.2edison Puma taypeNo ratings yet
- Presentacion TERMODINÁ..Document15 pagesPresentacion TERMODINÁ..rinocefaloNo ratings yet
- 15 1º Ley TermodinámicaDocument19 pages15 1º Ley Termodinámicasaulcarvajal23No ratings yet
- Sistema TermodinámicoDocument3 pagesSistema TermodinámicoAlexis RomeroNo ratings yet
- UF1026 - Caracterización de procesos e instalaciones frigoríficasFrom EverandUF1026 - Caracterización de procesos e instalaciones frigoríficasRating: 4 out of 5 stars4/5 (1)
- Mantenimiento de motores térmicos de dos y cuatro tiempos. TMVG0409From EverandMantenimiento de motores térmicos de dos y cuatro tiempos. TMVG0409Rating: 4 out of 5 stars4/5 (1)
- M Computacion I PDFDocument84 pagesM Computacion I PDFosvaldd74No ratings yet
- Matemáticas Fundamentales para Ingenieros - (Bernardo Frias Acevedo)Document441 pagesMatemáticas Fundamentales para Ingenieros - (Bernardo Frias Acevedo)qfacu50% (2)
- Optica y Ondas ResumenDocument12 pagesOptica y Ondas ResumenBernardo DelgadoNo ratings yet
- Mediciones y ErroresDocument52 pagesMediciones y ErroresDaniel Nuñez FalconNo ratings yet
- Manual Laboratorio Fisica General 2-2012 - EneroDocument158 pagesManual Laboratorio Fisica General 2-2012 - EneroAton RaNo ratings yet
- Ondas Es FisicaDocument232 pagesOndas Es Fisicacladimarce9306No ratings yet
- Las Tablas de TothDocument76 pagesLas Tablas de TothBernardo DelgadoNo ratings yet
- Estructura Organizacional, ExposicionDocument2 pagesEstructura Organizacional, ExposicionBernardo DelgadoNo ratings yet
- Informe de Penetrometro y VeletaDocument11 pagesInforme de Penetrometro y VeletaDaniel EscarcenaNo ratings yet
- Qui MicaDocument9 pagesQui MicaDiego Ruiz LópezNo ratings yet
- Ejercicios Energia Mecanica PDFDocument3 pagesEjercicios Energia Mecanica PDFazucar33% (3)
- Biología Celular y Molecular-Tarea 2Document7 pagesBiología Celular y Molecular-Tarea 2Katherine CalaNo ratings yet
- Ensayo La Arquitectura y El Medio Natural Mario Chavarria BarbozaDocument4 pagesEnsayo La Arquitectura y El Medio Natural Mario Chavarria BarbozaImpresos ChbNo ratings yet
- Eficiencia de RiegoDocument7 pagesEficiencia de RiegoAngelica Rejas RejasNo ratings yet
- Guia Laboratorio Mezclas FertilizantesDocument4 pagesGuia Laboratorio Mezclas FertilizantesJavier Andrés Quintero JaramilloNo ratings yet
- Producción de Amoniaco A Partir de Gas de SíntesisDocument4 pagesProducción de Amoniaco A Partir de Gas de SíntesisAlexander PicoNo ratings yet
- Absorsistem - Introducción Yazaki xhk60Document3 pagesAbsorsistem - Introducción Yazaki xhk60sgsierraNo ratings yet
- Estudio de Las Propiedades Fisicas de PeliculasDocument8 pagesEstudio de Las Propiedades Fisicas de Peliculasgladys_zapanaNo ratings yet
- Santuarios, Reservas Parques NacionalesDocument10 pagesSantuarios, Reservas Parques NacionalesCristina Elizabeth Rendon PerezNo ratings yet
- Versin Doc-Fisica 10 - 2012 - II PDocument133 pagesVersin Doc-Fisica 10 - 2012 - II Pmzambrano2No ratings yet
- 3 Badellon Eddy''Politicas de Exploracion Minera en BoliviaDocument33 pages3 Badellon Eddy''Politicas de Exploracion Minera en Boliviaapi-3719665No ratings yet
- Qué Es La Sobrepoblación Mundial 11ºDocument3 pagesQué Es La Sobrepoblación Mundial 11ºStevan SernaNo ratings yet
- Tarea de Geografía 4Document1 pageTarea de Geografía 4Carlos M.No ratings yet
- Informe Reactivos - Cnel EpDocument13 pagesInforme Reactivos - Cnel EpRaul PaucarNo ratings yet
- Acústica en auditorios menos deDocument17 pagesAcústica en auditorios menos deAlexandra Cabrera SaavedraNo ratings yet
- Taller de ComicDocument6 pagesTaller de ComicGina PinkNo ratings yet
- La Leyes de A TermodinamicaDocument30 pagesLa Leyes de A TermodinamicaSergio Gutiérrez Di Filippo0% (2)
- 4406 Mapa de Peligros Plan de Usos Del Suelo Ante Desastres y Medidas de Mitigacion de La Ciudad de HuancayoDocument245 pages4406 Mapa de Peligros Plan de Usos Del Suelo Ante Desastres y Medidas de Mitigacion de La Ciudad de HuancayoJesus Soriano RosalesNo ratings yet
- 100 Experimentos Sencillos de Física y QuímicaDocument138 pages100 Experimentos Sencillos de Física y QuímicaFrancisco Roberto AldereteNo ratings yet
- Mecánica de Los Fluidos - Propiedades de Los Fluidos (EJEMPLOS)Document11 pagesMecánica de Los Fluidos - Propiedades de Los Fluidos (EJEMPLOS)FRANCISCO JAVIER FUNDADOR RODRIGUEZNo ratings yet
- Hidrologia Rio CumbazaDocument47 pagesHidrologia Rio CumbazaAndrey Vela100% (5)
- Actividad Integradora 3Document4 pagesActividad Integradora 3Yomozuki YamilethNo ratings yet
- Tormenta solar de agosto: ¿Amenaza real o exageraciónDocument5 pagesTormenta solar de agosto: ¿Amenaza real o exageraciónramiroNo ratings yet
- Spa 2017-I - Geologia AplicadaDocument11 pagesSpa 2017-I - Geologia Aplicadakati_ros_16No ratings yet
- Geografía Introducción Al Campo de Estudio de La GeografíaDocument9 pagesGeografía Introducción Al Campo de Estudio de La GeografíaVictorm VelazquezNo ratings yet
- Mills La Imaginacion Sociologica ResumenDocument4 pagesMills La Imaginacion Sociologica Resumensofia hNo ratings yet
- Unidad 3 - 1C - 2021 - VF2Document35 pagesUnidad 3 - 1C - 2021 - VF2nahuel54No ratings yet
- Analizador de GasesDocument5 pagesAnalizador de Gasesrywer luna choqueNo ratings yet