Professional Documents
Culture Documents
Determinación de La Densidad de Un Gas
Uploaded by
Windibel Gutierrez SalgueroCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Determinación de La Densidad de Un Gas
Uploaded by
Windibel Gutierrez SalgueroCopyright:
Available Formats
Determinacin de la densidad de un gas
1. Objetivos
2. Introduccin terica.
3. En usos industriales.
4. Cuestionario
5. Conclusiones
6. ibliogra!"a
O#E$I%O&'
* Producir oxigeno por la descomposicin de bixido de plomo (PbO2).
* Calcular la densidad del oxigeno, a las condiciones a las que se desarrolla el experimento.
* Corregir la densidad del oxigeno, de las condiciones del experimento a la estandar de temperatura
y presin.
* Determinar el error relatio, comparando la densidad experimental contra la densidad terica del
oxigeno.
I($)OD*CCI+( $E+)IC,.
Para poder determinar la densidad de un material, es necesario conocer el peso especi!ico de cada
material, es decir la relacin que existe entre ("#m
$
), esto es la masa multiplicada por la graedad
entre el olumen que ocupa% por otra parte es necesario mencionar que la densidad es la relacin
que existe entre la masa de un material y el olumen que ocupa y sus unidades son di!erentes a las
de el peso especi!ico, ya que est&n dadas en ('g#m
$
).las unidades de densidad y peso especi!ico se
pueden expresar en la unidades del sistema ingles.
Para lo anterior tenemos lo siguiente(
3
m
kg
v
m
= =
)ntonces de acuerdo a la !ormula anterior, podemos *acer una relacin con la !ormula de los gases
ideales, lgicamente sabiendo los principios de los gases ideales se *ace la siguiente relacin,
entonces tenemos(
mol
g
Pm
m
n
nRT PV
= =
=
n
m
P
g n P m
M
M
=
= =
)ntonces tenemos(
( )( )
( ) ( )
( )
( ) ( ) ( )
( )( )
( )
DENSIDAD
T R
P P
T R P P
V
T R m
P P
V P
T R m
P
entonces
v
m
pero T R
P
m
PV nRT PV
M
M M M
M
= = = = = = =
= =
) (
) )( (
:
Pero traba+ando con un sistema particular, en este caso de gases, tenemos lo siguiente(
( )
( ) T R
P P
i M i
i
=
, densidad del gas% m , masa del gas% % , olumen del sistema% -. , peso molecular del gas%
) , constante uniersal de los gases% - , presin del sistema y $ , temperatura del sistema. -odas
las ariables con sus unidades correspondientes.
.dem&s de esto sabemos que la densidad de un gas esta en proporcin directa a la presin e
inersa a la temperatura la densidad de los gases se puede rescribir de presin inicial y presin !inal
esto es(
i f
f i
i
f
f
i
T P
T P
V
V
= =
/sando las !ormulas anteriores, podemos determinar la densidad de un gas, a continuacin se
presentan una serie de procedimientos, que se reali0an , para determinados experimentos, estos
tambien an ligados para la determinacin de la densidad de un gas.
E( *&O& I(D*&$)I,/E&.
.edicin de densidad continuo 0$ransmisor de densidad1.
)l medidor de densidad *a mostrado grandes enta+as e insuperables cualidades, cuando se trata de
procesos, que por su comple+idad necesita del monitoreo de la densidad con altos 1ndices de
precisin% ya que al *acerlo en l1nea se eita el uso de un laboratorio y toda la cantidad de muestras
que se deban tomar, que aunque se tomaran a interalos muy cortos, siempre tendr1amos un
des!asamiento entre la medicin e!ectuada y la densidad real (actual) a tra2s de la tuber1a, adem&s
que el detector en1a una se3al de control. )ste tipo de medidores tienen gran demanda en la
industria de la re!inacin de gasolinas y deriados del petrleo, por lo cr1tico de sus procesos y lo
peligroso de las &reas donde se requieren, el procedimiento anterior se emplea en procesos
comple+os.
Para reali0ar este experimento, utili0amos el siguiente material.
DE&,))O//O E2-E)I.E($,/'
,ctividad 1.4 Pesamos en la balan0a electrnica 5,6g de bixido de plomo (PbO2), el cual se meti
al tubo de ensayo, obtuimos los siguientes datos(
7asa del tubo de ensaye ac1o( 22334g
7asa de tubo de ensaye 8 (PbO2)( 22354g
7asa de (PbO2)( 435g
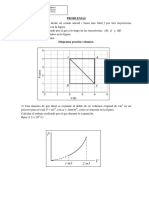
,ctividad 2.4 9e monto el equipo de traba+o como se muestra en el (dibu+o), cabe mencionar que se
*i0o con bastante precaucin para no causar alg:n da3o al material% (en este caso no se uso al aso
de precipitados de 265ml
;lenamos con agua el !rasco de boca anc*a *asta donde un tubo de idrio de conexin quede
!uera y el otro dentro del niel del agua.
9e colocaron los tapones en el tubote ensaye y en la botella respectiamente.
Colocamos el tubo de ensayo con PbO2 al otro extremo del tubo de conexin m&s corto.
Colocamos la probeta ac1a al otro extremo del tubo de conexin m&s largo +untamente con el
termmetro de 425<C a =25<C.
Conectamos el mec*ero en la l1nea de gas.
,ctividad 3.4 /na e0 colocado el tubo de ensaye en 2l tapn i *oradado, con (PbO2)% calentamos
el tubo de ensaye de una manera uni!orme.
,ctividad 4 .4 Pudimos percibir que el (PbO2), empe0 a reaccionar, es decir por la transmisin del
calor de la !lama el material se empe0 a desintegrar, cambio de color ca!2 oscuro a un color entre
naran+a y ro+i0o, *asta !inalmente desintegrarse en su totalidad% se puede mencionar que por la ley
de la conseracin de la energia esto no sucede y, esto se comprueba en que *ubo una reaccin.
,ctividad 5 .4 9e empe0 a generar un gas, (O2), el cual produ+o que *ubiera un desalo+o de agua a
traes del tubo que a *acia la probeta el cual es igual al olumen del al gas en !rasco de boca
anc*a.
,ctividad 6 .4 9uspendimos la !lama que calentaba el tubo de ensaye, cuando la sustancia que
estaba contenida en el desapareci, pues pr&cticamente nunca se llega a desalo+ar la cantidad que
en el muestrario se3alaba (>6ml), cabe mencionar que se paso el mec*ero alrededor del tubo casi
cuando se *ab1a consumido toda la sustancia para una me+or expansin del gas que tenia el tubo y
as1, obtener el m&ximo olumen de agua desalo+ada, la cual se estaba conteniendo en la probeta.
,ctividad 6 .4 ?a obtenido nuestro olumen de agua reali0amos la medicin correspondiente del
mismo y obtuimos lo siguiente.
@olumen de agua (A2O)( 44ml.
,ctividad 5 .4 9e de+ en!riar el tubo de ensaye, para despu2s pesar nueamente su masa con el
residuo que se quedo en el mismo, obtuimos la siguiente medicin(
7asa de tubo de ensaye despu2s de la reaccin 4 7asa del tubo de ensaye ac1o( 22366g7 22334g
7asa de (PbO2) despu2s del proceso( 4346g
;os datos que obtuimos en el proceso del experimento los presentamos en la siguiente tabla.
7asa del tubo de ensaye ac1o( 22334g
7asa de tubo de ensaye 8 (PbO2)antes de
la reaccin(
22354g
7asa de (PbO2)( 435g
@olumen de agua (A2O)( 44ml.
Presin (A2O) 213465atm
7asa de tubo de ensaye despu2s del
calentado(
22366g
7asa de (PbO2) despu2s del proceso( 4346g
-emperatura .mbiente 238C
C*E&$IO(,)IO'
1.- )scribir la ecuacin qu1mica de la reaccin e!ectuada.
+
) ( 2 ) ( ) ( 2 g s s
O PbO PbO
Balanceando la ecuacin anterior por el m2todo del tanteo, ya que la misma cantidad de &tomos en
los reactivos deben de estar en los productos, por la ;ey de la conseracin de la materia% entonces
tenemos lo siguiente(
+
) ( 2 ) ( ) ( 2
2 2
g s s
O PbO PbO
2.- Calcular la masa en (g) del oxigeno producido.
7asa del tubo con (PbO2) antes de la reaccin 4 7asa del tubo con (PbO2) despu2s de la reaccin.
g g g m
O
04 , 0 76 , 22 80 , 22
2
= =
3.- Calcular la densidad del Oxigeno en las condiciones del experimento.
a1 Directamente: Por medio del cociente de la masa del ox1geno producido, entre su olumen
equialente del agua.
@olumen de agua (A2O)( 44ml. pero CCml#=555ml , 43444lts.
7asa O2g( 4344
lts
g
lt
gr
V
m
9090 , 0
044 , 0
04 , 0
= = =
b) Indirectamente: .plicando la ecuacin modi!icada de los gases ideales, (es necesario utili0ar la
presin parcial del ox1geno en la me0cla).
"ota( para el calculo del -. 9 -esos atmicos.
Para reali0ar esta actiidad partimos del siguiente an&lisis(
nRT PV =
Pero sabemos que
M
P
m
n =
9ustituyendo en la ecuacin anterior tenemos(
RT
P
m
PV
M
=
Despe+ando la presin P de la ecuacin anterior tenemos(
M
P
RT
V
m
P =
( ) ( ) T R
v
m
P P
M
=
RT
P P
P
RT
P
M
M
= =
Pero para la densidad del O2.
-enemos(
. exp
2
2
T R
P P
O
M O
=
)n este caso se toma la presin parcial del O2, la cual obtenemos de la siguiente !orma(
O H O total
P P P
2 2
+ =
por lo tanto
O H total O
P P P
2 2
=
de donde(
nmHg mmHg mmHg P
O
932 , 563 068 , 21 585
2
= =
Pero como las unidades son mmAg,
conirti2ndolo en atms!eras, tenemos(
mmHg atm
mmHg amt
932 , 563 74201 , 0
760 1
9ustituyendo en la !ormula tenemos los siguientes resultados(
( ) ( )
( )
lts
g
atm
K
K mol
lts atm
atm
T R
P P
K mol
lts atm
mol
g
mol
g
M O
O
9765 , 0
3139 , 24
744 , 23
15 , 296 0821 , 0
32 74201 , 0
. exp
2
2
=
4.- Calcular la densidad del ox1geno (O2), en condiciones normales.
a1 )ncontrando el cociente de la masa de =mol en gramos, entre el olumen normal a esas
condiciones de temperatura y presin.
Como las condiciones de presin y temperatura son normales, tenemos los siguientes alores,
se3alando que un gas a estas condiciones ocupa un olumen de 223414lts..
Aplicando la Ley de Avogadro:
M
P
m
n =
entonces
mol n 1 =
Despe+ando m de la ecuacin anterior tenemos(
M
P n m =
entonces la masa(
g g mol m 32 32 1 = =
Como la densidad es para el (O2), en condiciones normales de presin y temperatura decimos que(
lts
g
O
O
lts
g
V
m
4276 , 1
414 , 22
32
2
2
= = =
b1 )ncontrar el cociente de la masa del ox1geno (O2) producido entre su olumen corregido a esas
condiciones de temperatura y presin.
De la !ormula(
Nota: en este paso las incgnitas iniciales de la ecuacin representan los valores experimentales, y
las finales las condiciones normales.
2
2 2
1
1 1
T
P V
T
P V
=
Delacionando los datos tenemos(
@= , @olumen experimental (5.5CClts)
P= , Presin atmos!2rica (6E6 mmAg)%
-= , -emperatura ambiente experimental (2$
o
C)% (2>$,=6< 8 2$< , 2:63158;)
@2 , @olumen molar (22.C=Clts)
P2 , Condiciones normales (=atm)
-2 , Condiciones normales (2>$
o
F)
Despe+ando @= para *allar olumen corregido tenemos(
( )( ) ( )
( ) ( )
lts
atm K
K atm lts
atm K
K atm lts
P T
T P V
V 750 , 32
680 , 202
906 , 6337
74201 , 0 15 , 273
15 , 296 1 414 , 22
1 2
1 2 2
1
=
=
= =
lts
g
lts
g
v
m
9770 , 0
750 , 32
32
= = =
c1 .plicando la ley de los Gases Hdeales.
nRT PV =
entonces(
M
P
RT
V
m
P =
( ) ( ) T R
v
m
P P
M
=
RT
P P
P
RT
P
M
M
= =
( ) ( )
( )( )
lts
g
K mol
lts atm
mol
g
lts
g
K
atm
427 , 1
425 , 22
32
15 , 273 0821 , 0
32 1
= =
5.- Calcular el error relatio, entre los alores calculados en(
a) $a y $b
b) Ca y Cb.
Para el inciso a tenemos que( $a es el alor experimental y $b el alor terico.
$a( 43:4:4g<lts
$b( 43:665g<lts
a)
% 56 , 4 % 100
9765 , 0
9090 , 0 9765 , 0
Re =
=
co ValorTe!ri
imental ValorEper co ValorTe!ri
lativo Error
Para el inciso b tenemos que( Ca es el alor terico y Cb el alor experimental.
Ca( 134266g<lts
Cb( 43:664g<lts
b)
% 32 , 74 % 100
4276 , 1
9770 , 0 4276 , 1
Re =
=
co ValorTe!ri
imental ValorEper co ValorTe!ri
lativo Error
6.- Calcular el porcenta+e de bixido de plomo (PbO2) descompuesto.
7asa del PbO2 antes de la reaccin( 435g
7asa del PbO2 despu2s de la reaccin( 4346g
5.6 =55I
5.CJ K
( )( )
% 92
5 , 0
100 46 , 0
= = "
Por lo cual se puede se3alar que el porcenta+e de PbO2 descompuesto es de 5=.
6.7 L Cual deber1a ser el olumen despla0ado para que el porcenta+e de error !uera 5M.
Para este punto tomaremos la densidad terica es decir el resultado de la pregunta $b esto es(
, 43:665g<lts y la masa de (O2) es igual a( 4344g
( ) ( )
( )
lts
g atm
K
K mol
lts atm
atm
T R
P P
K mol
lts atm
mol
g
mol
g
M O
O
9765 , 0
3139 , 24
744 , 23
15 , 296 0821 , 0
32 74201 , 0
. exp
2
2
=
g g g m
O
04 , 0 76 , 22 80 , 22
2
= =
De los datos anteriores podemos determinar lo siguiente(
lts
g
m
v
v
m
lts
g
te!rica
O O
teorica
0409 , 0
9765 , 0
04 . 0
2 2
= = = =
CO(C/*&IO(E&'
)n la reali0acin de este experimento comprobamos o bien, encontramos las densidades y el
olumen de un gas, cuando este s2 desprende de una reaccin% cabe se3alar que es importante
conocer las di!erentes maneras de encontrarlos tantos los alores tericos como los alores
experimentales. .dem&s de esto podemos eri!icar di!erentes comportamientos de a partir del
m2todo de traba+o o experimental que se realice% por otra parte tambi2n *icimos el calculo del error
relatio del experimento, entre los alores tericos4experimentales.
I/IO>),?@,'
EABerimentos de ?"sico7Cu"mica ,utor' D,%ID -. &DOE.,;E) -Eg. 613561.
EDI$O)I,/' DI&-,(O ,.E)IC,(,.
FttB'<<GGG.elBrisma.com< 7 Cuimica7
FttB'<<GGG.mitareanet.com<gases ideales < densidad
,arn DernEndeH
sideral5252NO*otmail.com
You might also like
- Indicador pH col moradaDocument12 pagesIndicador pH col moradakaremNo ratings yet
- Factores Que Afectan La Velocidad de Reacción PracticaDocument2 pagesFactores Que Afectan La Velocidad de Reacción PracticaAna Elena Betancourt BucheliNo ratings yet
- Funciones Químicas Orgánicas - QuimicaDocument3 pagesFunciones Químicas Orgánicas - QuimicaSamantha CarreñoNo ratings yet
- Primera Ley de La Temrodinamica.Document4 pagesPrimera Ley de La Temrodinamica.Alvaro Vasquez Flores100% (1)
- Guía Laboratorio Reacciones Químicas NovenoDocument6 pagesGuía Laboratorio Reacciones Químicas NovenoPIERO ISAAC LÓPEZ GARZÓNNo ratings yet
- 3FM3 Equipo5 Pract4Document15 pages3FM3 Equipo5 Pract4luisa gonzalez hernandezNo ratings yet
- Guia Rendimiento de ReaccionesDocument5 pagesGuia Rendimiento de ReaccionesAna Kairina Pineda PintoNo ratings yet
- Diseño de Procesos QuímicosDocument14 pagesDiseño de Procesos Químicosantonio9741No ratings yet
- Equilibrio MaterialDocument85 pagesEquilibrio MaterialAdolfo PazNo ratings yet
- CINÉTICA QUÍMICA TestDocument5 pagesCINÉTICA QUÍMICA TestArlinTon Antonio Galeano HernandezNo ratings yet
- Cuestiones de Estequiometría, Olimpiadas de Química, Vol 1 (2011) - Pag 268 - Parte1Document53 pagesCuestiones de Estequiometría, Olimpiadas de Química, Vol 1 (2011) - Pag 268 - Parte1David LópezNo ratings yet
- Reporte de Práctica 4 SecadoDocument10 pagesReporte de Práctica 4 SecadoLuisa SahagúnNo ratings yet
- Modulo de Quimica 10 y 11 PDFDocument61 pagesModulo de Quimica 10 y 11 PDFRobin De La PerlaNo ratings yet
- Nomenclatura de AlcanosDocument7 pagesNomenclatura de AlcanosJesus OrtizNo ratings yet
- Agroindustrial Uniagraria 2017Document6 pagesAgroindustrial Uniagraria 2017Pierre VargasNo ratings yet
- Guia de Practica de Punto de EbulliciónDocument2 pagesGuia de Practica de Punto de Ebulliciónjoel100% (1)
- BQ Práctica 3 - Guía - Energía de La NuezDocument3 pagesBQ Práctica 3 - Guía - Energía de La NuezOlguer William Ruales FrancoNo ratings yet
- Reconocimiento de Materiales,-1Document6 pagesReconocimiento de Materiales,-1Denis MaxiNo ratings yet
- Los Patrones ClimaticosDocument11 pagesLos Patrones Climaticosomar suazo100% (1)
- Disminución punto fusión NaClDocument8 pagesDisminución punto fusión NaClソーダ エドゥアルドNo ratings yet
- Taller 1. Fundamentos Líquidos y SólidosDocument3 pagesTaller 1. Fundamentos Líquidos y Sólidossebastian deoroNo ratings yet
- Apuntes de Fisicoquimica UtemDocument110 pagesApuntes de Fisicoquimica UtemAlan Cereceda EscalonaNo ratings yet
- Fisicoquímica II: Conceptos y aplicaciones de equilibrio de fases, electroquímica y cinética químicaDocument5 pagesFisicoquímica II: Conceptos y aplicaciones de equilibrio de fases, electroquímica y cinética químicaAngel DavidNo ratings yet
- Equilibrio Quimico en Medio AmortiguadoDocument98 pagesEquilibrio Quimico en Medio AmortiguadoFrancisco Monroy PerezNo ratings yet
- Biorreactores para El Cultivo de Células de Animales y PlantasDocument37 pagesBiorreactores para El Cultivo de Células de Animales y PlantasRicardoNo ratings yet
- Energía SolucionarioDocument54 pagesEnergía SolucionarioGabriel Gamarra LimayNo ratings yet
- Laboratorio de Química IDocument59 pagesLaboratorio de Química IJesus JaraNo ratings yet
- A4-Formulación Orgánica Libro 27febrmbDocument17 pagesA4-Formulación Orgánica Libro 27febrmbPaco MartínezNo ratings yet
- FEM Pila DaniellDocument19 pagesFEM Pila DaniellCesar AlvarezNo ratings yet
- Guía de Ejercicios de TermodinámicaDocument4 pagesGuía de Ejercicios de TermodinámicaLaboratoriodeciencias Altazor50% (2)
- Problemas 3. Classroom 2019 IDocument4 pagesProblemas 3. Classroom 2019 IAlain Llanqui ChocataNo ratings yet
- Modulo Caracterizacion de Contaminantes AtmosfericosDocument159 pagesModulo Caracterizacion de Contaminantes AtmosfericosDaniela Gomez100% (1)
- Enlaces Químicos y Fuerzas Intermoleculares-EjerciciosDocument9 pagesEnlaces Químicos y Fuerzas Intermoleculares-EjerciciosChristian GomezNo ratings yet
- Propiedades Fisicas de Los Componentes Puros PDFDocument48 pagesPropiedades Fisicas de Los Componentes Puros PDFLeonardo Barrios CarreraNo ratings yet
- PPTS13-14-AARICA-2020-01 Nearpod PDFDocument62 pagesPPTS13-14-AARICA-2020-01 Nearpod PDFDeysi Velayarce SanchezNo ratings yet
- Guia de Nomenclatura InorganicaDocument16 pagesGuia de Nomenclatura InorganicaIan JerezNo ratings yet
- Manual de Practicas de Laboratorio Quimica IIDocument27 pagesManual de Practicas de Laboratorio Quimica IIMariela de LunaNo ratings yet
- Quimica de Hidrocarburos 2013 SEgundo AprcialDocument13 pagesQuimica de Hidrocarburos 2013 SEgundo AprcialCINL123No ratings yet
- Teoria Quimica EstructuralDocument67 pagesTeoria Quimica EstructuralAgustín SilesNo ratings yet
- Química orgánica: funciones, isómeros y reaccionesDocument7 pagesQuímica orgánica: funciones, isómeros y reaccionesMarisol Gonsalez GarzonNo ratings yet
- Material s4 QuimicaDocument44 pagesMaterial s4 QuimicaYeseni AbarcaNo ratings yet
- Practica 4 Ley de Henry 2018-1 Ia-1Document8 pagesPractica 4 Ley de Henry 2018-1 Ia-1Ivaan's S. SanChes'sNo ratings yet
- Produccion de Carbonato de CalcioDocument5 pagesProduccion de Carbonato de CalcioCamilo TorresNo ratings yet
- Quimica GeneralDocument10 pagesQuimica GeneralVR RGNo ratings yet
- Carro de VaporDocument1 pageCarro de VaporJaneth Perez100% (1)
- Practica 8. PRINCIPIO DE LA CONSERVACIÓN DE LA MATERIA-1Document4 pagesPractica 8. PRINCIPIO DE LA CONSERVACIÓN DE LA MATERIA-1lyfaNo ratings yet
- Determinación Del Volumen Molar de Un GasDocument11 pagesDeterminación Del Volumen Molar de Un GasfuckumodafakaNo ratings yet
- Cuestionario de EnzimasDocument2 pagesCuestionario de EnzimasWALTER ACEVEDONo ratings yet
- Guia de Laboratorio TermodinamicaDocument36 pagesGuia de Laboratorio TermodinamicaBruno Orlando Castedo BeltranNo ratings yet
- Taller-de-quimica-aldehidos-y-cetonas-GRADO 11Document2 pagesTaller-de-quimica-aldehidos-y-cetonas-GRADO 11MARYURIS TUIRAN PEREZNo ratings yet
- Guía Ciencias Naturales Octavo 1.1Document13 pagesGuía Ciencias Naturales Octavo 1.1maria100% (1)
- Quimica 2001. Soluciones 6 ModelosDocument25 pagesQuimica 2001. Soluciones 6 ModelosfranjosevaNo ratings yet
- Banco de Preguntas T de Los GasesDocument18 pagesBanco de Preguntas T de Los GasesCésar HJ0% (1)
- Guia de GasesDocument5 pagesGuia de GasesJeniffer Katerine Carrillo GomezNo ratings yet
- Resumen Laboratorio TermodinamicaDocument13 pagesResumen Laboratorio TermodinamicaBrenda Angelica Alarcón TorresNo ratings yet
- 2 Informe 2 Densidad de Los GasesDocument6 pages2 Informe 2 Densidad de Los GasesJorge Stban PerezNo ratings yet
- Determinación Volumen Molar O2Document6 pagesDeterminación Volumen Molar O2joalcuNo ratings yet
- VolumenDocument9 pagesVolumencristianNo ratings yet
- PERFILES CAS HVLH Mayo 2020Document7 pagesPERFILES CAS HVLH Mayo 2020Windibel Gutierrez SalgueroNo ratings yet
- Formato de Atencion de Teleinterconsulta - Respuesta ConsultorDocument2 pagesFormato de Atencion de Teleinterconsulta - Respuesta ConsultorWindibel Gutierrez SalgueroNo ratings yet
- Metodo JanbuDocument4 pagesMetodo JanbuWindibel Gutierrez SalgueroNo ratings yet
- Guia de Registro HIS - 2020Document20 pagesGuia de Registro HIS - 2020Raul Pacheco PalominoNo ratings yet
- Manual HisDocument36 pagesManual HisNeil Luna LopezNo ratings yet
- Términos de Referencia para Contratación de ServiciosDocument2 pagesTérminos de Referencia para Contratación de ServiciosWindibel Gutierrez SalgueroNo ratings yet
- Consentimiento Informado para Teleconsultas HRDTDocument1 pageConsentimiento Informado para Teleconsultas HRDTWindibel Gutierrez SalgueroNo ratings yet
- RM179 2005Document2 pagesRM179 2005Windibel Gutierrez SalgueroNo ratings yet
- Taller de InvestigacionDocument21 pagesTaller de InvestigacionWindibel Gutierrez SalgueroNo ratings yet
- Notificación de eventos por desastres naturales y accidentalesDocument5 pagesNotificación de eventos por desastres naturales y accidentalesWindibel Gutierrez Salguero100% (3)
- Costos y Presupuestos en La ConstruccionDocument15 pagesCostos y Presupuestos en La ConstruccionWindibel Gutierrez SalgueroNo ratings yet
- Docente Acompañado DatosDocument2 pagesDocente Acompañado DatosDavid Bernilla MendozaNo ratings yet
- Alerta 012-2020 PDFDocument14 pagesAlerta 012-2020 PDFAlfredo Armando AbuinNo ratings yet
- Tratamiento Agua de NieblaDocument168 pagesTratamiento Agua de NieblaEdson Ramos HuamaniNo ratings yet
- Voleibol TraDocument7 pagesVoleibol TraWindibel Gutierrez Salguero100% (1)
- Interfaz y Uso Educativo EDMODODocument3 pagesInterfaz y Uso Educativo EDMODOWindibel Gutierrez SalgueroNo ratings yet
- Info01 PDFDocument12 pagesInfo01 PDFMayte Yeniffer Condori MamaniNo ratings yet
- Reglas y CronogramaDocument14 pagesReglas y CronogramaWindibel Gutierrez SalgueroNo ratings yet
- Diseño para El Mejoramiento de La Carretera Tramo La Almiranta - Palo Blanco - Distrito de Quiruvilca - Provincia de Santiago de Chuco - Departamento La LibertadDocument6 pagesDiseño para El Mejoramiento de La Carretera Tramo La Almiranta - Palo Blanco - Distrito de Quiruvilca - Provincia de Santiago de Chuco - Departamento La LibertadWindibel Gutierrez SalgueroNo ratings yet
- Boletín Estadístico: I Semestre 2020Document23 pagesBoletín Estadístico: I Semestre 2020Windibel Gutierrez SalgueroNo ratings yet
- Manual Materno Perinatal 2019Document47 pagesManual Materno Perinatal 2019yuvi_0824No ratings yet
- CDD Acompañamiento PedagógicoDocument21 pagesCDD Acompañamiento PedagógicoWindibel Gutierrez SalgueroNo ratings yet
- Manual de Actividades de Registro de Telemedicina - 23.09.2019Document15 pagesManual de Actividades de Registro de Telemedicina - 23.09.2019CHRISTIAMNo ratings yet
- Por Que Ser Un Buen EstudianteDocument10 pagesPor Que Ser Un Buen EstudianteWindibel Gutierrez SalgueroNo ratings yet
- Informe Final Con Detalles Sobre El Proceso de Ejecución Del ProyectoDocument3 pagesInforme Final Con Detalles Sobre El Proceso de Ejecución Del ProyectoWindibel Gutierrez SalgueroNo ratings yet
- Plan de Mejora Cotabambas 2017 1Document7 pagesPlan de Mejora Cotabambas 2017 1Jayro Daniel Quispe Ore100% (1)
- Diseño para El Mejoramiento de La Carretera Tramo La Almiranta - Palo Blanco - Distrito de Quiruvilca - Provincia de Santiago de Chuco - Departamento La LibertadDocument6 pagesDiseño para El Mejoramiento de La Carretera Tramo La Almiranta - Palo Blanco - Distrito de Quiruvilca - Provincia de Santiago de Chuco - Departamento La LibertadWindibel Gutierrez SalgueroNo ratings yet
- Plandemejora PDFDocument10 pagesPlandemejora PDFJessika GsevillanNo ratings yet
- EdmodoDocument21 pagesEdmodoWindibel Gutierrez SalgueroNo ratings yet
- Perfil Analista en InfraetsructuraDocument4 pagesPerfil Analista en InfraetsructuraWindibel Gutierrez SalgueroNo ratings yet
- Calibracion PipetasDocument12 pagesCalibracion Pipetasdigisis2001No ratings yet
- Reto 6.8.1Document4 pagesReto 6.8.1drdaviidNo ratings yet
- Predimensionamiento de Estructuras - SismicaDocument10 pagesPredimensionamiento de Estructuras - SismicaJhosep GonzalesNo ratings yet
- Apartarrayos Operacion Con Carga y Descanso Apartarrayo PDFDocument2 pagesApartarrayos Operacion Con Carga y Descanso Apartarrayo PDFEduardo Reyes HdezNo ratings yet
- Uso Adecuado de La CentrifugaDocument4 pagesUso Adecuado de La CentrifugaGamaliel Canté HdezNo ratings yet
- Tabla de Redes de ComputadorasDocument4 pagesTabla de Redes de ComputadorasDaeli Gonzalez AmbrocioNo ratings yet
- Caterpillar Serie KDocument3 pagesCaterpillar Serie KRonal Quispe HuamanNo ratings yet
- Presentación Auditoria Diagnostico Iso 17025 - Fraso AllianceDocument7 pagesPresentación Auditoria Diagnostico Iso 17025 - Fraso AllianceCMNo ratings yet
- Las 5s Del Mantenimiento IndustrialDocument4 pagesLas 5s Del Mantenimiento IndustrialAndres GuillcatandaNo ratings yet
- Cat 793F Mining TruckDocument5 pagesCat 793F Mining TruckForomaquinas100% (1)
- MULTICANALIZACIÓNDocument3 pagesMULTICANALIZACIÓNCristiann NappanNo ratings yet
- NCh1285 02 1997 PDFDocument17 pagesNCh1285 02 1997 PDFgestioneNo ratings yet
- Cuadros Comparativos TrazabilidadDocument11 pagesCuadros Comparativos TrazabilidadisamarNo ratings yet
- Iso 14001Document14 pagesIso 14001Ang LucNo ratings yet
- SP1 PDFDocument1 pageSP1 PDFMarco Antonio Quispe RoqueNo ratings yet
- Servidor Proxy en EndianDocument47 pagesServidor Proxy en EndianLuis Felipe SánchezNo ratings yet
- Mercedes Benz Clase B 200 BlueEFFICIENCY Manual La Merced PilarDocument1 pageMercedes Benz Clase B 200 BlueEFFICIENCY Manual La Merced Pilarservicio automotríz autovulcanNo ratings yet
- Guía de EjerciciosDocument3 pagesGuía de EjerciciosRodriguez Vasquez AntonioNo ratings yet
- NTC EpiDocument14 pagesNTC EpiJonathan Santanilla GomezNo ratings yet
- Alcances y Restricciones en Instalacion Basica MinisplitDocument3 pagesAlcances y Restricciones en Instalacion Basica MinisplitGustavo JimenezNo ratings yet
- CONCLUSIÓNDocument10 pagesCONCLUSIÓNJassel AvilaNo ratings yet
- Premios EfqmDocument35 pagesPremios EfqmJosue Daniel Zamudio HernandezNo ratings yet
- K3 Turbo DieselDocument2 pagesK3 Turbo DieselJesusNo ratings yet
- Criterios acreditación trazabilidadDocument14 pagesCriterios acreditación trazabilidadEduar Samuel Posada GiraldoNo ratings yet
- Nte Inen Iso Iec 25010 PDFDocument10 pagesNte Inen Iso Iec 25010 PDFluisNo ratings yet
- Norma Cadafe - Cables Monopolares de 15 KVDocument20 pagesNorma Cadafe - Cables Monopolares de 15 KVbasilio1aNo ratings yet
- Semana 7Document26 pagesSemana 7Angello Claudio Herrera OcanaNo ratings yet
- EnsayoDocument2 pagesEnsayoMary Espinosa LugoNo ratings yet
- ABUS - Puentes GrúaDocument32 pagesABUS - Puentes Grúahangarrod100% (1)
- Barras corrugadas ArcelorMittal ASTM A615 grado 60Document2 pagesBarras corrugadas ArcelorMittal ASTM A615 grado 60Luisin Castro0% (1)