Professional Documents
Culture Documents
Cuarzo
Uploaded by
Rafael La RottaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cuarzo
Uploaded by
Rafael La RottaCopyright:
Available Formats
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
1
CRISTALOQUMICA
TEMA 9
POLIMORFISMO Y TRANSFORMACIONES POLIMRFICAS.
TRANSFORMACIONES ORDEN - DESORDEN
NDICE
9.1 Introduccin
9.2 Estabilidad y equilibrio
9.3 Concepto de polimorfismo y de transformacin
polimrfica
9.4 Aspecto termodinmico de las transformaciones
polimrficas
9.5 Mecanismos del polimorfismo
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
2
9.1 INTRODUCCIN
A temperaturas distintas a las del cero absoluto los tomos, iones o molculas que
forman los cristales sufren vibraciones trmicas, haciendo que se desplacen de sus
posiciones de equilibrio.
La amplitud de tales vibraciones depende, entre otros factores, de:
La naturaleza del enlace
El tamao del tomo en relacin a la posicin atmica de la estructura cristalina.
Estas vibraciones pueden llegar a modificar la simetra del cristal o mineral y
explicar el fenmeno del polimorfismo.
El cristal en este caso deja de ser un ente esttico para pasar a ser un ente dinmico,
constituyendo las transiciones de fase un ejemplo de este dinamismo.
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
3
9.2 ESTABILIDAD Y EQUILIBRIO
A temperaturas elevadas una cierta configuracin atmica puede ser
termodinmicamente favorable, es decir, puede tener la ms alta probabilidad
termodinmica, mientras que a temperaturas ms bajas la configuracin
termodinmicamente ms probable puede ser diferente.
Esta probabilidad termodinmica se relaciona con la energa libre G (Gibbs) o F
(Helmholtz), que es mnima cuando la probabilidad es mxima. Por lo tanto, en
cualquier transformacin mineral la energa libre tender a un valor mnimo.
As, el estado ms estable a cualquier temperatura T dada ser aquel que posea la
energa libre ms baja. Sin embargo, hay que tener en cuenta que muchos minerales
naturales no son termodinmicamente estables, ya que son posibles cambios que
disminuirn la energa libre pero la cintica de tales cambios (velocidad de la
transformacin) puede ser lenta y mantener estructuras inestables.
Hay dos tipos de posible inestabilidad:
Inestabilidad
Metaestabilidad
El significado de estos trminos puede entenderse utilizando el ejemplo de la Figura
9.1, en la que se ilustra una ladera de una colina y una esfera.
Figura 9.1.- Equilibrio inestable (izquierda), metaestable (centro), inestable (derecha)
En la posicin 1 la esfera est en una situacin inestable y un pequeo cambio en
su posicin reducir su energa libre (en este caso energa potencial).
En la posicin 2, la esfera ha adquirido un mnimo en la energa libre, pero
todava tiene una energa mayor que si estuviera en la posicin 3, que es la estable. En
la situacin 2 se dice que est en un estado metaestable.
Para alcanzar la posicin 3 la esfera debe pasar primeramente por una situacin
intermedia, menos estable y de mayor energa, que acta como barrera al cambio, que
puede superar si se suministra una energa extra, la denominada energa de activacin.
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
4
El cambio en energa libre de un mineral cuando toma parte en una
transformacin puede representarse por la Figura 9.2.
Figura 9.2.- Cambio en energa libre de un mineral cuando sufre una transformacin
La coordenada de la reaccin puede ser cualquier variable que define el progreso
de la transformacin, por ejemplo, la transformacin de un estado de alta temperatura a
uno de baja, por debajo de la temperatura de transformacin. La diferencia en energa de
un estado 1 altamente metaestable a otro estado final 2 es negativa y se denomina fuerza
conductora para la transformacin. Para pasar del estado 1 al 2 es necesario superar la
barrera de energa F
a
, para lo cual se necesita una energa extra denominada energa
libre de activacin, que generalmente se suministra en forma de fluctuaciones trmicas,
de modo que las transformaciones son fuertemente dependientes de la temperatura.
Considerando una transformacin el mineral tender al equilibrio cuando la
energa libre de dicha transformacin tiende a un mnimo. De esta manera se puede
utilizar el trmino de equilibrio metaestable para la situacin 2 y equilibrio estable para
la situacin 3 de la Figura 9.1.
La energa libre de Gibbs viene dada por la expresin:
Ecuacin 1
que puede ponerse en la forma
Ecuacin 2
Donde:
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
5
E es la energa interna
P es la presin
V es el volumen
T es la temperatura
S es la entropa
H es la entalpa,
Ecuacin 3
La energa libre que generalmente se utiliza cuando no hay cambio en volumen
de la fase es la energa libre de Helmholtz:
Ecuacin 4
La fase ms estable, a presin atmosfrica (el trmino PV es despreciable), es la
que tiene la energa interna ms baja.
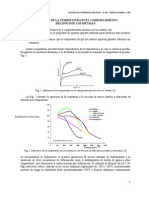
La variacin en energa libre con la temperatura, para una sola fase, es una curva
como la de la Figura 9.3.
Figura 9.3.- Evolucin del diagrama G-T
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
6
9.3 POLIMORFISMO, TRANSFORMACIONES POLIMRFICAS Y
CRISTALES O MINERALES POLIMORFOS
POLIMORFISMO
Fenmeno que hace que existan cristales o minerales polimorfos mediante
transformaciones polimrficas.
TRANSFORMACIN POLIMRFICA
Cambio de fase mineral debido a que cambian las condiciones fsicas (P y T) del
entorno mineral.
Ejemplos
Figura 9.4.- Diagrama de fases DIAMANTE (cbico) -
GRAFITO (hexagonal) C
Figura 9.5.- Diagrama de fases CALCITA (rombodrico)
- ARAGONITO (rmbico) CaCO
3
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
7
Figura 9.6.- Diagrama de fases CUARZO BAJ O
(rombodrico) - CUARZO ALTO (hexagonal) SiO
2
Figura 9.7.- Diagrama de fases CIANITA - ANDALUCITA- SILLIMANITA Al
2
SiO
5
CRISTALES O MINERALES POLIMORFOS
Los que tienen la misma composicin qumica pero diferentes estructuras
cristalinas.
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
8
9.4 ASPECTO TERMODINMICO DE LAS
TRANSFORMACIONES POLIMRFICAS
La transformacin de fases ms simple es la que ocurre entre dos formas
polimrficas de un mineral.
Para que tenga lugar la transformacin de una fase a otra, las curvas de
energa libre (curvas G) de cada fase deben intersectar a una temperatura
denominada temperatura de transformacin, T
c
.
A temperaturas por encima de T
c
la fase B es la ms estable y a temperaturas por
debajo de T
c
la fase ms estable es la A
La transformacin va acompaada de un cambio brusco en la energa interna
(ver Figura 9.8), es el calor latente de transformacin.
Figura 9.8.- Diagrama T-G mostrando una transformacin reversible a la temperatura T
c
A temperaturas por encima de Tc la fase B es la ms estable.
A temperaturas por debajo de Tc la fase ms estable es la A.
La transformacin va acompaada de un cambio brusco en la energa interna, es
el calor latente de transformacin
Cuando aumenta la temperatura, para que una curva cruce a la otra se requiere
que:
la forma de alta temperatura tenga una entropa mayor
el cambio en entropa sea discontinuo.
A la temperatura de transformacin, al aumentar la temperatura, el cambio en
energa interna es positivo (ver Figura9. 9).
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
9
Figura 9.9.- Diagramas T-G y T-H mostrando la evolucin de una
transformacin reversible
TRANSFORMACIN REVERSIBLE
Aquella en la que la temperatura de transformacin es la misma en el
calentamiento que en el enfriamiento (ver Figura 9.10).
Figura 9.10.- Diagrama T-G mostrando la evolucin de una
transformacin reversible
TRANSFORMACIN IRREVERSIBLE
Aquella en la que la temperatura de transformacin es diferente en el
calentamiento y en el enfriamiento (ver Figura 9.11).
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
10
Figura 9.11.- Diagrama T-G mostrando la evolucin de una transformacin irreversible.
sta es la ms frecuente en los minerales, ya que en stos la movilidad atmica
es demasiado lenta para que se cumpla la termodinmica ideal, por lo que hay
desviaciones de la conducta ideal.
Generalmente se requiere algn grado de sobreenfriamiento o
sobrecalentamiento para que la transformacin tenga lugar.
En este caso se dice que la transformacin se da en condiciones de no equilibrio.
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
11
9.5 MECANISMOS DEL POLIMORFISMO
Desplazamiento
El ajuste interno que permite pasar de una sustancia a otra es muy pequeo y
requiere poca energa. La estructura queda intacta prcticamente y los enlaces no se
rompen slo es necesario un pequeo desplazamiento de los tomos y un reajuste de
los ngulos de enlace. La transformacin es reversible.
Ejemplo: Transformacin del cuarzo a 573 C:
Cuarzo alto P6
2
22
Cuarzo bajo P3
1
21
Por encima de la temperatura de transformacin la forma estable del
cuarzo es el denominado cuarzo alto o cuarzo de alta temperatura y por
debajo de 573 C la forma estable es el cuarzo bajo o cuarzo de baja
temperatura.
La diferencia entre ambos radica en la simetra, puesta de manifiesto por
el grupo espacial.
La prdida de simetra ocurre, al bajar la temperatura, por la distorsin de
los ngulos de enlace, como consecuencia de que la distorsin puede
realizarse en dos sentidos contrarios (derecho e izquierdo, relacionados
por un giro de 180). En la transicin puede aparecer una macla, macla de
delfinado (slo en el cuarzo bajo) (Ver Figura 9).
Reconstruccin
Reajuste interno de los tomos da lugar a una ruptura de los enlaces y a una nueva
distribucin de los tomos. Requiere gran cantidad de energa. Es muy lento e
irreversible.
Ejemplo: El cambio de TRIDIMITA a CUARZO BAJ O (ver Figura 9.6).
Orden-Desorden
Implica cambio de estructura desordenada, de alta temperatura, a estructura
ordenada de baja temperatura.
C
e
l
i
a
M
a
r
c
o
s
P
a
s
c
u
a
l
12
Se dice que una estructura compuesta por tomos A y B es totalmente ordenada
cuando cada tipo de tomos ocupa su posicin especfica en la misma, es decir, si la
posicin de los tomos A es y la de los tomos B es , siempre A est en y B en
. Por el contrario, cuando los tomos A y B ocupan indistintamente las posiciones
y se dice que est desordenada (ver Figura 9.12).
Este desorden puede ser parcial o total.
Figura 9.12.- Dominios debidos a desorden en la posicin
Ejemplo: En el FELDESPATO POTSICO (KAlSi
3
O
8
) el Al ocupa una posicin
idntica al Si, a quien reemplaza en un mineral. La forma de alta temperatura de este
feldespato, la SANIDINA, muestra distribucin desordenada de Al en la red de
SiO
2
. La MICROCLINA, el feldespato potsico de baja temperatura, presenta una
distribucin ordenada del Al en la red del SiO
2
.
You might also like
- Anexo Aceros para NitrurarDocument16 pagesAnexo Aceros para NitrurarJuan Carlos Rodríguez RufinoNo ratings yet
- Foladori La Economía Ecológica PDFDocument8 pagesFoladori La Economía Ecológica PDFJuan Carlos Rodríguez RufinoNo ratings yet
- IPS E-Max Guía Clínica PDFDocument44 pagesIPS E-Max Guía Clínica PDFJuan Carlos Rodríguez Rufino100% (1)
- ProgramaciónGeneral RRSS FIA18Document10 pagesProgramaciónGeneral RRSS FIA18Juan Carlos Rodríguez RufinoNo ratings yet
- Ecologismo y marginalidadDocument16 pagesEcologismo y marginalidadJuan Carlos Rodríguez RufinoNo ratings yet
- Conflictos Ecológicos e Indicadores de SustentabilidadDocument10 pagesConflictos Ecológicos e Indicadores de Sustentabilidaddon huevo100% (1)
- Funciones de Más de Una VariableDocument11 pagesFunciones de Más de Una VariableJuan Carlos Rodríguez RufinoNo ratings yet
- Temperatura 5185Document8 pagesTemperatura 5185Joffre Lopez VaraNo ratings yet
- Aplicaciones A La Geométrica AnalíticaDocument2 pagesAplicaciones A La Geométrica AnalíticaJuan Carlos Rodríguez RufinoNo ratings yet
- El Tutorial de PythonDocument116 pagesEl Tutorial de PythonCarlos HernandezNo ratings yet