Professional Documents
Culture Documents
Ejercicios de Titulaciones Redox
Uploaded by
Lian CarmonaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ejercicios de Titulaciones Redox
Uploaded by
Lian CarmonaCopyright:
Available Formats
EJERCICIOS DE TITULACIONES REDOX.
Para los siguientes ejercicios utilice los datos indicados en la tabla siguiente, según
corresponda.
Sistema Eo Sistema Eo
MnO4-/Mn+2 1.51 Fe(CN)6-3/Fe(CN)6-4 0.36
-
BrO3 /Br2 1.52 SO4=/H2SO3 0.2
- +4 +2
Cl2/Cl 1.365 Sn /Sn 0.15
Cr2O7=/Cr+3 1.33 TiO+2/Ti+3 0.1
- = =
NO3 /NO2 0.8 S4O6 /S2O3 0.08
+3 +2 +3 +2
Fe /Fe 0.77 V /V -0.26
I2/I- 0.54 H2CO3/H2C2O4 -0.49
Todos los potenciales anteriores que dependen del pH fueron obtenidos a pH = 0 contra el
ENH. Considere además que los gases son solubles en agua.
EJERCICIOS:
1) MnO4- (0.025M ) con H2C2O4.
2) V+2 (0.034M) con MnO4-
3) BrO3- (0.081M) con S2O3=
4) H2C2O4 (0.076M) con BrO3-
5) Cl2 (0.09M) con V+2
6) Sn+2 (0.0156M) con Cr2O7=
7) NO3- (0.052M) con H2SO3
8) Fe(CN)6-4 (0.031M) con NO3-
9) Fe(CN)6-3 con S2O3=
10) I- (0.075M) con BrO3-
Puede construir luego cualquier otro ejercicio, solamente tenga cuidado de que entre los dos
valores de Eo se tenga una diferencia de 0.3 voltios o más. Si no fuera así puede ocurrir que
se necesiten realizar cálculos de grado de reacción para corregir valores que pierdan la
secuencia.
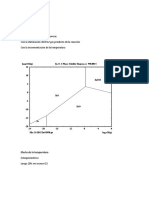
En cada ejercicio establezca las ecuaciones de E para APE, PE y DPE. Determine PE y
llene la tabla siguiente:
ft x E xmedia dE/dx
0.3
0.6
0.9
0.9910.95
1.00
1.01
1.05
1.1
1.5
You might also like
- Vii. Nomenclatura InorgánicaDocument49 pagesVii. Nomenclatura InorgánicaMILLA FLORYANNo ratings yet
- Tarea 12 Valoraciones Redox y Aplicaciones PotenciométricasDocument3 pagesTarea 12 Valoraciones Redox y Aplicaciones PotenciométricasDanielaNo ratings yet
- Enunciados-Ejer-Reacciones RedoxDocument3 pagesEnunciados-Ejer-Reacciones RedoxAlfonso SampedroNo ratings yet
- Guía 01 - ElectroquímicaDocument2 pagesGuía 01 - ElectroquímicaJuanNo ratings yet
- Oxido Reduccion (HCST)Document28 pagesOxido Reduccion (HCST)Cruz GarciaNo ratings yet
- Nomenclatura InorgánicaDocument42 pagesNomenclatura InorgánicaAlexandro Vásquez RojasNo ratings yet
- LABPRATORIODocument6 pagesLABPRATORIOjhonatanramosminano7No ratings yet
- Tabla de Potenciales Normales de ReduccionDocument1 pageTabla de Potenciales Normales de ReduccionAntonella BogadoNo ratings yet
- Oxidación de metales y propiedades periódicasDocument62 pagesOxidación de metales y propiedades periódicasMarifer garcia ortizNo ratings yet
- Balance de Ecuaciones Por ElDocument5 pagesBalance de Ecuaciones Por ElAdriana ToroNo ratings yet
- Estados de oxidación y nomenclatura inorgánicaDocument14 pagesEstados de oxidación y nomenclatura inorgánicaCRISTHIAN JESUS PANEZ MORENONo ratings yet
- Métodos de Balanceo de Ecuaciones QuímicasDocument6 pagesMétodos de Balanceo de Ecuaciones QuímicasAlondraLilianaNietoNo ratings yet
- Diagrama de EllinghamDocument5 pagesDiagrama de EllinghamAlejandro SanchezNo ratings yet
- Guia 2 2023Document6 pagesGuia 2 2023FRANCISCA VALENTINA VARASNo ratings yet
- Estados de OxidaciónDocument5 pagesEstados de OxidaciónFlorencia FloresNo ratings yet
- Tema 11 Reacciones RedoxDocument29 pagesTema 11 Reacciones RedoxAslal CoNo ratings yet
- Balanceo de Ecuaciones de Óxido - Reducción y AlgebraicoDocument30 pagesBalanceo de Ecuaciones de Óxido - Reducción y AlgebraicoChucho CrNo ratings yet
- Oxidacion-Reduccion EjerciciosDocument1 pageOxidacion-Reduccion EjerciciosFrancisca RojasNo ratings yet
- Ejercicios Resueltos de ElectroquimicaDocument3 pagesEjercicios Resueltos de ElectroquimicaJose Demons Peña Carvajal100% (2)
- Nomenclatura InorgánicaDocument5 pagesNomenclatura InorgánicaAldo R-dNo ratings yet
- Ejercicios resueltos de análisis electroquímicoDocument8 pagesEjercicios resueltos de análisis electroquímicoRENATO JAIR COSTA MINGANo ratings yet
- Ejercicios resueltos de análisis electroquímicoDocument8 pagesEjercicios resueltos de análisis electroquímicoRENATO JAIR COSTA MINGANo ratings yet
- Ejercicios Resueltos de Análisis ElectroanalíticoDocument8 pagesEjercicios Resueltos de Análisis ElectroanalíticoJUAN CARLOS LAZARO SALINASNo ratings yet
- Problemario 2P Química Básica V.alumnosDocument3 pagesProblemario 2P Química Básica V.alumnosci3994449No ratings yet
- Guia QuimicaDocument26 pagesGuia QuimicaJosé RuízNo ratings yet
- Reacciones de Transferencia de ElectronesDocument15 pagesReacciones de Transferencia de Electronesapi-272567009No ratings yet
- Nomenclatura InorganicaDocument14 pagesNomenclatura InorganicaIván Camacho MoyaNo ratings yet
- Cap 4 ElectroquímicaDocument30 pagesCap 4 Electroquímicaralph arisNo ratings yet
- Tiosulfato - Plata 2Document7 pagesTiosulfato - Plata 2Gianm ValerianoNo ratings yet
- Oxido ReducciónDocument6 pagesOxido ReducciónJhanaangeliqueNo ratings yet
- Tabla de Potenciales EstándarDocument2 pagesTabla de Potenciales EstándarArwen LightwoodNo ratings yet
- Cuestionario #04Document6 pagesCuestionario #04JulianCaceresValdezNo ratings yet
- Qi 1Document51 pagesQi 1AndresNo ratings yet
- Tema 8 Fondo Claro ADB 2022Document24 pagesTema 8 Fondo Claro ADB 2022Sergio SerantesNo ratings yet
- Números de oxidación compuestos inorgánicosDocument4 pagesNúmeros de oxidación compuestos inorgánicosCarlos SalcedoNo ratings yet
- Método Ión Electrón CompletoDocument13 pagesMétodo Ión Electrón CompletoSebastián Melehuechún VargasNo ratings yet
- Soluciones Examenes RedoxDocument14 pagesSoluciones Examenes RedoxMarta MariaNo ratings yet
- NOMENCLATURA QUÍMICADocument6 pagesNOMENCLATURA QUÍMICAjorge gonzalezNo ratings yet
- Reacciones RedoxDocument16 pagesReacciones RedoxAnel Adames89% (9)
- Ejercicios RedoxDocument15 pagesEjercicios RedoxSebastián Melehuechún VargasNo ratings yet
- Examen 3er Parcial Quimica Inorganica VF - Gerardo DiezDocument7 pagesExamen 3er Parcial Quimica Inorganica VF - Gerardo DiezMajo ChavezNo ratings yet
- R2. LCQDocument5 pagesR2. LCQjessicaNo ratings yet
- Quimica 3 Anual 1 2010Document10 pagesQuimica 3 Anual 1 2010pepe duduNo ratings yet
- Taller 1 Analsis Instrumental IDocument2 pagesTaller 1 Analsis Instrumental IHanner Alexis QuinteroNo ratings yet
- Quimica, Ejercicio RepasoDocument6 pagesQuimica, Ejercicio Repasonatas_marangasnNo ratings yet
- Segundo Parcial Quimica GralDocument6 pagesSegundo Parcial Quimica GralDiegoNo ratings yet
- Taller Estados de Oxidacion 8° AbDocument11 pagesTaller Estados de Oxidacion 8° Abedgar dario badillo maciasNo ratings yet
- Apoyo - Ion ElectronDocument22 pagesApoyo - Ion ElectronEdward TPNo ratings yet
- 3ro 2021 SEMANA4-T8-Nomenclatura Inorganica Nvo FormatoDocument15 pages3ro 2021 SEMANA4-T8-Nomenclatura Inorganica Nvo FormatoNicole Denisse Alvarez CentenoNo ratings yet
- Graficos HSC Trabajo2Document10 pagesGraficos HSC Trabajo2Felimon Garcia LimaNo ratings yet
- QuímicaDocument56 pagesQuímicaLuisa Adriana Ríos CandilaNo ratings yet
- Ejercicios Resueltos de Análisis ElectroanalíticoDocument4 pagesEjercicios Resueltos de Análisis ElectroanalíticoEstefanny MantillaNo ratings yet
- Guía Laboratorio 8 Quimica InorganicaDocument4 pagesGuía Laboratorio 8 Quimica InorganicaJose Carlos Guillen LauraNo ratings yet
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAFrom EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANo ratings yet
- Diferencia Entre Aceite Esencial Vs Aceite VegetalDocument3 pagesDiferencia Entre Aceite Esencial Vs Aceite VegetalLian CarmonaNo ratings yet
- Lista de Insumos Ana LiliaDocument2 pagesLista de Insumos Ana LiliaLian CarmonaNo ratings yet
- ZirconioDocument4 pagesZirconioLian CarmonaNo ratings yet
- ZirconioDocument3 pagesZirconioAnna KoronaNo ratings yet
- Tarjetas de Crédito1Document19 pagesTarjetas de Crédito1Lian CarmonaNo ratings yet
- Practica 11Document14 pagesPractica 11Lian CarmonaNo ratings yet