Professional Documents
Culture Documents
Bond Sigma Metátesis e Inserción Migratoria de Alquenos
Uploaded by
Elvis RenzoOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Bond Sigma Metátesis e Inserción Migratoria de Alquenos
Uploaded by
Elvis RenzoCopyright:
Available Formats
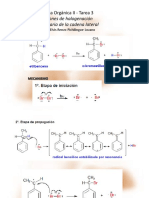
3.7.
BOND SIGMA METATHESIS
3.7.1. Hidrogenolisis: Activación H-H
Es posible dejar que H2 o H+ reaccionen con un complejo d0 metal-alquilo en una
reacción que parece ser una adición oxidativa de H2 seguida de una eliminación
reductora de alcano
Sin embargo, se sabe que la adición oxidativa es imposible con los complejos de
metal d0 , porque no tienen los electrones de no enlace requeridos para formar
los dos enlaces con los nuevos ligandos que resultan de esta reacción. Como se
muestra en el esquema a continuación (izquierda), primero se forma un complejo
H2 intermediate intermedio, luego se forma un estado de transición de 4 centros al
cuadrado que luego puede seguir dos caminos topológicamente simétricos: volver
al complejo H2 inicial o continuar remitir al complejo de alcano transitorio
que finalmente libera el alcano.3.13 Este mecanismo sigue la metátesis del enlace
La hidrogenólisis por metátesis de enlaces desempeña un papel importante en la
descoordinación de polímeros a partir de metales (ver Capítulo 6).
4. 1, 2 INSERCIÓN MIGRATORIA DE ALQUILERES Y
ALQUINOS EN LOS BONOS M-H
Al contrario que el CO, los alquenos se insertan muy fácilmente en un enlace
metal-hidruro para dar un complejo metal-alquilo, y la reacción es reversible. De
hecho, dependiendo de las condiciones, el complejo de metal-alquilo puede dar
lugar a la reacción de extrusión, también llamada eliminación de, produciendo el
complejo de metal-hidruro de alqueno. Esta reacción de eliminación es el
mecanismo de descomposición de los complejos de metal-alquilo que tienen al
menos un hidrógeno y como máximo 16 electrones de valencia en el metal
La reacción de inserción, como su reverso, involucra una especie de hidruro de
metal-olefina, y por lo tanto requiere, en una dirección u otra, un sitio vacío. Por lo
tanto, es necesario partir de un complejo que tenga como máximo electrones de
16 valencias. El estado de transición implica una estructura cuadrada, luego el
último intermedio tiene un enlace agótico M-H-C en equilibrio con el complejo final
La continuidad de la interacción M-H-C a lo largo del mecanismo anterior da como
resultado una estereoselectividad sincrónica con retención de la configuración en
ambos átomos de carbono del enlace doble o triple insertado.
El equilibrio de inserción- -eliminación se desplaza en la dirección de la inserción
de alquenos y alquinos que contienen sustituyentes que retiran electrones. Por lo
tanto, en los ejemplos anteriores y siguientes, los complejos metal-fluoroalquilo
son estables, incluso con electrones de 16 valencia y un átomo de hidrógeno.
La presencia de sustituyentes que retiran electrones no siempre es una condición
indispensable para que la inserción sea cuantitativa. Schwarz 6.8 ha establecido
una importante aplicación de inserción de alquenos en el enlace Zr-H del llamado
reactivo de Schwarz, [ZrCp2 (H) (Cl)].
La regioespecificidad de la reacción anterior es antiMarkownikov, que produce un
complejo de alquilo primario. Además, si el reactivo de Schwarz reacciona con 2-
buteno, el producto de inserción es un complejo de alquilo secundario inestable,
esta inestabilidad cinética se debe presumiblemente a la masa estérica. Este
último complejo se reorganiza para dar un complejo de alquilo primario mediante
la eliminación de H $ $ seguida de una inserción regioespecífica del intermedio 1-
buteno.
Los complejos de Zr-alquilo [ZrCp2 (R) (Cl)] obtenidos por inserción de olefinas
reaccionan con diversos electrófilos con retención de la configuración en el átomo
de carbono en el curso de la descomplejación, que conduce a la funcionalización
de las olefinas; por ejemplo, la reacción con N-bromosuccinimida (NBS) o I2
produce el RX del haluro:
La oxidación de [ZrCp2 (R) (Cl)] usando H2O2 / H2O o t-BuOOH da el alcohol
ROH. Estos complejos [ZrCp2 (R) (Cl)] también se insertan fácilmente en el enlace
Zr-alquilo para dar complejos Zr-acilo [ZrCp2 (COR) (Cl)]. Estos últimos
reaccionan con HCl diluido para dar los aldehídos RCHO, con H2O2 / H2O para
dar los ácidos carboxílicos RCOOH, con Br2 en metanol para producir los ésteres
metílicos RCOOMe y con NBS para conducir a los bromuros de acilo RCOBr.
Consulte también la Parte V, Cap. 21 para otros ejemplos de reacciones de
inserción estequiométrica (uso del reactivo de Collman) y catalítica (con Pd) y sus
aplicaciones en síntesis orgánica.
You might also like
- ArticuloDocument8 pagesArticuloSHERLY KIMBERLY RAMOS JESUSNo ratings yet
- Informe Labo 2ORGANICADocument13 pagesInforme Labo 2ORGANICAKEVIN ENDER TAYPE HUANCANo ratings yet
- REPORTE LABORATORIO I de La Cruz P. Rosa M.Document9 pagesREPORTE LABORATORIO I de La Cruz P. Rosa M.wilfredoroman16No ratings yet
- Informe 3 BoranosDocument34 pagesInforme 3 BoranosMELANIE CINDY SURCO SOLISNo ratings yet
- Laboratorio Nº7 BIOINORGANICA Facultad de Ciencias UNIDocument13 pagesLaboratorio Nº7 BIOINORGANICA Facultad de Ciencias UNIMELANIE CINDY SURCO SOLISNo ratings yet
- Sintesis de Macrociclos de CobaltoDocument12 pagesSintesis de Macrociclos de CobaltoSharon Laurente Ramón100% (4)
- Usos Del Diagrama de EllinghamDocument2 pagesUsos Del Diagrama de EllinghamAreli Noriega CamachoNo ratings yet
- Purificación de ferroceno mediante sublimaciónDocument2 pagesPurificación de ferroceno mediante sublimaciónFelipe Rojas AcevedoNo ratings yet
- Resumen de Compuesto Inorgánicos de Estructura Compleja PDFDocument146 pagesResumen de Compuesto Inorgánicos de Estructura Compleja PDFAlberto RodríguezNo ratings yet
- Síntesis de magnetita y estudio de sus propiedades magnéticasDocument36 pagesSíntesis de magnetita y estudio de sus propiedades magnéticasDiego HernandezNo ratings yet
- Isomeros FinalDocument5 pagesIsomeros FinalJohanna GalanNo ratings yet
- Los Aerosoles Son Coloides en Los Que La Fase Dispersa Es Un Líquido o Un Sólido y El Medio Dispersor Es Un GasDocument7 pagesLos Aerosoles Son Coloides en Los Que La Fase Dispersa Es Un Líquido o Un Sólido y El Medio Dispersor Es Un GasYsa Verito DCNo ratings yet
- Serie EspectroquímicaDocument10 pagesSerie Espectroquímicamariliaguillen20% (1)
- Elementos No Metalicos Del Grupo 16Document23 pagesElementos No Metalicos Del Grupo 16aguado1993No ratings yet
- Complejos de Werner PDFDocument49 pagesComplejos de Werner PDFGuillermo RTNo ratings yet
- LEB1.Equilibrio Heterogéneo Liquido-LiquidoDocument18 pagesLEB1.Equilibrio Heterogéneo Liquido-LiquidoDULCE FERNANDA MIRELES ESTUPIÑANNo ratings yet
- Cálculos estequiométricos y problemas de titulaciónDocument3 pagesCálculos estequiométricos y problemas de titulaciónFernanda FloresNo ratings yet
- Características y reacciones de los compuestos alílicosDocument9 pagesCaracterísticas y reacciones de los compuestos alílicosfelipe mejia guerraNo ratings yet
- Reaccion de WittigDocument3 pagesReaccion de WittigMayra BedoyaNo ratings yet
- Electroquímica Lab N°4 CodeposiciónDocument9 pagesElectroquímica Lab N°4 CodeposiciónSoy un Gordo ConchatumadreNo ratings yet
- Volumetría RedoxDocument21 pagesVolumetría RedoxMelanie De los RíosNo ratings yet
- CalculosDocument11 pagesCalculosOSCAR DANIEL ARREDONDO GAÑANNo ratings yet
- Polimeros - BaquelitaDocument8 pagesPolimeros - BaquelitaJonathan ManriqueNo ratings yet
- Asignación Diagrama de Fases Magnesio-CobreDocument7 pagesAsignación Diagrama de Fases Magnesio-CobreDaniel David Mantilla QuinteroNo ratings yet
- Preinforme Practica Isomeros Nitro y NitritoDocument5 pagesPreinforme Practica Isomeros Nitro y Nitritoferney romerocaperaNo ratings yet
- Reactividad de carbonilos y aromáticosDocument68 pagesReactividad de carbonilos y aromáticosEren GarciaNo ratings yet
- Electrodo de Membrana Líquida para CalcioDocument2 pagesElectrodo de Membrana Líquida para CalcioDianaa Isabella Fernandez0% (1)
- Guia 2 de GaussDocument11 pagesGuia 2 de GaussTibisay MarquezNo ratings yet
- Creando entrada Gaussian H2O2Document6 pagesCreando entrada Gaussian H2O2Maria NavasNo ratings yet
- PRACTICO 5 EstereoquímicaDocument2 pagesPRACTICO 5 Estereoquímicaariel yana morga0% (1)
- Metodos Volumetricos de Formacion de ComplejosDocument25 pagesMetodos Volumetricos de Formacion de ComplejosPabloSanchezNo ratings yet
- Informe Proyecto Final Corteva (1) (Reparado)Document38 pagesInforme Proyecto Final Corteva (1) (Reparado)CarlosAlbertoGonzalezNo ratings yet
- Reporte Experimental QuelatoDocument9 pagesReporte Experimental QuelatoEdgar ArmandoNo ratings yet
- Cinética de saponificación del acetato de etiloDocument9 pagesCinética de saponificación del acetato de etiloLeydi Jhoana Garcia CardenasNo ratings yet
- Exf cq312-19-1Document3 pagesExf cq312-19-1jeavibuNo ratings yet
- Química Analítica Sesion 9Document29 pagesQuímica Analítica Sesion 9RandleMcmurphiNo ratings yet
- Preparación de AlumbreDocument8 pagesPreparación de AlumbreKATHERINE LISET ORTIZ PATERNINA ESTUDIANTE ACTIVO100% (1)
- Ferroceno Shere y SusanDocument6 pagesFerroceno Shere y SusanSusan L. Bazán CastroNo ratings yet
- ComplejosCo3 PDFDocument6 pagesComplejosCo3 PDFNadia WilsonNo ratings yet
- ComplejosDocument41 pagesComplejosAnthony Alexandere VivancoNo ratings yet
- 23-02-2017 Síntesis de Un Material Luminiscente Por CoprecipitaciónDocument2 pages23-02-2017 Síntesis de Un Material Luminiscente Por CoprecipitaciónLuis CampuzanoNo ratings yet
- 9 Constantes de EstabilidadDocument14 pages9 Constantes de EstabilidadAleiozNo ratings yet
- Tabla Conteo de ElectronesDocument1 pageTabla Conteo de ElectronesEdward AlexanderNo ratings yet
- Constante de Estabilidad Ag (NH3)Document3 pagesConstante de Estabilidad Ag (NH3)ÁngelNo ratings yet
- Redox TP9Document11 pagesRedox TP9David LeudoNo ratings yet
- Laboratorio N°7Document4 pagesLaboratorio N°7Brian Condo RamosNo ratings yet
- Informe 16 - Descomposición CatalíticaDocument17 pagesInforme 16 - Descomposición CatalíticaKATHERINNE LUZ CHUCO DE LA CRUZNo ratings yet
- Síntesis Mn(acac)3Document6 pagesSíntesis Mn(acac)3GICELANo ratings yet
- Sol Ex P Cq312 19-2Document3 pagesSol Ex P Cq312 19-2Elvis RenzoNo ratings yet
- Metodos Con PermanganatoDocument18 pagesMetodos Con PermanganatoKatyNo ratings yet
- Informe 3 Trayectoria ParabólicaDocument5 pagesInforme 3 Trayectoria ParabólicaRicardo JesusNo ratings yet
- QUÍMICA DE COORDINACIÓNDocument79 pagesQUÍMICA DE COORDINACIÓNjhon fernandoNo ratings yet
- AluminioDocument8 pagesAluminiocelimarNo ratings yet
- Practica 7 Preparacion Del Acido Maleico A Aci FumaricoDocument7 pagesPractica 7 Preparacion Del Acido Maleico A Aci FumaricoJavier Solano GaribayNo ratings yet
- Determinación de band gap en semiconductores por espectroscopía Uv-Vis y reflectancia difusaDocument28 pagesDeterminación de band gap en semiconductores por espectroscopía Uv-Vis y reflectancia difusaDurvel de la CruzNo ratings yet
- Conductimetría: medición conductividad disolucionesDocument8 pagesConductimetría: medición conductividad disolucionesjose huallpa floresNo ratings yet
- 1.selección de Detectores en Cromatografía de Gases MasasDocument44 pages1.selección de Detectores en Cromatografía de Gases MasasJuan Carlos VazquezNo ratings yet
- COOQ Resumen T.6Document13 pagesCOOQ Resumen T.6Alba Rivas GuijarroNo ratings yet
- Reducción de Ácidos CarboxílicosDocument17 pagesReducción de Ácidos CarboxílicosJorge Mario Fernandez PeñaNo ratings yet
- Alquenos MonoDocument14 pagesAlquenos MonoDavid Fernando Chacon Candia0% (1)
- Guia de 1er LaboratorioDocument3 pagesGuia de 1er LaboratorioElvis RenzoNo ratings yet
- Laboratorio 5 ORGA 3 2020 - 2Document15 pagesLaboratorio 5 ORGA 3 2020 - 2Elvis RenzoNo ratings yet
- Laboratorio 5 OrgaDocument1 pageLaboratorio 5 OrgaElvis RenzoNo ratings yet
- Mario Samamé Boggio: ingeniero y minero peruanoDocument6 pagesMario Samamé Boggio: ingeniero y minero peruanoElvis RenzoNo ratings yet
- Bet, Tga, DTGDocument15 pagesBet, Tga, DTGElvis RenzoNo ratings yet
- Informe 3Document12 pagesInforme 3Elvis RenzoNo ratings yet
- INFORME3Document8 pagesINFORME3Elvis RenzoNo ratings yet
- INFORME3Document8 pagesINFORME3Elvis RenzoNo ratings yet
- Exposición Lab 6 FINALDocument10 pagesExposición Lab 6 FINALElvis RenzoNo ratings yet
- Labo 2 Orga3 FINALtDocument14 pagesLabo 2 Orga3 FINALtElvis RenzoNo ratings yet
- Lab.4 OrgDocument8 pagesLab.4 OrgElvis RenzoNo ratings yet
- Robert Monroe Libro 1 Viajes Fuera Del Cuerpo 1971 PDFDocument137 pagesRobert Monroe Libro 1 Viajes Fuera Del Cuerpo 1971 PDFFuegodelCielo100% (1)
- Informe 3Document12 pagesInforme 3Elvis RenzoNo ratings yet
- Lab3 Orga2Document13 pagesLab3 Orga2Elvis RenzoNo ratings yet
- Tarea Primer LaboratorioDocument1 pageTarea Primer LaboratorioElvis RenzoNo ratings yet
- Guia de 1er LaboratorioDocument3 pagesGuia de 1er LaboratorioElvis RenzoNo ratings yet
- Historia de La Organometalica 20192Document9 pagesHistoria de La Organometalica 20192Elvis RenzoNo ratings yet
- Informe 1Document12 pagesInforme 1Elvis RenzoNo ratings yet
- Silabus de Los Cursos Nivelacion VeranoDocument5 pagesSilabus de Los Cursos Nivelacion VeranoElvis RenzoNo ratings yet
- 1ROLISTODocument67 pages1ROLISTOElvis RenzoNo ratings yet
- Sol Ex P Cq312 19-2Document3 pagesSol Ex P Cq312 19-2Elvis RenzoNo ratings yet
- Tarea 3 Orga 2Document2 pagesTarea 3 Orga 2Elvis RenzoNo ratings yet
- Integra Por Sustitución 2011Document11 pagesIntegra Por Sustitución 2011Elvis RenzoNo ratings yet
- Material 1 Algebra-Grupo XxiDocument3 pagesMaterial 1 Algebra-Grupo XxiElvis RenzoNo ratings yet
- Historia Organometalica 2019-2Document13 pagesHistoria Organometalica 2019-2Elvis RenzoNo ratings yet
- Expresiones AlgebraicasDocument41 pagesExpresiones AlgebraicasAraceli Guerrero ApolinarioNo ratings yet
- Problemas de Tiempos y CalendariosDocument5 pagesProblemas de Tiempos y CalendariosElvis RenzoNo ratings yet
- Problemas Resueltos de ConjuntosDocument3 pagesProblemas Resueltos de ConjuntosElvis RenzoNo ratings yet
- Tiempos y CalendariosDocument3 pagesTiempos y CalendariosElvis RenzoNo ratings yet
- Problemas Sobre EdadesDocument3 pagesProblemas Sobre EdadesElvis RenzoNo ratings yet
- Documento ReclamacionDocument2 pagesDocumento Reclamacionenrique santosNo ratings yet
- 22 Al 42. Adn Activacion 64 Codigos.Document29 pages22 Al 42. Adn Activacion 64 Codigos.Anonymous EA4t5iay100% (1)
- ACTIVIDAD #3 - ABC - ComunicaciónDocument2 pagesACTIVIDAD #3 - ABC - ComunicaciónCasandra Joaquin VelasquezNo ratings yet
- Proyecto InfoDocument2 pagesProyecto InfoGERARDO EMIR VALDEZ CABRERANo ratings yet
- EstadisticaDocument4 pagesEstadisticaJorge Loyola BravoNo ratings yet
- Liberación de Hormigón.Document2 pagesLiberación de Hormigón.Franklin GarcíaNo ratings yet
- Evidencia Semana3Document4 pagesEvidencia Semana3Yesid VasquezNo ratings yet
- Elaboración de licores artesanales y maridaje con postres cuencanosDocument158 pagesElaboración de licores artesanales y maridaje con postres cuencanosCarol Daniela Mamani RamosNo ratings yet
- Planeacion 08 de Agosto MartesDocument7 pagesPlaneacion 08 de Agosto Martesyudis kodinaNo ratings yet
- RAÚL ESPINOZA FUENTES Manual de Procedimiento Civil, El Juicio EjecutivoDocument110 pagesRAÚL ESPINOZA FUENTES Manual de Procedimiento Civil, El Juicio EjecutivoNicko Aguila Gonzalez100% (4)
- Catalogo StarkerDocument24 pagesCatalogo Starkerdavekoz33% (3)
- Riesgos en El Uso de QuimicosDocument8 pagesRiesgos en El Uso de QuimicosLuis Andres Ortiz CristiNo ratings yet
- Análisis Granulométrico Por Tamizado: MTC E - 107 - Astm D 422 - Aashto T 88Document20 pagesAnálisis Granulométrico Por Tamizado: MTC E - 107 - Astm D 422 - Aashto T 88guiulfoNo ratings yet
- ACCIDENTOLOGÍADocument17 pagesACCIDENTOLOGÍAEnrique BogadoNo ratings yet
- Iberdrola ESDocument4 pagesIberdrola ESLidia RoblesNo ratings yet
- Libros de Psicoanálisis (Links)Document4 pagesLibros de Psicoanálisis (Links)Amalia Elizabeth RodríguezNo ratings yet
- JUNTOSDocument16 pagesJUNTOSTomàs CuacoNo ratings yet
- Patatas y Huevos OsmoticosDocument7 pagesPatatas y Huevos OsmoticossalarcsanNo ratings yet
- Cálculo de La Sección de Un Conductor 2021Document7 pagesCálculo de La Sección de Un Conductor 2021Alonso VeloNo ratings yet
- La Historia de La Zanahoria, El Huevo y El Café ¿Con Quién Te Identificas - REFLEXIONES CRISTIANASDocument2 pagesLa Historia de La Zanahoria, El Huevo y El Café ¿Con Quién Te Identificas - REFLEXIONES CRISTIANASJUDITHNo ratings yet
- Desastre ChosicaDocument30 pagesDesastre ChosicaKaterineKataleyaNo ratings yet
- Manual Completo de Practicas de LaboratorioDocument39 pagesManual Completo de Practicas de LaboratorioVera Loor José EdwinNo ratings yet
- Investigación y ExtensiónDocument4 pagesInvestigación y Extensiónivette nayaraNo ratings yet
- Evaluación de Ciencias BásicasDocument351 pagesEvaluación de Ciencias BásicasChristian PucaNo ratings yet
- Upo.d1 TranstornoDocument56 pagesUpo.d1 TranstornoUNE-TNo ratings yet
- BorazinaDocument2 pagesBorazinaAlan Cabrera50% (2)
- CASO PRACTICO - Auditoria de Recursos Humanos KDocument5 pagesCASO PRACTICO - Auditoria de Recursos Humanos KOlgaNo ratings yet
- Plan de Marketing Cafe DoradoDocument75 pagesPlan de Marketing Cafe DoradoAllizon RengifoNo ratings yet
- 50.1 Componentes Del Costo de Los Inventarios (NIC 2) DUO PRACTICUMDocument88 pages50.1 Componentes Del Costo de Los Inventarios (NIC 2) DUO PRACTICUMEymiCristinaNo ratings yet
- Revision Estado Cumplimiento SG SSTDocument44 pagesRevision Estado Cumplimiento SG SSTJulian PabonNo ratings yet