Professional Documents
Culture Documents
Capitulo 1.2
Uploaded by
benru290 ratings0% found this document useful (0 votes)
55 views21 pagesCalculo de Z
Original Title
CAPITULO 1.2
Copyright
© Attribution Non-Commercial (BY-NC)
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCalculo de Z
Copyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
55 views21 pagesCapitulo 1.2
Uploaded by
benru29Calculo de Z
Copyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 21
Cálculo de Z de un gas de Van
Der Waals
• Multiplicamos la ecuación (1.18) por V* y
dividimos por RT entonces quedaría:
Z = PV* / RT
Z = (V* / V* - b) – a / RTV*
• Multiplicamos y dividimos por V*
Z = ( 1 / (1 – b/V*)) – a / RTV*
• Cuando P es baja (b/V*) es pequeña comparada
con 1, de aquí que podamos decir que:
1/(1 – b/V *) = 1 + (b/V*) + (b/V*)2 + …
elaboró: Dra. Mònica Alcalà Rdz. 1
Cálculo de Z de un gas de Van
Der Waals
• Empleando este resultado en la ecuación anterior
obtenemos:
Z = 1 + (b - a ) 1/V* + (b/V*)2 + (b/V*)3 1.21a
RT
• sería más complicado tratar de obtener una ecuación
para Z en función de P y T, ya que en su lugar haremos
una aproximación sabiendo que cuando P 0
(1/V*) 0 y Z=1
elaboró: Dra. Mònica Alcalà Rdz. 2
Cálculo de Z de un gas de Van
Der Waals
• Este desarrollo para Z corregido en P2 es:
Z = 1 + 1 (b - a/RT )P + a (2b - a/RT)P2 + … 1.21b
RT (RT)3
• La ecuación anterior nos muestra que los términos que
producen el comportamiento no ideal se anulan cuando la
presión se aproxima a cero, o la temperatura a infinito.
elaboró: Dra. Mònica Alcalà Rdz. 3
Cálculo de Z de un gas de Van
Der Waals
• Por regla general un gas real se comporta
idealmente para una P baja y T alta.
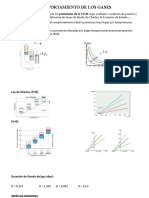
•La pendiente de la ecuación 1.21b se obtiene al
graficar Z y P y con T = cte.
elaboró: Dra. Mònica Alcalà Rdz. 4
Cálculo de Z de un gas de Van
Der Waals
Z = 1 (b – a/RT) + 2a (2b – a/RT)P + …
P (RT) (RT)3
A P = 0, tenemos que:
Z= 1 (b – a/RT)
P (RT)
elaboró: Dra. Mònica Alcalà Rdz. 5
Temperatura de Boyle
• A cierta temperatura intermedia entre T1 y Tc esta
definida la TB, temperatura de Boyle, a esta
temperatura la pendiente inicial de la ecuación 1.21
b tiene que ser cero
(b-a / RTB) = 0 esto da:
TB = a / Rb
elaboró: Dra. Mònica Alcalà Rdz. 6
Temperatura de Boyle
• A la temperatura de Boyle la curva Z contra P es
tangente a la curva para el gas ideal a P = 0 y se
eleva por encima de la misma sólo muy lentamente.
• El gas real a la TB se comporta idealmente en un
amplio intervalo de presiones, debido a que casi se
compensan el efecto del tamaño molecular y el de
fuerzas intermoleculares.
elaboró: Dra. Mònica Alcalà Rdz. 7
Ley de Estados
correspondientes
• Van Der Waals señaló que si se utilizan
variables reducidas para expresar los
estados de los gases, entonces, de forma
bastante aproximada, todos los gases
muestran el mismo comportamiento P, V*, T.
• Dos gases distintos a las mismas Pr Y Tr
tendrán prácticamente el mismo Vr, LEC.
Vr = f (Pr, Tr)
elaboró: Dra. Mònica Alcalà Rdz. 8
Propiedades Reducidas
• Para calcular las propiedades reducidas será necesario:
Pr = P / Pc
Tr = T / Tc
Vr = V* / V*c
Hacer notar la importancia de propiedades reducidas.
elaboró: Dra. Mònica Alcalà Rdz. 9
Propiedades Reducidas
• Por ejemplo: Argón a 302 K y 16 atm y etano a
381 K y 18 atm, ¿se encuentran en estados
correspondientes?.
• Cualquier ecuación de estado que comprenda
sólo dos constantes además de R, puede ser
expresada en función de las variables reducidas.
• Las ecuaciones que compendian más de dos
constantes, fueron desechadas, por contradecir
la ley de estados correspondientes.
elaboró: Dra. Mònica Alcalà Rdz. 10
Otras ecuaciones de Estado
Se han propuesto muchas otras ecuaciones de estado
para gases:
• Berthelot
• Dieterici
Pero no más complicada que VDW y menos precisas
que esta.
• Una ecuación de estado bastante exacta de dos
parámetros es la Redlich - Kwong.
elaboró: Dra. Mònica Alcalà Rdz. 11
Otras ecuaciones de Estado
• Es útil a un intervalo bastante amplio de T y P, a y b
de RW son diferentes a a y b de VDW.
P + ( a )(Vm – b) = RT
Vm(Vm + b) T1/2
• La mecánica estadística demuestra que se puede
expresar la ecuación de estado de un gas real como
el siguiente desarrollo de serie de potencias.
elaboró: Dra. Mònica Alcalà Rdz. 12
Otras ecuaciones de Estado
• PVm = RT ( 1 + B (T) + C (T) + D (T) + …)
Vm Vm2 Vm3
• Esta es la ecuación de estado virial, los
coeficientes viriales son B, C y D y son funciones
de T.
elaboró: Dra. Mònica Alcalà Rdz. 13
Otras ecuaciones de Estado
• Los coeficientes viriales se determinan a partir de
mediciones experimentales P - V - T de los gases.
• Dada la precisión limitada de los resultados sólo
se permite la evaluación de B (T) y algunas veces
de C (T).
elaboró: Dra. Mònica Alcalà Rdz. 14
Otras ecuaciones de Estado
• La mecánica estadística proporciona ecuaciones
que relacionan los coeficientes del virial con la
energía potencial de las FIA.
• Una forma equivalente para la ecuación 1.25
utiliza un desarrollo en serie de potencias de P:
PVm = RT (1 + B* (T)P + C* (T)P2 + D* (T)P3
elaboró: Dra. Mònica Alcalà Rdz. 15
Otras ecuaciones de Estado
• Para relacionar los coeficientes B*, C* con B y C,
despejamos P de la ecuación virial, sustituimos la
ecuación resultante en el lado derecho de 1.26 y
comparamos los coeficientes de cada potencia de
1/Vm con los de 1.25 el resultado que se obtiene
para los dos primeros coeficientes es:
• B = B* / RT, C = (B*2 + C*) R2 T2
• B* = B (RT), C* = (C – B*2) / R2T2
• Si P no es alto, los términos C/Vm o C*P2 son
despreciables.
elaboró: Dra. Mònica Alcalà Rdz. 16
Otras ecuaciones de Estado
• La ecuación virial se convierte en:
Vm = RT / P + B (T)
Cuando la P es baja y T es elevada.
• La ecuación anterior demuestra que cuando la P
es baja el segundo coeficiente virial B (T)
representa la corrección al volumen molar del gas
ideal, RT / P.
elaboró: Dra. Mònica Alcalà Rdz. 17
Postulados de la teoría cinética
para los gases perfectos
• Las ecuaciones vistas hasta el momento son
empíricas ya que provienen de la observación
experimental.
• La teoría cinética de los gases sirve muy bien
para definir a los gases perfectos a través de
sus postulados:
elaboró: Dra. Mònica Alcalà Rdz. 18
Teoría cinética de los gases
• Los gases están constituidos de partículas
pequeñas, individuales y discretas llamadas
moléculas.
• Las moléculas son muy pequeñas en
comparación con el volumen ocupado por el gas
tal que sus distancias de separación son muy
grandes.
• Las moléculas se mueven continuamente en
forma caótica chocando entre si y contra las
paredes del recipiente que lo contiene.
elaboró: Dra. Mònica Alcalà Rdz. 19
Teoría cinética de los gases
• Los choques entre si son elásticos y las
moléculas no pierden o ceden energía en esos
choques.
• Los choques contra las paredes se manifiestan
como una fuerza aplicada en esa superficie y se
traduce en presión.
• La velocidad con que se mueven las moléculas y
su energía cinética dependen de forma directa de
la temperatura, ya que modifican los estados de
energía cinética, rotacional y vibracional.
elaboró: Dra. Mònica Alcalà Rdz. 20
Teoría cinética de los gases
• Las grandes distancias de separación entre
moléculas hacen que sea despreciable la
interacción entre ellas (fuerzas atractivas o
repulsivas)
• Los gases así descritos son ideales o
perfectos y ellos obedecen las expresiones
simples vistas hasta aquí.
elaboró: Dra. Mònica Alcalà Rdz. 21
You might also like
- Gases Reales 20-IiDocument5 pagesGases Reales 20-IiDanny Palma AyalaNo ratings yet
- Clase4 5VIRTFQIDocument40 pagesClase4 5VIRTFQIRichard Antony Alva RuizNo ratings yet
- Gases RealesDocument17 pagesGases RealesGustavo Espinoza Rivera100% (2)
- 1.2 Gases Reales - AnotacionesDocument39 pages1.2 Gases Reales - AnotacionesBea EgNo ratings yet
- Trabajo de Fisicoquimica 2Document15 pagesTrabajo de Fisicoquimica 2Sayuri Elena Petro MaceaNo ratings yet
- 1.2 Gases RealesDocument36 pages1.2 Gases RealesElizabeth Vivar RojasNo ratings yet
- Gases IdealesDocument24 pagesGases IdealesАлександр Кирос КасересNo ratings yet
- Termodinámica de gases: Leyes y ecuacionesDocument34 pagesTermodinámica de gases: Leyes y ecuacionespatriarca28No ratings yet
- Corre Laci OnesDocument46 pagesCorre Laci Onesdéborah_rosalesNo ratings yet
- Balance de Materia Y Energia PI-111B: Universidad Nacional de Ingenieria Facultad de Ingienieria Quimica Y TextilDocument38 pagesBalance de Materia Y Energia PI-111B: Universidad Nacional de Ingenieria Facultad de Ingienieria Quimica Y TextilMauricio Norabuena MontesNo ratings yet
- 1.2 Gases RealesDocument55 pages1.2 Gases RealesLuis CONDORI SOTO100% (1)
- Problemario Termo IPN Septiembre 2015Document35 pagesProblemario Termo IPN Septiembre 2015Carol Sán0% (1)
- Gases Reales - Uso de Ecuaciones de Estado PDFDocument6 pagesGases Reales - Uso de Ecuaciones de Estado PDFGeraldine D. FernándezNo ratings yet
- Clase 1 2019-1 Gases IDEALES-REALESDocument39 pagesClase 1 2019-1 Gases IDEALES-REALESAlberto perez william100% (1)
- Ecuaciones de estado para gases ideales y realesDocument63 pagesEcuaciones de estado para gases ideales y realesCallejas Palominos Eduardo0% (1)
- Gases Reales-Ec Van Der WaalsDocument27 pagesGases Reales-Ec Van Der WaalsVanessa TrujilloNo ratings yet
- 05-13-2019 174142 PM (ECUACIONES DE ESTADO) - Actualizado 13.05.2019Document16 pages05-13-2019 174142 PM (ECUACIONES DE ESTADO) - Actualizado 13.05.2019Andii Vasquez RojasNo ratings yet
- Factor de Compresibilidad Z, Definido ComoDocument11 pagesFactor de Compresibilidad Z, Definido ComoJuan SotoNo ratings yet
- Escuela Superior Politécnica de Chimborazo: Ing. Adrián Rodríguez PinosDocument10 pagesEscuela Superior Politécnica de Chimborazo: Ing. Adrián Rodríguez PinosEnrique AlejandroNo ratings yet
- Unidad. 1Document78 pagesUnidad. 1erick sanchezNo ratings yet
- Ecuación de Gases RealesDocument9 pagesEcuación de Gases RealesAli DíazNo ratings yet
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesElsa Marzana SanizoNo ratings yet
- Comportamiento de los gasesDocument25 pagesComportamiento de los gasesERIKA LOZADA RUSSELNo ratings yet
- Estados CorrespondientesDocument16 pagesEstados CorrespondientesCarlos AlarconNo ratings yet
- Leyes de los gases y su aplicaciónDocument64 pagesLeyes de los gases y su aplicaciónMaykol AlbercaNo ratings yet
- Termodinámica-Factor de Compresibilidad-2Document5 pagesTermodinámica-Factor de Compresibilidad-2Clara Díaz CruzNo ratings yet
- 05 Gases RealesDocument21 pages05 Gases RealesGustavo GilNo ratings yet
- Ecuaciones de EstadoDocument10 pagesEcuaciones de EstadoMiguel Angel PalominoNo ratings yet
- Gases Reales - USILDocument29 pagesGases Reales - USILjoseNo ratings yet
- Presentación de PowerPointDocument29 pagesPresentación de PowerPointSicomoseaRamiresNo ratings yet
- IntroIQ Clase 17 y 18Document27 pagesIntroIQ Clase 17 y 18AR QuímicaNo ratings yet
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesAlfredo G. PradaNo ratings yet
- Gases IdealesDocument19 pagesGases IdealesDianePumeNo ratings yet
- Densidad y Peso Molecular Del AireDocument12 pagesDensidad y Peso Molecular Del AireFernanda LemaNo ratings yet
- Trabajo Escrito Termodinamica eDocument7 pagesTrabajo Escrito Termodinamica eJuan MonterrozaNo ratings yet
- T 3 A. Gases RealesDocument27 pagesT 3 A. Gases RealesTatiana ZorrillaNo ratings yet
- Trabajo Escrito Termodinamica FinalDocument8 pagesTrabajo Escrito Termodinamica FinalJuan MonterrozaNo ratings yet
- 05-Clase Termo - Gases Reales Correlaciones y Tablas de Vapor 201027Document56 pages05-Clase Termo - Gases Reales Correlaciones y Tablas de Vapor 201027Carlos SandovalNo ratings yet
- 03 Gases DAIERDocument30 pages03 Gases DAIERValentinaNo ratings yet
- TAREA DE TERMO II (1)Document7 pagesTAREA DE TERMO II (1)Viviana BailonNo ratings yet
- Gases RealesDocument35 pagesGases RealesAlma EscobarNo ratings yet
- Gases ideales y realesDocument31 pagesGases ideales y realesLuisa M PadovaniNo ratings yet
- Gases Reales-Fuerzas Intermoleculares PDFDocument34 pagesGases Reales-Fuerzas Intermoleculares PDFdamiánNo ratings yet
- Ecuaciones de Estado para Gases No IdealesDocument29 pagesEcuaciones de Estado para Gases No IdealesFernando LópezNo ratings yet
- Clase I - Segunda ParteDocument28 pagesClase I - Segunda ParteJuan Manuel AldereteNo ratings yet
- Informe de Laboratorio N°2 FiCoDocument14 pagesInforme de Laboratorio N°2 FiCoSteven Chavez ZelayaNo ratings yet
- Termo 3Document36 pagesTermo 3José Emilio GuardiaNo ratings yet
- Tema 1 IntroGasesDocument22 pagesTema 1 IntroGasesDaniel SerkinNo ratings yet
- Introducción y Conceptos Básicos Ing. Juan Carlos Valdez LoaizaDocument58 pagesIntroducción y Conceptos Básicos Ing. Juan Carlos Valdez LoaizaSanto 125No ratings yet
- TMN 121 4 GASES IDEALES 1Document41 pagesTMN 121 4 GASES IDEALES 1kevin.martinez.rNo ratings yet
- Gases 2 HojasDocument26 pagesGases 2 HojasHector LuceroNo ratings yet
- Clase 5Document34 pagesClase 5Miguel AngelNo ratings yet
- 4.-Ecuaciones de Estado - Cálculo de Propiedades Con Ecuaciones de EstadoDocument34 pages4.-Ecuaciones de Estado - Cálculo de Propiedades Con Ecuaciones de Estadokagf8750% (2)
- Gases RealesDocument53 pagesGases RealesCatherine MoranteNo ratings yet
- Termod - Capitulo-Ecuaciones de EstadoDocument32 pagesTermod - Capitulo-Ecuaciones de EstadoDennis Elias TaipeNo ratings yet
- Trabajo de Termo Propiedades ResidualesDocument25 pagesTrabajo de Termo Propiedades ResidualesLuis Gamero50% (2)
- Gases Reales PresentacionDocument48 pagesGases Reales PresentacionEdwinNo ratings yet
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Manual Vitale - ESDocument11 pagesManual Vitale - ESEnrique Piqueras DomenechNo ratings yet
- Gq-Fo-29 Al 36 Formatos InspeccionesDocument14 pagesGq-Fo-29 Al 36 Formatos InspeccionesGloria HernandezNo ratings yet
- Libro de Control de Clases: #Orden de CompraDocument8 pagesLibro de Control de Clases: #Orden de CompraSussy Ortiz MercadoNo ratings yet
- Serie 02 Integral Definida e IndefinidaDocument7 pagesSerie 02 Integral Definida e IndefinidajtmuciruNo ratings yet
- Makrolon® Multi UV Un Programa Con Muchas SolucionesDocument2 pagesMakrolon® Multi UV Un Programa Con Muchas SolucionesJUAN1995ANo ratings yet
- Ejercicios Cinetica, Estequiometria y Diseño BiorreactoresDocument2 pagesEjercicios Cinetica, Estequiometria y Diseño Biorreactoresantonioch3003No ratings yet
- Concentrado estimado de obra de introducción de red de drenaje sanitarioDocument1 pageConcentrado estimado de obra de introducción de red de drenaje sanitarioRuben CM100% (1)
- Serie GDocument14 pagesSerie GAraveug DivadNo ratings yet
- Memoria Descriptiva para SubDocument2 pagesMemoria Descriptiva para SubCarlos DominguezNo ratings yet
- Cartilla Mampostería Confinada PDFDocument68 pagesCartilla Mampostería Confinada PDFWilmer Alexander Sanchez GomezNo ratings yet
- Manual de Usuario Del Aida 41Document8 pagesManual de Usuario Del Aida 41jonathan40056No ratings yet
- Practica 2 El Perfil Del SueloDocument3 pagesPractica 2 El Perfil Del SueloPablo Muñoz CastellanosNo ratings yet
- Anejo Nacional EC7 - JEGDocument21 pagesAnejo Nacional EC7 - JEGMR RALFNo ratings yet
- Reconocimiento Nitrógeno: Potasio MetálicoDocument21 pagesReconocimiento Nitrógeno: Potasio MetálicoEdgar Huanca AguilarNo ratings yet
- Esfuerzo en Una Llave Con Elementos FinitosDocument13 pagesEsfuerzo en Una Llave Con Elementos FinitosasmolinabNo ratings yet
- UBICACIÓNDocument3 pagesUBICACIÓNCristhian Raul Rodriguez SucapucaNo ratings yet
- Concresive 1090Document4 pagesConcresive 1090Carlos Alexis Puicon HuamanNo ratings yet
- Ciclo de MarchaDocument3 pagesCiclo de MarchaBenja DietzNo ratings yet
- Simulación de cascada neumática para secuencia A+B+A-BDocument7 pagesSimulación de cascada neumática para secuencia A+B+A-BAndres SoriaNo ratings yet
- Silla de RuedasDocument15 pagesSilla de RuedasEddy OrtegaNo ratings yet
- Direccion Hidraulica ManualDocument0 pagesDireccion Hidraulica Manualgeorgeus2967% (3)
- Repaso 26 30 31Document17 pagesRepaso 26 30 31Sebastian Romero100% (1)
- Practica 4Document1 pagePractica 4Itari CervantesNo ratings yet
- Estructuras de AceroDocument9 pagesEstructuras de AceroJacs AlexNo ratings yet
- Tipos de Reacciones QuimicasDocument4 pagesTipos de Reacciones QuimicasSanti AvareceNo ratings yet
- GIMPDocument8 pagesGIMPraul francisco avila medinaNo ratings yet
- Introduccion Laboratorio de MantenimientoDocument2 pagesIntroduccion Laboratorio de MantenimientoRonny ValarezoNo ratings yet
- Taller TeoricoDocument9 pagesTaller TeoricoSteeven EngraciaNo ratings yet
- R-31 - Inspección Herramientas ManualesDocument1 pageR-31 - Inspección Herramientas ManualesJorge Maximiliano Castro AranedaNo ratings yet
- EPN WPS 02 especificación procedimiento soldadura SMAW junta T placa 4mmDocument2 pagesEPN WPS 02 especificación procedimiento soldadura SMAW junta T placa 4mmChristian Castro MhNo ratings yet