Professional Documents
Culture Documents
Atomos
Uploaded by
kalamar102Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Atomos
Uploaded by
kalamar102Copyright:
Available Formats
LA ESTRUCTURA ELECTRNICA DE LOS TOMOS
1.- La descripcin macroscpica del Universo.
El desarrollo de la Fsica hasta finales del siglo XIX permite una descripcin de nuestro entorno cotidiano que se basa en unos hechos que se aceptan como evidentes de por s. Estos hechos son: a) Es posible determinar exactamente la posicin de un cuerpo y si ste es extenso, entonces se puede definir un punto cualquiera de l, por ejemplo su centro de masas, cuya posicin puede conocerse con toda exactitud. b) Es posible conocer con toda exactitud la velocidad de un punto de un cuerpo, por ejemplo la de su centro de masas. c) Todo cuerpo material est provisto de una masa cuyo valor es inalterable. d) El espacio es una referencia inalterable en cuyo seno los cuerpos se mueven e) El tiempo es una referencia inalterable que fluye de una manera constante. Adems, las leyes de la Mecnica establecidas firmemente por Newton permiten un marco terico matemtico que permite determinar la evolucin de cualquier sistema mecnico conociendo su posicin y velocidad en un instante dado y las fuerzas que actan sobre l. Sin embargo, a medida que los aparatos de medida se hicieron ms precisos, se descubri muy pronto que todas estas premisas eran falsas. Algunas fueron refutadas por el desarrollo del electromagnetismo y la Relatividad (naturaleza absoluta del espacio y del tiempo y la constancia de la masa) y otras por el desarrollo de la Mecnica Cuntica iniciada por Planck, aplicada al tomo por Bohr y Sommerfeld, y llevada a sus ltimas consecuencias por De Broglie, Schrdinger y Heisenberg a finales de los aos veinte del ltimo siglo.
2.- La descripcin microscpica del Universo.
El hecho de poder precisar exactamente la posicin y la velocidad de un cuerpo, que nos parece tan obvio, no es en absoluto cierto. Los cuerpos de masa muy pequea, tales como los electrones (de masa igual a 9.10-31 kg), son objetos que escapan absolutamente a nuestra intuicin basada en nuestra experiencia cotidiana al relacionarnos con nuestro entorno desde que nacemos. Cuando la masa de un cuerpo es muy pequea los conceptos tales como posicin o velocidad dejan de tener sentido tal como nosotros los concebimos en nuestro mundo macroscpico: por ejemplo, cada vez que midiramos la posicin de un cuerpo obtendramos un resultado diferente y slo tiene sentido establecer matemticamente la probabilidad de hallar dicho cuerpo en un cierto volumen del espacio cuando intentamos saber donde est. Este hecho, que nos parece desde luego grotesco, no es debido a imprecisiones experimentales de nuestros aparatos de medida, sino que expresa una propiedad fundamental del universo. Otra peculiaridad propia de nuestra concepcin del mundo que nos rodea es que la energa de un cuerpo (cintica, potencial o total) puede adquirir un valor cualquiera sin ms que modificar adecuadamente su velocidad o posicin. Sin embargo, cuando la masa del objeto estudiado es muy pequea y este objeto est sometido a ciertos tipos de fuerzas como, por ejemplo a: a) una fuerzas recuperadoras propias de los osciladores armnicos b) fuerzas de choque cuando un cuerpo choca contra las paredes del recipiente que lo contiene c) fuerzas de atraccin elctrica como las que actan sobre un electrn atrado por el ncleo atmico
entonces su energa total no puede ser cualquiera sino que slo puede adoptar ciertos valores muy concretos: decimos que la energa est cuantificada y, por esta razn, la rama de la Fsica que estudia el mundo microscpico se denomina la Mecnica Cuntica. Sin embargo, a medida que se consideran cuerpos de mayor masa, por ejemplo el ncleo de un tomo, la probabilidad de encontrarlo en un regin muy limitada del espacio (lo que llamaramos, segn nuestra experiencia macroscpica cotidiana, la posicin del cuerpo) aumenta considerablemente. De la misma manera, para cuerpos de masa macroscpica los valores de las energas que puede adquirir son tan prximos que pueden considerarse prcticamente continuos. As, se podra decir que la Mecnica Clsica, basada en la axiomtica de Newton y a la que parece responder el mundo que nos rodea, sera el caso lmite de la Mecnica Cuntica cuando la masa de los cuerpos involucrados tiende a infinito. La Mecnica Cuntica permite explicar y predecir las propiedades de los tomos, el enlace qumico entre ellos, la luz que emiten, la energa emitida por los cuerpos debida a su temperatura, el ferromagnetismo y muchos otros fenmenos. Por otra parte, gran parte de los dispositivos que utilizamos en nuestra vida cotidiana, desde el lector de CD hasta el ordenador, se basan en las propiedades cunticas de los electrones o de la emisin luminosa: el funcionamiento de un transistor slo se puede explicar cunticamente, de la misma manera que el funcionamiento de un laser es puramente cuntico.
3.- La funcin de onda de un sistema cuntico.
G G De la misma manera que la aplicacin de la segunda ley de Newton F = ma permite, en el mundo macroscpico, estudiar y predecir el comportamiento de cualquier sistema mecnico, Schrdinger (1926) estableci una ecuacin que permite el estudio de los cuerpos de masa muy pequea como, por ejemplo, el electrn. No es posible entrar en detalles aqu acerca de la forma de la ecuacin de Schrdinger porque las matemticas involucradas estn muy lejos de las que se estudian en el Bachillerato. Sin embargo, a fin de poder aplicar sus resultados al estudio del electrn en un tomo, es necesario comentar ciertos hechos:
a) La ecuacin de Schrdinger permite el clculo de una cierta funcin matemtica, la llamada funcin de onda de una partcula que depende de sus caractersticas propias (masa, spin 1, etc.) y de las fuerzas que actan sobre ella. b) El conocimiento de la funcin de onda de una partcula permite el conocimiento de todas sus propiedades: energa, probabilidad de presencia en una cierta regin del espacio, etc. c) Si consideramos un volumen infinitamente pequeo dV situado en un punto de coordenadas x, y, z del espacio, la probabilidad de hallar la partcula en este dV viene dada por De hecho, este resultado slo sera vlido de fuese un nmero real, lo que ocurre en ciertos casos. En el caso general, es un valor complejo y la probabilidad de presencia de una partcula viene dada por el cuadrado de su mdulo:
2 dV
dV
El spin de una partcula es una caracterstica propia que en el mundo macroscpico podra compararse al giro sobre s misma. El spin del electrn slo puede adoptar dos valores que convencionalmente se de1 1 signan como + y . 2 2
4.- Los estados de un electrn en un tomo.
Al resolver la ecuacin de Schrdinger aplicada a un electrn de carga e que est sometido a una fuerza de atraccin coulombiana
F=
1 Ze 2 4 0 r 2
por parte de un ncleo atmico de nmero atmico Z, y por tanto de carga Ze, se obtiene una funcin de onda
= ( x, y, z, n, A, m, s )
que, adems de la posicin x, y, x, depende de otros cuatro parmetros: 1. El nmero cuntico principal n que puede tomar valores positivos n = 1, 2, 3 ... Por razones histricas debidas a la espectroscopia tambin se suelen denominar mediante letras: K, L, M, N, O, P ... 2. El nmero cuntico secundario A que, para un valor dado de n, slo puede tomar valores desde A = 0 hasta A = n 1, en total n valores. Una nomenclatura, tambin heredada de la espectroscopia, utiliza unas letras concretas para indicar el nmero cuntico secundario tal como indica la siguiente tabla: Nmero cuntico secundario
A=0 A =1 A=2 A=3
Denominacin s p d f
3. El nmero cuntico magntico m que, para un valor dado de A , slo puede tomar 2 A +1 valores diferentes, desde A hasta A : A , A +1, ..., 0, 1, ..., A . As, por ejemplo, si A = 2, m puede valer slo m = 2, m = 1, m = 0, m = 1 y m = 2, en total cinco valores diferentes (5 = 2 A +1). 4. El nmero cuntico de spin s que slo puede tomar dos valores: s =
1 1 ys= . 2 2
El estado de un electrn en un tomo viene caracterizado por los valores de sus cuatro nmeros cunticos n, A , m y s. La energa total del electrn depende nicamente del valor del nmero cuntico principal n y slo puede adoptar los valores dados por la expresin:
En =
donde h = 6,624 . 1034 J.s es la constante de Planck, una constante universal cuyo valor caracteriza el comportamiento del Universo, m, en esta expresin, la masa del electrn, e su carga en valor absoluto y Z el nmero atmico del tomo. As pues, un electrn slo puede adoptar en un tomo las energas dadas por la expresin anterior para los valores n = 1, n = 2, ... Cualquier otro valor para la energa es imposible. Por otra parte, tngase en cuenta que si los valore de la energa se toman como negativos es porque la energa potencial del electrn en el tomo es negativa y, a sumarla con la energa cintica para obtener la energa total, resulta tambin un valor negativo. Adems, cuanto mayor sea el nmero cuntico principal n, es decir cuanto mayor sea la energa del electrn, ms alejado se encontrar, en promedio, del ncleo.
Z 2e4 m 1 8 0 2 h 2 n 2
5.- Emisin de luz.
Un electrn slo puede modificar su energa si recibe del exterior una energa suficiente que le permita adquirir otro de los valores permitidos, alejndose del ncleo: se dice entonces que el electrn se excita. Un electrn excitado puede espontneamente regresar a un estado de menor energa emitiendo la diferencia de energas en forma de un fotn. Un fotn es, en el marco de la Mecnica Cuntica, la partcula asociada a una onda electromagntica cuya energa E y frecuencia vienen relacionadas mediante la constante de Planck h segn la expresin
E = h
As pues, si un electrn excitado pasa de un nivel energtico inicial caracterizado por un nmero cuntico ni a otro final, de menor energa, caracterizado por n f ( ni > n f ), la conservacin de la energa determina que
E f Ei = h
lo que lleva a que la emisin electromagntica, la luz emitida por el tomo, tenga una frecuencia, lo que caracteriza su color, dada por:
Z 2e4 m 1 1 2 2 8 0 2 h n f ni
Este hecho fue observado experimentalmente por mtodos espectroscpicos antes de establecerse la Mecnica Cuntica: la observacin de la luz emitida por un gas caliente a travs de un prisma permite ver separadamente los diferentes colores que la forman y se observa un conjunto de rayas de diferentes colores, cada una correspondiente a las diferentes frecuencias calculadas mediante la expresin anterior.
6.- Orbitales.
Se denomina orbital a cada estado de un electrn determinado por un conjunto posible de valores para los nmeros cunticos n, A y m. Cada orbital determina una forma geomtrica concreta para la zona de mayor probabilidad de hallar el electrn alrededor del ncleo. Cada orbital puede contener dos electrones diferentes, caracterizador por valores diferentes del nmero cuntico de spin: s =
1 1 y s = . Para identificar un orbital basta dar los valores de n, A y 2 2
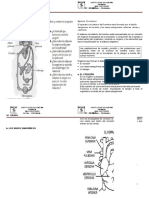
m aunque para designar los valores de A se utilizan las letras s, p, d , f, ... As, por ejemplo, un orbital 1s designa al nico orbital con n = 1 y A = 0 que podr contener como mximo dos electrones. Tambin, a guisa de ejemplo, comentemos que existen 3 orbitales diferentes 2p ( A =1), caracterizados por los tres valores posibles de m: m = 1, m = 0 y m = 1, que pueden contener, como mximo, 6 electrones entre todos. El conjunto de orbitales correspondientes a un mismo nmero cuntico principal se suele denominar capa, y as se puede hablar de las capas K, M, N, etc Las siguientes figuras indican la forma geomtrica de algunos orbitales. Se ha representado en diferentes colores las zona del espacio en la cual hay diferentes probabilidades de hallar al electrn.
7.- La configuracin electrnica de los tomos.
El tomo ms simple es el de hidrgeno. En su estado fundamental, es decir en el estado de mnima energa, posee un nico electrn en el orbital 1s. Para describir su estructura electrnica se proceder de la siguiente manera: primero se indica el nmero cuntico principal, a continuacin la letra que designa al nmero cuntico secundario y, en forma de superndice, los electrones contenidos con estos parmetros. As pues, la estructura del hidrgeno ser: H: 1s1
Es decir un nico electrn en un orbital 1s. Para hallar la estructura electrnica de tomos con ms electrones en principio se debera ir rellenando los sucesivos orbitales de energa creciente con electrones con la condicin que un orbital slo puede contener, como mximo, dos electrones. As pues, para el siguiente elemento, el helio se tendr: He: 1s2 Capa K llena
y para los siguientes elementos de la tabla peridica: Li: 1s2 2s1 Be: 1s2 2s2 B: 1s2 2s2 2p1 C: 1s2 2s2 2p 2 N: 1s2 2s2 2p 3 O: 1s2 2s2 2p4 F: 1s2 2s2 2p5 Ne: 1s2 2s2 2p6 Na: 1s2 2s2 2p6 3s1 Mg: 1s2 2s2 2p6 3s2 Al: 1s2 2s2 2p6 3s2 3p1 Si: 1s2 2s2 2p6 3s2 3p2 P: 1s2 2s2 2p6 3s2 3p3 S: 1s2 2s2 2p6 3s2 3p4 Cl: 1s2 2s2 2p6 3s2 3p5 A: 1s2 2s2 2p6 3s2 3p6 K: 1s2 2s2 2p6 3s2 3p6 4s1
Capa L llena
Capa M llena
Obsrvese que los gases nobles, que se caracterizan por su prcticamente nula reactividad qumica se caracterizan tambin por tener llena su ltima capa. Este hecho para los restantes gases nobles no se continua cumpliendo, pero s que, exceptuando el helio, tienen llenos los orbitales s y p ms externos: s2p6. Tambin es interesante observar que todos los metales alcalinos tienen en su capa ms externa un solo electrn s y los halgenos siete electrones s2p5. A medida que el nmero atmico se hace mayor los tomos contienen ms electrones y llega un momento en que el llenado sucesivo de los orbitales ya no se realiza utilizando esta regla tan elemental que se acaba de explicar: la interaccin entre los electrones de las capas inferiores y los nuevos electrones que se deberan ubicar ya no es despreciable y, por otra parte, los electrones ms internos apantallan el ncleo y hacen que los nuevos electrones sean atrados por una fuerza menor que la que correspondera.
Sin embargo, existe una regla muy simple que permite saber cmo se van llenando sucesivamente los diferentes orbitales en cualquier caso. Se debe escribir una tabla como la mostrada en la pgina siguiente. Esta tabla se debe recorrer en el sentido de las flechas e ir anotando el llenado de los sucesivos orbitales que aparecen hasta completar el nmero de electrones indicado por el nmero atmico Z del elemento que se est estudiando.
1 s2
2 s2
2 p6
3 s2
3 p6
3 d10
4 s2
4 p6
4 d10
4 f14
5 s2
5 p6
5 d10
5 f14
6 s2
6 p6
7 s2
As, por ejemplo, la estructura del Tntalo, que es el elemento de nmero atmico 73, ser: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d3 Ta:
You might also like
- Guia Tutoria Quinto Grado PDFDocument232 pagesGuia Tutoria Quinto Grado PDFEdith Torres75% (8)
- Aventura de Los Molinos de VientoDocument2 pagesAventura de Los Molinos de Vientoandres_c4145061100% (1)
- Ciencia y Amb.Document71 pagesCiencia y Amb.andres_c4145061No ratings yet
- FOTOSINTEDocument1 pageFOTOSINTEandres_c4145061No ratings yet
- Celula Vegetal y Celula AnimalDocument1 pageCelula Vegetal y Celula Animalandres_c4145061No ratings yet
- Cual de Estos NO Es Un Antecedente de La Segunda Guerra MundialDocument3 pagesCual de Estos NO Es Un Antecedente de La Segunda Guerra Mundialandres_c4145061No ratings yet
- Conspiraciones LimeñasDocument2 pagesConspiraciones Limeñasandres_c4145061100% (7)
- Ejer Cici Os AlgebraDocument2 pagesEjer Cici Os Algebraandres_c4145061No ratings yet
- Importancia Del Estudio de La BiologiaDocument2 pagesImportancia Del Estudio de La Biologiaandres_c4145061No ratings yet
- 1ejercicios Con AngulosDocument2 pages1ejercicios Con Angulosandres_c4145061No ratings yet
- Matriz de Competencias y Capacidades DCN 2015.Document97 pagesMatriz de Competencias y Capacidades DCN 2015.Jorge EspinozaNo ratings yet
- El RenacimientoDocument1 pageEl Renacimientoandres_c4145061No ratings yet
- El Último BesoDocument2 pagesEl Último BesoDavid RenderoNo ratings yet
- Conducta Disruptiva en El AulaDocument9 pagesConducta Disruptiva en El AuladanimoureNo ratings yet
- EL AIRE Es Una Mezcla de Varios Gases Que Nos Rodea Por Todas PartesDocument2 pagesEL AIRE Es Una Mezcla de Varios Gases Que Nos Rodea Por Todas Partesandres_c4145061No ratings yet
- Clases de InvertebradosDocument1 pageClases de Invertebradosandres_c4145061No ratings yet
- Curso de Pascal Por Nacho CabanesDocument488 pagesCurso de Pascal Por Nacho Cabanesandres_c4145061100% (1)
- Determinación de ConjuniosDocument4 pagesDeterminación de Conjuniosandres_c4145061No ratings yet
- Aplico Razonamiento VerbalDocument3 pagesAplico Razonamiento Verbalandres_c4145061No ratings yet
- Catholicnet - El PadrenuestroDocument2 pagesCatholicnet - El Padrenuestroandres_c4145061No ratings yet
- Aparato CirculatorioDocument2 pagesAparato Circulatorioandres_c4145061No ratings yet
- Sillabus de SecDocument1 pageSillabus de Secandres_c4145061No ratings yet
- Partes de La Planta WordDocument3 pagesPartes de La Planta WordelizabethNo ratings yet
- Revolución CalienteDocument3 pagesRevolución Calienteandres_c4145061No ratings yet
- APLICAantonimosDocument2 pagesAPLICAantonimosandres_c4145061No ratings yet
- Qué Comprendí de La LecturaDocument1 pageQué Comprendí de La Lecturaandres_c4145061No ratings yet
- Educación privada San Idelfonso 4o gradoDocument2 pagesEducación privada San Idelfonso 4o gradoandres_c4145061No ratings yet
- Partes de La Planta WordDocument3 pagesPartes de La Planta WordelizabethNo ratings yet
- Partes de La Planta WordDocument3 pagesPartes de La Planta WordelizabethNo ratings yet
- Aparato CirculatorioDocument2 pagesAparato Circulatorioandres_c4145061No ratings yet