Professional Documents
Culture Documents
Serie de Révision15 2015 PDF
Uploaded by
AzizElheniOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Serie de Révision15 2015 PDF
Uploaded by
AzizElheniCopyright:
Available Formats
Prof : GOUIDER ABDESSATAR
Srie De Rvision N15
A.S : 2014/2015
4 Sc
Exercice 1
On ralise 25C, une pile (P) lectrochimique symbolise par : Pb Pb 2 (C1 ) Sn 2 (C 2 ) Sn .
1/ a- Ecrire lquation chimique associe la pile (P).
b- Faire le schma de la pile (P).
2/ a- Calculer la valeur de la f..m. standard E de la pile (P) sachant que les potentiels standards
d'lectrodes des couples Pb2+/Pb et Sn2+/Sn sont respectivement E 0(Pb2 / Pb) 0,13 V et
E 0(Sn 2 / Sn ) 0,14 V.
b- Donner l'expression de la f..m. E de la pile (P) en fonction de la f..m standard E et des concentrations
C1 et C2.
c- En dduire la valeur de la constante d'quilibre K de la raction spontane qui se produit dans la pile
(P) en circuit ferm.
3/ a- Calculer la valeur initiale de la f..m. E de la pile (P) dans le cas o les concentrations initiales en
ions Pb2+ et Sn2+ ont respectivement les valeurs C1 = 1 mol.L-1 et C2 = 0,1 mol.L-1.
b- Ecrire dans ce cas, en le justifiant, les quations des transformations qui se produisent au niveau des
lectrodes de (P) lorsque le circuit est ferm.
En dduire l'quation de la raction bilan.
4/ Aprs un certain temps de fonctionnement, la f..m. E de la pile s'annule. Dterminer :
a- l'avancement volumique final yf de la raction bilan produite dans la pile,
b- les valeurs des concentrations finales des solutions en ions Pb2+ et Sn2+, notes respectivement C1 et C 2 .
Exercice 2
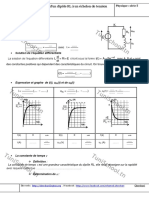
La pile reprsente ci-dessous alimente un circuit extrieur comportant un conducteur ohmique de
rsistance R, un voltmtre, un ampremtre et deux interrupteurs K1 etK2.
Durant toute lexprience, la temprature est maintenue constante, gale 25C. Dans les deux
compartiments, les deux solutions ont le mme volume V, suppos constant, et la mme concentration
initiale : [Pb2+]0 = [Sn2+]0 = 0,5 mol.L-1.
1/ a- Donner le symbole de la pile.
b- Ecrire lquation chimique associe cette pile.
2/ On ferme K2 et on laisse K1 ouvert. Lindication
K1
R
A
du voltmtre est telle que la f..m initiale de la pile
est : Ei = VPb VSn = 0,01 V.
K2
a- Prciser, en le justifiant, la polarit des bornes de
V
lectrode
la pile.
lectrode
0
en Pb
en Sn
b- Dterminer la valeur de sa f..m. standard E .
c- En dduire la valeur de la constante dquilibre
K.
3/ A un instant pris comme origine des temps, on
ouvre K2 et on ferme K1.
a- Quel est le rle du pont salin ?
Pont salin
b- Ecrire lquation de la raction qui se produit
spontanment. Justifier.
2
2
2
2
(Sn SO 4 )
( Pb SO 4 )
c- A un instant ultrieur de date t1, la molarit en ion
Pb2+ a vari de 0,1 mol.L-1. La pile est-elle use cet
instant ? Justifier.
Exercice 3
On considre la pile lectrochimique de symbole : Pb Pb 2 (C1 ) Ni 2 (C 2 ) Ni.
1) a- Faire le schma de cette pile.
b- Ecrire lquation de la raction associe cette pile.
c- Exprimer la fonction des concentrations relative cette raction en fonction de C1 et C2.
d- Donner lexpression de la f..m. E de cette pile en fonction de et de sa f..m. normale E0.
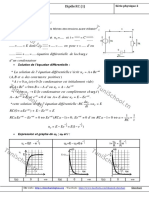
2) On fait varier les concentrations C1 et C2 et on mesure chaque fois la f..m. E de cette pile. Les
rsultats de mesure ont permis alors de tracer la courbe E = f(- log) ci-dessous :
5
E(10
V)
l og
10
a- Dterminer lquation numrique de cette courbe.
b- En dduire la valeur de :
i/ la f..m. normale E0 de la pile.
ii/ la constante dquilibre de la raction associe cette pile.
c- Sachant que le potentiel normal dlectrode E 0(Pb Pb ) 0,13V , calculer alors E 0( Ni
2
Ni )
d- Comparer les pouvoirs oxydant et les pouvoirs rducteur des deux couples redox Pb2+/Pb et Ni2+/Ni.
3) Maintenant, on prend C1 = 10-1 mol.L-1 et C2 = 10-2 mol.L-1.
a- Indiquer, en le justifiant, la raction spontane qui a lieu lorsque la pile dbite.
Sachant que les deux compartiments de cette pile ont un mme volume V, dterminer les concentrations
molaires [Ni2+] et [Pb2+] lorsque la pile ne dbite plus.
Exercice 4
On donne : 1u = 1,66.10-27 Kg = 931,5 MeV.C-2 ; 1 MeV = 1,6.10-13 J ; C = 3.108 m.s-1
m(Na) = 23,99096 u ; m(Mg) = 23,98504 u ; mp = 1,00728 u ; mn = 1,00867 u
On considre les noyaux de sodium 2411 Na et de magnsium 24
12 Mg .
1) Dfinir lnergie de liaison dun noyau AZ X .
2) Calculer lnergie de liaison El(Na) dun noyau de sodium et El(Mg) dun noyau de magnsium.
3) Quel est, parmi 2411 Na et 24
12 Mg , le noyau le plus stable ?
Exercice 5
On donne :
masse dun proton mp = 1,00728 u
masse dun neutron mn = 1,00867 u
1 u = 931,5 Mev.c-2
56
nergie de liaison dun noyau de 56
26 Fe : El( 26 Fe ) = 492 Mev
1) a- Calculer en Mev.c-2 le dfaut de masse associ un noyau de 56
26 Fe.
b- En dduire sa masse m( AZ X ) en u.
2) Complter le tableau suivant :
56
26
nergie de liaison : El (Mev)
nergie de liaison par nuclon :
El
(Mev)
A
Fe
60
29
Cu
210
84
Po
492
..
1648,5
..
8,75
..
3) Comparer la stabilit des trois noyaux indiqus dans ce tableau.
You might also like
- Os Chimie Corrige ch7 PDFDocument38 pagesOs Chimie Corrige ch7 PDFAzizElheniNo ratings yet
- ?????? ?????mazanza 7 Kou Nouvo. ?????? ?????Document82 pages?????? ?????mazanza 7 Kou Nouvo. ?????? ?????Ronald Fleurelus100% (24)
- Cours RMN SolideDocument33 pagesCours RMN Solidemojakovich50% (2)
- C13Phy - Aspects - Energetiques - Exos - EcEpEm PDFDocument6 pagesC13Phy - Aspects - Energetiques - Exos - EcEpEm PDFAzizElheniNo ratings yet
- TP 2 CalorimetreDocument10 pagesTP 2 Calorimetreabelmomo50% (4)
- Devoir de Syth - Se N - 1 PDFDocument4 pagesDevoir de Syth - Se N - 1 PDFMustafa SemmaaNo ratings yet
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebNo ratings yet
- Série Pile Math 1 SCDocument3 pagesSérie Pile Math 1 SCScriblouNo ratings yet
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 pagesChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounNo ratings yet
- Serie Oxydo ReductionDocument3 pagesSerie Oxydo Reductionyoussef.jemal.appleNo ratings yet
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaNo ratings yet
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Document8 pagesControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- Classification ElectrochimiqueDocument2 pagesClassification ElectrochimiqueRodrigue TchoffoNo ratings yet
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFNo ratings yet
- Devoir de Synthèse N°1 - Physique-Chimie - 2ème Sciences (2010-2011) MR Abdelouaheb AâmelDocument3 pagesDevoir de Synthèse N°1 - Physique-Chimie - 2ème Sciences (2010-2011) MR Abdelouaheb AâmelBk AyoutessNo ratings yet
- Séri N°12Document5 pagesSéri N°12Jihad ELNo ratings yet
- DEVOIR Synthese1 Bac M 2013Document5 pagesDEVOIR Synthese1 Bac M 2013Yassine Riahi100% (1)
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5Document5 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5qwerty aertyNo ratings yet
- Série D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienDocument2 pagesSérie D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienInass LayachNo ratings yet
- Lycée Ibn Hazm Physique Cours: 10 Comportement Globale D'un CircuitDocument12 pagesLycée Ibn Hazm Physique Cours: 10 Comportement Globale D'un CircuitAmine TananNo ratings yet
- 02 - Solutions Electrolytiques Et ConcentrationsDocument4 pages02 - Solutions Electrolytiques Et ConcentrationsionelbudNo ratings yet
- Devoir de Synthese N - 1-2Document5 pagesDevoir de Synthese N - 1-2Med BriniNo ratings yet
- Bac 2014 Bac Tech Epreuve Physique Session Controle Correction PDFDocument5 pagesBac 2014 Bac Tech Epreuve Physique Session Controle Correction PDFmomme deyahiNo ratings yet
- Condensate UrDocument3 pagesCondensate Urdhouib imenNo ratings yet
- 4 DS3 2009 2010Document4 pages4 DS3 2009 2010Fethi Ferchiou100% (2)
- Devoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDDocument3 pagesDevoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDHiba NajiNo ratings yet
- Microsoft Word Spectre Atomique 4 M S PDFDocument4 pagesMicrosoft Word Spectre Atomique 4 M S PDFAmal RezguiNo ratings yet
- S Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFDocument3 pagesS Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFmaanane maananeNo ratings yet
- 10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursDocument2 pages10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursMrt KikxNo ratings yet
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimNo ratings yet
- dc1 4emeScExp Sadiki 12-13-1Document4 pagesdc1 4emeScExp Sadiki 12-13-1ben zayed ali100% (1)
- الباكالورياDocument3 pagesالباكالورياfootball news1No ratings yet
- Noyau Masse Energie PDFDocument4 pagesNoyau Masse Energie PDFHadjer Jojo100% (1)
- Bac Math Pysh Acide Base Serie 4Document1 pageBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliNo ratings yet
- Chute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof OthmaneDocument18 pagesChute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof Othmanemohamedelhafhouf2006No ratings yet
- AvancementDocument2 pagesAvancementYoussef Ben AmarNo ratings yet
- Nucléaire Série D'exercices + NotesDocument4 pagesNucléaire Série D'exercices + NotesChaher AyachyNo ratings yet
- Devoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARwalidNo ratings yet
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadNo ratings yet
- Pendule Elastique Exercices Non Corriges 1 2Document4 pagesPendule Elastique Exercices Non Corriges 1 2Llouis PhysicsNo ratings yet
- Devoir de Synthése 1 Bac InformatiqueDocument5 pagesDevoir de Synthése 1 Bac Informatiquedhouib imen0% (1)
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucineNo ratings yet
- 5devoir de Synthèse N°1Document5 pages5devoir de Synthèse N°1Wassim Ben TanfousNo ratings yet
- Sciencesphysiqueg1 2018sujetDocument4 pagesSciencesphysiqueg1 2018sujetThamer SaiihiNo ratings yet
- Site TS C 09 L'ElectrolyseDocument4 pagesSite TS C 09 L'ElectrolysePecorellaNo ratings yet
- Série D'exercices - Physique Le Dipôle RC - Bac Toutes Sections (2016-2017) MR GOUIDER ABDESSATARDocument2 pagesSérie D'exercices - Physique Le Dipôle RC - Bac Toutes Sections (2016-2017) MR GOUIDER ABDESSATARMohamed El Ouahdani100% (2)
- DS 2001 11 13Document2 pagesDS 2001 11 13الغزيزال الحسن EL GHZIZAL Hassane0% (1)
- Devoir de Controle 1 2020Document3 pagesDevoir de Controle 1 2020khalifakarouiNo ratings yet
- RC1 1Document5 pagesRC1 1mehdi benmassoudNo ratings yet
- Série D'exercices N°11 - Chimie Loi de Modération Loi de Modération - Bac Sciences Exp (2012-2013) MR Chattouri Samir PDFDocument3 pagesSérie D'exercices N°11 - Chimie Loi de Modération Loi de Modération - Bac Sciences Exp (2012-2013) MR Chattouri Samir PDFAzizElheniNo ratings yet
- Sujet Rév N°4Document6 pagesSujet Rév N°4Roua TliliNo ratings yet
- Controle À DomicileDocument4 pagesControle À DomicileZineb BicharNo ratings yet
- 201702061155324Document6 pages201702061155324Ali RammalNo ratings yet
- Devoir 1 BiofDocument3 pagesDevoir 1 BiofImane Eddoha100% (1)
- 3e DS1 2009 2010Document3 pages3e DS1 2009 2010fethi1100% (1)
- Radio Act IfDocument4 pagesRadio Act IfRida Adil100% (2)
- Cours 1 Noyaux-Masse Et ÉnergieDocument4 pagesCours 1 Noyaux-Masse Et ÉnergieMotafa LahmNo ratings yet
- Série 5 - La Chute Verticale D'un SolideDocument2 pagesSérie 5 - La Chute Verticale D'un SolideMed yahyaNo ratings yet
- Serie n15Document4 pagesSerie n15Yossri HmaiedNo ratings yet
- Série N°11 Chimie Les Piles 2013 2014)Document4 pagesSérie N°11 Chimie Les Piles 2013 2014)Amen RouissiNo ratings yet
- Série Piles Transformations SpontanéesDocument5 pagesSérie Piles Transformations SpontanéesDaghsni SaidNo ratings yet
- 17 SpectreDocument8 pages17 SpectrelemiaNo ratings yet
- 13b Mec Forcees ScExp PDFDocument5 pages13b Mec Forcees ScExp PDFAzizElheniNo ratings yet
- 15 Interaction Onde PDFDocument7 pages15 Interaction Onde PDFAzizElheniNo ratings yet
- 18 Reaction Nucleaire PDFDocument10 pages18 Reaction Nucleaire PDFAzizElheniNo ratings yet
- 14 Ondes ProgressivesDocument6 pages14 Ondes ProgressiveslemiaNo ratings yet
- 2016 Sadiki PDFDocument5 pages2016 Sadiki PDFAzizElheniNo ratings yet
- 11-Oscill Mec Libres PDFDocument9 pages11-Oscill Mec Libres PDFAzizElheniNo ratings yet
- 4 RL PDFDocument8 pages4 RL PDFAzizElheniNo ratings yet
- 8 LC PDFDocument3 pages8 LC PDFAzizElheniNo ratings yet
- 9-rlc Force PDFDocument7 pages9-rlc Force PDFAzizElheni50% (2)
- C12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFDocument4 pagesC12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFAzizElheniNo ratings yet
- 13 Mec Forcees PDFDocument5 pages13 Mec Forcees PDFAzizElheniNo ratings yet
- 11-Oscill Mec Libres PDFDocument9 pages11-Oscill Mec Libres PDFAzizElheniNo ratings yet
- 3 RC PDFDocument4 pages3 RC PDFAzizElheniNo ratings yet
- 10-rlc Force PDFDocument5 pages10-rlc Force PDFAzizElheniNo ratings yet
- Re Capitulatif Avancement PDFDocument4 pagesRe Capitulatif Avancement PDFAzizElheniNo ratings yet
- 5 RL PDFDocument3 pages5 RL PDFAzizElheni100% (1)
- 4 Ind MagnDocument4 pages4 Ind MagnBoussetta ZouhaierNo ratings yet
- 1 Condensateur PDFDocument3 pages1 Condensateur PDFAzizElheni100% (1)
- S6 Chapitre 6 Cinetique Chimique PDFDocument12 pagesS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- 2 RC PDFDocument7 pages2 RC PDFAzizElheniNo ratings yet
- C12Phy - Systemes - Oscillants - Oscillateur - Elastique - Exos - Ressort PDFDocument4 pagesC12Phy - Systemes - Oscillants - Oscillateur - Elastique - Exos - Ressort PDFAzizElheniNo ratings yet
- C13Phy Aspects Energetiques PDFDocument4 pagesC13Phy Aspects Energetiques PDFAzizElheniNo ratings yet
- C10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFDocument14 pagesC10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFAzizElheniNo ratings yet
- C10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFDocument7 pagesC10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFAzizElheniNo ratings yet
- C11Chim - Controle - Evolution - Exos - SavondeMarseille PDFDocument8 pagesC11Chim - Controle - Evolution - Exos - SavondeMarseille PDFAzizElheniNo ratings yet
- C11Phy Mouvements Plans PDFDocument5 pagesC11Phy Mouvements Plans PDFAzizElheniNo ratings yet
- C10Chim Esterification Hydrolyse PDFDocument5 pagesC10Chim Esterification Hydrolyse PDFAzizElheniNo ratings yet
- Bocaly PDFDocument70 pagesBocaly PDFYousra SbaiaNo ratings yet
- TD Alcool 2024 LSLL - WahabdiopDocument4 pagesTD Alcool 2024 LSLL - WahabdiopFrédéric JeffersonNo ratings yet
- 2 Eme Séance Les Glucides Structre Et Propriétés 2021-2022Document13 pages2 Eme Séance Les Glucides Structre Et Propriétés 2021-2022beyoulaya22No ratings yet
- Astm D4951-14 (2019)Document8 pagesAstm D4951-14 (2019)Anonh AdikoNo ratings yet
- Projet de Fin D'etudes - PDFDocument117 pagesProjet de Fin D'etudes - PDFRacem Loukil100% (2)
- Terminologie RoutiereDocument14 pagesTerminologie RoutiereAnas MoutmirNo ratings yet
- Bac 2018 Washington Physique Chimie SpécialitéDocument11 pagesBac 2018 Washington Physique Chimie SpécialitéLETUDIANTNo ratings yet
- Matériel GénétiqueDocument7 pagesMatériel GénétiquenasroddineNo ratings yet
- La Succession Stratigraphique Du C.M.N. (Ou R.2.3.) Au Centre de La Sous-Province Cuprifere Shabienne Par J. CailteuxDocument14 pagesLa Succession Stratigraphique Du C.M.N. (Ou R.2.3.) Au Centre de La Sous-Province Cuprifere Shabienne Par J. CailteuxGloria BanzaNo ratings yet
- Biomat FicheDocument7 pagesBiomat FicheFRTNo ratings yet
- Chapitre II Acides Et Bases 2021-2022 Partie 1Document11 pagesChapitre II Acides Et Bases 2021-2022 Partie 1KHEDIM MouradNo ratings yet
- Citerne Mazout GWDocument12 pagesCiterne Mazout GWismailinesNo ratings yet
- DS PureSante 10decouvertes 1 PDFDocument28 pagesDS PureSante 10decouvertes 1 PDFYaqoubTouréNo ratings yet
- SFHH Lista Positiva Desinfectantes 2009Document28 pagesSFHH Lista Positiva Desinfectantes 2009RWEREWNo ratings yet
- Chimie - Correction TP 02 - Solutions LectrolytiquesDocument2 pagesChimie - Correction TP 02 - Solutions Lectrolytiquesla physique selon le programme Français100% (3)
- Dalle en Beton ArmeDocument2 pagesDalle en Beton Armemathx34694No ratings yet
- Chapitre IDocument31 pagesChapitre Izahramathlouthi127No ratings yet
- 2 - Transformations NucléairesDocument12 pages2 - Transformations Nucléairesreef yousf100% (1)
- Trabsfert de Chaleur Par ConvectionDocument74 pagesTrabsfert de Chaleur Par ConvectionMANE SariatuNo ratings yet
- Série 2 S2 2023 12 2 2023Document2 pagesSérie 2 S2 2023 12 2 2023mammarhanae939No ratings yet
- TP Hemolyse S3 BachelorDocument9 pagesTP Hemolyse S3 BachelorSohayb Ait OuallNo ratings yet
- EX1. Calculer L'humidité Relative D'un Certain Volume D'air Humide Dont LaDocument2 pagesEX1. Calculer L'humidité Relative D'un Certain Volume D'air Humide Dont LaOuijdane MaaNo ratings yet
- A - Developpement Des MedicamentsDocument63 pagesA - Developpement Des MedicamentsAmal Oulad AliNo ratings yet
- Cinetique 2Document22 pagesCinetique 2BENARIMA AbdelhakimNo ratings yet
- Atome IonsDocument3 pagesAtome Ionsmedox hmxNo ratings yet
- PH2SCH06Document3 pagesPH2SCH06chadaNo ratings yet
- Joint 1Document2 pagesJoint 1Mohammed Hanoune Kandri RodyNo ratings yet