Professional Documents
Culture Documents
Problemas Cinetica Enzimatica 10-11 Con Respuestas
Uploaded by
ジェファーソン マスコCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Problemas Cinetica Enzimatica 10-11 Con Respuestas
Uploaded by
ジェファーソン マスコCopyright:
Available Formats
Universidad de Alcal Departamento de Bioqumica y Biologa Molecular Bioqumica. 2 de Farmacia.
Curso 2010/11
Problemas de cintica enzimtica 1.- En un cultivo de bacterias, la velocidad de reaccin de un enzima E fue de
20 g/min para una concentracin de sustrato de 3 mM. Si la concentracin de sustrato es igual o superior a 7 mM, la velocidad no supera los 40 g/min. Al aadir un inhibidor competitivo, la velocidad de la reaccin fue de 20 g/min para una concentracin de sustrato de 8 mM. Calculese la Km, la Vmax y la Ki para este enzima, sabiendo que la concentracin de inhibidor aadido es de 6 mM.
a) Vmax: Si para una [S] 7 mM la velocidad es 40 g/min, la Vmax=40 g/min b) Km: Vmax ser 20 g/min, como esta velocidad se consigue con una [S]
= 3 mM, la Km = 3 mM Otra forma es utilizando la ecuacin de Michaelis:
V= Vmax [S] Km + [S] 40 = 20 x 3 Km + 3
c) Como es un inhibidor competitivo Vmax = Vmax= 40 g/min y Vmax= 20
g/min. Esta velocidad se alcanza con una [S] de 8 mM en presencia de inhibidor, por lo tanto Km= 8 mM. Adems sabemos que Km = Km
Km =
1+
[I] Ki
Km
Por lo tanto Ki = 3,6 mM
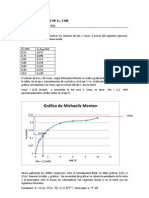
2.- Las velocidades iniciales a varias concentraciones de sustrato para una
reaccin catalizada por un enzima hipottico son: [S] (moles/l) 5x10-2 5x10-3 5x10-4 5x10-5 5x10-6 5x10-7 V (moles/min) 0.25 0.25 0.25 0.20 0.071 0.0096
a) Cul es la velocidad mxima para esta reaccin?
b) Por qu la velocidad inicial permanece constante a una [S] mayor de 5x10-4 M c) Cul es la concentracin de enzima libre para una [S] de 5x10-4 M? d) Cul es la Km de la enzima? e) Calcular la velocidad inicial para [S]=1x10-6 y [S]=1x10-1 f) Calcular la concentracin de producto formado en los cinco primeros minutos de reaccin utilizando 10 ml de una disolucin de sustrato 2x10-3 M
a) Vmax = 0.25 mol/min, ya que por encima de [S] de 5x10-4 no aumenta b) Porque todos los enzimas est ocupados transformando un sustrato c) Cero, todos los enzimas ocupados, a esa [S] se da la Vmax d) Empleando la ecuacin de Michaelis, utilizando la velocidad 0.20, 0.070
0.0096 y sus correspondientes [S], como sabemos la Vmax, obtenemos una Km 0 1,25 x 10-5 moles/l
e) Sabiendo la Km y Vmax, aplicamos Michaelis utilizando esas [S] y
obtenemos: [S]=1x10-6 [S]=1x10-1 una V = 0,018 mol/min una V = 0,25 mol/min
f) A [2x10-3] la V = Vmax = 0,25 mol/min
En 5 min 0,25 x 5 = 1,25 mol Tenemos 10 ml de sustrato, luego 1,25 mol / 10-2 l = 1,25 x 102 mol/l
3.- A partir de los siguientes datos de una reaccin enzimtica, determinar de
que manera est actuando el inhibidor. Determinar la Km para el enzima y la Ki para el complejo enzima-inhibidor. Cul es la velocidad mxima? [S] mM 2 3 4 10 15 g producto/h (sin inhibidor) 139 179 213 313 370 g producto/h (6 mM inhibidor) 88 121 149 257 313
Se calculan los inversos de [S], producto sin inhibidor y producto con inhibidor, se representa y = 1/V frente a x = 1/[S] Sin inhibidor: La lnea corta en y = 2x10-3, entonces 1/Vmax = 2x10-3, luego Vmax = 0,5x103 g/h La lnea corta en x = -2x10-1, entonces -1/Km = -2x10-1, luego Km = 5 mM
Con inhibidor: Como es un inhibidor competitivo la Vmax es la misma en presencia y ausencia de inhibidor. La lnea corta en x = -1,1x10-1, entonces -1/Km = -1,1x10-1, luego Km=9 mM La Ki se calcula como en el ejercicio 1 Ki = 7,5 mM
4.- Habindose conseguido aislar de Salmonella tyfpimurium una enzima que cataliza
la reaccin AP, se decidi hacer un estudio estructural y cintico de dicha enzima: [A] mM V(mmol P/ min) V (nmol P/min) con J 1,00 1,00 0,66 0,55 0,71 0,41 0,25 0,50 0,25 0,20 0,41 0,20
donde J es un inhibidor de E cuya influencia como tal se quiere estudiar. [J] = 0,25mM a) Km de la enzima estudiada para A, y Vmax para la transformacin A--P en presencia de E b) Que tipo de inhibidor es J?. Calcula la Ki. c) Cul seria el efecto sobre la Vmax de la enzima, de un aumento de la concentracin de J?
Se calcula siguiendo el mismo procedimiento que el problema 4 a) Vmax = Vmax = 1.66 mmol P/min b) KM = 0.5 mM c) KM = 1.25 mM (con inhibidor) d) Ki = 0.16 nM (Inhibicin Competitiva)
5.- La cintica de una enzima viene determinada como funcin de la concentracin de
sustrato en presencia y ausencia del inhibidor I. [S], Mx10-5 V(mol/min) sin inhibidor V(mol/min) con inhibidor 10 M
-4
0.3 10.4 2.1
0.5 14.5 2.9
1.0 22.5 4.5
3.0 33.8 6.8
9.0 40.5 8.1
a) Calcular la Km y la Vmax en presencia y ausencia de inhibidor b) Que tipo de inhibidor es? Calcular la Ki
Se calcula siguiendo el mismo procedimiento que el problema 4 a) Vmax = 50 mol/min b) Vmax = 9.5 mol/min c) KM = 1.1x10-5 M d) Ki = 2.3x10-5 M (Inh. No Competitiva)
You might also like
- Problemario BiorreactoresDocument23 pagesProblemario BiorreactoresSandra Luz Peregrino0% (3)
- Ejercicios Bioenergética y Redox ResueltosDocument5 pagesEjercicios Bioenergética y Redox ResueltosLuis Castro100% (2)
- Problemas Cinetica20114 (1) CLASEDocument3 pagesProblemas Cinetica20114 (1) CLASEJhojan Ugarte Chinchero100% (1)
- Ejercicios, Equipo4 EnzimasDocument25 pagesEjercicios, Equipo4 EnzimasCarlos VillarrealNo ratings yet
- Clase Practica 19Document6 pagesClase Practica 19Kenya SantacruzNo ratings yet
- PROBLEMAS ENZIMÁTICOSDocument5 pagesPROBLEMAS ENZIMÁTICOSJulio Cesar Castañeda Mancipe80% (5)
- Curva de productividad de etanol con Z. mobilisDocument2 pagesCurva de productividad de etanol con Z. mobilisJoseph Frank Bruno Zapata50% (2)
- Ejercicios Cinética EnzimáticaDocument6 pagesEjercicios Cinética EnzimáticaSambita MaryNo ratings yet
- Tutorial Calculos de KM y VmaxDocument3 pagesTutorial Calculos de KM y VmaxFrancisca Fuentes100% (1)
- Ejercicios Con RespuestaDocument22 pagesEjercicios Con RespuestaBritton Collins0% (1)
- 4 Cinetica EnzimaticaDocument5 pages4 Cinetica EnzimaticaMoradoNo ratings yet
- Problemas de Bioenergética Tarea2015-1Document3 pagesProblemas de Bioenergética Tarea2015-1lowry12333% (3)
- Problemas Resuelto Hasta El 2 BiprocesosDocument18 pagesProblemas Resuelto Hasta El 2 BiprocesosCarlos Ccopa GNo ratings yet
- Cinética de FermentaciónDocument26 pagesCinética de FermentaciónElizabeth Granda Carazas33% (3)
- Balance de materia en biorreactores para biomasa, sustrato y productoDocument10 pagesBalance de materia en biorreactores para biomasa, sustrato y productoValeria Nicole Cabrera RomeroNo ratings yet
- Determinacion Espectrofotometrica de La Constante de Michaelis MentenDocument3 pagesDeterminacion Espectrofotometrica de La Constante de Michaelis MentenChristian Paúl Calispa CastroNo ratings yet
- Problemas de BioquímicaDocument7 pagesProblemas de BioquímicaNoe Barboza Linares0% (2)
- Serie 2Document3 pagesSerie 2Emilio ZendejasNo ratings yet
- Problemas Cinetica EnzimaticaDocument9 pagesProblemas Cinetica EnzimaticamichypaoNo ratings yet
- Cinética enzimática problemas bioquímicaDocument7 pagesCinética enzimática problemas bioquímicaVictor Aguirre A75% (4)
- Ejercicicios de Cinetica 2013 II PDFDocument10 pagesEjercicicios de Cinetica 2013 II PDFElizabethAngaritadeFarfanNo ratings yet
- Taller Cinetica Enzimatica Ii 019Document2 pagesTaller Cinetica Enzimatica Ii 019EDWARD ALEXIS GOMEZ GUACA100% (1)
- Problemas Cinetica Propuestos para El ExamenDocument3 pagesProblemas Cinetica Propuestos para El ExamenBlas Alfaro StefanyNo ratings yet
- ProblCineticaEnzimatica. ATCasaDocument3 pagesProblCineticaEnzimatica. ATCasaJohanna Pilar LlagllaNo ratings yet
- Cinetica Enzimatica Ejercicios ResueltosDocument26 pagesCinetica Enzimatica Ejercicios Resueltospvv1963100% (1)
- Problemas de Cinética EnzimáticaDocument14 pagesProblemas de Cinética EnzimáticaJhojan Ugarte ChincheroNo ratings yet
- Problemas de enzimas: determinación de KM, Vmax, número de recambio y actividad específicaDocument8 pagesProblemas de enzimas: determinación de KM, Vmax, número de recambio y actividad específicaTonyFontanaNo ratings yet
- I. Seminarios Cinética EnzimáticaDocument7 pagesI. Seminarios Cinética EnzimáticaLaura Célix100% (1)
- Cálculo Km y Vmax enzimáticasDocument4 pagesCálculo Km y Vmax enzimáticasKaren Tafur100% (1)
- Cinética MicrobianaDocument22 pagesCinética Microbianaprietalinda100% (2)
- Ejercicios de Cinetica EnzimaticaDocument39 pagesEjercicios de Cinetica EnzimaticaMichael Thorn50% (2)
- Práctica 9 - Inmovilización de EnzimasDocument6 pagesPráctica 9 - Inmovilización de EnzimasMARCO ANTONIO CACERES VILLANONo ratings yet
- Cinetica Enzimatica y Cinetica MicrobianaDocument20 pagesCinetica Enzimatica y Cinetica MicrobianaJulio Soto LovonNo ratings yet
- Balance Materia en Sistemas de CultivoDocument19 pagesBalance Materia en Sistemas de CultivoWilfredo TullumeNo ratings yet
- Cinetica MicrobianaDocument27 pagesCinetica MicrobianamelyNo ratings yet
- Ejercicos CorregidosDocument3 pagesEjercicos CorregidosMireya NeneneNo ratings yet
- EnzximoDocument8 pagesEnzximoMichelle HidroboNo ratings yet
- PROBLEMAS DE INHIBICIÓN ENZIMÁTICA AlumnosDocument6 pagesPROBLEMAS DE INHIBICIÓN ENZIMÁTICA Alumnosfernando MartinNo ratings yet
- Procesos de Conservación de Alimentos (2a. Ed.) - (PG 6 - 189)Document184 pagesProcesos de Conservación de Alimentos (2a. Ed.) - (PG 6 - 189)cedu126No ratings yet
- Ejercicios Cinética Michaelis MentenDocument2 pagesEjercicios Cinética Michaelis MentenDavid Esteban Soler Camargo100% (1)
- Problemas Resueltos de Cinética EnzimáticaDocument23 pagesProblemas Resueltos de Cinética Enzimáticaafsasf0% (1)
- Guia Ejercicios Bio-Reactores ActualizadaDocument35 pagesGuia Ejercicios Bio-Reactores ActualizadaCairus RosalesNo ratings yet
- CINÉTICA ENZIMÁTICA Ejercicios Estudiantes 2020-IIDocument4 pagesCINÉTICA ENZIMÁTICA Ejercicios Estudiantes 2020-IIMichell E. TamayoNo ratings yet
- Ejercicios de ingeniería de biorreactores para el cálculo de concentraciones celulares y de sustrato usando la cinética de MonodDocument24 pagesEjercicios de ingeniería de biorreactores para el cálculo de concentraciones celulares y de sustrato usando la cinética de MonodFeshir Gutierrez0% (3)
- Ecuación de Michaelis-Menten (Deducción)Document2 pagesEcuación de Michaelis-Menten (Deducción)Eduardo CienfuegosNo ratings yet
- Crecimiento Microbiano y Cálculo de RendimientosDocument18 pagesCrecimiento Microbiano y Cálculo de RendimientosCorazon Contento100% (2)
- Enzimática: Km, Vmax, Ki de enzimas con inhibidoresDocument3 pagesEnzimática: Km, Vmax, Ki de enzimas con inhibidoresValentina ArangoNo ratings yet
- Cinética Enzimática Ejercicios 1Document1 pageCinética Enzimática Ejercicios 1Felipe RomoNo ratings yet
- Serie de Problemas de Cinética EnzimáticaDocument4 pagesSerie de Problemas de Cinética EnzimáticaCristina CrrsNo ratings yet
- Taller de Bioquímica 2Document2 pagesTaller de Bioquímica 2Andres Felipe JuezNo ratings yet
- Lista de Problemas Enzimas 23-24Document9 pagesLista de Problemas Enzimas 23-24alahoz1199No ratings yet
- Taller 3 Cinética de EnzimasDocument1 pageTaller 3 Cinética de EnzimasValentina ArangoNo ratings yet
- Problemas de Cinética EnzimáticaDocument3 pagesProblemas de Cinética EnzimáticamcmmartinNo ratings yet
- Problemas de Catálisis QuímicaDocument2 pagesProblemas de Catálisis QuímicaJuan AguilarNo ratings yet
- Problemas C.E 2Document5 pagesProblemas C.E 2Alejandro PeñafielNo ratings yet
- Jitorres - Problemas Enzimas 1Document7 pagesJitorres - Problemas Enzimas 1Juan MoralesNo ratings yet
- Problemas Resueltos de Catálisis QuímicaDocument13 pagesProblemas Resueltos de Catálisis QuímicaCARLOS IVAN NIETO POLO SALINASNo ratings yet
- Enzimas TareaDocument1 pageEnzimas TareaRafael Gonzalo Aceves GomezNo ratings yet
- Guía de Problemas N°3 - Bioquímica I 2021 - UNRNDocument3 pagesGuía de Problemas N°3 - Bioquímica I 2021 - UNRNGabii Van CauwenbergheNo ratings yet
- Problemas de BioquimicaDocument3 pagesProblemas de Bioquimicarobert ocrospomaNo ratings yet
- Banco de PreguntasDocument10 pagesBanco de PreguntasAlejandro VanegasNo ratings yet
- UROANALISISDocument41 pagesUROANALISISジェファーソン マスコ0% (1)
- CabezaDocument7 pagesCabezaジェファーソン マスコNo ratings yet
- SuerosDocument9 pagesSuerosMaye Cayllahua PeñaNo ratings yet
- Metodos de Estudio en HistologiaDocument45 pagesMetodos de Estudio en Histologiaジェファーソン マスコNo ratings yet
- Atlasdesedimentourinario1 100623151058 Phpapp02Document165 pagesAtlasdesedimentourinario1 100623151058 Phpapp02Jano GarciaNo ratings yet
- Tipo de AntígenosDocument3 pagesTipo de Antígenosジェファーソン マスコNo ratings yet
- Peróxido de HidrógenoDocument7 pagesPeróxido de HidrógenoLenin Corrales MolloNo ratings yet
- Modelo Leninger Mayo-16Document8 pagesModelo Leninger Mayo-16ジェファーソン マスコNo ratings yet
- 921845341.examen de Orina 1Document86 pages921845341.examen de Orina 1ジェファーソン マスコNo ratings yet
- Examen de Orina CompletaDocument30 pagesExamen de Orina Completaジェファーソン マスコNo ratings yet
- Técnica Histológica: Proceso deDocument6 pagesTécnica Histológica: Proceso deLeyendo Sobre NubesNo ratings yet
- Manual de Procedimientos para Inmonología. Banco de SangreDocument139 pagesManual de Procedimientos para Inmonología. Banco de Sangreamonra1067% (6)
- 28 Problemas ResueltosDocument11 pages28 Problemas ResueltosNora Cadenillas Fernàndez80% (5)
- H - E JeffferDocument5 pagesH - E Jeffferジェファーソン マスコNo ratings yet
- Ficha Pre InscripcionDocument1 pageFicha Pre Inscripcionジェファーソン マスコNo ratings yet
- Técnicas inmunológicas: diagnóstico y detecciónDocument10 pagesTécnicas inmunológicas: diagnóstico y detecciónジェファーソン マスコNo ratings yet
- Cito - XDDocument2 pagesCito - XDジェファーソン マスコNo ratings yet
- Libro: Parasitologia Humana Editor Dr. Werner Apt Baruch. Mcgraw Hill. Interamerica Editores S.A. México. 2013Document4 pagesLibro: Parasitologia Humana Editor Dr. Werner Apt Baruch. Mcgraw Hill. Interamerica Editores S.A. México. 2013EndirNatera0% (1)
- Alteraciones Cromosomicas EstructuralesDocument3 pagesAlteraciones Cromosomicas Estructuralesジェファーソン マスコNo ratings yet
- Microsoftpowerpoint Hemocult 110618131419 Phpapp02Document47 pagesMicrosoftpowerpoint Hemocult 110618131419 Phpapp02ジェファーソン マスコ100% (1)
- Definición, fundamentos y usos de la turbidimetría y nefelometríaDocument5 pagesDefinición, fundamentos y usos de la turbidimetría y nefelometríaジェファーソン マスコ100% (2)
- PRACTICA MicrobiologiaDocument3 pagesPRACTICA Microbiologiaジェファーソン マスコNo ratings yet
- La CoccidioidomicosisDocument2 pagesLa Coccidioidomicosisジェファーソン マスコNo ratings yet
- Uro Cult IvoDocument2 pagesUro Cult Ivoジェファーソン マスコNo ratings yet
- Manual Inmunología UJATDocument27 pagesManual Inmunología UJATジェファーソン マスコNo ratings yet
- HematologiaDocument785 pagesHematologiaJuan Esteban Baro92% (50)
- Bacteriolog A Diagn SticaDocument151 pagesBacteriolog A Diagn SticaDavid García V.100% (13)
- Doc1 2Document6 pagesDoc1 2ジェファーソン マスコNo ratings yet
- Coccidioidomicosis Exposicion JessicaDocument64 pagesCoccidioidomicosis Exposicion Jessicaジェファーソン マスコNo ratings yet
- Leucemia ExposicionDocument50 pagesLeucemia Exposicionジェファーソン マスコ100% (3)
- Informe #6 (Cinética de La Invertasa)Document16 pagesInforme #6 (Cinética de La Invertasa)Carlos100% (2)
- Cinetica Trabajo ImprimirDocument23 pagesCinetica Trabajo ImprimirMitchie ZavaletaNo ratings yet
- Clase 4 - EnzimasDocument45 pagesClase 4 - EnzimasKRISTELL ELENA PEREZ MONJANo ratings yet
- Tema 5. EnzimasDocument10 pagesTema 5. EnzimasPablo VillaescusaNo ratings yet
- Practica de AlkaDocument7 pagesPractica de AlkaMartuchiz Tuchizz0% (1)
- Cinetica QuimicaDocument4 pagesCinetica QuimicaMarqoz MartiniNo ratings yet
- Química 4to Medio CinéticaDocument3 pagesQuímica 4to Medio CinéticaManuel Vargas AlvaradoNo ratings yet
- Cinética química problemas resueltos temperatura tiempo concentraciónDocument13 pagesCinética química problemas resueltos temperatura tiempo concentraciónbryggyttNo ratings yet
- Fundamentos Generales de La Lixiviación y Variables Que Influyen en La OperaciónDocument7 pagesFundamentos Generales de La Lixiviación y Variables Que Influyen en La OperaciónDiego Ignacio Cabrera AlvarezNo ratings yet
- Cinética Química de La Hidrólisis Del Cloruro de TercDocument4 pagesCinética Química de La Hidrólisis Del Cloruro de TercGustavo GuillénNo ratings yet
- Problemas de FisicoquimicaDocument2 pagesProblemas de FisicoquimicaJuanito AlvaradoNo ratings yet
- Pre-Lab No. 7Document4 pagesPre-Lab No. 7Ruby JuárezNo ratings yet
- 3-Curso FlotacionDocument224 pages3-Curso FlotacionJose Antonio Roas Velasquez100% (2)
- TALLER2 - CINÉTICA QUÍMICA 2021 RRDocument6 pagesTALLER2 - CINÉTICA QUÍMICA 2021 RRRoberto Eduardo Quispe MamaniNo ratings yet
- Física 11: Impulso y cantidad de movimientoDocument9 pagesFísica 11: Impulso y cantidad de movimientoMartin BarrientosNo ratings yet
- 9 Cine Tic Ay Reactor EsDocument21 pages9 Cine Tic Ay Reactor EsNicolas Castaño0% (1)
- Descomposición Del Peróxido de HidrógenoDocument11 pagesDescomposición Del Peróxido de HidrógenoandresleonardoNo ratings yet
- Corrosión-TEORICODocument4 pagesCorrosión-TEORICODino Llanca LeonNo ratings yet
- Cinetica QuimicaDocument21 pagesCinetica QuimicaAnthony Alexandere VivancoNo ratings yet
- Guía Cuarto Medio Química Cinetica y EquilibrioDocument7 pagesGuía Cuarto Medio Química Cinetica y EquilibrioTamara GuzmanNo ratings yet
- Marco TeóricoDocument8 pagesMarco TeóricoDaniel Arroyo AedoNo ratings yet
- Saponificacion de Acetato de EtiloDocument7 pagesSaponificacion de Acetato de EtiloLuis MendozaNo ratings yet
- EnzimasDocument34 pagesEnzimasCharlesNo ratings yet
- Tabla Estequeometrica FOGLER PDFDocument57 pagesTabla Estequeometrica FOGLER PDFMartín ZufíaNo ratings yet
- 1 Trabajo y Energía CinéticaDocument19 pages1 Trabajo y Energía CinéticaLexa GrifinNo ratings yet
- Formulario Cultivo Continuo PDFDocument5 pagesFormulario Cultivo Continuo PDFhitomitsukiNo ratings yet
- Solucion A La PracticaDocument14 pagesSolucion A La Practicaalexander beltranNo ratings yet
- Fisico Qu Í MicaDocument3 pagesFisico Qu Í MicaJhon alexanderNo ratings yet
- Informe Laboratorio 8Document8 pagesInforme Laboratorio 8GeanineLiNo ratings yet