Professional Documents
Culture Documents
Informe de Tinción
Uploaded by
Nathaly LaraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe de Tinción
Uploaded by
Nathaly LaraCopyright:
Available Formats
UNIVERSIDAD POLITECNICA SALESIANA CIENCIAS DE LA VIDA INGENIERA EN BIOTECNOLOGA
INTEGRANTES: Jhoselyn Cueva, Christian Jcome. CURSO: 3 B TEMA: TINCIN GRAM. OBJETIVOS: Identificar bacterias Gram + y Gram mediante la tincin de Gram. Aplicar la tcnica aprendida en clase. MARCO TEORICO: TINCIN DE GRAM Es un tipo de tincin diferencial empleado en microbiologa para la visualizacin de bacterias, sobre todo en muestras clnicas. EXPLICACIN DEL PROCESO:
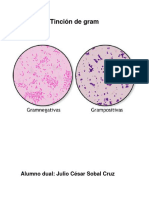
El cristal violeta (colorante catinico) penetra en todas las clulas bacterianas (tanto Gram positivas como Gram negativas) a travs de la pared bacteriana. El lugol es un compuesto formado por I2 (yodo) en equilibrio con KI (yoduro de potasio) y Sl (Siulterio), los cuales estn presente para solubilizar el yodo, y actan de mordiente, haciendo que el cristal violeta se fije con mayor intensidad a la pared de la clula bacteriana. El I 2entra en las clulas y forma un complejo insoluble en solucin acuosa con el cristal violeta. La mezcla de alcohol-acetona que se agrega, sirve para realizar la decoloracin, ya que en la misma es soluble el complejo I 2/cristal violeta. Los organismos Gram positivos no se decoloran, mientras que los Gram negativos s lo hacen. Para poner de manifiesto las clulas Gram negativas se utiliza una coloracin de contraste. Habitualmente es un colorante de color rojo, como la safranina o la fucsina. Despus de la coloracin de contraste las clulas Gram negativas son rojas, mientras que las Gram positivas permanecen azules. La safranina puede o no utilizarse, no es crucial para la tcnica. Sirve para hacer una tincin de contraste que pone de manifiesto las bacterias Gram negativas. Al trmino del protocolo, las Gram positivas se vern azul-violceas y las Gram negativas, se vern rosas (si no se hizo la tincin de contraste) o rojas (si se us, por ejemplo, safranina).
Esta importante coloracin diferencial fue descubierta por Hans Christian Gram en 1884. En este mtodo de tincin, la extensin bacteriana se cubre con solucin de uno de los colorantes de violeta de metilo, que se deja actuar durante un lapso determinado. Se escurre luego el exceso de violeta de metilo y se aade luego una solucin de yodo, que se deja durante el mismo tiempo que la anterior; despus se lava el portaobjetoscon alcohol hasta que ste no arrastre ms colorante. Sigue a tal tratamiento una coloracin de contraste, como safranina, fucsina fenicada diluida, pardo Bismarck, pironin B o hasta inclusive verde de malaquita. Algunos microorganismos retienen el colorante violeta, an despus de tratarlos con un decolorante, y el color no se modifica al aadir ste; otros pierden con facilidad el primer tinte, y toman el segundo. Los que fijan el violeta, se califican de grampositivos, y los que pierden la primera coloracin y retienen la segunda, de gramnegativos. Basndonos pues, en la reaccin Gram, podemos clasificar a los microorganismos en uno de los dos grupos. Los colorantes de p-rosanilina son los que mejores resultados dan en la coloracin Gram. Los representantes ms usados de este grupo son violeta de metilo y violeta cristal o de genciana. En realidad, violeta de metilo es el nombre atribuido al compuesto tetrametil-p-rosanilina. El matiz de color de la p-rosanilina se intensifica al aumentar el nmero de grupos metilo en la molcula; por consiguiente, de los tres grupos, el tono ms oscuro es la hexametil-p-rosanilina (violeta cristal), y el tinte ms ligero, la tetrametil-p-rosanilina (violeta de metilo). Los nombres violeta de metilo 3R, 2R, R, B, 2B, 3B, etc., se refieren al nmero de grupos metilo contenidos. La letra R indica matices rojos, y la letra B, tonos azules. El violeta de cristal contiene seis grupos metilo, y se considera como el mejor colorante primario para teir por el mtodo de Gram. La facultad de las clulas para tomar la coloracin Gram no es propia de toda sustancia viviente, sino que se limita casi en absoluto a hongos y bacterias. As vemos que las clulas de plantas y animales superiores no conservan la primera coloracin; los mohos se tien con cierta irregularidad; los grnulos de micelios propenden retener el colorante. La reaccin de Gram no es infalible ni constante; puede variar con el tiempo del cultivo y el pH del medio, y quiz por otras causas. TECNICAS DE COLORACIN:
1. Fijar un frotis
Con la ayuda de un mechero, flamear un asa bacteriolgica y esperar que enfre un poco. Tomar el asa (previamente flameada) y con sta tomar un poco de muestra. Una vez obtenida una pequea cantidad de la muestra (con el asa), hacer que sta tenga contacto con una lmina portaobjetos, la cual servir para depositar la muestra contenida en el asa. Con el asa (conteniendo la muestra) sobre la lmina portaobjetos, proceder a realizar la extensin de la muestra en el portaobjetos mediante movimientos giratorios (dar vueltas con el asa) sobre la lmina, de tal forma que al terminar la extensin, tengamos como producto una espiral en la parte media de la lmina. Esperar que seque al aire libre o ayudarse con la llama de un mechero para fijar la muestra, teniendo en cuenta que el calor no debe ser directo (slo se pasa por la llama), puesto que el calor
excesivo puede cambiar la morfologa celular de las bacterias a observar. El calor deseable es aqul en el que el portaobjetos sea apenas demasiado caliente para ser colocado sobre el dorso de la mano.
2. Tincin
Con violeta cristal, violeta de genciana, azul de metileno o en todo caso tinta china utilizando una cantidad suficiente de dicho colorante sobre la muestra, como para lograr cubrirla por completo. Se deja actuar al colorante por 1 minuto. Esta tincin de 1 minuto est dada para trabajar a una temperatura ambiente de 25 C.
3. Enjuague
Al transcurrir el minuto, se debe enjuagar la lmina conteniendo la muestra con agua corriente. Para realizar el lavado, se debe tener en cuenta que el chorro de agua NO debe caer directamente sobre la muestra, sta debe caer sobre la parte superior de la lmina que no contiene muestra. El chorro debe ser un chorro delgado, aproximadamente de medio a un milmetro de espesor. Tambin el enjuague se debe realizar poniendo la lmina portaobjetos en posicin inclinada hacia abajo. La solucin de cristal violeta, se recomienda sea al 1%.
4. Mordiente
Una vez enjuagado el portaobjetos, se aplica como mordiente yodo o lugol durante 3 minuto ms. El mordiente es cualquier sustancia que forma compuestos insolubles con colorantes y determina su fijacin en las bacterias..
5. Decoloracin (paso critico)
Pasado el minuto de haber actuado el mordiente, el frotis se decolora con etanol al 75 %, etanol al 95 %, acetona o alcohol-acetona, hasta que ya no escurra ms lquido azul. Para esto se utiliza el gotero del frasco del decolorante. Se van aadiendo cantidades suficientes del decolorante, hasta lograr que ste salga totalmente transparente, es decir, hasta que ya no escurra ms lquido azul.
6. Lavado y secado
Lavar con agua para quitar los residuos de decolorante y esperar que seque la lmina al aire libre o con la ayuda de la llama de un mechero de la forma anteriormente descrita.
7. Tincin de contraste
Una vez que la lmina ya sec, procedemos a teir nuevamente, pero esta vez se va a utilizar un colorante de contraste como por ejemplo la safranina, dejar actuar durante 1 minuto.
8. Nuevo enjuague
Pasado el minuto correspondiente, se procede a enjuagar la lmina con agua, se escurre el agua sobrante y se seca en la forma anteriormente descrita. De esta manera, ya tendremos listo el frotis para su respectiva observacin microscpica.
MATERIALES: Mechero asa cristal violeta de Hucker Safranina Alcohol lugol Aceite de inmersin Portaobjetos Aguan destilada fucsina PROCEDIMIENTO: En un porta bien limpio (con alcohol, papel de filtro y flameado) Se coloc una gota de agua destilada a la que, con el asa, previamente esterilizada a la llama, al rojo vivo, se lleva una pequea cantidad de suspensin de bacterias o una colonia. Con el asa se extiende la gota y las bacterias sobre el porta y se fija la extensin por el calor, calentando suavemente a la llama del mechero hasta que se seque. Se puso una gota de cristal violeta de Hucker (colorante inicial), el cual dejamos reposar 1 minuto Se lav con agua destilada Se puso lugol (mordiente) una gota, el cual dejamos reposar por 1 minuto. Se decolor con alcohol de 95 (decolorante) Se lava con agua destilada Se puso una gota de fucsina bsica (colorante de contraste), se dej reposar 1 minuto. Se lava con agua corriente. Se sec suavemente y sin frotar con papel de filtro Una vez que la preparacin est totalmente seca, poner una gota muy pequea de aceite de inmersin y se observ al microscopio con el objetivo de inmersin.
CONCLUSIONES: La tincin de Gram es una herramienta muy til en el laboratorio de microbiologa as como en los anlisis clnicos y diagnostico medico siendo ineludible conocer su fundamento y procedimiento, para poder tener una correcta interpretacin de los datos que nos otorga la
diferenciacin de Gram positiva y negativa concluyendo que debido a la estructura de sus paredes celulares tendrn o no propiedades patolgicas diferentes Los resultados sobre la prctica tincin de Gram positiva o negativa es realmente importante para el diagnstico y buen tratamiento de la patologa relacionada microorganismos es necesario saber cmo influyen en las manifestaciones clnicas las diferencias existentes entre la pared celular de las bacterias Gram positivas y Gram negativas en su deteccin. La tincin de Gram no es una prueba fiable de tincin de bacterias en medios de cultivo con escasos nutrientes (p. ej., cultivos viejos o en fase estacionaria) o tratados con antibiticos debido a la degradacin del peptidoglicano.
BIBLIOGRAFA:
Aulton Michael E., Ciencia y diseo de formas farmacuticas, 2 edicin, Ed. Elsevier Espaa, 2004. Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath (1994). Bergey's Manual of Determinative Bacteriology (9th ed.). Lippincott Williams & Wilkins. Madigan, MT; Martinko J, Parker J (2004). Brock Biology of Microorganisms (10th ed.). Lippincott Williams & Wilkins.
You might also like
- Informe de Laboratorio 2 Gram FinalDocument7 pagesInforme de Laboratorio 2 Gram FinalJose Cesar MamaniNo ratings yet
- Induccion RTU GE D20Document40 pagesInduccion RTU GE D20gabriel galvez figueroaNo ratings yet
- CuestionarioDocument7 pagesCuestionarioAlejandro Nuñez PinzonNo ratings yet
- Tincion GramDocument14 pagesTincion Grammayin zapataNo ratings yet
- Prueba de Resistencia A La Compresión Del ConcretoDocument8 pagesPrueba de Resistencia A La Compresión Del ConcretoJohn STCNo ratings yet
- Informe de Laboratorio 2 Gram FinalDocument7 pagesInforme de Laboratorio 2 Gram FinalJose Cesar Mamani100% (1)
- Trabajo Final de Historia Global, La Basura en PanamáDocument17 pagesTrabajo Final de Historia Global, La Basura en PanamáKevin Adames (4you)100% (1)
- INFORMATICA MODULO 22 Cuestionario CONTESTADO,.Document10 pagesINFORMATICA MODULO 22 Cuestionario CONTESTADO,.berthaNo ratings yet
- Tincion de GramDocument11 pagesTincion de GramFernando Lopez BautistaNo ratings yet
- Tinción o Coloración de BacteriasDocument6 pagesTinción o Coloración de Bacterias'Betu BluuNo ratings yet
- TinciónesDocument15 pagesTinciónesDaniela Penagos SolisNo ratings yet
- Tincion de GramDocument15 pagesTincion de GramJasmin Rojas100% (1)
- Tincion GramDocument3 pagesTincion GramFernando TiradoNo ratings yet
- Tinción Compuesta Gram y BKDocument5 pagesTinción Compuesta Gram y BKJorge RodríguezNo ratings yet
- Pasos para La Coloracion GramDocument4 pagesPasos para La Coloracion GramRicardo Jaramillo ChicattiNo ratings yet
- Informe de Tincion de GramDocument11 pagesInforme de Tincion de GramLau RiveraNo ratings yet
- Informe de Tincion de GramDocument11 pagesInforme de Tincion de GramIvonne PambabayNo ratings yet
- 10 Morfología y TinciónDocument10 pages10 Morfología y TinciónNilton Rios TamayoNo ratings yet
- Informe Lab 2 PDFDocument10 pagesInforme Lab 2 PDFBryanDuqueÁlvarezNo ratings yet
- Técnicas de TinciónDocument9 pagesTécnicas de TinciónAlan GomezNo ratings yet
- INFORMEDocument10 pagesINFORMEsebastian yañezNo ratings yet
- TincionesDocument2 pagesTincionesEstephania Caballero LoaizaNo ratings yet
- La Tinción de Gram y Ziehl NeelsenDocument5 pagesLa Tinción de Gram y Ziehl NeelsenMarjorie Cejas PobleteNo ratings yet
- Quinto Informe de BiologiaDocument17 pagesQuinto Informe de BiologiaJhymmy RojasNo ratings yet
- Practica No 2Document6 pagesPractica No 2juan david casas canizalesNo ratings yet
- Pre Informe Biologia Laboratorio 7Document5 pagesPre Informe Biologia Laboratorio 7DANIEL ARTURO MARTINEZ ACOSTANo ratings yet
- Métodos para Teñir y Observar Frotis MicrobiológicosDocument4 pagesMétodos para Teñir y Observar Frotis MicrobiológicosCVRNo ratings yet
- Practica 3 de MicrobiologiaDocument4 pagesPractica 3 de MicrobiologiaCarlos ChávezNo ratings yet
- Tinción Gram y Ziehl NeelsenDocument4 pagesTinción Gram y Ziehl NeelsenCarla EstefaniaNo ratings yet
- Coloracion GramDocument11 pagesColoracion GramJuan Camilo GonzálezNo ratings yet
- Informe de Practica Microbiologia N°03Document8 pagesInforme de Practica Microbiologia N°03giorgio cervantes rodriguezNo ratings yet
- Informe de Laboratorio - Practica No.5Document7 pagesInforme de Laboratorio - Practica No.5Valentina Sarmiento EspañaNo ratings yet
- La Coloración de GramDocument11 pagesLa Coloración de Gramdirce823100% (2)
- Trabajo Practico #8Document6 pagesTrabajo Practico #8NadyaLizzyAstorgaNo ratings yet
- Tincion de GramDocument6 pagesTincion de GramLETICIA LOVERA CASAPIANo ratings yet
- Tinción de Gram - 2021Document4 pagesTinción de Gram - 2021natalia niñoNo ratings yet
- Informe - Tincion de GramDocument6 pagesInforme - Tincion de GramJoîz Vêrito100% (1)
- Fundamento de ColoracionesDocument7 pagesFundamento de ColoracionesjerssonNo ratings yet
- Gram y CapsulasDocument3 pagesGram y CapsulasDuván MarquezNo ratings yet
- Práctica TincionesDocument13 pagesPráctica Tincionesmarisol salgado perezNo ratings yet
- Practica de Tinción de GramDocument3 pagesPractica de Tinción de GramMauricio ValdésNo ratings yet
- Tinción de GranDocument5 pagesTinción de GranJesus SantosNo ratings yet
- Tincion GRAMDocument9 pagesTincion GRAMroyser avellaneda alarconNo ratings yet
- Tincion de Gram 2Document9 pagesTincion de Gram 2THANYA KARINA LEON HERNANDEZNo ratings yet
- Práctica de Laboratorio Identificación BacterianaDocument12 pagesPráctica de Laboratorio Identificación BacterianaPaola AlvaradoNo ratings yet
- Coloracion Gram Reporte .Document8 pagesColoracion Gram Reporte .Jhordan Palacios LazoNo ratings yet
- Practica4 5.5microbiologia IADocument8 pagesPractica4 5.5microbiologia IAFrankoNo ratings yet
- PRACTICA NO 1 - Tinción de GramDocument10 pagesPRACTICA NO 1 - Tinción de GramQue te importaNo ratings yet
- Infor 5 - Micro (Coloracion Gram y Ziehl Neelsen)Document8 pagesInfor 5 - Micro (Coloracion Gram y Ziehl Neelsen)Anderson DominguezNo ratings yet
- Guia de Practica 2022-2Document27 pagesGuia de Practica 2022-2MANRIQUE GUTIÉRREZ STEPHANY GIOMAYRANo ratings yet
- Practica 6 Tinciones (Autoguardado)Document7 pagesPractica 6 Tinciones (Autoguardado)Anonymous v5NZckO6100% (1)
- Coloracion de GramDocument12 pagesColoracion de GramLesly Huarcaya CondoriNo ratings yet
- Informe N°1 de Laboratorio de MicrobiologíaDocument6 pagesInforme N°1 de Laboratorio de MicrobiologíaMara Cecilia Llontop Garcia ZapateroNo ratings yet
- V. Resultados: Observaciones MicroscopicasDocument10 pagesV. Resultados: Observaciones MicroscopicasKathy Kathy FloresNo ratings yet
- Informe de TincionesDocument5 pagesInforme de TincionesJorge Bolaño RamosNo ratings yet
- Tincion Gram - Universidad ContinentalDocument9 pagesTincion Gram - Universidad ContinentalEnrique MunguiaNo ratings yet
- Tinción de GramDocument7 pagesTinción de GramJulio Sobal CruzNo ratings yet
- Taller N°2Document3 pagesTaller N°2Katt ValenzuelaNo ratings yet
- Microbiologia Sem 5Document6 pagesMicrobiologia Sem 5romario meza aliagaNo ratings yet
- Examen en Fresco y Coloracion GramDocument17 pagesExamen en Fresco y Coloracion GramEKA G. R.No ratings yet
- Informe1 MBDocument13 pagesInforme1 MBDaniel JesusNo ratings yet
- Tinción GramDocument4 pagesTinción GramMichelle RodríguezNo ratings yet
- Tincion Gram Informe - OutputDocument9 pagesTincion Gram Informe - OutputChristian MazonNo ratings yet
- CLASE. Tinción de Gram. OkDocument8 pagesCLASE. Tinción de Gram. OkAngel MajanoNo ratings yet
- Dominando las Tinciones: Manual para el Laboratorio MicrobiológicoFrom EverandDominando las Tinciones: Manual para el Laboratorio MicrobiológicoNo ratings yet
- Manual - Warm Crystal 2500 - V2Document64 pagesManual - Warm Crystal 2500 - V2Antonio Machado OliverNo ratings yet
- Inspiron 23 5348 Aio Setup Guide2 PT BRDocument2 pagesInspiron 23 5348 Aio Setup Guide2 PT BRDorobo WarubozoNo ratings yet
- Ensayo J LenguajeDocument12 pagesEnsayo J LenguajeprofecarlaNo ratings yet
- ECOGEOS Ficha Tecnica 220213 AgrícolaDocument1 pageECOGEOS Ficha Tecnica 220213 AgrícolaEcogestoresNo ratings yet
- Infraestructura CriticaDocument3 pagesInfraestructura CriticaJose Miguel Iriarte NeiraNo ratings yet
- Zonificacion 18-10Document1 pageZonificacion 18-10Melisa Gutierrez MedranoNo ratings yet
- Programación IESSV 2018-19 1º ASIR (Tardes) - Implantación de Sistemas OperativosDocument25 pagesProgramación IESSV 2018-19 1º ASIR (Tardes) - Implantación de Sistemas OperativosLuis FontalbanNo ratings yet
- Riesgo BiomecanicoDocument59 pagesRiesgo BiomecanicoMaría Ximena Pulgarín OteroNo ratings yet
- Residuos Tóxicos Del DuraznoDocument22 pagesResiduos Tóxicos Del DuraznoFrancis GCNo ratings yet
- Semana 3 PDFDocument15 pagesSemana 3 PDFYera Jade Espinoza HerreraNo ratings yet
- Silabo Primer Ciclo, Pensamiento Logico UntDocument2 pagesSilabo Primer Ciclo, Pensamiento Logico UntNataly Vilchez VásquezNo ratings yet
- PDF Masa y Volumen CompressDocument2 pagesPDF Masa y Volumen CompressRicardo GNo ratings yet
- Autoreporte de Condiciones de SaludDocument1 pageAutoreporte de Condiciones de SaludGerardo CastrillonNo ratings yet
- Herramientas DigitalesDocument8 pagesHerramientas DigitalesJuancho ZarateNo ratings yet
- 001 Taller 1 PHPDocument22 pages001 Taller 1 PHPIsabelNo ratings yet
- Semana 06 - Membrana Celular IIDocument19 pagesSemana 06 - Membrana Celular IIBren ANo ratings yet
- Valbol - CatálogoDocument24 pagesValbol - CatálogoforoNo ratings yet
- Importación y Exportaciones en HondurasDocument35 pagesImportación y Exportaciones en HondurasCarlos Roberto Larios BonesNo ratings yet
- Recomendaciónes para Conducción InvernalDocument12 pagesRecomendaciónes para Conducción InvernalCarlos Alberto LERTORANo ratings yet
- Ciclo de Vida de Un ErrorDocument2 pagesCiclo de Vida de Un Errormedina1520No ratings yet
- ETICA PROFESIONAL - Estra Sumativa - NIvel III Grupo C - MARIA FERNANDA VARGAS ULATEDocument4 pagesETICA PROFESIONAL - Estra Sumativa - NIvel III Grupo C - MARIA FERNANDA VARGAS ULATECarlos SalazarNo ratings yet
- GFPI-F-023 Formato Planeacion Seguimiento y Evaluacion Etapa ProductivaDocument4 pagesGFPI-F-023 Formato Planeacion Seguimiento y Evaluacion Etapa ProductivaNicolasNo ratings yet
- Cosmeticos Trabajo LunesDocument27 pagesCosmeticos Trabajo LunesMilowannyNo ratings yet
- SIMILITUDES Y DIFERENCIAS ENTRES LOS ARTÍCULOS: LOS SISTEMAS DE COSTOS Y LA CONTABILIDAD DE GESTIÓN: PASADO, PRESENTE Y FUTURO - LOS SISTEMAS DE COSTEO: BASES Y METODOLOGÍAS - ¿CÓMO ELABORAR UN ESTADO DE COSTOS DE LA PRODUCCIÓN VENDIDA?Document10 pagesSIMILITUDES Y DIFERENCIAS ENTRES LOS ARTÍCULOS: LOS SISTEMAS DE COSTOS Y LA CONTABILIDAD DE GESTIÓN: PASADO, PRESENTE Y FUTURO - LOS SISTEMAS DE COSTEO: BASES Y METODOLOGÍAS - ¿CÓMO ELABORAR UN ESTADO DE COSTOS DE LA PRODUCCIÓN VENDIDA?DelfinOviedoNo ratings yet
- Áreas Protegidas - ResueltoDocument8 pagesÁreas Protegidas - ResueltoAndreita Abril BrionesNo ratings yet