Professional Documents
Culture Documents
Fertilitas
Uploaded by
Alpasca FirdausOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Fertilitas
Uploaded by
Alpasca FirdausCopyright:
Available Formats
Analisis Sperma pada Infertilitas Pria Pendahuluan Sekitar 10% dari pasangan suami-istri mengalami infertilitas 1,2,3,4.
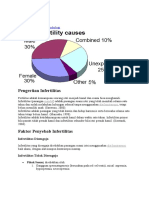
Faktor peyebab infertilitas berasal dari suami, istri, atau keduanya. Faktor lain dari kedua belah pihak sebesar 30--40%. Menurut penelitian yang dilakukan Lim dan Ratnam, faktor penyebab yang berasal dari suami sebesar 33%, sedangkan hasil penelitian WHO pada 1989 sebesar 40%. Penelitian yang dilakukan Arsyad terhadap 246 pasangan infertil di Palembang menunjukkan infertilitas yang disebabkan faktor pria sebesar 48,4%2. Laboratorium klinik sangat berperan dalam diagnosis dan penatalaksanaan pria infertil1. Pemeriksaan laboratorium yang merupakan tulang punggung laboratorium andrologi dan laboratorium rumah sakit atau Assisted Reproductive Technology (ART) adalah analisis sperma dan pemeriksaan hormone. Memiliki keturunan merupakan salah satu ciri mahluk hidup. Untuk dapat memiliki keturunan diperlukan sel gamet (ovum dan sperma) serta seperangkat alat reproduksi yang memprasaranai proses pembentukan, pematangan sel gamet, proses fertilisasi, hingga terjadinya kehamilan sampai akhirnya fetus dilahirkan. Pada organ yang terlibat dan proses yang berjalan seringkali terjadi hambatan atau permasalahan. Salah satu permasalahan yang menyebabkan seseorang sulit atau tidak bisa memiliki keturunan secara alami adalah tidak terjadinya fertilisasi antara sel telur dan sperma. Untuk mengatasi masalah tersebut maka berkembanglah teknologi reproduksi berbantu (assisted reproduction technology) yang bertujuan untuk menghasilkan zigot dari fertilisasi antara sel telur dan sel sperma secara in vitro. Zigot yang dihasilkan kemudian dikultur dan ditransfer kembali ke dalam uterus pada saat embrio berumur 3 hari.
Definisi Fertilitas adalah kemampuan seorang istri untuk menjadi hamil dan melahirkan bayi hidup serta kemampuan suami menghamilkannya. Pasangan infertil adalah suatu kesatuan hasil interaksi biologik yang tidak menghasilkan kehamilan dan kelahiran bayi hidup. Pasangan suami istri disebut infertilitas primer jika istri belum
berhasil hamil walaupun bersanggama teratur dan dihadapkan kepada kemungkinan kehamilan selama 12 bulan berturut-turut. Disebut pasangan infertilitas sekunder jika istri pernah hamil, akan tetapi tidak berhasil hamil lagi walaupun bersanggama teratur dan dihadapkan kepada kemungkinan kehamilan selama 12 bulan berturut-turut. Adapun infertilitas idiopatik adalah bentuk infertilitas, yang setelah pemeriksaan lengkap kedua pasangan dinyatakan normal, dan ditangani selama 2 tahun tidak juga berhasil hamil. Pemeriksaannya meliputi pemeriksaan dasar infertilitas, HSG, uji pasca-sanggama, laparoskopi berikut hidrotubasi, dan sekurang-kurangnya 2 kali analisis sperma. Kenyataan idiopatik pada tahap klinik ini dipertegas lagi dengan serangkaian uji imunologik dan uji fertilisasi in vitro (FIV) atau uji fertilisasi in vivo (secara TAGIT). Jika dengan cara-cara terakhir ini tetap gagal dan analisis sitogenetik dari gamet yang gagal difertilisasi atau zigot yang gagal berkembang menunjukkan hasil yang normal, maka keadaan inilah yang dikatakan sebagai keadaan idiopatik yang sesungguhnya. Kemajuan andrologi juga mempermudah klasifikasi penyebab infertilitas pria. Penyebab infertilitas pria diklasifikasikan berdasarkan gangguan produksi sperma, gangguan fungsi sperma, gangguan transportasi sperma, dan penyebab idiopatik. Gangguan produksi sperma bisa terjadi pratestis, misalnya hipogonadisme, kelebihan estrogen, kelebihan androgen, kelebihan glukokortikoid, dan hipotiroidisme. Bisa terjadi pula di daerah testis, misalnya gangguan maturasi, hipospermatogenesis, sindroma sel sertoli, sindroma Klinefelter, kriptorkidisme, orkhitis, dan lain-lain. Kelainan di luar organ testis seperti varikokel dan hidrokel menyebabkan gangguan produksi sperma. Sebab infertilitas pria yang lain adalah gangguan fungsi sperma. Keadaan ini bisa disebabkan adanya pyospermia, hemospermia, adanya antibodi anti sperma, nekrozoospermia, dan astenozoospermia. Selain hal tersebut, infertilitas pria bisa disebabkan oleh gangguan transportasi sperma, antara lain kelainan anatomi dari saluran-saluran yang dilewati sperma. Kelainan anatomi itu bisa berupa agenesis vas deferens maupun vesika seminalis, hipospadia dan epispadia, obstruksi vas deferens/epididimis yang bisa disebabkan TB epididimis, gonokokal epididimis, pasca trauma, klamidial epididimis, serta mikoplasma epididimis. Kelainan anatomi didapat bisa karena tindakan vasektomi. Pemeriksaan Laboratorium Analisis Sperma World Health Organization (WHO) telah mempublikasikan petunjuk laboratorium analisis sperma sejak 1980. Kemudian dilakukan perbaikan edisi pada 1987 dan 1992. Edisi terbaru adalah edisi keempat tahun 1999. Pada edisi terakhir ini diperkenalkan prosedur laboratorium analis sperma standar untuk menetapkan diagnosis pria infertil, pengembangan pelayanan inseminasi buatan, pengembangan penelitian dan kemungkinan kontrasepsi pria, kemungkinan efek samping dari toksin maupun polutan lain, serta kedokteran forensik. Petunjuk laboratorium analis sperma edisi terbaru WHO 1999 sangat diperlukan karena berguna dalam pengembangan andrologi. Di dalamnya memuat
jaminan kualitas pemeriksaan laboratorium yang ditingkatkan, pengembangan tes fungsi sperma, pemeriksaan semen otomatis, keberhasilan uji-coba WHO pada metode hormonal untuk kontrasepsi pria, perhatian terhadap toksin di lingkungan sekitar yang menyebabkan gangguan fertilitas pria berupa penurunan jumlah sperma dan frekuensi gangguan saluran kelamin, diakuinya penyebab genetik pada infertilitas pria, dan pengembangan besar pada menejemen infertilitas pria dengan infra cyloplusmic sperm injection (ICSI) . Petunjuk laboratorium analisis sperma WHO 1999 secara umum berisi tentang: (1) Prosedur standar pemeriksaan semen yang meliputi deskripsi plasma semen, konsentrasi sperma, motilitas, morfologi, hitung sel selain sperma, dan tes antibodi yang melapisi sperma; (2) Jenis-jenis tes pilihan yang tidak rutin dilakukan, tetapi tergantung kebutuhan; (3) Jenis tes riset yang digunakan dalam laboratorium riset andrologi; (4) Garis besar teknik-teknik memisahkan sperma; (5) Cara melakukan kontrol kualitas laboratorium andrologi; (6) Metode yang lebih detail tentang tes interaksi mukus servikalis dengan sperma; (9) Tambahan-tambahan tentang nilai rujukan analisis sperma, petunjuk teknik pewarnaan sperma, persiapan tes immunobead, dan biokimia semen. Perubahan besar dan modifikasi yang ada pada petunjuk laboratorium analisis sperma WHO 1999 ini adalah: Pertama, tentang kesalahan penghitungan dari aspek statistik (statistical aspects of counting errors). Saat ini direkomendasikan penghitungan 200 sperma dua kali untuk menghitung konsentrasi sperma, motilitas, dan morfologi. Dengan adanya peningkatan jumlah sperma yang dihitung (sebelumnya 100 sperma), akan memperbaiki akurasi hasil pemeriksaan. Kedua, tentang penghitungan motilitas sperma berdasarkan bergerak tidaknya dan kecepatan sperma bergerak. Diketahui panjang kepala sperma 5 m dan panjang ekor sperma 50 m. Jika sperma bergerak dengan kecepatan 5 kali panjang kepala sperma atau setengah kali panjang ekor sperma maka diperkirakan kecepatan sperma adalah 25 m/detik. Metode ini memiliki reprodusibilitas yang lebih baik daripada metode yang direkomendasikan sebelumnya. Ketiga, tentang perubahan penilaian morfologi sperma yang lebih sederhana. Sebelumnya analisis harus mengidentifikasi dan menghitung bentuk-bentuk abnormal sperma selain bentuk normalnya. Saat ini hanya menentukan bentuk normal dan abnormal, tanpa harus menghitung detail dari bentuk-bentuk abnormal sperma. Keempat, tentang kontrol kualitas analisis sperma. Kontrol kualitas analisis sperma diperlukan untuk mendeteksi dan mengoreksi kesalahan sistematik serta variabilitas yang tinggi. Aktivitas kontrol kualitas disiapkan dengan satu laboratorium rujukan sebagai kontrol kualitas interna. Penetapan kualitas eksterna didasarkan pada hasil evaluasi sampel yang sama yang dievaluasi di beberapa laboratorium. Pengambilan Sampel Sebelum diambil, penderita diberi penjelasan tertulis tentang tatacara pengumpulan dan membawa semen ke tempat pemeriksaan. Semen diambil setelah abstinensi sedikitnya 48 jam dan tidak lebih lama dari tujuh hari. Nama, masa abstinensi, dan waktu pengambilan dicatat pada formulir yang dilampirkan pada setiap semen yang akan dianalisis. Untuk evaluasi awal, dilakukan pemeriksaan dua sediaan. Waktu antara kedua pemeriksaan tersebut bergantung pada keadaan setempat, tetapi tidak boleh kurang dari tujuh hari atau lebih dari tiga bulan. Semen
diantar ke laboratorium dalam waktu satu jam sesudah dikeluarkan. Semen sebaiknya diperoleh dengan cara masturbasi dan ditampung dalam botol kaca bermulut lebar. Semen dilindungi dari suhu yang ekstrim selama pengangkutan ke laboratorium (suhu antara 20400C). Makroskopik Pertama kali sampel semen datang di laboratorium dilakukan pemeriksaan makroskopik. Semen normal tampak berwarna putih kelabu dan berbau seperti bunga akasia pada pagi hari Semen yang berbau busuk diduga disebabkan oleh suatu infeksi. Dalam keadaan normal, semen mencair (liquefaction) dalam 60 menit pada suhu kamar. Dalam beberapa kasus pencairan tidak terjadi secara sempurna dalam 60 menit. Hal ini menunjukkan adanya gangguan pada fungsi kelenjar prostat. Untuk itu, semen segera diperiksa setelah pencairan atau dalam waktu satu jam setelah ejakulasi. Setelah diamati penampilannya, dilanjutkan dengan pengukuran volume semen. Volume semen diukur dengan gelas ukur atau dengan cara menghisap seluruh semen ke dalam suatu semprit atau pipet ukur. Nilai normal >/2,0 ml2,6. Jika volume semen terlalu sedikit maka tidaklah cukup untuk menetralkan keasaman suasana rahim. Dengan demikian, sperma yang berada di rongga rahim akan segera mati sehingga kehamilan tidak terjadi. Volume dianggap abnormal jika semen < 2,0 ml. Pemeriksaan makroskopik dilakukan dengan melihat konsistensinya. Untuk mengetahui konsistensi semen diukur dengan dua cara. Semen yang ada pada semprit diteteskan dari ujung jarum. Jika terjadi gangguan konsistensi maka tetesan membentuk benang yang panjangnya lebih dari 2 cm. Konsistensi juga diukur dengan cara memasukkan tangkai kaca ke dalam semen, kemudian mengamati benang yang terbentuk pada saat tangkai kaca tersebut dikeluarkan. Panjang benang > 2 cm dikatakan abnormal. Semen yang terlalu encer maupun terlalu kental kurang baik bagi sperma. Pada semen yang mempunyai konsitensi tinggi, kecepatan gerak sperma akan terhambat. Dengan demikian, akan mengurangi kesuburan pria tersebut. Sebaliknya, semen yang terlalu encer biasanya mengandung jumlah sperma yang rendah sehingga kesuburan juga berkurang. Pemeriksaan makroskopik yang lain adalah pemeriksaan pH semen tersebut. Cara mengukur pH semen relatif mudah. Setetes semen disebarkan secara merata di atas kertas pH. Setelah 40 detik, warna daerah yang dibasahi akan merata, kemudian dibandingkan dengan kertas kaliberasi untuk dibaca pH-nya. pH semen normal yang diukur dalam waktu satu jam setelah ejakulasi berada dalam kisaran 7,2 sampai 7,8. Jika pH lebih besar dari 7,8 maka dicurigai adanya infeksi. Sebaliknya, jika pH kurang dari 7 pada semen azoospermia, perlu dipikirkan kemungkipan disgenesis vas deferens, vesika seminal, atau epididimis. Mikroskopik Pada pemeriksaan mikroskopik, semen diperiksa morfologi, motilitas, jumlah sperma, adanya sel-sel bukan sperma, dan aglutinasi sperma. Motilitas sperma diperiksa dengan beberapa cara. Dalam beberapa tahun, telah diperkenalkan beberapa cara pemeriksaan ciri gerak sperma manusia yang objektif, termasuk pemotretan jangka waktu (time exposure) dan mikrografi komputer yang menggunakan kamera
video serta cara-cara menggunakan teknologi laser. Cara klasifikasi sederhana yang biasa dipakai adalah bahan semen satu tetes dibubuhkan pada slide dan ditutup dengan gelas penutup. Pemeriksaan dilakukan dengan mikroskop biasa, pembesaran 400 kali, kondensor diturunkan, cahaya minimal, atau memakai mikroskop fase kontras. Pemeriksaan dilakukan pada suhu kamar. Lapangan pandang diperiksa secara sistematik dan motililas sperma yang dijumpai dicatat. Kategori yang dipakai untuk mengklasifikasi motilitas sperma disebut (a), (b), (c), (d), dan didefinisikan sebagai berikut: Kategori (a) jika sperma bergerak cepat dan lurus ke muka. Kategori (b) jika geraknya lambat atau sulit maju lurus atau bergerak tidak lurus. Kategori (c) jika tidak bergerak maju. Kategori (d) jika sperma tidak bergerak. Biasanya empat sampai enam lapangan pandang yang diperiksa untuk memperoleh seratus sperma secara berurutan yang kemudian diklasifikasi sehingga menghasilkan persentase setiap kategori motilitas. Dianjurkan untuk melakukan pemeriksaan ulang dengan tetesan sperma kedua yang diperlakukan dengan tatacara sama. Pemeriksaan mikroskopik berikutnya adalah memeriksa jumlah sperma. Pemeriksaan dilakukan dengan 2 cara, yaitu secara kasar dan penghitungan dalam kamar hitung. Penentuan secara kasar dilakukan dengan menghitung jumlah spermatozoa rata-rata pada beberapa lapangan pandang pembesaran objektif 40 kali, kemudian mengalikan angka tersebut dengan 106. Jika ada 40 sperma/lapangan maka jumlah sperma secara kasar kira-kira 40 juta/ml. Setelah menghitung jumlah sperma secara kasar, dilanjutkan pemeriksaan selular yang bukan sperma. Elemen bukan sperma juga dilihat antara lain sel epitel gepeng dari saluran uretra, sel spermatogenik, dan lekosit. Jumlah sel tersebut ditaksir dalam setiap lapangan pandangan pada sediaan basah seperti penghitungan jumlah sperma. Jika jumlah sel tersebut melebihi 1 juta/ml atau satu setiap lapangan pandangan dengan pembesaran objektif 40 kali, dilakukan pemulasan khusus untuk membedakan antara lekosit yang peroksidase positif dengan sel lain. Jika lekosit lebih dari 1 juta/ml mungkin perlu pemeriksaan untuk menentukan apakah orang tersebut menderita infeksi. Walaupun tidak ada sel lekosit, tidak mengesampingkan kemungkinan infeksi. Pada pemeriksaan mikroskopik berikut diperiksa adanya aglutinasi. Aglutinasi sperma berarti bahwa sperma motil saling melekat kepala dengan kepala, bagian tengah dengan bagian ekor, atau campuran bagian tengah dengan bagian ekor. Melekatnya sperma yang tidak motil atau motil pada benang mukus atau pada sel bukan sperma tidak boleh dicatat sebagai aglutinasi. Adanya aglutinasi merupakan petunjuk, tetapi bukan pasti akan adanya faktor imunologi sebagai penyebab infertilitas. Aglutinasi tidak tergantung banyaknya. Beberapa kelompok kecil sperma yang beraglutinasi sudah dianggap positif. Adanya aglutinasi pada analisis sperma perlu dikonfirmasi dengan uji imunologi MAR.
Uji Biokimiawi Uji biokimiawi dilakukan bila ada kelainan mikroskopik dan makroskopik. Uji biokimia menunjuk kepada fungsi kelenjar asesori, yaitu asam sitrat, gamma glutamil transpeptidase, dan fosfatase asam untuk kelenjar prostat. L. karnitin bebas dan alfa glukosidase untuk epididimis. Kadar petanda atau petanda khas yang rendah menggambarkan fungsi sekresi yang kurang baik, sehingga hal tersebut dipakai untuk menilai fungsi kelenjar asesori laki-laki. Suatu infeksi menyebabkan penurunan sekresi yang besar, tetapi nilai yang diperoleh untuk berbagai petanda masih dalam kisaran nilai normal yang besar. Suatu infeksi juga menyebabkan kerusakan pada epitel sekresi sehingga walaupun telah diberi pengobatan, kemampuan sekresi tetap rendah. Uji biokimiawi semen untuk menilai kemampuan sekresi prostat adalah mengukur kadar seng dan asam sitrat. Sekret kelenjar prostat merupakan bagian yang meliputi 15%-30% dari volume total semen. Sekret kelenjar prostat tidak berwarna, bening, dan bersifat asam lemah (pH 6,5), mengandung banyak sekali asam sitrat serta fosfatase asam11. Kadar seng dan asam sitrat memberi ukuran yang bisa dipercaya tentang sekresi kelenjar prostat. Antara seng, asam sitrat, dan asam fosfatase ditemukan korelasi yang baik, tetapi untuk kemudahannya hanya dua uji pertama yang sering dipakai. Selain pengukuran sekresi prostat, perlu juga dilakukan pemeriksaan kemampuan sekresi vesika seminal. Sekret vesika seminalis ini merupakan komponen yang banyak sekali digunakan untuk indikator dalam menangani kasus infertilitas. Komponen ini pada waktu diejakulasikan berbentuk kental, kaya akan karbohidrat dan protein. Kemampuan sekresi vesika seminal bisa diketahui dengan pengukuran fruktosa. Penentuan fruktosa penting pada kasus duktus deferens, dan merupakan fraksi yang padat dengan spermatozoa. Cairan epididimis ini mengandung banyak sekali lipid dan glikogen. Di samping itu, mempunyai aktivitas fosfatase asam11. Uji biokimia semen untuk mengetahui kapasitas sekresi epididimis adalah pemeriksaan L karnitin. L karnitin bebas memberikan gambaran tentang fungsi sekresi epididimis.
Uji Imunologi Pemeriksaan uji imunologi dilakukan karena kecurigaan adanya antibodi pelapis sperma pada semen tersebut. Antibodi-pelapis sperma merupakan tanda khas dan patognomonik untuk infertilitas yang disebabkan faktor imunologi. Antibodi sperma dalam semen tergolong dua kelas imunologi, yaitu IgA dan IgG. Pengujian terhadap antibodi tersebut dilakukan pada semen segar dan menggunakan cara reaksi antiglobulin campuran , yaitu uji MAR ( Mixed Antislobulin Reaction) atau cara butir imun (Immunobead). Uji MAR IgG dilakukan dengan mencampur semen segar dengan butir lateks atau sel eritrosit biri-biri yang dilapisi dengan IgG manusia. Suatu antiserum IgG manusia yang monospesifik kemudian dibubuhkan kepada campuran tersebut. Terbentuknya gumpalan campuran antara butir dan sperma motil merupakan bukti adanya antibodi IgG pada spermatozoa. Diagnosis infertilitas dengan sebab imunologi merupakan suatu kemungkinan jika 40% atau lebih sperma motil mempunyai partikel yang melekat. Kemungkinan infertilitas karena sebab imunologi perlu dipikirkan jika 10--40% sperma motil mempunyai partikel yang melekat. Uji tambahan seperti uji kontak sperma-getah servik (KSGS) dan titrasi antibodi sperma dalam serum akan memperkuat atau menolak diagnosis. Pemeriksaan imunologi semen yang lain adalah uji butir imun. Uji butir imun dilakukan untuk mengetahui adanya antibodi yang berada di permukaan sperma. Butir imun merupakan bola poliakrilamida dengan imunoglobulin kelinci-anti imunoglobulin manusia yang terikat secara kovalen. Adanya antibodi IgG dan IgA bisa diteliti sekaligus dengan uji ini. Sperma dicuci terlebih dahulu agar terbebas dari cairan semen dengan cara sentrifugasi dan kemudian diresuspensi dalam larutan dapar. Suspensi sperma kemudian dicampur dengan suatu suspensi butir imun. Proporsi sperma dengan antibodi permukaan kemudian ditentukan dan kelas antibodinya (IgG atau IgA) diidentifikasi dengan menggunakan 2 jenis butir imun. Jika uji butir imun positif maka perlu dilakukan uji tambahan seperti uji KSGS dan titrasi antibodi sperma dalam serum untuk memperkuat atau menolak diagnosis. Uji Mikrobiologi Uji mikrobiologi dilakukan jika dicurigai ada infeksi mikroba pada semen tersebut. Semen yang akan dibiakkan dikumpulkan dengan melakukan perhatian khusus untuk mencegah kontaminasi. Sebelum mengumpulkan semen, penderita diminta mengeluarkan kencingnya terlebih dahulu. Segera setelah itu , ia mencuci tangannya dan genitalianya dengan sabun, kemudian membilasnya serta mengeringkannya dengan handuk bersih. Botol semen dalam keadaan steril. Biakan plasma semen membantu menegakkan diagnosis infeksi kelenjar asesori, terutama prostat. Biakan semen dilakukan jika penderita menunjukkan tanda atau gejala infeksi kelenjar asesori atau semen mengandung sel darah putih dalam jumlah lebih 1 juta/ml. Hasil biakan diinterpretasi dengan hati-hati. Uji-uji lain seperti pemeriksaan air seni pertama dan kedua serta cairan prostat yang diperoleh melalui pemijatan prostat dan air seni setelah pemijatan prostat, perlu dilakukan untuk menunjang diagnosis. Juga
perlu dilakukan analisis biokimia semen. Pemeriksaan analisis sperma yang diuraikan tersebut masih menggunakan manual. Otomatisasi Saat ini telah diperkenalkan suatu alat analisis sperma otomatik menggunakan peralatan komputer (Computer-Aided Semen Analysis = CASA). Beberapa tahun terakhir alat ini telah dipakai. Pemeriksaan analisis sperma dengan CASA dapat menghitung konsentrasi sperma, motilitas sperma, dan morfologi sperma. Pengembangan jumlah analisis sperma memungkinkan CASA akan digunakan luas dalam laboratorium analisis semen pada masa yang akan datang. Prosedur ART Analisis sperma banyak dipakai pada teknologi bantu reproduksi (ART). ART adalah teknik bidang kedokteran untuk membantu proses reproduksi dengan cara mengatasi hambatan bertemunya spermatozoa dan oosit, sehingga memungkinkan terjadinya konsepsi pada pasangan infertil. Pelaksanaannya diperlukan persiapan sperma dan analisis berulang-ulang. Ada beberapa alasan cukup kuat mengapa sperma harus dipersiapkan terlebih dahulu sebelum digunakan dalam ART. Plasma semen mengandung faktor yang dapat mengurangi kemampuan fertilisasi spermatozoa. Plasma semen juga mengandung mikroorganisme dan sel-sel lain seperti lekosit yang mensekresi bahan-bahan yang dapat menghambat fertilisasi. Di samping itu, lebih efisien bila dilakukan inseminasi oosit hanya dengan spermatozoa berkualitas baik dan menyingkirkan yang jelek. Hal yang terpenting adalah pemisahan spermatozoa dari seminal plasma akan menginduksi terjadinya kapasitasi. Tujuan metode persiapan sperma adalah pemisahan spermatozoa motil dari plasma semen, dengan hasil tuaian semaksimal mungkin dan kerusakan pada sel spermatozoa seminimal mungkin. Selain itu, hasil persiapan sperma harus sebersih mungkin dari debris. Beberapa metode persiapan sperma adalah pencucian dan renang atas (PRA), swim up, migration gravity sedimentation, albumin column filtration , kolom bertingkat percoll (KBP), dan teknik migrasi ke samping (TMS). Secara rutin di laboratorium ART, metode persiapan sperma PPA dan KBP digunakan untuk inseminasi intra uterin dan fertilisasi in vitro, sedangkan TMS diperlukan untuk ICSI. Proses PRA berdasarkan kemampuan spermatozoa motil untuk migrasi dari endapan plasma semen menuju lapisan atas medium dan proses KBP untuk pemisahan spermatozoa yang berdasarkan pada filtrasi melalui partikel-partikel kolom percoll. Proses TMS berdasarkan kemampuan spermatozoa motil untuk migrasi secara horizontal. Salah satu cara dari ART adalah TAGIT (Tandur Alih Gamet Intra Tuba) atau GIFT (Gamet Intra Fallopian Transfer). Prosedur ini mempertemukan sel benih (gamet), yaitu ovum dan sperma dengan cara menyemprotkan campuran sel benih itu memakai kanul tuba ke dalam bagian ampula. FIV atau bayi tabung adalah usaha fertilisasi yang dilakukan di luar tubuh, di dalam cawan biakan dengan suasana yang mendekati alamiah. Jika berhasil pada saat mencapai stadium morula, hasil fertilisasi ditanduralihkan ke endometrium rongga uterus. Kedua tindakan ini memiliki indikasi dan syarat-syarat tersendiri. Tandur alih gamet intra tuba indikasinya infertilitas
idiopatik, endometriosis ringan, sindroma Rokitansky-Klister-Hauser, tuba satu dengan ovarium kontralateral, infertilitas primer dengan umur di atas 35 tahun, dan oligozoospermia. Syaratnya tuba paten, uterus dan endometrium normal, ovarium berfungsi normal, serta ada sperma yang motil. FIV indikasinya infertilitas primer dengan umur lebih 35 tahun, gagal dengan TAGIT, oklusi tuba bilateral, donasi ovum, sindroma Rokitansky-Kuster-Hauser, infertilitas idiopatik yang gagal dengan TAGIT, dan oligozoospermia. Syaratnya uterus dan endometrium utuh, ovarium masih berfungsi normal, serta ada sperma yang motil. Karena dalam program ini diinginkan beberapa ova sekaligus, maka setiap pasien menjalani pemicuan ovulasi. Yang sering dipakai adalah klomifen dan gonadotropin. Pada keadaan tertentu, misalnya haid tak teratur, peninggian kadar gonadotropin (FSH, LH) dengan ovarium yang normal (sindroma ovarium resisten gonadotropin) dapat diberikan analog GnRH lebih dahulu untuk membendung pada tingkat hipotalamus. Kemudian ovulasi dapat dipacu dengan gonadotropin (dalam hal ini lebih baik dipakai FSH murni). Selama pemicuan ovulasi ini, dilakukan pemantauan secara hormonal terhadap kadar LH, E2, maupun dengan ultrasonografi. Apabila telah dicapai folikel matang dengan ukuran garis tengah 18--20mm dan kadar E2 dalam serum mencapai 1000--1500pg/ml, dilakukan penyuntikan hCG. Hal ini diikuti dengan aspirasi folikel untuk memperoleh beberapa ova, 32--35 jam kemudian3. Jika pasien adalah peserta TAGIT maka pada hari aspirasi folikel, 2-3 jam sebelumnya dilakukan pencucian sperma suami. Sperma ini kemudian diambil yang motil saja untuk bersama-sama dengan ova yang diperoleh dimasukkan ke dalam ampul saluran telur per laporoskopi. Jadi, dalam hal ini tidak dilakukan pembuahan di luar tubuh pasien. Diharapkan fertilisasi di ampula dapat terjadi secara alamiah. Jika pasien mengikuti program FIV, setelah beberapa ovulasi berhasil diperoleh dengan cara pencucian yang serupa, fertilisasi dilakukan di luar tubuh pasien, yaitu di dalam media biakan. Apabila fertilisasi berhasil maka pada stadium morula (8-12 sel), embrio yang sedang tumbuh itu dipindahkan (ditanduralihkan) ke rongga uterus (endometrium) memakai kanul khusus, pada hari ke 3-5 pasca aspirasi folikel. Selanjutnya, pasien diberi substitusi progesteron untuk memberi dukungan pada korpus luteum, sebelum fungsi produksi diambil alih oleh sel-sel trofoblas dari plasenta. Pemantauan terhadap kemungkinan kehamilan dilakukan dengan pemeriksaan hCG darah atau urin. Meskipun teknik ini sangat canggih dan rumit, usaha ini belum tentu memberikan keberhasilan. Di pusat-pusat FIV, keberhasilan sekitar 30-35%. Akhir-akhir ini, teknik FIV menjadi titik perhatian karena cukup banyak aspek yang perlu dipikirkan dan cukup banyak disiplin ilmu yang terlibat. Yang lebih penting lagi, cara ini telah melibatkan banyak aspek hukum dan medikolegal. Analisis semen merupakan tes yang paling penting untuk menetapkan pria infertil. Karena dari analisis semen didapatkan informasi tentang siklus hormon reproduksi pria, spermatogenesis, dan terbukanya saluran repoduksi pria. Disebut azoospermia jika tidak ada spermatozoa sama sekali pada semen yang mungkin disebabkan pretestikuler, tesitikuler, dan post-testikuler. Oligospermia jika paremeter semen lain normal, kecuali jumlah spermatozoa yang jumlahnya di bawah 40 juta/ejakulat atau 20 juta/ml. Astenozoospermia diindikasikan jika motilitasnya
kurang dari 50% yang progresif. Jika abnormalitasnya tunggal, kurang dari 20%, baru dianggap tidak normal. Teratozoospermia jika morfologi abnormal sperma lebih dari 50%. Keadaan ini lebih sering dijumpai sebagai abnormalitas campuran, misalnya oligoastenoteratozoospermia.
Simpan Beku Sperma Dalam penyediaan bahan untuk prosedur ART, terutama yang tertunda, diperlukan simpan beku sperma. Simpan beku sperma adalah penyimpanan sperma pada suhu sangat rendah (-1960C) dalam nitrogen cair. Sebelum dilakukan penyimpanan, sperma terlebih dahulu dicampur cryoprotectant. Sperma yang bisa dilakukan simpan beku meliputi sperma normal, sperma sub-normal, misalnya oligozoospermia ataupun sperma dari epididimis, sperma segar (native semen), atau sperma yang sudah disiapkan (washed semen). Semuanya ini memerlukan analisis sperma. Lingkup penggunaan simpan beku sperma dalam bidang reproduksi antara lain sebagai langkah profilaksis pada tindakan medis yang memungkinkan terjadinya penurunan kuantitas dan atau kualitas sperma dalam derajat yang bermakna, misalnya penggunaan kemoterapi pada kasus keganasan, tindakan pengamanan sperma sebelum dilakukan vasektomi karena kemungkinan terjadinya antibodi-antisperma (ASA), dan post-vasektomi yang dampaknya akan mengganggu kesuburan. Simpan beku sperma juga dilakukan pada kelainan oligozoospermia dengan cara kolektif sehingga bisa didapatkan tuaian lebih banyak dari pemrosesan beberapa ejakulat. Manfaat lain yaitu sebagai sarana pendukung (back up) laboratorium teknik bantu reproduksi, simpan beku sperma diperlukan keberadaannya.
Dalam proses simpan beku sperma, perlu memperhatikan beberapa hal, antara lain faktor laju perubahan suhu saat proses bekuan dan pencairan (thawing) serta konsentrasi cryoprotectant yang digunakan sehingga didapatkan tuaian normal. Cara pembekuan dilakukan perlahan-lahan dengan kecepatan penurunan suhu 10C per menit. Dengan demikian, spermatozoa akan mengalami proses eksoosmosis, yaitu keluarnya air intraseluler sampai terjadinya keseimbangan potensial kimia antara intraseluler dan ekstraseluler. Keluarnya air intraseluler menyebabkan peningkatan konsentrasi solut infra seluler dan menghindarkan toksik efek karena pembentukan es dalam sel. Berkaitan dengan hal tersebut, pada proses pembekuan perlu diperhatikan rentang suhu kritis, yaitu antara 40C sampai 600C. Di sini menggunakan cryoprotectant yang berfungsi memberikan proteksi spermatozoa terhadap suhu rendah sehingga kerusakan sel dapat dihindarkan. Adapun komponen utama cryoprotectant adalah gliserol yang mekanisme proteksinya adalah sebagai berikut: (1) menurunkan titik beku solut intraseluler; (2) interaksi dengan membran sel yang menyebabkan perubahan dari relatif cair menjadi kaku selama pembekuan; serta (3) mencegah terjadinya perubahan konsentrasi elektrolit intrasel dan ekstrasel dengan cara mengikat elektrolit dan sebagian air. Karena itu, konsentrasi tertentu dari gliserol, yaitu 7%, memberikan hasil yang terbaik. Digunakan thawing yang merupakan salah satu tahapan pekerjaan simpan beku, yaitu pengambilan sampel di mana terdapat peleburan dari kondisi beku menuju cair. Sampel sperma beku relatif toleran terhadap perubahan suhu saat thawing, bisa dengan kecepatan perubahan suhu 150C per menit. Yang perlu diperhatikan adalah suhu kritis saat thawing, yaitu antara 700C sampai 200C11. Setelah pencairan sperma, diperlukan analisis sperma untuk evaluasi jumlah dan viabilitasnya. Daftar Pustaka 1. Demers LM, In Vitro Fertilization and Assisted Reproductive Technologies, Biotech Lab International, March-April 2000 2. Arsyad KM, Penatalaksanaan Infertilitas Masa Kini, Dexa Media, No.4 Vol.? Agustus-November 1994, hal 6-11. 3. Jacoeb TZ, Teknik Penanganan Pasangan Infertil Sampai Fertilisasi In Vitro, hal 173-94 4. Anonymous, Penuntun Laboratorium WHO untuk Pemeriksaan Semen Manusia dan Interaksi Semen Getah Serviks, Balai Penerbit FKUI, Perkumpulan Andrologi Indonesia, Perkumpulan Kontrasepsi Mantap Indonesia, Jakarta, 1988 hal 1-504. 5. Hinting A, Penatalaksanaan Infertilitas Pria: Standarisasi dan Permasalahan, Lab Biomedik, FK Unair, Surabaya hal 1-11 6. Bhatia V, Current Synopsis of Male Infertility Part 1: Aetiology and Investigations, Medical Progress October 1999, pp 8-12 7. Sarkar S, Andrology Laboratory and Fertility Assessment, In: Henry JB, Clinical Diagnosis and Management by laboratory Methods, pp 507-14 8. Baker HWG, WHO Standardised Methods of Semen Analysis: 1999 Edition, University of Melbourne Departement of Obstetrics and Gynaecology The Royal Women's Hospital, Cariton 430543 Victoria, Australia, pp 1-3 9. Sono OP, Uji Biokimia pada Semen Manusia, Lab. Biomedik FK Unair Surabaya, hal 1-4 10. Baker HWG, Computer-Aided Semen Analysis, University of Melbourne Departement of Obstetrics and Gynaecology The Royal Women's Hospital,
Cariton 430543 Victoria, Australia, pp 1-4 11. Moeloek N, Proses Reproduksi, Kesuburan dan Seks Pria dalam Perkawinan , FKUI, Jakarta, 1985, hal 1-235 12. Winarso H, Simpan Beku Sperma Manusia, Post Graduate Course Penatalaksanaan Infertilitas Pria dan Analisis Semen di Surabaya, tanggal 22-23 Oktober 1999, hal 1-8 13. Chang YS, Male Infertility and Microfertilisation , Medical Progress January 1999, pp 11-3 14. Bhatia V, Male Factor Infertility Part 2: Management, Medical Progress November 1999, pp 25-7 15. Baker HWG, Basic Research in Male Infertility, University of Melbourne Departement of Obstetrics and Gynaecology The Royal Women's Hospital, Cariton 430543 Victoria, Australia, pp 1-3 16. Arsyad KM, Terapi Medis Infertilitas Pria, Subbag Andrologi Biologi Reproduksi, Bag Biologi Medik FKUniversitas Sriwijaya, hal 1-10 17. Baker HWG, Future of the Treatment of Male Infertility, University of Melbourne Departement of Obstetrics and Gynaecology The Royal Women's Hospital, Carton 430543 Victoria, Australia, pp 1-3 18. Lunardhi H, Persiapan Sperma pada ART, Laboratorium Biomedik Fakultas Kedokteran Universitas Airlangga, Surabaya, hal 1-9 19. Hinting A, Assisted Reproductive Technology pada Infertilitas Pria, Laboratorium Biomedik, FK Unair, Surabaya, hal 1-5 20. Susilawati T, Evaluasi Kapasitasi dan Reaksi Akrosom, Post Graduate Course Penatalaksanaan Infertilitas Pria dan Analisis Semen di Surabaya , tanggal 22-23 Oktober 1999, hal 1-10 21. Soebadi DM, Teknik Pengambilan Sperma Epididimis dan Testis pada Azoospermia, SMF Urologi Lab. Ilmu Bedah RSUD dr. Soetomo FK Unair, 1999, hal 1-10 22. Moeloek N, Aspek Endokrinologi Infertilitas Pria, Bagian Biologi Fakultas Kedokteran Universitas Indonesia, Jakarta hal 1-10 23. Adimoelja A, Aspek Disfungsi Ereksi dan Ejakplasi, Pelatihan Penatalaksanaan Infertilitas Pria dan Analisis Semen, Hotel Santika Surabaya, 22-23 September 1999, hal 1-5 24. Simorangkir DR, Morfologi Mikroskopis Testis Manusia: Normal dan Kelainan, Pelatihan Penatalaksanaan Infertilitas
You might also like
- Teknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)From EverandTeknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Rating: 5 out of 5 stars5/5 (2)
- Etika Moral Akhlak Diskusi KelompokDocument2 pagesEtika Moral Akhlak Diskusi KelompokAlpasca Firdaus62% (29)
- ANALISIS SPERMA TERBARUDocument24 pagesANALISIS SPERMA TERBARUShamsulNo ratings yet
- Referat Forensik SilviaDocument36 pagesReferat Forensik SilviaMikhail HalimNo ratings yet
- Tes Kesuburan Pria Dan WanitaDocument4 pagesTes Kesuburan Pria Dan WanitaPutri SandewiNo ratings yet
- ASUHAN KEBIDANAN PADA INFERTILDocument15 pagesASUHAN KEBIDANAN PADA INFERTILYenny ArmayantiNo ratings yet
- Analisis SemenDocument11 pagesAnalisis SemenDila Pramitha Sukmana PutriNo ratings yet
- Analisis SemenDocument7 pagesAnalisis SemenEka SuciawatiNo ratings yet
- Pemeriksaan Infertilitas Pada PerempuanDocument43 pagesPemeriksaan Infertilitas Pada PerempuanP17312215128 AMALIA QUTHURUN NADA100% (1)
- Cek SpermaDocument3 pagesCek SpermaSepti WidhiawatiNo ratings yet
- Penilaian Morfologi SpermaDocument9 pagesPenilaian Morfologi SpermadudududiduNo ratings yet
- Penilaian Morfologi Sperma Menurut Kriteria WHO Dan StrictDocument11 pagesPenilaian Morfologi Sperma Menurut Kriteria WHO Dan StrictdudududiduNo ratings yet
- FertilitasDocument26 pagesFertilitasDewi HandayaniNo ratings yet
- Makalah SpermaDocument28 pagesMakalah SpermaRismayanti SyamsulNo ratings yet
- PTM ViiDocument50 pagesPTM Viibz6dt4ttpbNo ratings yet
- Analisa Kasus ReproduksiDocument17 pagesAnalisa Kasus ReproduksiDita Ayu SyahfitriNo ratings yet
- Infertilitas PrimerDocument10 pagesInfertilitas PrimerYoan KapressyNo ratings yet
- LBM 4 KB - Step 7Document19 pagesLBM 4 KB - Step 7Mukhamad Arif MunandarNo ratings yet
- Buku InfertilitasDocument28 pagesBuku InfertilitasmuthiaNo ratings yet
- Analisis Semen dan SpermaDocument2 pagesAnalisis Semen dan Spermacynthia_bakrieNo ratings yet
- Teksam Bab IIDocument6 pagesTeksam Bab IIIi Iftah AzizahNo ratings yet
- Referat InfertilitasDocument10 pagesReferat InfertilitasRdindaaNo ratings yet
- Infertilitas Pada PriaDocument10 pagesInfertilitas Pada PriaSi Lala100% (1)
- Pemeriksaan Fisik InfertilitasDocument7 pagesPemeriksaan Fisik InfertilitasputriNo ratings yet
- PEMERIKSAAN TAMBAHAN FERTILITASDocument15 pagesPEMERIKSAAN TAMBAHAN FERTILITASHastia 660No ratings yet
- Infertilitas Hui - UnismaDocument52 pagesInfertilitas Hui - Unismaresa hardodiantoNo ratings yet
- Asuhan Kebidanan Pada Infertil (HAND OUT)Document11 pagesAsuhan Kebidanan Pada Infertil (HAND OUT)Larasanthi Komala DewiNo ratings yet
- Kasus 2 PBLDocument42 pagesKasus 2 PBLTeguh YudhaNo ratings yet
- Bahan Oa2Document8 pagesBahan Oa2Desi NataliaNo ratings yet
- Bab IiDocument11 pagesBab IiMar DiahNo ratings yet
- Laporan Praktikum Patologi Klinik Almas 2Document19 pagesLaporan Praktikum Patologi Klinik Almas 2ain bustonNo ratings yet
- Flebotomi Sampel SpermaDocument17 pagesFlebotomi Sampel SpermaAfrizal DocNo ratings yet
- Materi Fertilitas + SumberDocument19 pagesMateri Fertilitas + SumberCindy AnggraeniNo ratings yet
- Promil Periksa Apa SajaDocument28 pagesPromil Periksa Apa Sajasy_ajoekoeNo ratings yet
- InfertilitasDocument30 pagesInfertilitasNila Lumiere100% (2)
- InfertilitasDocument11 pagesInfertilitasMuhammad YahyaNo ratings yet
- Infertilitas Diagnosis dan PenatalaksanaanDocument14 pagesInfertilitas Diagnosis dan PenatalaksanaanRereNo ratings yet
- Bab 1Document39 pagesBab 1Eka DevianyNo ratings yet
- Penilaian Hasil Pemeriksaan SemenDocument24 pagesPenilaian Hasil Pemeriksaan SemenLuluNo ratings yet
- Makalah Infertilitas Blok 25Document13 pagesMakalah Infertilitas Blok 25Chandra Franata100% (1)
- Asuhan Kebidanan Pada InfertilDocument13 pagesAsuhan Kebidanan Pada InfertilGita GrayesaNo ratings yet
- Fertilitas dan Pemeriksaan TambahanDocument15 pagesFertilitas dan Pemeriksaan TambahanAras PinantiNo ratings yet
- ANALISIS SEMEN DAN SIKLUS REPRODUKSIDocument22 pagesANALISIS SEMEN DAN SIKLUS REPRODUKSIFakhri Al- AzhariNo ratings yet
- Tes FragmentasiDocument55 pagesTes FragmentasiekasyamputraNo ratings yet
- Daftar PenyakitDocument71 pagesDaftar PenyakitDyne Soraya LathifahNo ratings yet
- Laporan Pemeriksaan SpermaDocument9 pagesLaporan Pemeriksaan Spermalarasti putriNo ratings yet
- AaaaaDocument18 pagesAaaaaRudi Anz AnsyahNo ratings yet
- Pandangan Islam Mengenai InfertilitasDocument6 pagesPandangan Islam Mengenai InfertilitasViyu EmiliaNo ratings yet
- MENGAPA BAYI TABUNGDocument16 pagesMENGAPA BAYI TABUNGLulu CarmitaNo ratings yet
- Askep Pada Klien Dengan Infertilitas 1Document37 pagesAskep Pada Klien Dengan Infertilitas 1Amar AkbarNo ratings yet
- Inseminasi Intra Uterine".Document16 pagesInseminasi Intra Uterine".Vino G Albert100% (1)
- Makroskopis SpermaDocument8 pagesMakroskopis SpermaPG TKNo ratings yet
- ANALISIS SPERMADocument11 pagesANALISIS SPERMAResepsionis BIODIKANo ratings yet
- Modul MKPD SteroidogenesisDocument30 pagesModul MKPD SteroidogenesisPutri Nur AidaNo ratings yet
- 2.1 MakalahDocument4 pages2.1 MakalahDinda A. LestariNo ratings yet
- SEBAB INFERTILITASDocument13 pagesSEBAB INFERTILITASSuciPurnamarzaNo ratings yet
- Askeb Infertil PrimerDocument11 pagesAskeb Infertil PrimerFahri Furqan0% (1)
- Kualitas Sperma Menjadi Penyebab KemandulanDocument9 pagesKualitas Sperma Menjadi Penyebab KemandulanminchazaNo ratings yet
- Pemeriksaan Tambahan Fertilitas Kelompok 3Document3 pagesPemeriksaan Tambahan Fertilitas Kelompok 3Husniah TaswinNo ratings yet
- Mikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaFrom EverandMikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaRating: 2.5 out of 5 stars2.5/5 (2)
- Mikrobiologi Medis I: Patogen dan Mikrobioma ManusiaFrom EverandMikrobiologi Medis I: Patogen dan Mikrobioma ManusiaRating: 4 out of 5 stars4/5 (11)
- Monitoring HemodinamikDocument68 pagesMonitoring Hemodinamikmuhrival.doc100% (5)
- TranslateDocument9 pagesTranslateAlpasca FirdausNo ratings yet
- EpistaksisDocument12 pagesEpistaksisLeo KolongNo ratings yet
- PBL 2 18Document36 pagesPBL 2 18Alpasca FirdausNo ratings yet
- Tumbuh Kembang NormalDocument3 pagesTumbuh Kembang NormalAlpasca FirdausNo ratings yet
- P ('t':3) Var B Location Settimeout (Function (If (Typeof Window - Iframe 'Undefined') (B.href B.href ) ), 15000)Document1 pageP ('t':3) Var B Location Settimeout (Function (If (Typeof Window - Iframe 'Undefined') (B.href B.href ) ), 15000)Alpasca FirdausNo ratings yet
- ABSES PERIODONTALDocument13 pagesABSES PERIODONTALLaila Fitrotuz ZahrohNo ratings yet
- P ('t':3) Var B Location Settimeout (Function (If (Typeof Window - Iframe 'Undefined') (B.href B.href ) ), 15000)Document1 pageP ('t':3) Var B Location Settimeout (Function (If (Typeof Window - Iframe 'Undefined') (B.href B.href ) ), 15000)Alpasca FirdausNo ratings yet
- Soal HypoxiaDocument3 pagesSoal HypoxiaAlpasca FirdausNo ratings yet
- Interpretasi APGAR ScoreDocument4 pagesInterpretasi APGAR ScoreAlpasca FirdausNo ratings yet
- Teori PengetahuanDocument12 pagesTeori PengetahuanIswadiNo ratings yet
- Cover Knrio DDocument3 pagesCover Knrio DAlpasca FirdausNo ratings yet
- Tumbuh Kembang NormalDocument3 pagesTumbuh Kembang NormalAlpasca FirdausNo ratings yet
- Penyakit Membran Hialin (RDS)Document13 pagesPenyakit Membran Hialin (RDS)Alpasca FirdausNo ratings yet
- AbortusDocument6 pagesAbortusAlpasca FirdausNo ratings yet
- SOALDocument8 pagesSOALAlpasca FirdausNo ratings yet
- Tumbuh Kembang NormalDocument3 pagesTumbuh Kembang NormalAlpasca FirdausNo ratings yet
- Buku Pintar Obstetri GinekologiDocument18 pagesBuku Pintar Obstetri GinekologiAlpasca FirdausNo ratings yet
- Buku Pintar Obstetri GinekologiDocument18 pagesBuku Pintar Obstetri GinekologiAlpasca FirdausNo ratings yet
- Buku Pintar Obstetri GinekologiDocument18 pagesBuku Pintar Obstetri GinekologiAlpasca FirdausNo ratings yet
- Buku Pintar Obstetri GinekologiDocument18 pagesBuku Pintar Obstetri GinekologiAlpasca FirdausNo ratings yet
- Pemeriksaan Fisik Ibu HamilDocument20 pagesPemeriksaan Fisik Ibu HamilRidwan Conan86% (7)
- PraktikumDocument4 pagesPraktikumAlpascaFirdausNo ratings yet
- Pemeriksaan Fisik Ibu HamilDocument20 pagesPemeriksaan Fisik Ibu HamilRidwan Conan86% (7)
- AbortusDocument6 pagesAbortusAlpasca FirdausNo ratings yet
- PraktikumDocument4 pagesPraktikumAlpascaFirdausNo ratings yet
- LI-Daus Pre EclampsiaDocument5 pagesLI-Daus Pre EclampsiaAlpasca FirdausNo ratings yet
- Laporan TutorialDocument2 pagesLaporan TutorialAlpasca FirdausNo ratings yet