Professional Documents
Culture Documents
2 Enzym Bases
Uploaded by
Khyarhoum BrahimOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
2 Enzym Bases
Uploaded by
Khyarhoum BrahimCopyright:
Available Formats
Licence - Unit d'Enseignement 1 - Travaux dirigs d'Enzymologie N1 - E.
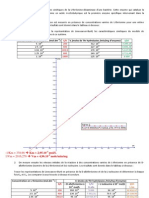
JASPARD (Vitesse initiale - L'quation de Michaelis-Menten - Vmax, Km, kcat) Exercice N1. Une enzyme E catalyse la raction d'hydrolyse: A + H2O <=====> B + C On suit la cintique d'apparition du produit C, pour diffrentes concentrations en substrat A. Les valeurs obtenues (en moles de C par tube) sont prsentes dans le tableau suivant: temps (min) 0 2,5 5 7,5 12,5 17,5 [S0] (mM) 30 100 0 0 1,9 3,2 3,9 6,4 5,6 9,6 7,6 15,2 9,1 18,3
10 0 0,9 1,8 2,5 3,7 4,4
150 0 3,6 7,1 10,7 17,6
1. Reprsentez les cintiques et dterminez la vitesse initiale de chacune d'elle. Dans quelle condition de concentration du substrat A s'est-on plac pour suivre ces cintiques? Pourquoi ne se procupe-t-on pas de la concentration de l'eau ? 2. Tracez la courbe de saturation et commentez la. Dterminez les paramtres cintiques de l'enzyme partir de cette reprsentation. 3. Dterminez les paramtres cintiques l'aide de la reprsentation des double inverses. Expliquez la diffrence entre les valeurs dtermines partir de ces deux reprsentations. 4. Les ractions enzymatiques sont effectues dans un tube contenant 1 ml de la solution d'enzyme une concentration initiale de 3 M, le volume ractionnel tant complt par 2 ml de substrat dans le tampon appropri. Calculez les valeurs des paramtres cintiques (exprimez la concentration en molarit). 5. Une unit d'enzyme (U) est la quantit qui hydrolyse 1 mole de substrat par minute. Par ailleurs, l'activit spcifique d'une enzyme est le rapport de l'activit maximale de l'enzyme sa concentration (exprime en mg/ml) dans le milieu ractionnel. Enfin, la masse molaire de l'enzyme E est de 100.000 dalton. Calculez l'activit spcifique en U.mg-1. 6. On considre que l'enzyme a t totalement purifie. Calculez la valeur de la constante catalytique (kcat) en s-1. 7. Si l'enzyme E est une enzyme dite "Michaelienne", quelle constante du schma ractionnel classique pour une telle enzyme correspond cette constante ? Expliquez-en les units. Retrouvez les units de Km sur la base de celles des constantes de vitesse k1, k-1 et k2. Exercice N2. L'tude prliminaire de l'activit de deux enzymes (E1 et E2) vis--vis du mme substrat donne les rsultats suivants: [S0] (mM) E1: vi (M.min -1) E2: vi (M.min -1) 1 0,040 0,270 2 0,078 0,280 3 0,124 0, 275 4 0,160 0,280 5 0,205 0,285
Tracez la courbe vi = f([S0]). Quelles conclusions pouvez-vous en tirer ? Exercice N3. La phosphatase alcaline catalyse l'hydrolyse des esters de l'acide ortho-phosphorique. Pour suivre l'activit enzymatique, on utilise un substrat synthtique, le paranitrophnol-phosphate (M. M. = 371 g.mol-1) qui libre du paranitrophnol (M. M. = 139 g.mol-1) qui absorbe 410 nm avec un coefficient d'extinction pondral: 1% = 1260 g-1.100 mL.cm-1. Chaque raction est effectue dans un volume ractionnel de 10 ml contenant 0,2 ml d'enzyme une concentration initiale de 10 mg/ml. On obtient les rsultats suivants (longueur du trajet optique = 1 cm): [S0] (mg/tube) vi (unit DO.min-1) 0 0 0,26 0,39 0,65 1,50 1,95 3,80 0,147 0,167 0,190 0,212 0,231 0,238
Dterminez les valeurs des paramtres cintiques de cette enzyme vis--vis de ce substrat (on exprimera la concentration en molarit). Calculez l'activit spcifique de l'enzyme avec l'unit de concentration prcise dans l'exercice N1. Exercice N4: (Epreuve TD de Biochimie - Janvier 1999 - 4 points) D'une part, on a purifi une isomrase. D'autre part, on a clon la squence codant cette isomrase dans un vecteur d'expression et transform des bactries. On a fait une culture de ces bactries et induit la synthse protique. Enfin, de l'extrait brut bactrien obtenu, une enzyme recombinante a t purifie que l'on appelle l'enzyme inconnue (Einc). On tudie la raction d'isomrisation d'un substrat S en un produit P, en prsence: - 1re exprience: de l'isomrase seule; - 2me exprience: de l'isomrase ET de l'enzyme inconnue. Pour chaque exprience, on mesure la vitesse initiale de la raction (exprime en nM.s-1) pour diffrentes concentrations [S0] du substrat. Les rsultats sont rsums dans le tableau suivant: vi (nM.s-1) [S0] (M) 0,2 0,4 1 2 1re exprience: [Isomrase] = 10 pM 1,2 1,6 2,1 2,3 2 exprience: [Isomrase] = 10 pM + [Einc] = 10 pM 2,4 3,2 4,2 4,6
1. Pour chaque exprience, dterminez les paramtres cintiques Vmax et KM, partir de la reprsentation graphique de votre choix. Il n'est pas ncessaire de tracer les courbes de saturation. 2. Calculez la valeur de la constante catalytique de l'isomrase (kcatIso). On a dtermin la constante catalytique de l'enzyme inconnue: kcatEinc = 15360 min-1. 3. Un seul paramtre cintique diffre entre les 2 expriences (d'un facteur 2). Lequel et pourquoi ? 4. En conclusion, l'enzyme inconnue dont le gne a t clon est-elle bien l'isomrase ?
You might also like
- TD N1 Enzymologie PR ChernaneDocument2 pagesTD N1 Enzymologie PR ChernaneZineb Dahmani100% (1)
- TD1 CorrigeDocument12 pagesTD1 CorrigeLinda KoundziNo ratings yet
- Enzymologie Et BioénergétiqueDocument15 pagesEnzymologie Et BioénergétiqueZorba ZorbaNo ratings yet
- Chapitre 2 La Cinétique EnzymatiqueDocument15 pagesChapitre 2 La Cinétique EnzymatiqueAbdouli RoukayaNo ratings yet
- TD2 CorigesDocument15 pagesTD2 CorigesDjawed BoutNo ratings yet
- SVI4-M21-Enzymologie Et Biochimie Métabolique-Polycopié TP InvertaseDocument12 pagesSVI4-M21-Enzymologie Et Biochimie Métabolique-Polycopié TP InvertaseSioud Besma50% (2)
- Fiche TD Enzymologie Réactions Enzymatiques - CopieDocument2 pagesFiche TD Enzymologie Réactions Enzymatiques - Copiebenali anfalNo ratings yet
- Exercices Diriges Enzymologie 2011 2012Document8 pagesExercices Diriges Enzymologie 2011 2012alphonse198867% (3)
- TD Série 2 EnzymologieDocument3 pagesTD Série 2 EnzymologieAzzeddine KhartaNo ratings yet
- Voir Un Cours Sur Les Paramètres Cinétiques Des Réactions Ctalysées Par Les EnzymesDocument4 pagesVoir Un Cours Sur Les Paramètres Cinétiques Des Réactions Ctalysées Par Les EnzymesLAMINE DEGUISTARNo ratings yet
- Exercice Enzymologies INTERNET CORRECTIONDocument7 pagesExercice Enzymologies INTERNET CORRECTIONabdel krim100% (1)
- Exercices de Biochimie Métabolique: TweeterDocument7 pagesExercices de Biochimie Métabolique: TweeterLAMINE DEGUISTARNo ratings yet
- Modèle de Correction Des TPDocument4 pagesModèle de Correction Des TPFatima Ezzahra JayedNo ratings yet
- TP BiochDocument31 pagesTP BiochRoberta Vasques100% (3)
- Cinetique ExercicesDocument15 pagesCinetique ExercicesAyyoub Dahbi100% (1)
- TD3 CorrigesDocument18 pagesTD3 CorrigesDjawed BoutNo ratings yet
- Emd Enzymo AppDocument1 pageEmd Enzymo AppSam Épse RbiNo ratings yet
- TD1 EnzymologieDocument7 pagesTD1 EnzymologieasmaNo ratings yet
- Cours de Biochimie: Enzymologie ApprofondieDocument90 pagesCours de Biochimie: Enzymologie ApprofondieTemtem HmNo ratings yet
- Compilés EnzymologieDocument5 pagesCompilés EnzymologieHadrien De GreefNo ratings yet
- Sujet Enzymologie 2Document2 pagesSujet Enzymologie 2daly6868No ratings yet
- TD 2 D'enzymologieDocument3 pagesTD 2 D'enzymologieabdel krim100% (2)
- Correction TD 2Document6 pagesCorrection TD 2Linda KoundziNo ratings yet
- TD 3 Cinétique 1SDocument2 pagesTD 3 Cinétique 1SRadjaa Add100% (1)
- TSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Document3 pagesTSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Chris Zericho0% (3)
- Support Correction TD Enzymologie L3 2019-2020 - Sans Exo 5Document26 pagesSupport Correction TD Enzymologie L3 2019-2020 - Sans Exo 5Jean Luc KonanNo ratings yet
- Cinétique EnzymatiqueDocument39 pagesCinétique EnzymatiqueMjaied SawsenNo ratings yet
- Correction Des Compte Rendus de TP - EnzymologieDocument6 pagesCorrection Des Compte Rendus de TP - EnzymologieErnesto Che GuevaraNo ratings yet
- Examin EnzymologieDocument2 pagesExamin Enzymologiekhmaj9792100% (1)
- TD 4Document1 pageTD 4Fatïma ZohraNo ratings yet
- 04-Interaction Protéine LigandsDocument10 pages04-Interaction Protéine LigandsKhadidja SellaiNo ratings yet
- TD 4 Avec SolutionDocument6 pagesTD 4 Avec Solutionmistic JayNo ratings yet
- TP de L'invertaseDocument11 pagesTP de L'invertaseDrissZaoui82% (11)
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- Examen 2017 Ratt CorrigeDocument10 pagesExamen 2017 Ratt Corrigefawzi badiNo ratings yet
- Voir Un Cours Sur Les Inhibition Des Réactions EnzymatiquesDocument3 pagesVoir Un Cours Sur Les Inhibition Des Réactions EnzymatiquesbobNo ratings yet
- Corrigé-Type TD 3 - SuiteDocument14 pagesCorrigé-Type TD 3 - Suitebiochimie L3No ratings yet
- Les OpéronsDocument13 pagesLes OpéronsSOO BABA100% (1)
- Terpènes Et Biosynthèse TerpéniqueDocument15 pagesTerpènes Et Biosynthèse TerpéniqueRẵmîRandyHassad100% (1)
- Dosage Des ProteinesDocument25 pagesDosage Des ProteinesOussama MokretarNo ratings yet
- ChapI ENZYMOLOGIE COENZYMES ET VITAMINESDocument49 pagesChapI ENZYMOLOGIE COENZYMES ET VITAMINESbessama84100% (2)
- TD 06Document3 pagesTD 06LAMINE DEGUISTAR100% (1)
- Serie9 Exos PDFDocument2 pagesSerie9 Exos PDFrahmani67% (3)
- TD3 de Techniques D'analyse BiologiquesDocument2 pagesTD3 de Techniques D'analyse BiologiquesMelissa BaloulNo ratings yet
- TD4 AaDocument4 pagesTD4 AaRadia Kadi100% (1)
- Exercice EnzymologieDocument6 pagesExercice EnzymologieXuan Carpentier100% (1)
- Compte Rendu TP - EnzymesDocument5 pagesCompte Rendu TP - Enzymesapi-26003185250% (2)
- TD 1 ChromatographieDocument16 pagesTD 1 Chromatographienassima chenikha0% (1)
- Série N°3Document3 pagesSérie N°3lmd2009No ratings yet
- Corrigé de Lexamen de Remplacement de Biochimie 2017 Final PDFDocument5 pagesCorrigé de Lexamen de Remplacement de Biochimie 2017 Final PDFZineb DahmaniNo ratings yet
- Compte Rendu TP TABDocument4 pagesCompte Rendu TP TABAnia Izariren100% (3)
- Corrigé de L'examen de Remplacement de Biochimie (2016)Document7 pagesCorrigé de L'examen de Remplacement de Biochimie (2016)elhidhab2014No ratings yet
- Corrigé de Lexamen de Biochimie 2016 PDFDocument4 pagesCorrigé de Lexamen de Biochimie 2016 PDFAbdellah Ait SoussNo ratings yet
- BIOENERGETIQUE SNP 22-23 CorrigeDocument1 pageBIOENERGETIQUE SNP 22-23 CorrigeZahra IdNo ratings yet
- TD 3 de BiochimieDocument5 pagesTD 3 de BiochimieRich HoulrichNo ratings yet
- Biochimie Approfondie TD 4Document4 pagesBiochimie Approfondie TD 4Alhassane BahNo ratings yet
- TD Corrigé 05Document12 pagesTD Corrigé 05amine cheurfaNo ratings yet
- TD Enzymologie 02Document4 pagesTD Enzymologie 02kayleadzbNo ratings yet
- Enzymologie Approf TD3 2024Document2 pagesEnzymologie Approf TD3 2024issaalimahamat1998No ratings yet
- TD 2 EnzymologieDocument3 pagesTD 2 Enzymologieines znetiNo ratings yet
- Bio Cell 6Document5 pagesBio Cell 6Khyarhoum BrahimNo ratings yet
- A 1056 FDocument213 pagesA 1056 FKhyarhoum BrahimNo ratings yet
- PolycopiéCoursn°1Document4 pagesPolycopiéCoursn°1Khyarhoum BrahimNo ratings yet
- La BiosécuritéDocument27 pagesLa BiosécuritéKhyarhoum Brahim100% (1)
- TP GramDocument7 pagesTP Gramoussama_8894% (77)
- Cadre Juridique Et Réglementaire de L UNIVERSITE DE NOUAKCHOTTDocument146 pagesCadre Juridique Et Réglementaire de L UNIVERSITE DE NOUAKCHOTTKhyarhoum BrahimNo ratings yet
- DS04 CDocument10 pagesDS04 CbaatoutmbNo ratings yet
- TD Meca Reactionnelscorrige PDFDocument13 pagesTD Meca Reactionnelscorrige PDFAyyoub Dahbi100% (1)
- Cours M2 PINGPONGDocument8 pagesCours M2 PINGPONGAllah Beurem BonheurNo ratings yet
- Chapitre 3 - Mécanisme RéactionnelDocument5 pagesChapitre 3 - Mécanisme RéactionnelBeatrice Florin100% (2)
- Cinetique Enz.a 2 Sub1Document14 pagesCinetique Enz.a 2 Sub1Mira45No ratings yet
- Controle de Cinétique 2019 2020 Avec CorrigéDocument7 pagesControle de Cinétique 2019 2020 Avec CorrigéMy ProofNo ratings yet
- Cours - Biopharmacie Et Pharmacocinétique - Quatrième Partie - GPH - 2023-2024Document3 pagesCours - Biopharmacie Et Pharmacocinétique - Quatrième Partie - GPH - 2023-2024fatahaymenrowNo ratings yet
- Chapitre II Mécanisme RéactionnelDocument14 pagesChapitre II Mécanisme RéactionnelBENZEKRIBENALLOU MokhtarNo ratings yet
- But Du TPDocument12 pagesBut Du TPGüzęl Bârãæ100% (1)
- Controle de Rattrapage de Cinétique 2019 2020 Avec CorrigéDocument7 pagesControle de Rattrapage de Cinétique 2019 2020 Avec CorrigéMy ProofNo ratings yet
- Cours - Chimie - RESUME CINETIQUE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni SahbiDocument3 pagesCours - Chimie - RESUME CINETIQUE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni SahbiKais Ben Aicha100% (2)
- Fichier Produit 2658Document4 pagesFichier Produit 2658FlorinaNo ratings yet
- GCH 2006 Calcul Des Reacteurs Chimiques Cours PDFDocument16 pagesGCH 2006 Calcul Des Reacteurs Chimiques Cours PDFsettou bouthGpNo ratings yet
- TD (1) Cinétique ChimieDocument3 pagesTD (1) Cinétique ChimieAnass ZaouiNo ratings yet
- TD 5: Cinétique Enzymatique (Première Partie) : Exercice 1Document1 pageTD 5: Cinétique Enzymatique (Première Partie) : Exercice 1sebsebaa77No ratings yet
- Cinetique ChimiqueDocument29 pagesCinetique ChimiqueChrist FiagreNo ratings yet
- Chapitre I RHDocument16 pagesChapitre I RHMalek SaidaouiNo ratings yet
- Cours 3 Cinétique Khenifi-ConvertiDocument6 pagesCours 3 Cinétique Khenifi-ConvertiÑar ĎjesNo ratings yet
- Chap 3 Mécanismes RéactionnelsDocument37 pagesChap 3 Mécanismes Réactionnelsfadoua lakouissiNo ratings yet
- TP GDRDocument11 pagesTP GDRLAGP18 Grp03No ratings yet
- CoursdecintiqueDocument85 pagesCoursdecintiquepelamimarie100% (1)
- Cours Cinéique UM6P 20 - 21Document57 pagesCours Cinéique UM6P 20 - 21Hifdi AyaNo ratings yet
- Chapitre3cinetique FormelleDocument37 pagesChapitre3cinetique FormellestefanNo ratings yet
- Cinetique Chimique PDFDocument21 pagesCinetique Chimique PDFياسين السعدانيNo ratings yet
- BCPST1 chpII-cinétiq 2022Document10 pagesBCPST1 chpII-cinétiq 2022Fannes DesignNo ratings yet
- 1S-T1.2Modélisation Et Suivi D'une Transformation Chimique Et Titrage ColorimétriqueDocument4 pages1S-T1.2Modélisation Et Suivi D'une Transformation Chimique Et Titrage ColorimétriqueAlejandra Lorite AbadNo ratings yet
- Cours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARDocument53 pagesCours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARLi NaNo ratings yet
- TD+Corr Série 5Document6 pagesTD+Corr Série 5ismailmoudziri7No ratings yet
- Voir L'énoncé.: Enzymologie N°1 Vitesse Initiale - L'équation de Michaelis-Menten - Paramètres Cinétiques: V, K, KDocument2 pagesVoir L'énoncé.: Enzymologie N°1 Vitesse Initiale - L'équation de Michaelis-Menten - Paramètres Cinétiques: V, K, KLAMINE DEGUISTARNo ratings yet