Professional Documents
Culture Documents
Lab4 QI
Uploaded by
Oliver Matias LlanosOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Lab4 QI
Uploaded by
Oliver Matias LlanosCopyright:
Available Formats
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Laboratorio N 4
Qumica Industrial I
Equilibrio Inico (Parte I)
I. Objetivos
Realizar el estudio de un aspecto muy importante en el equilibrio heterogneo;
que se refiere a sales poco solubles.
Determinar el pH de soluciones acuosas empleando indicadores cidos-bsicos
y de soluciones que se hidrolizan.
Determinar la concentracin de cidos y bases por volumetra.
II. Fundamento terico
Los compuestos solubles en agua pueden clasificarse como electrolitos y no
electrolitos. Los electrolitos son compuestos que se ionizan (o disocian en sus iones
componentes) para dar disoluciones acuosas que conducen la corriente elctrica. Los
no electrolitos existen como molculas en disolucin acusa, y esta no conduce la
corriente elctrica.
Los electrolitos fuertes se ionizan o se disocian por completo, o casi por completo, en
disolucin acuosa diluida. Entre los electrolitos fuertes pueden mencionarse los
cidos fuertes, las bases fuertes y casi todas las sales solubles.
La ionizacin es el proceso por el cual un compuesto molecular se separa formando
iones en disolucin, por ejemplo HCl.
En 1680 Robert Boyle not que los cidos disolvan muchas sustancias, cambiaban el
color de algunos tintes naturales y perdan sus propiedades caractersticas cuando se
mezclaban con lcalis. En 1814 J. Gay-Lussac concluy que los cidos neutralizaban a
las bases y que los dos tipos de sustancias deberan definirse en trminos de sus
reacciones entre s.
En 1923 J. N. Bronsted y T. M. Lowry presentaron independientemente sus teoras
cido base, pero como resultaron muy parecidas, la unificaron como la teora de
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Bronsted y Lowry. Esta indicaba que un cido es una sustancia, que en solucin
acuosa, libera H
+
y una base es una sustancia, que en solucin acuosa, acepta H
+
.
En ese mismo ao G. N. Lewis present una teora cido base ms completa. Un cido
es cualquier especie que puede aceptar compartir un par de electrones. Una base es
cualquier especie que puede donar un par de electrones.
Producto inico del agua
Kw = [H3O
+
] [OH
-
] = 10
-14
a 25 C
Esta constante, Kw, se llama producto inico del agua.
Concepto y clculo de pH y pOH
Sorensen defini el concepto de pH para facilitar el trabajo con las concentraciones de
iones H3O
+
, que son cantidades muy pequeas en disoluciones acuosas y son
expresadas en potencias negativas de diez.
Sorensen propuso:
pH = -log [H3O+] o ms comnmente como pH = -log [H+].
- Si [H+] > 10
-7
, el pH < 7 y la solucin es cida.
- Si [H+] = 10
-7
, el pH es = 7 y la solucin es neutra
- Si [H+] < 10
-7
, el pH > 7 y la solucin es bsica.
El pOH = -log [OH-]
La escala de pH comienza en 0 y termina en 14; la escala de pOH es inversa, cuando
pH=0, pOH=14 cuando pH=14, pOH=0, y cuando pH = 7, pOH =7.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Relacin entre pH, pOH y pKw:
Kw = [H][OH], se aplica logaritmo:
logKw = log ([H][OH]) = log [H] + log [OH], se multiplica por -1 y se obtiene:
-log Kw = - (log [H]) + (- log[OH])
Si pKw = -logKw, entonces: pKw = pH + pOH
Dado que pKw= -log (1x10
-14
), entonces: pH + pOH = 14
Reactivos indicadores
Un indicador qumico es un cido o base dbil cuya forma disociada tiene diferente
color que la forma sin disociar, ello es debido a que estn formados por sistemas
resonantes aromticos, que pueden modificar la distribucin de carga segn la forma
que adopten. Esta alteracin por el desplazamiento hacia una forma ms o menos
disociada, hace que la absorcin energtica del sistema se modifique y con ello el
color.
Si acordamos que cualquier indicador se designe como Hln y sus aniones con In
-
. La
disociacin del tornasol en las soluciones puede ser representada de la siguiente
manera:
HIn In
-
+ H
+
Color Azul Color Rojo
La aplicacin de la ley de accin de masas a este equilibrio, nos da que:
, de lo que .
Si el medio es cido, y aumenta la concentracin de H
+
, deber disminuir la relacin
[In
-
]/[HIn]. Para ello el equilibrio tendr que desplazarse hacia la izquierda,
aumentando la concentracin de HIn, y dominando su color.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Si el medio es bsico, el cociente tendr que aumentar, desplazndose el equilibrio
hacia la derecha y dominando el color B. Naturalmente como se trata de un equilibrio,
coexisten las dos formas, y por ello el color que toma procede de la mezcla de colores
y de su proporcin.
Indicadores cido base
Indicador Color
(cido)
Color
(base)
Intervalo
Violeta de metilo Amarillo Violeta 0.3 2.0
Azul de timol Rojo Amarillo 1.0 2.5
Rojo de o-cresol Rojo Amarillo 1.0 2.0
Anaranjado de metilo Rojo Amarillo 3.0 4.4
Rojo de metilo Rojo Amarillo 4.4 6.0
Azul de Bromocresol Amarillo Azul 6.0 8.0
Rojo neutro Rojo Amarillo 7.0 8.0
Rojo de cresol Amarillo Rojo 7.0 9.0
Fenolftalena Incoloro Rojo 8.0 10.0
Timolftalena Incoloro Azul 9.4 10.6
Amarillo de alizarina Amarillo Violeta 10 12.0
1,3,5-Trinitrobenceno incoloro Rojo 12 13.4
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
III. Diagramas o esquemas del proceso
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 2: Determinacin del pH de soluciones acidas de diferentes
concentraciones
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
Experimento N 4: Titulacin de un acido dbil, CH3COOH, con una base fuerte,
NaOH.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
IV. Datos experimentales
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
Nmero de
prueba
Volumen de AgNO3
1 11.2ml
2 10.5ml
3 10.3ml
Experimento N 2: Determinacin del pH de soluciones acidas de diferentes
concentraciones
Se prepara en los tubos de ensayo las concentraciones de HCl.
Serie N1
Tubo de ensayo Molaridad del HCl PH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
Serie N2
Tubo de ensayo Molaridad HCl pH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
- A la primera serie la preparamos con 3 gotas de violeta de metilo.
- A la segunda serie la preparamos con 3 gotas de anaranjado de metilo.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
Este experimento es ms analtico, no tiene clculos, y los cambios
presenciados estn apuntados en observaciones.
Experimento N 4: Titulacin de un acido dbil, CH3COOH, con una base fuerte,
NaOH.
Molaridad del NaOH = 0.1M
Molaridad del CH3COOH = X M
Volumen de H2O = 20ml
Volumen de CH3COOH = 10ml
2 gotas de Anaranjado de Metilo.
TABLA N1
V NaOH
1 5ml
2 4ml
2 gotas de Fenolftalena.
TABLA N2
VNaOH
1 10.2ml
2 8.5ml
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
V. Clculos y resultados
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
Datos:
Molaridad del NaCl = X M
Molaridad del AgNO3 = 0.01 M
Volumen de NaCl X molar = 10ml
Volumen de AgNO3: volumen aadido hasta que cambie a un color permanente.
Por lo tanto podemos hallar la molaridad del NaCl.
En el equilibro justo cuando cambia de color se tiene:
- Para la prueba 1
[NaCl].VNaCl = [AgNO3].VAgNO3
X.(10ml) = 0.01.(11.2ml)
X = 0.0112 M
- Para la prueba 2
[NaCl].VNaCl = [AgNO3].VAgNO3
X.(10ml) = 0.01.(10.5ml)
X = 0.0105 M
- Para la prueba 3
[NaCl].VNaCl = [AgNO3].VAgNO3
X.(10ml) = 0.01.(10.3ml)
X = 0.0103 M
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 2: Determinacin del pH de soluciones cidas de diferentes
concentraciones
Datos:
Se prepara en los tubos de ensayo las concentraciones de HCl.
Serie N1
Tubo de ensayo Molaridad del HCl PH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
Serie N2
Tubo de ensayo Molaridad HCl pH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
- A la primera serie la preparamos con 3 gotas de violeta de metilo.
- A la segunda serie la preparamos con 3 gotas de anaranjado de metilo.
Escala de colores para el indicador
0.1 0.01 0.001 0.0001
Serie con violeta de metilo turquesa azul morado morado
Serie con anaranjado de metilo rojo rojo naranja naranja claro
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
Este experimento es ms analtico, no tiene clculos, y los cambios
presenciados estn apuntados en observaciones.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 4: Titulacin de un acido dbil, CH3COOH, con una base fuerte,
NaOH.
Trabajando con los datos experimentales de la tabla 1
-
Para el caso de 5ml VNaOH
Volumen utilizado de NaOH = 5ml
# Equiv CH3COOH = # EquivNaOH
n(CH3COOH).VCH3COOH =n( NaOH).5ml
MCH3COOH. VCH3COOH + agua = MNaOH. 5ml
X. (1 )(30ml) = (0.1) (1) (5ml)
x= 0.016 M
-
Para el caso de 4ml VNaOH
Volumen utilizado de NaOH = 4ml
# Eq CH3COOH = # EqNaOH
n(CH3COOH).VCH3COOH =n( NaOH).4ml MCH3COOH. VCH3COOH + agua = MNaOH. 4ml
X. (1) (30ml) = (0.1) (1) (4ml) X= 0.013M
El cambio de color al final es ANARANJADO CLARO DE BAJA INTENSIDAD..
Trabajando con los datos experimentales de la tabla 2
-
Para el caso de 10.2ml VNaOH
Volumen utilizado de NaOH = 10.2ml
# Eq CH3COOH = # EqNaOH
n(CH3COOH).VCH3COOH =n( NaOH).10.2ml MCH3COOH. VCH3COOH + agua = MNaOH. 10.2ml
X. (1) (30ml) = (0.1) (1) (10.2ml) X= 0.004M
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
-
Para el caso de 8.5ml VNaOH
Volumen utilizado de NaOH = 8.5ml
# Eq CH3COOH = # EqNaOH
n(CH3COOH).VCH3COOH =n( NaOH).8.5ml
MCH3COOH. VCH3COOH + agua = M (NaOH). (8.5ml)
X. (1) (30ml) = (0.1) (1) (8.5ml) X= 0.0283M
El cambio de color al final es VIOLETA O ROJO GROSELLA.
VI. Observaciones
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
Ag
+
+ Cl
-
AgCl Precipitado blanco
2Ag
+
+ Cr2O4
-2
Ag2Cr2O4 Precipitado rojizo
1 Precipitacin AgCl
++ (blanco) [Ag
+
] [Cl
-
] kps(AgCl)
2 Precipitacin Ag2Cr2O4 ++
(rojizo) [Ag
+
]
2
[Cr2O4
-2
] kps(Ag2Cr2O4)
El NaCl se nota de incoloro
El K2CrO4 se nota de color amarillo
Al mezclar el cloruro de sodio con el AgNO3 la solucin se enturbia a un color
blanquecino.
Al mezclar K2CrO4 con el AgNO3 la solucin toma un color rojo salmn
Al agregar el AgNO3 a la solucin formado porNaCl y K2CrO4 la solucin se torna
de un color salmn rojizo.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 2: Determinacin del pH de soluciones acidas de diferentes
concentraciones
Serie N1
Tubo de ensayo Molaridad del HCl PH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
Serie N2
Tubo de ensayo Molaridad HCl pH
1 0.1 1
2 0.01 2
3 0.001 3
4 0.0001 4
A la primera serie la preparamos con 2 gotas de violeta de metilo.
A la segunda serie la preparamos con 2 gotas de anaranjado de metilo.
Cuando se le aade 2 gotas de violeta de metilo a la primera serie se observa
los cambios de colores de las soluciones en el cual su intensidad de color del
primer tubo (0.1M) al ltimo tubo (0.0001M) est disminuyendo.
Cuando se le aade 2 gotas de anaranjado de metilo a la segunda serie se
observa los cambios de colores de las soluciones en el cual su intensidad de
color del primer tubo (0.1M) al ltimo tubo (0.0001M) est aumentando.
Escala de colores para el indicador
0.1 0.01 0.001 0.0001
Serie con violeta de metilo turquesa azul morado morado
Serie con anaranjado de metilo rojo rojo naranja naranja claro
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
El cambio de calor en presencia de violeta de metilo y anaranjado de metilo.
Con Violeta de metilo se vuelve color turquesa.
Con Anaranjado de metilo se vuelve color rojo.
Al comparar el color del HCl (xM) con los indicadores (violeta de metilo y
anaranjado de metilo), percibimos que en el primer indicador el color es el ms
tenue de la escala, mientras que en el segundo el color es el ms intenso.
Por lo tanto:
Los tubos con HCl X Molar se aproxima a HCl 0.1 M en la escala de colores del
Experimento N2.
Experimento N 4: Titulacin de un acido dbil, CH3COOH,
con una base fuerte, NaOH.
Al realizar la titulacin y utilizar el anaranjado de metilo
se observ que la solucin se tornaba a un anaranjado de
baja intensidad
Al realizar la titulacin y utilizar el indicador
fenolftalena se observ que la solucin se tornaba a un
color violeta o rojo grosella
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
VII. Cuestionario
1.- Cules son las ecuaciones correspondientes de la experiencia referente a sales
poco solubles?
Cl(ac) + AgNO3 (ac) NO3(ac) + AgCl
2 AgNO3 (ac) + K2CrO4 (ac) Ag2CrO4 + 2 KNO3 (ac)
- Ag
+
(aq) + Cl
-
(aq) AgCl(s) Reaccin de titulacin
- CrO4
2-
+ 2Ag
+
(aq) Ag2CrO4(s) Reaccinn del punto final
2.- En la Experiencia N1. Cuntos mL de nitrato de plata emple hasta observar
un cambio permanente y que concentracin [Cl
-
] significa tal volumen?
V: Volumen de nitrato de plata
[Ag
+
] = 0.01 M [Cl
-
] x 10mL = [Ag
+
] x V
1 V = 11.2 mL [Cl
-
] = 0.0112 M
2 V = 10.5 mL [Cl
-
] = 0.0105 M
3 V = 10.3 mL [Cl
-
] = 0.0103 M
3.- A qu concentracin de iones [Ag
+
] precipita el AgCl?
Para resolver este problema usaremos el siguiente dato:
Kps = | Ag
1+
|| Cl
1-
| = 1.7x10
-10
Usando los resultados de la anterior pregunta ([NaCl] = [Cl
-
])
1 | Cl
1-
| = 1.517x10
-8
2 | Cl
1-
| = 1.619x10
-8
3 | Cl
1-
| = 1.650x10
-8
4.- Qu concentracin de iones cloruro queda en la solucin al momento que
empieza a precipitar el CrO4Ag2?
De las ecuaciones:
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Se tiene que:
Kps(primera ecuacin)=[CrO4
=
][ Ag
+
]
2
Del problema 1 se obtuvo:
[Ag
+
]=
=1.48*10
-6
M para la primera ecuacin
Si el nitrato de plata , AgNO3 ,se agrega a una solucin saturada de cloruro de plata (lo primero que
ocurre), el incremento provocado en la concentracin molar del catin plata har que el producto
inico sea mayor que el Kps, por lo tanto, precipitar algo de cloruro de plata para restablecer el
equilibrio.(por eso primero se ve turbia el agua) .pero tambin al encontrar [Ag
+
] el [CrO4=] se une
para formar AgCrO4 hasta llegar al equilibrio que es cuando se forma el precipitado color salmn
rojizo, en ese instante los # de equivalente de esas sustancias son iguales:
Nmero de equivalentes de (CrO4
=
)= Nmero de equivalentes de (Ag
+
)
0.1M*0.1mL= [Ag
+
]*10mL
[Ag
+
]=0.001M
Que a su vez es la misma del [Cl
-
] al llegar al equilibrio, por eso es que al final solo ve un
tono tenue de color salmn rojizo y un poco de turbiedad.
Por lo tanto: [Cl
-
]= 0.001M
5.- Cmo determinara si una solucin es acida o bsica?
Depende de la concentracin de H
+
u OH
-
que posea la solucin. Para determinar si
una solucin es acida o bsica usamos el concepto de pH y pOH que podemos medirlas
usando indicadores qumicos como la fenolftalena.
pH = -Log[H
+
] y pOH = -Log[OH
-
] y pH + pOH = 14; si pH < 7 entonces la solucin es
acida en caso contrario ser bsica.
6.- En la Experiencia N4, al agregar 20 mL de H2O destilada, Vario el N de moles
de CH3COOH? Vario su concentracin? Por qu?
El nmero de moles del CH3COOH se mantiene constante debido a que solo se agrega
agua con la cual no reacciona, por otro lado su concentracin si varia una pequea
cantidad la cual para los clculos consideramos despreciables.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
7.- Cuantas moles de NaOH se utilizaron en la experiencia N4?
VNaOH: Volumen de NaOH utilizado.
Dato: [NaOH] = 0.1M
Indicador:
- Anaranjado de metilo:
1 VNaOH = 5 mL nNaOH = 0.5 mmoles.
2 VNaOH = 4 mL nNaOH = 0.4 mmoles.
- Fenolftalena:
1 VNaOH = 10.2 mL nNaOH = 1.02 mmoles.
2 VNaOH = 8.5 mL nNaOH = 0.85 mmoles.
8.- A que llamamos pH y pOH?
ndice de iones H
+
(pH) e ndice de iones OH
-
(pOH), mediante estas expresiones se
puede decir si una solucin es cida o bsica.
pH = -Log[H+] y pOH = -Log[OH]
9.- Cul ser el pH de las siguientes concentraciones de [H
+
] : 10, 10
-1
, 10
-7
, 10
14
,
10
-2
M?
De la frmula de arriba (pH = -Log[H+]):
- [H
+
] = 10 M pH = -1
- [H
+
] = 10
-1
M pH = 1
- [H
+
] = 10
-7
M pH = 7
- [H
+
] = 10
14
M pH = -14
- [H
+
] = 10
-2
M pH = 2
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
10.- Haga una grfica pH. Vs. V del Exp N4
11.- Indique algn mtodo para determinar la cantidad de AgNO3
- El mtodo de Mohr.
- Mtodo argento mtrico
El mtodo argentomtrico o volumtrico es recomendable para agua con
concentraciones entre 1,5 y 100 mg/l de cloruros. esta basado en el mtodo de Mohr.
Sobre una muestra ligeramente alcalina, con pH entre 7 y 10, se aade disolucin de
AgNO3 valorante, y disolucin indicadora K2CrO4. Los Cl
-
precipitan con el in Ag
+
formando un compuesto muy insoluble de color blanco. Cuando todo el producto ha
precipitado, se forma el cromato de plata, de color rojo ladrillo, que es menos
insoluble que el anterior y nos seala el fin de la valoracin.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
12.- Cierto estudiante toma una cantidad determinada de un cido dbil de
carcter desconocido; la disuelve en una cantidad no medida de agua, y la titula
con una base fuerte de concentracin desconocida. Cuando l ha agregado 10 mL
de base observa que la concentracin de H3O+ es 10
-5
M. Continua la titulacin
hasta que alcanza el punto de equivalencia para la neutralizacin de iones H+. En
este punto su bureta indica 22.2 mL. Cul es la constante de disociacin del
cido?
Vb=0.0222 L
HA + BOH AB + H2O
Sabemos Ca.Va Cb.Vb Cb.Vb
En el equilibrio: #moles HA = #moles BOH
Luego Ca.Va = Cb.(0.0222)
HA + BOH AB + H2O
0.0222 Cb 0.01Cb 0.01Cb
Cuando se establece el equilibrio: [H
+
] = 10
-5
M
HA(aq) H
+
(aq) + OH
-1
[HA] [H
+
] [A
-1
]
[HA] = (0.022Cb /V+0.01) 10
-5
Ka= [H
+
][A
-1
] / [HA] = (10
-5
)(0.01.Cb /V+0.01+10
-5
) 8.19.10
-6
0.0222Cb / V+0.01 - 10
-5
)
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
13.- Una solucin de un cido desconocido fue titulada con NaOH, 0.1 M. Se alcanz
el punto de equivalencia cuando se haba agregado 36.12 mL de base. Luego se
agregaron 18.06 mL de HCl, 0.1 M a la solucin, y se encontr que el pH, medido
con un potencimetro era 4.92. Calcle la constante de disociacin del cido
desconocido.
HA A- + H+
Primero hallamos la concentracin de la disolucin al final del proceso:
Ka = [A-] [H+]
[HA]
PH = 4.92 [H+] = 1,2.10
-5
# de moles H+ = C.V = (54,18)(1,2.10
-5
) = 65.10
-5
Cuando se agreg 18,06ml de HCl
# de moles H+ = (18,06).(0,1) = 1,806
# de moles A- = (0,1).(36,12) = 3,612
Inicialmente moles de HA: 3,612-1,806 = 1,806
[HA] = 1,806 = 0,03
54,18
[H
+
] = 1,2.10
-5
[A
-1
] = 0,03
Ka = 1,2.10
-5
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Cuestionario adicional
1.- Escriba las reacciones correspondientes al experimento 1, referente a las sales
poco solubles.
- Ag
+
(aq) + Cl
-
(aq) AgCl(s) Reaccin de titulacin
- CrO4
2-
+ 2Ag
+
(aq) Ag2CrO4(s) Reaccinn del punto final
2.- Segn sus resultados del experimento 1, cul es la concentracin de la
solucin x M de NaCl?
Datos:
VNaCl = 10 mL (medido)
[AgNO3] = 0.01 M
VAgNO3 = 1 (11.2 mL), 2 (10.5 mL), 3 (10.3 mL)
El experimento se realiz 3 veces donde hubo diferentes VAgNO3:
[NaCl] x VNaCl = [AgNO3] x VAgNO3
1 [NaCl] = 0.0112 M 2 [NaCl] = 0.0105 M 3 [NaCl] = 0.0103 M
3.- Segn sus resultados del experimento 1, a qu concentracin de iones Ag+ en
la solucin del matraz, precipita el cloruro de plata AgCl?
Para resolver este problema usaremos el siguiente dato:
Kps = | Ag
1+
|| Cl
1-
| = 1.7x10
-10
Usando los resultados de la anterior pregunta ([NaCl] = [Cl
-
])
1 | Cl
1-
| = 1.517x10
-8
2 | Cl
1-
| = 1.619x10
-8
3 | Cl
1-
| = 1.650x10
-8
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
4.- Segn sus resultados del experimento 1, qu concentracin de iones cloruro Cl
queda en solucin en el momento que empieza a precipitar el cromato de plata
Ag2CrO4?
De las ecuaciones:
Se tiene que:
Kps(primera ecuacin)=[CrO4
=
][ Ag
+
]
2
Del problema 1 se obtuvo:
[Ag
+
]=
=1.48*10
-6
M para la primera ecuacin
Si el nitrato de plata , AgNO3 ,se agrega a una solucin saturada de cloruro de plata (lo
primero que ocurre), el incremento provocado en la concentracin molar del catin
plata har que el producto inico sea mayor que el Kps, por lo tanto, precipitar algo
de cloruro de plata para restablecer el equilibrio.(por eso primero se ve turbia el
agua) .pero tambin al encontrar [Ag
+
] el [CrO4=] se une para formar AgCrO4 hasta
llegar al equilibrio que es cuando se forma el precipitado color salmn rojizo, en ese
instante los # de equivalente de esas sustancias son iguales:
Nmero de equivalentes de (CrO4
=
)= Nmero de equivalentes de (Ag
+
)
0.1M*0.1mL= [Ag
+
]*10mL
[Ag
+
]=0.001M
Que a su vez es la misma del [Cl
-
] al llegar al equilibrio, por eso es que al final
solo ve un tono tenue de color salmn rojizo y un poco de turbiedad.
Por lo tanto: [Cl
-
]= 0.001M
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
5.- Cul es el pH de cada una de las siguientes soluciones acuosas de HCl, 10 M, 1
M, 0.1M, 0.01M, 0.001 M, 0.0001M?
- [H
+
] = 10 M pH = -1
- [H
+
] = 10
0
M pH = 0
- [H
+
] = 10
-1
M pH = 1
- [H
+
] = 10
-2
M pH = 2
- [H
+
] = 10
-3
M pH = 3
- [H
+
] = 10
-4
M pH = 4
6.- Con referencia a la escala de color de los indicadores Anaranjado de metilo y
Violeta de metilo, estudiada en el experimento 2, establezca la concentracin
desconocida de HCl XM del exp.3.
Con los datos del Exp. 2, desarrollamos la siguiente tabla:
0.1M 0.01M 0.001M 0.0001M
Violeta de metilo Turquesa Azul Morado Morado
Anaranjado de metilo Rojo Rojo Naranja Naranja claro
En el exp. 3 el HCl XM es color turquesa al aadir violeta de metilo, y es color rojo al
aadir anaranjado de metilo. Por tanto es de 0.1M de concentracin.
7.- Diferencie el significado de punto equivalente y punto final en una titulacin.
El punto de equivalencia o equivalente en una reaccin es cuando toda la cantidad de
iones H
+
aportados por el cido han sido neutralizados por una cierta cantidad de
iones OH
-
proporcionados por la base. En cambio el punto final de la titulacin es
cuando se ha excedido por lo menos un poco la cantidad de iones H
+
u OH
-
lo cual solo
se puede notar mediante indicadores como la fenolftalena.
8.- Cul es la ecuacin de la reaccin de neutralizacin de la solucin de cido
actico correspondiente al Experimento 4.?
CH3COOH + NaOH CH3COONa + H2O
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
9.- Cuntos moles de hidrxido de sodio NaOH, se utilizaron en la valoracin del
experimento 4? Determine la concentracin desconocida de la solucin de cido
actico CH3COOH xM.
Datos:
Molaridad del NaOH = 0.1M
Molaridad del CH3COOH = X M
Volumen de H2O = 20ml
Volumen de CH3COOH = 10ml
Indicador:
Anaranjado de metilo:
1 VNaOH = 5 mL nNaOH = 0.5 mmoles.
# Equiv CH3COOH = # Equiv NaOH
n (CH3COOH). VCH3COOH =n (NaOH). 5ml
MCH3COOH. VCH3COOH + agua = MNaOH. 5ml
X. (1) (30ml) = (0.1) (1) (5ml)
X = 0.016 M
2 VNaOH = 4 mL nNaOH = 0.4 mmoles.
# Equiv CH3COOH = # Equiv NaOH
n (CH3COOH).VCH3COOH =n (NaOH).4ml
MCH3COOH. VCH3COOH + agua = MNaOH. 4ml
X. (1) (30ml) = (0.1) (1) (4ml)
X = 0.013 M
Fenolftalena:
1 VNaOH = 10.2 mL nNaOH = 1.02 mmoles.
# Equiv CH3COOH = # Equiv NaOH
n (CH3COOH).VCH3COOH =n (NaOH).10.2ml
MCH3COOH. VCH3COOH + agua = MNaOH. 10.2ml
X. (1) (30ml) = (0.1) (1) (10.2ml)
X = 0.004 M
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
2 VNaOH = 8.5 mL nNaOH = 0.85 mmoles.
# Equiv CH3COOH = # Equiv NaOH
n (CH3COOH).VCH3COOH =n (NaOH).8.5ml
MCH3COOH. VCH3COOH + agua = MNaOH. 8.5ml
X. (1) (30ml) = (0.1) (1) (8.5ml)
X = 0.0283 M
10.- Busque valores tabulados de manuales de qumica, e indique para los
indicadores usados en experimento No1, los respectivos rangos de viraje de pH y
color. Qu otros indicadores podra utilizarse para el experimento No2.?
En el experimento No 1 se us el cromato de potasio, que es una sustancia solida a
20C de color amarillo limn con un pH de 8.8. Revisando la tabla de indicadores
acido-base sera ms conveniente utilizar el rojo de cresol ya que su rango de viraje de
pH es de 7.0 9.0 para reemplazar al cromato de potasio porque al estar el pH del
cromato cerca de un extremo del rango del rojo de cresol (amarillorojo); la
fenolftalena tambin podra servir.
11.- Calcular el pH de una solucin obtenida mezclando 25 mL de solucin 0.5M de
HCl, 10 ml de solucin 0.5M de NaOH y 15 mL de agua.
Cuando se mezclan un cido con una base se neutralizan
#Eq-gHCl=(0.5M)(1)(0.025L)=0.0125 Eq-g
#Eq-g de NaOH=(0.5M)(1)(0.01L)=0.005Eq-g
Se observa que #Eq-g de NaOH < #Eq-gHCl
Lo cual indica que la solucin tiene un carcter acido
El #Eq-gHCl en exceso es
#Eq-gHCl=0.0125-0.005=0.0075Eq-g
Volumen total=50ml=0.05L
La concentracin de HCl en exceso es:
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
N=0.0075Eq-g/50L=0.00015Eq-g/L
M=0.00015mol/L
|HCl|=|H
+
|=0.00015M
pH=-
pH=3.82
12.- Calcular el pH de la solucin obtenida mezclando 15 mL de solucin 0.5M de
cido actico CH3COOH y 15 mL de agua. El pKa del cido actico = 4.760.
CH3COOH H
+
+ CH3COO
-
INICIO 0.0075M
VARIACION -X +X +X
EQUILIBRIO 0.0075-X X X
nCH3COOH =(0.5m/L)0.015=0.0075mol
Ka= 4.760
Ka=
= 4.760
X= 0.0074882
Vt=30ml=0.03L
|H
+
|=0.0074882mol/0.03L=0.2496066M
pH=-
pH=0.60274
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
13.- Explique, porque es ms apropiado el uso de fenolftalena que el uso de
anaranjado de metilo como indicador en la titulacin realizada en el experimento
No4?
En el experimento No 4 reaccionan un cido dbil con una base fuerte; en el punto de
equivalencia se forma una sal con lo que la hidrlisis es bsica. Se deber utilizar un
indicador que vire en la zona bsica de pH > 7. La fenolftalena sera un indicador
adecuado, pero no el anaranjado de metilo o el rojo de metilo.
14.- Sealar cules de las series de cidos enumerados a continuacin,
corresponden al ordenamiento de pH menor a mayor, supuesto una misma
concentracin molar de cido.
a. HNO3, HNO2, CH3COOH, HCN.
b. HCl, CH2ClCOOH, HF, H3BO3.
c. HCN, HF, HOCl, HCOOH
a. HNO3, HNO2, CH3COOH, HCN.
PH HNO3<PH HNO2<PH CH3COOH<PH HCN
Ka Acido fuerte 4.5x10
-4
1.86x10
-5
4.0x10
-10
b. HCl, CH2ClCOOH, HF, H3BO3.
PH HCl<PH CH2ClCOOH<PH HF<PH H3BO3
Ka Acido fuerte 1.6X10
-3
7.2X10
-4
7.3X10
-10
c. HCN, HF, HOCl, HCOOH.
PH HF<PH HCOOH<PH HOCl <PH HCN
ka 4.0x10
-10
7.2x10
-4
2.95x10
-8
1.8x10
-4
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
VIII. Conclusiones
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
- Usando el Kps podemos predecir qu tan soluble es el compuesto.
- Usando la relacin de nmeros de equivalentes podemos hallar con una buena
aproximacin la concentracin de una sustancia desconocida.
Experimento N 2: Determinacin del pH de soluciones acidas de diferentes
concentraciones
- Al observar los cambios de colores de las soluciones se puede concluir si la
solucin es bsica, acida o neutra debido a que los indicadores tienen un rango
de viraje de colores el cual indica el PH de la solucin.
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
Sin importar el indicador que se utilice, el pH debe ser el mismo.
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
Experimento N 4: Titulacin de un cido dbil, CH3COOH, con una base fuerte,
NaOH.
Por los colores observados se deduce:
En el anaranjado de metilo
Por lo tanto el pH de la solucin esta sobre 4.4
En el indicador de fenolftalena
La solucin torno a un color rosado o rojo grosella por lo tanto se concluye
que la solucin es una base
pH 0 08.2 8.212.0 >12.0
Condiciones fuertemente
cidas
cidas o
neutra
bsicas fuertemente
bsicas
Color naranja incoloro rosa incoloro
Imagen
Por lo tanto el pH de la solucin tiende entre 8.2 a 12
Naranja de metilo (Indicador de pH )
Inferior a pH 3,1
Sobre pH 4,4
Rojo Naranja-amarillo
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
IX. Recomendaciones
Experimento N 1: Determinacin volumtrica de iones cloruro Cl
-
por valoracin
con iones Ag
+
Se recomienda solicitar una pipeta ms , para evitar reacciones imprevistas
Se recomienda utilizar un embudo al momento de colocar las sustancias en la
bureta, pues podra desperdiciarse sustancias, innecesariamente.
Se recomienda evitar distraccin alguna al momento de hacer el conteo de
gotas, pues los resultados entre las pruebas podran variar mucho entre s.
Experimento N 2: Determinacin del pH de soluciones acidas de diferentes
concentraciones
Tener cuidado con las concentraciones de los tubos, deben estar rotulados
debido a que tienen concentraciones similares.
Experimento N 3: Determinacin de [H
+
] en una solucin acida desconocida
Observar cuidadosamente al comparar el HCl (xM) con la soluciones de la
escala.
Experimento N 4: Titulacin de un acido dbil, CH3COOH, con una base fuerte,
NaOH.
Se recomienda realizar ms de una titulacin para tener un resultado ms
exacto
Al primer cambio de color constante anotar el volumen gastado ya que si se lo
realiza despus hay un grado de error
Qumica Industrial I
Facultad de Ingeniera Industrial y Sistemas
UNIVERSIDAD NACIONAL DE INGENIERIA
X. Referencias bibliografas
Qumica Analtica Adon A. Gordon editorial Schaumpag 51-53
Clculos qumicos Benzonpag 136- 137
Anlisis Qumico Cuantitativo Daniel C. Harris 2
da
edicin Capitulo 6 Pg. 116-
117
Qumica bsica editorial Limusa Wileypag 530-538
Qumica. Whitten-Davis-Peck-Atanley. Pg. 703,726-730,755
http://e-ducativa.catedu.es
http://www.educa.madrid.org
http://www.gobiernodecanarias.org/educacion/3/usrn/lentiscal/1-
cdquimica-tic/applets/Neutralizacion/teoria-neutralizacion.htm
You might also like
- Lab4 QIDocument45 pagesLab4 QIOliver Matias LlanosNo ratings yet
- Informe 9Document11 pagesInforme 9Max Serolf Zaid100% (1)
- QG Ii N°7Document11 pagesQG Ii N°7Luis FrancoNo ratings yet
- Informe de Laboratorio N°7Document12 pagesInforme de Laboratorio N°7Kleber Victor Bautista BaygorreaNo ratings yet
- Informe de Quimica 10Document10 pagesInforme de Quimica 10Joy Way Quispe QuintanaNo ratings yet
- Medicion de PHDocument7 pagesMedicion de PHva.mbetancourthNo ratings yet
- Zúniga, Quintana, Cano, Paniagua y ReyesDocument12 pagesZúniga, Quintana, Cano, Paniagua y ReyesManuelNo ratings yet
- Soluciones Acidas y Basicas Informe 5Document15 pagesSoluciones Acidas y Basicas Informe 5jorge100% (1)
- Prac 6. - Equilibrio IonicoDocument11 pagesPrac 6. - Equilibrio IonicoAllan Siouux100% (1)
- Equilibrio Ionico en Soluciones AcuosasDocument12 pagesEquilibrio Ionico en Soluciones AcuosasYessenia Palomino PeñaNo ratings yet
- Uso de Indicadores de Escala de PHDocument16 pagesUso de Indicadores de Escala de PHRoger Sicha HuamanNo ratings yet
- Informe-Uso de Indicadores PH PohDocument16 pagesInforme-Uso de Indicadores PH PohAlbert Jefferson Espinoza BulejeNo ratings yet
- Guía Soluciones Segunda ParteDocument14 pagesGuía Soluciones Segunda ParteMariana MosqueraNo ratings yet
- QuimicaDocument12 pagesQuimicaJhossell De La CruzNo ratings yet
- Acidos y BasesDocument5 pagesAcidos y BasesCesar Xavier Lizarazu Fuentes100% (2)
- PH de Las SolucionesDocument9 pagesPH de Las SolucionesMario David Zavaleta LópezNo ratings yet
- Informe 9Document18 pagesInforme 9karycrisNo ratings yet
- Indicadores y Escala PH Y PohDocument9 pagesIndicadores y Escala PH Y PohAlexander Yauri Gomez0% (2)
- Practica #10 Quimica - FinalDocument16 pagesPractica #10 Quimica - FinalGustavo André Asenjo MiñopeNo ratings yet
- Equilibrio Ionico en Solu. Acuosas Parte 2Document20 pagesEquilibrio Ionico en Solu. Acuosas Parte 2Dani DortaNo ratings yet
- INFORME 11 - Laboratorio QuímicaDocument16 pagesINFORME 11 - Laboratorio QuímicaKevin Acuña CenzanoNo ratings yet
- Inv. U3 Analit. E1 Inv U3.Document7 pagesInv. U3 Analit. E1 Inv U3.extimidoNo ratings yet
- Archivo 1Document32 pagesArchivo 1conyriverosNo ratings yet
- Curvas de Valoración Ácido-BaseDocument20 pagesCurvas de Valoración Ácido-Basefalco elaguila0% (1)
- Guía 4 Química GeneralDocument13 pagesGuía 4 Química GeneralAndrés CotoNo ratings yet
- InformeDocument12 pagesInformeDiego Medrano HidalgoNo ratings yet
- Cap 1 Importancia Del PH en Las Industrias y Modulo de LaboratorioDocument18 pagesCap 1 Importancia Del PH en Las Industrias y Modulo de Laboratoriodahamedapril21No ratings yet
- Informe de Laboratorio de Quimica ! UNIDocument14 pagesInforme de Laboratorio de Quimica ! UNIdanyNo ratings yet
- Determinación de La Concentración Molar de Una DisoluciónDocument7 pagesDeterminación de La Concentración Molar de Una DisoluciónNatalia Granados GutiérrezNo ratings yet
- Determinacion de PHDocument12 pagesDeterminacion de PHpechando2519No ratings yet
- Informe 10Document12 pagesInforme 10Ramcés Ramos HinostrozaNo ratings yet
- Practica 6-Medición de Nivel de PHDocument7 pagesPractica 6-Medición de Nivel de PHJonathan FloresNo ratings yet
- Informe Química 2.0Document9 pagesInforme Química 2.0pablo perezNo ratings yet
- Guia - 7 - QQ - Acidos y Bases - Simulación PDFDocument12 pagesGuia - 7 - QQ - Acidos y Bases - Simulación PDFAlex FuNo ratings yet
- Determinacion Del PHDocument8 pagesDeterminacion Del PHYolanda DelgadoNo ratings yet
- Informe 4 QuimciaDocument5 pagesInforme 4 Quimciaxavier lazoNo ratings yet
- Reconocimiento Acidos y BasesDocument14 pagesReconocimiento Acidos y BasesDiana Villalba0% (1)
- Laboratorio 5Document6 pagesLaboratorio 5Cesar PsNo ratings yet
- Indicadores y Titulación Ácido BaseDocument25 pagesIndicadores y Titulación Ácido BaseMilagros V. InfanteNo ratings yet
- Practica 1Document7 pagesPractica 1Lyly Llanes CarreónNo ratings yet
- Labo 7 Analisis TemirnadoDocument24 pagesLabo 7 Analisis TemirnadoRuben Toribio100% (1)
- Informe 6 - Titulacion Acido BaseDocument15 pagesInforme 6 - Titulacion Acido BaseMilagroz Zx0% (1)
- Informe 2Document11 pagesInforme 2Sergio SepulvedaNo ratings yet
- Indicadores y Titulación Ácido BaseDocument7 pagesIndicadores y Titulación Ácido BaseCarlitos Sánchez CallaNo ratings yet
- Trabajo Práctico de Laboratorio Nº2Document8 pagesTrabajo Práctico de Laboratorio Nº2aleinNo ratings yet
- 6to Laboratorio de Análisis Químico Reconocimiento de AnionesDocument21 pages6to Laboratorio de Análisis Químico Reconocimiento de AnionesRaúl Berrospi Rodriguez100% (1)
- Practicas de Laboratorio BioquimicaDocument38 pagesPracticas de Laboratorio BioquimicaMiguel MorenoNo ratings yet
- Practica 11Document13 pagesPractica 11Natividad Valderrama Castañeda BNo ratings yet
- 4.determinación Colorimétrica Del PHDocument6 pages4.determinación Colorimétrica Del PHHenry Acosta ArguelloNo ratings yet
- LAB 7, Acidimetria y AlacalimetriaDocument12 pagesLAB 7, Acidimetria y AlacalimetriaRobert Michel Montalvo CuchoNo ratings yet
- Apuntes Química Aplicada Modulo IDocument13 pagesApuntes Química Aplicada Modulo IIdelberto BenitezNo ratings yet
- Valoraciones AcidosDocument17 pagesValoraciones AcidoseminsonNo ratings yet
- 5 Informe-Equilibrio IonicoDocument18 pages5 Informe-Equilibrio IonicoCesar Saavedra100% (3)
- Practica 2Document9 pagesPractica 2pilar0% (1)
- Informe de Laboratorio Acidos y BasesDocument13 pagesInforme de Laboratorio Acidos y BasesAlcides Hermoza Mejia60% (5)
- Reacciones Ácido-BaseDocument6 pagesReacciones Ácido-BaseAngie GhNo ratings yet
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Ejercicios de FluidosDocument3 pagesEjercicios de FluidosAntonioNo ratings yet
- Obra TriloríaDocument10 pagesObra TriloríagabyNo ratings yet
- EnergíaDocument4 pagesEnergíaEduardo Martin Taboada RodriguezNo ratings yet
- Jean Heidmann - El Principio AntropicoDocument6 pagesJean Heidmann - El Principio AntropicoKresimir GracaninNo ratings yet
- CuestionarioDocument2 pagesCuestionarioCesar Vera ParamoNo ratings yet
- Alcanos MapasDocument8 pagesAlcanos MapasJairo IsraelNo ratings yet
- LeucipoDocument8 pagesLeucipoAndrés MotaNo ratings yet
- Tesis de Canales AbiertosDocument208 pagesTesis de Canales AbiertosWilliam Richardson100% (1)
- Planeación Didáctica Química I Agosto 2010 Enero 2011 - Ver2003Document14 pagesPlaneación Didáctica Química I Agosto 2010 Enero 2011 - Ver2003José Luis Bautista Avila100% (4)
- Energia Trabajo y Potencia BiofisicaDocument24 pagesEnergia Trabajo y Potencia BiofisicaCarolVanessaCorreaGuizadoNo ratings yet
- Valvulas de Estrangulamiento y Cámara de MezcladoDocument11 pagesValvulas de Estrangulamiento y Cámara de MezcladoJuan Carlos Gutierrez ArredondoNo ratings yet
- Diseño de Pavimentos Cap 7Document40 pagesDiseño de Pavimentos Cap 7Julian Vidal ValenciaNo ratings yet
- 5a. - Análisis DimensionalDocument48 pages5a. - Análisis DimensionalCésar Augusto Niño CastroNo ratings yet
- Programación Grado TerceroDocument5 pagesProgramación Grado TerceroYineth Ramirez PeñaNo ratings yet
- Entropia Diapositivas para ExponerDocument19 pagesEntropia Diapositivas para ExponerRosalia Alvarez HernandezNo ratings yet
- Unidad 3 Estado de EsfuerzosDocument15 pagesUnidad 3 Estado de Esfuerzosisraelramirezg0% (1)
- ET013 Transformador Trifásico de Distribución Tipo Seco AbiertoDocument14 pagesET013 Transformador Trifásico de Distribución Tipo Seco AbiertoalexleguiNo ratings yet
- Ejercisios Propuestos 2do ParcialDocument12 pagesEjercisios Propuestos 2do ParcialJulissa GutierrezNo ratings yet
- HistoryDocument2 pagesHistoryBryan Briceño ChihuanNo ratings yet
- Sistemas Lineales en CerchasDocument5 pagesSistemas Lineales en CerchasGabriel MatosNo ratings yet
- Concretos Especiales (Iv-A)Document28 pagesConcretos Especiales (Iv-A)Gary Arias EspinozaNo ratings yet
- Introducción: Potencial TermodinámicoDocument4 pagesIntroducción: Potencial Termodinámicocarlis floresNo ratings yet
- Etm - Lampara Fluoresc T9Document80 pagesEtm - Lampara Fluoresc T9franklinNo ratings yet
- Efecto Seebeck, Peltier y ThompsonDocument9 pagesEfecto Seebeck, Peltier y ThompsonLeopoldoPavesiNo ratings yet
- 2.3 Equilibrio Estatico: FormulaDocument3 pages2.3 Equilibrio Estatico: FormulaMAUCRAFT REX777No ratings yet
- Analisis Cuantitativo MuestreoDocument14 pagesAnalisis Cuantitativo MuestreoProxy80% (10)
- Taller2 - CalculoIntegral - 2020 1Document3 pagesTaller2 - CalculoIntegral - 2020 1Diana HerreraNo ratings yet
- Granulometría para Material de Base y SubbaseDocument6 pagesGranulometría para Material de Base y SubbasePablo Luis Mendivil Padilla0% (1)
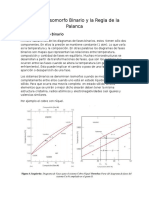
- Sistema Isomorfo Binario y La Regla de La PalancaDocument3 pagesSistema Isomorfo Binario y La Regla de La PalancaCarlos Abraham Paniahua Pérez100% (1)
- Aplicaciones de Las Ecuaciones Diferenciales de Primer OrdenDocument5 pagesAplicaciones de Las Ecuaciones Diferenciales de Primer OrdenMiltonAngelinoAychoFlores0% (1)