Professional Documents
Culture Documents
Repaso P1 - Solubilidad
Uploaded by
Emily GonzalezOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Repaso P1 - Solubilidad
Uploaded by
Emily GonzalezCopyright:
Available Formats
EJERCICIOS DE SOLUBILIDAD
1. En el Equilibrio de solubilidad de los hidróxidos metálicos Mx(OH)y puede representarse el
equilibrio en solución acuosa mediante gráficos lineales pM(abs) vrs pH(ord). ¿Cuál es la relación
para el valor del intercepto en eje de ordenadas de la ecuación lineal?
R: pKw – pKps / y
2. ¿De los siguientes pares de sales cuál no puede compararse sus solubilidades únicamente por los
valores de sus Kps?
a. Cloruro de plata / bromuro de plata
b. Cloruro plumboso / cloruro de calcio
c. Sulfato férrico / fosfato de calcio
3. Cuántas veces se incrementa la solubilidad del yoduro de plata (pKps = 16.1), si 1.5 L de una
soluciòn saturada de esta sal se le agrega 13.5 L de agua.
a) duplica b) sube cinco veces c) sube diez veces
d) sube quince veces e) sube 9 veces f) ninguna de las anteriores
4. Si agrego 0.001 moles de la sal de sulfato de bario (pKps = 10) en un litro de agua. ¿ Què
porcentaje se disolverà de la cantidad referida?
a) 1 % b) 3.16 % c) 10.0 % d) 31.6 % e) 100 %
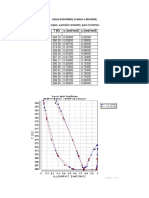
5. La concentración de calcio en una solución es de 40.08 ppm, cuál será el α3, cuando precipite el 99
% del ión metálico presente como ortofosfato tricálcico. (pKps = 29, pK1 = 2.23, pK2 = 7.21 y pK3
12.32)
R:____ α3 = 0.016______________________
Se disuelven 2 gramos de muestra de CaCO3, cuyo pKs = 8.35 y cuyas pK1 = 6.35 y pK2 = 10.33.
Se estabiliza a un pH = 4, luego a 7 y luego a 10, para cada pH,
6. Determine el alfa 2 : α2 = 2.08 E (-9)
7. Determine la solubilidad de dicha sal: S = 1.465 M
You might also like
- Lucas Marques 1Document86 pagesLucas Marques 1Alejandra Medina100% (2)
- Las Leyes EspiritualesDocument212 pagesLas Leyes EspiritualesVicent Guillem87% (15)
- Embriones pollo inoculación virusDocument7 pagesEmbriones pollo inoculación virusNadia AuzsaNo ratings yet
- Preparación de Colorantes Amarillo de Martius, Naranja LL y Tincion de FibrasDocument12 pagesPreparación de Colorantes Amarillo de Martius, Naranja LL y Tincion de FibrasLigia FletesNo ratings yet
- Ecuación Soave-Redlich-KwongDocument16 pagesEcuación Soave-Redlich-KwongMajo GuevaraNo ratings yet
- Sentencia Del Tribunal Sobre Libre Transito (Rejas) 03482-2005-HCDocument10 pagesSentencia Del Tribunal Sobre Libre Transito (Rejas) 03482-2005-HCgustavo chahunNo ratings yet
- Presión de VaporDocument4 pagesPresión de VaporJuly Vergara100% (1)
- Repaso NRP Orgánica 1Document8 pagesRepaso NRP Orgánica 1Fernando de LeonNo ratings yet
- Principios Del Del Derecho NotarialDocument14 pagesPrincipios Del Del Derecho Notarialcarolina valeroNo ratings yet
- DicianoargentatoDocument3 pagesDicianoargentatoBriza SaadNo ratings yet
- 1ep - Iq 2 (A)Document1 page1ep - Iq 2 (A)Xavii ZyanNo ratings yet
- Ecuaciones de Diseño (CSTR) - Semana 4Document21 pagesEcuaciones de Diseño (CSTR) - Semana 4Stey SantiagoNo ratings yet
- Clase 4 Magnitudes Molares ParcialesDocument66 pagesClase 4 Magnitudes Molares ParcialesEduardo Escobar AlvarezNo ratings yet
- EVALUACIÓN DIAGNÓSTICA TerminadaDocument5 pagesEVALUACIÓN DIAGNÓSTICA TerminadaIvaan RomaanNo ratings yet
- Entrega Tarea 3 IRHDocument17 pagesEntrega Tarea 3 IRHfernando orosNo ratings yet
- Reactores ProyectoDocument3 pagesReactores ProyectoAdrian Alvarez SaltoNo ratings yet
- Determinación de cloruros métodos Mohr Fajans VolhardDocument25 pagesDeterminación de cloruros métodos Mohr Fajans VolhardKevin AlfaroNo ratings yet
- 1ep - Iq 2 (N)Document1 page1ep - Iq 2 (N)Xavii ZyanNo ratings yet
- Celda GalvánicaDocument5 pagesCelda GalvánicaCguti612No ratings yet
- Reporte 2 Grupo 4p-1Document24 pagesReporte 2 Grupo 4p-1jisharNo ratings yet
- Equilibrio de Fases Líquido-Vapor en Sistemas BinariosDocument11 pagesEquilibrio de Fases Líquido-Vapor en Sistemas BinariosYasmin PaolaNo ratings yet
- Problema 6Document2 pagesProblema 6yossymarNo ratings yet
- Ejercicos Cinetica QuimicaDocument25 pagesEjercicos Cinetica QuimicaNadia FernandezNo ratings yet
- F.S.Tarea1 GAMRDocument11 pagesF.S.Tarea1 GAMRGabriel RochaNo ratings yet
- Problemario3. PolarimetríaDocument2 pagesProblemario3. PolarimetríaAlexis GarcíaNo ratings yet
- Problemas RFP 2018082111Document6 pagesProblemas RFP 2018082111Jorge Gutierrez AranibarNo ratings yet
- Pre-Reporte 7Document9 pagesPre-Reporte 7angelNo ratings yet
- CUESTIONARIO Quimicccccca ADocument2 pagesCUESTIONARIO Quimicccccca AcristianNo ratings yet
- Tarea 03Document2 pagesTarea 03Roger Rojas PadillaNo ratings yet
- Química Orgánica I ProblemasDocument5 pagesQuímica Orgánica I ProblemasGuery SaenzNo ratings yet
- Primer Parcial Intermedia 2 USACDocument9 pagesPrimer Parcial Intermedia 2 USACManola LunaNo ratings yet
- 2 - PH Curvas de Titulacion y Soluciones BufferDocument7 pages2 - PH Curvas de Titulacion y Soluciones Bufferstephanie esther escobar sotoNo ratings yet
- Síntesis de Un Halogenuro de AlquiloDocument17 pagesSíntesis de Un Halogenuro de AlquiloChristopher RamosNo ratings yet
- Problemas 1 Flores Garcia Elizabeth CompressDocument18 pagesProblemas 1 Flores Garcia Elizabeth CompressCarlos Antonio Arias ChoquehuancaNo ratings yet
- Ejemplos Balances C Reaccion Recirculado Purga09PDocument5 pagesEjemplos Balances C Reaccion Recirculado Purga09PArthursskNo ratings yet
- ArgentometríaDocument5 pagesArgentometríaCcortesO100% (1)
- Reporte 3 Analisis CualitativoDocument20 pagesReporte 3 Analisis CualitativoPablo DLNo ratings yet
- Reporte No. 2 Lab. Analisis CuantitativoDocument12 pagesReporte No. 2 Lab. Analisis CuantitativoRicaarDo BlaancoNo ratings yet
- Termodinamica Del Equilibrio Tarea 2 PDFDocument1 pageTermodinamica Del Equilibrio Tarea 2 PDFErika LM100% (1)
- Agua ButanolDocument3 pagesAgua ButanolElvisNo ratings yet
- Química analítica - problemas de ácidos y basesDocument1 pageQuímica analítica - problemas de ácidos y basesRocio BedogniNo ratings yet
- Global Transferencia de MomentoDocument4 pagesGlobal Transferencia de MomentoArmando APNo ratings yet
- Pre - Reporte 3 CapilaridadDocument7 pagesPre - Reporte 3 CapilaridadEmily GonzalezNo ratings yet
- Ejemplo de 5.1Document6 pagesEjemplo de 5.1Kevin Jholsin Soto CalixtoNo ratings yet
- Clase # 8 Constante de AcidezDocument28 pagesClase # 8 Constante de AcidezJennifer Montenegro ParraNo ratings yet
- Post Test UNIDAD 4Document2 pagesPost Test UNIDAD 4Jesus HernandezNo ratings yet
- Problemas de Analisis InstrumentalDocument3 pagesProblemas de Analisis Instrumentalluis carlos jimenez gameros100% (1)
- Tarea 7.Document4 pagesTarea 7.Jesus Hernandez100% (1)
- Variables de ProcesoDocument6 pagesVariables de ProcesoAINA DANAE HEREDIA CASTRONo ratings yet
- Aldehidos y Cetonas ReaccionesDocument79 pagesAldehidos y Cetonas ReaccionesOmar Michel GonzalezNo ratings yet
- Discusion 3Document9 pagesDiscusion 3Luis EnriqueNo ratings yet
- El Óxido de Etileno Es Producido Por Oxidación Catalítica Del EtilenoDocument1 pageEl Óxido de Etileno Es Producido Por Oxidación Catalítica Del EtilenoDailen PalominoNo ratings yet
- Reporte 2 EstereoisomeriaDocument12 pagesReporte 2 Estereoisomeria201801240Linda Gabriela Paz LinaresNo ratings yet
- FQ - Aplicaciones de Beta y Kappa - MCBVDocument2 pagesFQ - Aplicaciones de Beta y Kappa - MCBVMARIA DEL CARMEN BARAJAS VALDIVIANo ratings yet
- Practica 5 - AnalisisDocument10 pagesPractica 5 - AnalisisJV JhonnyNo ratings yet
- CV-T4 Geogebra y SymbolabDocument14 pagesCV-T4 Geogebra y SymbolabSebastian Vargas García100% (1)
- Tarea Cinética QuímicaDocument3 pagesTarea Cinética QuímicaCarlos VillamarNo ratings yet
- Guía de Cuerpos RígidosDocument22 pagesGuía de Cuerpos RígidosRomulo MelendezNo ratings yet
- Guía de Problemas Nº3-ADocument4 pagesGuía de Problemas Nº3-AAgostina fNo ratings yet
- 760 mph to m/s, 921 kg/m3 to lbm/ft3, 5.37x103 kJ/min to hpDocument3 pages760 mph to m/s, 921 kg/m3 to lbm/ft3, 5.37x103 kJ/min to hpBrenda Contreras0% (2)
- Ejercicios Gravimetría - 01Document1 pageEjercicios Gravimetría - 01Fiorella castillo sanchezNo ratings yet
- Hoja 4 SolubilidadDocument2 pagesHoja 4 SolubilidadA A Asdasd DfNo ratings yet
- boletin9Document3 pagesboletin9Maca Omil MoraNo ratings yet
- Practico 1 QMC108Document2 pagesPractico 1 QMC108Yayner Eliam Garrón PanosoNo ratings yet
- Seminarios de Química General IIDocument6 pagesSeminarios de Química General IIsuscripci3507No ratings yet
- Práctica 3 LOPU ULDADocument14 pagesPráctica 3 LOPU ULDAEmily GonzalezNo ratings yet
- Liq1 Reporte 1 IdctcDocument74 pagesLiq1 Reporte 1 IdctcEmily GonzalezNo ratings yet
- Dilatación Térmica SustanciasDocument9 pagesDilatación Térmica SustanciasEmily GonzalezNo ratings yet
- Anova OstwaldDocument6 pagesAnova OstwaldEmily GonzalezNo ratings yet
- Equipos y Materiales Flujo de FluidosDocument1 pageEquipos y Materiales Flujo de FluidosEmily GonzalezNo ratings yet
- Manual de Nomenclatur Final II PDFDocument34 pagesManual de Nomenclatur Final II PDFEmily GonzalezNo ratings yet
- HDO Práctica de Secado LIQ2Document2 pagesHDO Práctica de Secado LIQ2Emily GonzalezNo ratings yet
- Liq1-Resultados 1-IdctcDocument52 pagesLiq1-Resultados 1-IdctcEmily GonzalezNo ratings yet
- Diagrama LechosDocument1 pageDiagrama LechosEmily GonzalezNo ratings yet
- Examen Final Segundo Semestre 2018Document11 pagesExamen Final Segundo Semestre 2018Emily GonzalezNo ratings yet
- Apendice R1Document5 pagesApendice R1Emily GonzalezNo ratings yet
- Analisis de CorrelacionDocument2 pagesAnalisis de CorrelacionEmily GonzalezNo ratings yet
- Cristaleria y EquipoDocument25 pagesCristaleria y EquipoEmily GonzalezNo ratings yet
- Algoritmo ExperimentalDocument1 pageAlgoritmo ExperimentalEmily GonzalezNo ratings yet
- Diagrama de FlujoDocument14 pagesDiagrama de FlujoEmily GonzalezNo ratings yet
- Folleto de NomenclaturaDocument12 pagesFolleto de NomenclaturaJuan GutierrezNo ratings yet
- Extraccion LiquidoDocument4 pagesExtraccion LiquidoEmily GonzalezNo ratings yet
- 16 PasosDocument11 pages16 PasosEmily GonzalezNo ratings yet
- Cristaleria y EquipoDocument25 pagesCristaleria y EquipoEmily GonzalezNo ratings yet
- Diagrama de FlujoDocument14 pagesDiagrama de FlujoEmily GonzalezNo ratings yet
- 09 Transfer en CIA de MomentumDocument20 pages09 Transfer en CIA de MomentumLilyCáceresPereaNo ratings yet
- 16 PasosDocument11 pages16 PasosEmily GonzalezNo ratings yet
- Variables de Parametro - eDocument3 pagesVariables de Parametro - eEmily GonzalezNo ratings yet
- Folleto de NomenclaturaDocument12 pagesFolleto de NomenclaturaJuan GutierrezNo ratings yet
- Hoja de Trabajo Fuerzas DistribuidasDocument2 pagesHoja de Trabajo Fuerzas DistribuidasEmily GonzalezNo ratings yet
- Envio 7 - ResueltoDocument2 pagesEnvio 7 - ResueltoEmily GonzalezNo ratings yet
- Extraccion LiquidoDocument4 pagesExtraccion LiquidoEmily GonzalezNo ratings yet
- Bitacora Semana 1Document1 pageBitacora Semana 1Emily GonzalezNo ratings yet
- Fluido PatrónDocument2 pagesFluido PatrónEmily GonzalezNo ratings yet
- Universidad San Carlos de Guatemala: Grupo 5 de IngenieríaDocument5 pagesUniversidad San Carlos de Guatemala: Grupo 5 de IngenieríaEmily GonzalezNo ratings yet
- La AutobiografíaDocument5 pagesLa AutobiografíaRUTH MONTENEGRO REAÑONo ratings yet
- Criterios jurídicos para rectificar actas del estado civil en VeracruzDocument19 pagesCriterios jurídicos para rectificar actas del estado civil en VeracruzFernanda SanchezNo ratings yet
- UNSM Matemática Discreta silaboDocument3 pagesUNSM Matemática Discreta silaboItalo QuirozNo ratings yet
- Principios de Logica FilosoficaDocument33 pagesPrincipios de Logica FilosoficaRoberto Trejo Trejo0% (1)
- The Addiction Formula-pdf-SpanishDocument74 pagesThe Addiction Formula-pdf-SpanishJonathan TolentinoNo ratings yet
- 1.-Diseño Molecular de La VidaDocument29 pages1.-Diseño Molecular de La VidaFigueroa CristianNo ratings yet
- Moviento de ProyectilesDocument16 pagesMoviento de ProyectilesalexNo ratings yet
- Ejercicios Comprension LectoraDocument7 pagesEjercicios Comprension LectoraLæ EsNo ratings yet
- Auditoria OperacionalDocument38 pagesAuditoria OperacionalFabian_Antonio_2623100% (5)
- La Oración de La MaestraDocument8 pagesLa Oración de La MaestraBIBINOTENo ratings yet
- Cap 200920 PERU20 PROGRAMA20 JUNTOSDocument44 pagesCap 200920 PERU20 PROGRAMA20 JUNTOSAngela Florez SotoNo ratings yet
- Capitulo 1 - Los Sistemas Electricos - 2018Document61 pagesCapitulo 1 - Los Sistemas Electricos - 2018DEITMAR ALENKAR WARNES MENACHONo ratings yet
- Mitos, Creencias y Dogmas)Document14 pagesMitos, Creencias y Dogmas)Isaac AbregoNo ratings yet
- Riesgos IndustrialesDocument28 pagesRiesgos IndustrialesJonathan Bobadilla0% (1)
- Diagnosticar motivación universidad San AgustínDocument12 pagesDiagnosticar motivación universidad San AgustínSonia Elizabeth Uscca NoaNo ratings yet
- Delineando El Plan Estratégico de Mi EmprendimientoDocument2 pagesDelineando El Plan Estratégico de Mi EmprendimientoAngela MorenoNo ratings yet
- Patrones de La Habilidad de Las PalabrasDocument2 pagesPatrones de La Habilidad de Las Palabrasnicolashornos0% (1)
- Plan Mejoramiento - Geometría 8°Document3 pagesPlan Mejoramiento - Geometría 8°Ana Bedoya DíazNo ratings yet
- Mezquita de CórdobaDocument2 pagesMezquita de CórdobaIsmael AuamNo ratings yet
- AcentuaciónDocument24 pagesAcentuaciónJph LibeNo ratings yet
- Principio de Superposición en Análisis EstructuralDocument11 pagesPrincipio de Superposición en Análisis EstructuralHans Andersson Castillo CabanillasNo ratings yet
- Sesion 2. MERCANTILISMODocument16 pagesSesion 2. MERCANTILISMOMarife CastilloNo ratings yet
- Comprensión Del Concepto de Las OperacionesDocument14 pagesComprensión Del Concepto de Las OperacionesgladysehNo ratings yet
- Design Thinking-12-19Document8 pagesDesign Thinking-12-19Anabelen fsNo ratings yet