Professional Documents
Culture Documents
Hexagonal
Hexagonal
Uploaded by
Diana Moedano0 ratings0% found this document useful (0 votes)
6 views86 pagesorg
Original Title
Hexagonal (5)
Copyright
© © All Rights Reserved
Available Formats
PDF or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this Documentorg
Copyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
0 ratings0% found this document useful (0 votes)
6 views86 pagesHexagonal
Hexagonal
Uploaded by
Diana Moedanoorg
Copyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
You are on page 1of 86
Reacciones de Hidrégenos «
en los Compuestos &
Carbonilicos y B-Dicarbonilico :
Reacciones de Condensacion
ie
FFE teks erred
18
ymalmente se piensa en los dcidos come en los Acidos minerales de la quimica inorganica 0
alos acidos carboxilicos de la quimica organica. No obstante, varias familias de compues-
js organicos presentan enlaces carbono-hidrogeno moderadamente débiles y pueden clasifi-
igse COMO Acidos de carbono. En este capitulo se estudian las reacciones de algunos acidos
carbon que comprenden la ruptura de un enlace carbono-hidrégeno y la eliminacion del
-\grégeno como proton. Generalmente se requiere de una base para romper estos enlaces
lsbono-hidrégeno relativamente débiles, y el producto organico de esta reaccion recibe el
qmbre de carbanion (contraccion de carbono-anidn):
BF ROS
hoi wf — BH + —
Acido de carbono Base Carbanién
Los hidrégenos de la mayoria de los enlaces carbono-hidrégeno no son muy acidos, de
lanera que deben emplearse bases fuertes para romperlos; sin embargo, los hidrogenos uni-
lis 2 un atomo de carbono adyacente a un doble enlace carbono-oxigeno son bastante acidos
lacomparacion con, por ejemplo, un enlace C—H en un alcano. Tales hidrogenos reciben el
hombre de hidrégenos ce:
0
| ll
Ho o-G
\
H_ Hidrogeno-w
onde G = —~H, —-R, —Ar, —OR, y otros
Una parte importante de este capitulo se dedica a reacciones que involucran
lidrogenos « y a los carbaniones « que resultan de su a@i.ziraccion por parte de la base.
Muchos de ellos involucran reacciones de condensacién (ver sec. 24.8).
Los hidrégenos @ en los aldehidos, cetonas y ésteres, rucden abstraerse por una base
herte. Los hidrogenos que son a a los dos dobles enlaces ca:>ono-oxigeno son incluso mas
lcidos y, por tanto, son abstraidos por bases mas débiles; los compuestos que presentan este
-fp0 de hidrégeno son ejemplos de los compuestos 8-dicarbonilo:
froy Capitulo 24/ REACCION! JENOS @ EN LOS COMPUESTOS CARBONILicgg ‘
H Hidrogeno w
Compuesto 6-dicarbonilo
donde G y G’ = —H, —R, —Ar, —OR y otros
En nuestro estudio de los hidrogenos « se examina el equilibrio ceto-enol con ci
talle, ya que involucra la formacién de carbaniones a.
Los aldehidos que no contienen hidrégenos a no pueden formar un carbanién , Ex
mentan un tipo especial de reaccion en solucion basica denominada reaceién de Can
lert
Compuestos Carbonilicos
24.1 Acidos de Carbono; Formacion y Estructura de los Carbanione
@
Un método para comparar la acidez de los compuestos es examinar las constantes de
equilibrio para la disociacion de un proton, los valores K,. Considere los compuestos siguien:
tes y sus constantes de disociacién: - i
Propano: CH;CH, —CH,—H === CH,CH,—CH,:® + H® KR, < 10740
Propeno: CH,=CH—CH,—H === CHy=CH—CH,:° +H® Kw 10°36
Acetaldehido: O=¢—CH,-H == 0=C—CH,:? + H®
H A
Acetona: =C—CH,—-H === O=C—CH,:9 + H®
dey CH;
Acetato de etilo: O=C—CH,—-H === O=C—CH,:° + H®
0C,A, bewr,
Al comparar estos compuestos se observa que el acetal: shido, Ja acetona y el acetato de
\ttilo son de acidez bastante semejante y todos poseen un dol:fe enlace carbono-oxigeno, que
se sefiala con negritas. Se conoce la polaridad del doble enlac: “arbono-oxigeno, de modo que No.
debe sorprendernos el hecho de que este grupo polar facili‘c ¢e gran manera la eliminaci6n de_
24,1 WeINOS GF LaFOUTIY, FOTNaUIUN y ESUULLUT Ue Us Cervelo me
nidroxido de sodio acuoso es lo suficientemente basico como para abstraer un hidr6
“de un aldehido o una cetona, pero cl equilibrio favorece al compuesto carbonilic«
Hidrogeno Acido Base Carbanién a
del carbono a
i ie R = H, alquilo 0 arilo
oncentracion de equilibrio del carbanion siempre es muy pequefia.
La solucién de hidroxido de sodio acuoso no puede emplearse para eliminar un hidr
go de un éster, ya que hidrolizaria al grupo éster. No obstante, puede formarse u
panion cw en un éster mediante el uso de un ion alcoxido como base, en el alcohol. El ic
jjaxido y el alcohol siempre deben contener el mismo grupo R como la parte alcohélica d
‘ar, Aqui el equilibrio también favorece al éster libre mas que a su carbanion a.
|; Esteres: ‘
Les tI .
RO-C—G 5+} <= RO-C—C— + HOR .
‘ ¥ 6
Midroaeas #88 Base Carbaniona
De hecho, los carbaniones « pueden formarse en compuestos diferentes a los aldehidc
etonas, ésteres y compuestos 8-dicarbonilicos. Con una seleccin adecuada de la base,
muede generar un carbanion en posicién « a un grupo acilo en un anhidrido (ver sec. 24.1
del grupo ciano en un nitrilo, o del grupo nitro en un compuesto nitro (ver sec. 24.18). C
é fa compuesto debe poseer, por supuesto, un hidrogeno &. Por otra parte, los carbanione:
yo pueden generarse en los cloruros de acilo, ya que este grupo funcional es tan reacti
wn respecto a cualquier especie basica, que experimenta una sustitucion nucleofilica de ac
preferencia a la formacién del carbanién. Un Gcido carboxilico presenta el proton m
| acido unido al grupo carboxilo, que se sustrae en presencia de una base para producir
ion carboxilato mas que un carbanion. Por ultimo, los hidrégenos enlazados al nitroge
| ei una amida son mas acidos y, por lo regular, mas faciles de separar por medio de una ba
que los hidrégenos w. En la seccion 28.10A se analizan Jas propiedades acidas del enl:
iH en las amidas. Ademas, las amidas experimentan una sustitucion nucleofilica de ac
(por ejemplo, 1a hidrélisis) en presencia de ciertas bases.
La estabilidad poco comun de un carbanion « generado en el carbono adyacente a
. loble enlace carbono-oxigeno, proporciona una fuerza directriz adicional para su fort
- cin, Ahora examinemos la estructura electronica de un carbanién a. Es posible pror
F cionar dos estructuras de éste, Tales estructuras de resonancia se presentan aqui junto co!
* csiructura hibrida que mejor representa la distribuci6n electronica en el anion!
You might also like
- Tercer Examen ReactquimhomDocument3 pagesTercer Examen ReactquimhomDiana MoedanoNo ratings yet
- Curvas de SecadoDocument6 pagesCurvas de SecadoDiana MoedanoNo ratings yet
- Solucion Del Examen PDFDocument5 pagesSolucion Del Examen PDFDiana MoedanoNo ratings yet
- Previo Secador Rotatorio-Diana Laura Moedano PérezDocument7 pagesPrevio Secador Rotatorio-Diana Laura Moedano PérezDiana MoedanoNo ratings yet
- ConclusionesDocument2 pagesConclusionesDiana MoedanoNo ratings yet
- FerrostalDocument33 pagesFerrostalDiana MoedanoNo ratings yet
- LN KDocument2 pagesLN KDiana MoedanoNo ratings yet
- Publicidad Subliminal en Nuestros TiemposDocument9 pagesPublicidad Subliminal en Nuestros TiemposDiana MoedanoNo ratings yet
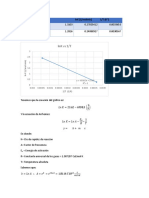
- Gráfico 9. Sistema 9 Abs Vs Tiempo: 1.07 1.27 F (X) 0.0051164336x + 0.5925151515 R 0.9650452363Document1 pageGráfico 9. Sistema 9 Abs Vs Tiempo: 1.07 1.27 F (X) 0.0051164336x + 0.5925151515 R 0.9650452363Diana MoedanoNo ratings yet
- P6EQ7Document8 pagesP6EQ7Ybonhe Ahava Ezmer100% (1)
- 338260846Document10 pages338260846Diana MoedanoNo ratings yet
- Reactores 3er ParcialDocument20 pagesReactores 3er ParcialDiana MoedanoNo ratings yet
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (897)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (844)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (540)
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5810)
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (401)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (590)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (348)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (74)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (266)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2259)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1092)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (122)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (822)