Professional Documents
Culture Documents
PRACTICA No 4 y 7
Uploaded by
Mauricio Rodriguez RamirezOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
PRACTICA No 4 y 7
Uploaded by
Mauricio Rodriguez RamirezCopyright:
Available Formats
PRACTICA No.
04 – TEJIDOS VEGETALES
Presencial x Autodirigida Remota
Tipo de practica
Otra ¿Cuál
Temáticas de la práctica Tejidos vegetales: protector, parenquimático, conductor y de sostén.
Propósitos
Esta práctica permite a los estudiantes comprobar la diversidad y
especialización de los tejidos vegetales , además de adquirir la
habilidad para realizar cortes a mano alzada
Objetivos
Comprobar la diversidad y especialización de las células
vegetales y sus agrupaciones en tejidos.
Intencionalidades formativas Agudizar el sentido de la observación de las estructuras
vegetales, aspecto importante para comprender la morfología
vegetal.
Meta
Diferenciar los tipos de tejido vegetal
Competencias
Adquirir habilidad en la elaboración de cortes a mano alzada y en
coloración
Fundamentación Teórica
Revisar el siguiente video:
Salazar, Y & Piña, C. (2005). Tejidos vegetales. Bogotá: Universidad Nacional Abierta y a Distancia.
Recuperado de https://youtu.be/OM-LamKEu6s
Descripción de la practica
En la presente práctica los estudiantes distinguirán las diferentes clases de tejidos vegetales y sus
respectivas funciones.
Recursos a utilizar en la práctica (Equipos / instrumentos)
MATERIALES QUE DEBEN LLEVAR LOS ESTUDIANTES
Hojas de Lirio, Pera, Hojas de olivo. Láminas portaobjetos y laminillas cubreobjetos. Bisturí o cuchilla, Pinza.
MATERIALES QUE SERÁN SUMINITRADOS EN EL LABORATORO
Microscopio.
Software a utilizar en la práctica u otro tipo de requerimiento para el desarrollo de la práctica.
Computador para la observación de los videos de Tejidos vegetales
Metodología
En esta práctica observe a través del microscopio la morfología de los distintos tejidos vegetales.
TEJIDO PROTECTOR
Observación hojas de Lirio
Desarrolle el siguiente diagrama de flujo antes de su ingreso al laboratorio;
1. Tome una hoja de lirio y con un bisturí haga una pequeña incisión en el limbo
2. Con ayuda de una pinza levante la capa externa para obtener una lámina fina.
3. Coloque la lámina fina obtenida en el portaobjetos y agregue una gota agua.
4. Enfoque al microscopio con objetivo de 10x y 40x. Identifique las células oclusivas, los ostiolos y los
cloroplastos.
5. Escriba sus observaciones.
Observación hojas de Olivo
Otro ejemplo de tejido protector puede observarlo en la hoja de olivo.
1. Raspe el envés de una hoja de olivo.
2. Coloque el raspado en una lámina portaobjetos y adicione unas gotas de agua.
3. Observe los pelos escamiformes.
4. Escriba sus observaciones
TEJIDOS MECÁNICOS O DE SOSTÉN
Observación de células de Pera
Desarrolle el siguiente diagrama de flujo antes de su ingreso al laboratorio
1. Raspe con un cuchillo o bisturí una parte pequeña de mesocarpio de pera y colóquela en un
portaobjetos.
2. Coloque el corte en una lámina portaobjetos y adicione unas gotas de agua.
3. Cubra con una laminilla cubreobjetos evitando que se formen burbujas.
4. Elimine el exceso de agua con papel absorbente
5. Observe el microscopio con objetivo de 10 X y 40x. Identifique las esclereidas.
6. Escriba sus observaciones.
Sistema de Evaluación
La evaluación se llevará a cabo por medio de las siguientes actividades
1. Evaluación parcial presencial al iniciar la práctica
2. Asistencia , participación y presentación del informe de la práctica realizada durante el laboratorio
Informe o productos a entregar
INFORME
Debe contener los siguientes puntos:
Respuesta a cuestionario del informe
Resultados + Discusión + Conclusiones
Referencias bibliográficas
El informe debe incluir el siguiente formato donde se registra
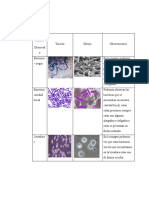
MATERIAL TIPO DE TEJIDO Y ESTRUCTURAS DIBUJO ANÁLISIS Y CONCLUSIONES
BIOLÓGICO OBSERVADAS
(adicionalmente incluya forma
de las células y función del
tejido)
LIRIO
OLIVO
PERA
Además en el informe se deben responder las siguientes preguntas:
1. ¿Qué forma tiene las células observadas?
2. Señale las partes de cada una de las células observadas e identifíquelas su nombre.
3. ¿Defina claramente la función de cada tejido?
PRACTICA No 7. FENÓMENOS DE TRANSPORTE CELULAR
Presencial x Autodirigida Remota
Tipo de práctica
Fenómenos de transporté celular, transporte pasivo, difusión simple,
Temáticas de la práctica difusión facilitada, diálisis, y osmosis
Propósito
Afianzar y aplicar los conocimientos teoricos de los fenomenos de
transporte a traves de la memebrana celular.
Objetivo
Analizar y aplicar los modelos experimentales para observar los
fenómenos de transporte celular, osmosis, plasmólisis y difusión
Intencionalidades formativas
Competencias
Se basan en el dominio la relación cognitivo-procedimental orientada a:
1. Capacidad para reconocer los diferentes fenómenos de transporte
celular
2. Fortalecer los conocimientos teóricos de la célula
3. Aplicar las diferentes técnicas experimentales
Fundamentación Teórica
En todos los sistemas vivos, desde los procariotas hasta los eucariotas multicelulares más complejos, la
regulación del intercambio de sustancias con el mundo inanimado ocurre a nivel de la célula individual y se
realiza a través de la membrana celular. El transporte a través de la membrana ocurre por dos mecanismos
transporte activo y transporte pasivo.
Granillo, V. M. D. P. (2014). Unidad 1. Diversidad Biológica y Taxonomía. Larousse - Grupo Editorial Patria.
Biología general: los sistemas vivientes. (pp. 85-132) México, D.F., Recuperado de
http://bibliotecavirtual.unad.edu.co:2077/lib/unadsp/reader.action?ppg=92&docID=11046867&tm=14679878
55988
Descripción de la práctica
Mediante la práctica se comprenderá que el transporte de moléculas a través de membranas biológicas es de
vital importancia para que se cumplan la mayor parte de los procesos celulares
Recursos a utilizar en la práctica (Equipos / instrumentos)
MATERIALES QUE DEBE LLEVAR EL ESTUDIANTE
Bata Blanca, Guantes.
Papel absorbente
Jabón
Tapabocas.
Papel y lápiz para tomar apuntes
Cebolla
Elodea
Reloj
Lancetas
Láminas portaobjetos, Laminillas
MATERIALES QUE LE SERÁN SUMINISTRADOS EN EL LABORATORIO
Microscopio,
Papel de Arroz o de óptica,
Pipeta de 1 ml
Lugol
Solución de sacarosa al 10%
Cloruro de sodio al 10%, 2%, 0.9% 0.4%
Alcohol antiséptico
Metodología
Experimental
Procedimiento
1. Osmosis en células de Elodea
1.1. Tome con pinzas una hoja de Elodea y adicione una gota de agua de acuario, teniendo en cuenta que el
haz este dirigido hacia arriba.
1.2. Enfoque el borde del ápice de la hoja con objetivos de menor y mayor aumento; observe el arreglo general
de las estructuras celulares y observe detalladamente la relación existente entre la membrana plasmática y la
pared celular. Como la célula está en su medio ambiente natural, la cantidad de agua que entra y sale a la
célula es aproximadamente igual, el volumen celular permanece constante.
1.3. Tome la placa anterior como control para las futuras observaciones
1.4. Prepare un nuevo montaje reemplazando el agua de acuario por una solución de sacarosa al 10%.
Inmediatamente después de haber agregado la sacarosa, anote el tiempo en el que se inicia la observación. A
partir de este momento haga observaciones permanentes sobre una misma célula, hasta que note la aparición
de espacios entre la pared celular y la membrana plasmática.
1.5. Que fenómenos ocurren?, ¿Cuánto tiempo demoro en presentarse el fenómeno?
2. Osmosis en células de cebolla
2.1. Prepare una placa con una muestra de epidermis de cebolla
2.2. Agregue una gota de cloruro de sodio (NaCl) al 10% y deje actuar por unos segundos
2.3. Adicione una gota de Lugol.
2.4. Tome la lámina con la preparación fíjese que esté completamente seca en la parte inferior
2.5. Inicie la observación con el objetivo de 4X seguido del 10X y 40X
2.6. Observe los cambios que ocurren en las células.
2.7. Que fenómenos se presentan? La solución salina al 10% es, con respecto al citoplasma de las células,
hipotónica, hipertónica o isotónica?
3. Osmosis y diálisis en Células Sanguíneas
3.1. Limpie con un algodón empapado en alcohol la yema del dedo, pinche utilizando una lanceta estéril.
3.2. Sobre tres portaobjetos limpios y marcados con los números 1, 2 y 3 coloque una gota de sangre.
3.3. Sobre la lámina número 1, agregue 1 gota de NaCl al 0.9%, cubra con laminillas y observe con aumentó de
40X. Haga un esquema de los eritrocitos y describa la forma de las células, Conserve esta lámina como
control.(en condiciones normales, el suero salino normal 0.9% de NaCl es isotónico para los glóbulos rojos)
3.4. Al portaobjeto número 2, agregue 1 gota de NaCl al 0.4%, cubra con una laminilla, observe y haga el
esquema de los eritrocitos y describa la forma de las células.
3.5. A la lámina número 3, agregue 1 gota de NaCl al 2% cubra con una laminilla, observe y haga el esquema
de los eritrocitos y describa la forma de las células.
3.6. Explique la razón del cambio morfológico en las células con cada una de las soluciones y cuál es la
dirección del flujo del agua en la célula con cada una de las soluciones
Sistema de Evaluación
La evaluación se llevará a cabo por medio de las siguientes actividades
1. Evaluación parcial presencial al iniciar la práctica
3. Presentación de informe de la práctica realizada durante el laboratorio.
Informe o productos a entregar
INFORME
Debe contener los siguientes puntos:
Respuesta a las preguntas planteadas al final de las experiencias realizadas
Explique las diferencias entre transporte activo y transporte pasivo
Explique los mecanismos moleculares del transporte activo a través de la membranas biológicas
Conclusiones
Referencias bibliográficas
En el informe debe incluirse el siguiente cuadro y las respuestas a las preguntas del informe final.
OBJETO OBSERVADO AUMENTO DIBUJO ANÁLISIS Y CONCLUSIONES
Osmosis en la célula de 40X
la Elodea
Osmosis en la célula de 40X
la cebolla
Osmosis y diálisis en 40X
células sanguíneas
0.9%
0.4%
2%
You might also like
- Memoria Curso Fertilización FoliarDocument145 pagesMemoria Curso Fertilización Foliarttonitta6956100% (2)
- Proceso de Extendido de TelaDocument25 pagesProceso de Extendido de TelaJhonny R100% (1)
- Guía Ilustrada Orquideas PDFDocument12 pagesGuía Ilustrada Orquideas PDFDiego QuinteroNo ratings yet
- Células Eucariotas. Informe de práctica de Biología CelularDocument8 pagesCélulas Eucariotas. Informe de práctica de Biología CelularJavier Moisés100% (1)
- Informe de LaboratorioDocument30 pagesInforme de Laboratoriotakira18No ratings yet
- Funciones Y Componentes de Una Sarta de PerforaciónDocument5 pagesFunciones Y Componentes de Una Sarta de PerforaciónAnyelo Alvarado33% (3)
- Análisis Teórico y Acercamiento A Las Primeras EtapasDocument12 pagesAnálisis Teórico y Acercamiento A Las Primeras Etapaserika ceraNo ratings yet
- Informe Practica 4Document8 pagesInforme Practica 4Alexandra MoralesNo ratings yet
- Taller 2 - Unidades Químicas de ConcentraciónDocument4 pagesTaller 2 - Unidades Químicas de ConcentraciónLUZ ANGELA ABRIL LUNANo ratings yet
- Transporte celular: Difusión, ósmosis y plasmólisisDocument5 pagesTransporte celular: Difusión, ósmosis y plasmólisisMartines JuarezNo ratings yet
- Tarea 1 RadiobiologiaDocument5 pagesTarea 1 RadiobiologiaZuly Duran OrtegaNo ratings yet
- Informe Del Laboratorio 6-7-8Document25 pagesInforme Del Laboratorio 6-7-8carlos andres BeltranNo ratings yet
- Ensayo Sobre La Comprensión HumanaDocument6 pagesEnsayo Sobre La Comprensión HumanaCarlos SanchezNo ratings yet
- QB06 Taller IIDocument10 pagesQB06 Taller IICarolina Carvajal0% (3)
- Informe Laboratorio de Biología N°2Document13 pagesInforme Laboratorio de Biología N°2YEGONo ratings yet
- Práctica 3 - Observación de Cloroplastos en Células Vegetales y La Ciclosis en ElodeaDocument5 pagesPráctica 3 - Observación de Cloroplastos en Células Vegetales y La Ciclosis en ElodeaElhy Valencia RomeroNo ratings yet
- Trabajo Biologia Colaborativo LABO 1 56 UNADDocument29 pagesTrabajo Biologia Colaborativo LABO 1 56 UNADandres garciaNo ratings yet
- Práctica N 01 Laboratorio BiologiaDocument17 pagesPráctica N 01 Laboratorio BiologiaSalomon0% (1)
- Ecologia Tarea 4Document19 pagesEcologia Tarea 4juancoropezaNo ratings yet
- Unidad 1Document5 pagesUnidad 1Stefani PLNo ratings yet
- Fisiologia Vegetal 1Document6 pagesFisiologia Vegetal 1camiloNo ratings yet
- Reporte de laboratorio de Biología sobre estructuras celularesDocument8 pagesReporte de laboratorio de Biología sobre estructuras celularesalberto riveraNo ratings yet
- Fase 1 - Elaboración de Ensayo y VideoDocument4 pagesFase 1 - Elaboración de Ensayo y VideoLina MariaNo ratings yet
- Una Voz en La Fuga CosmicaDocument2 pagesUna Voz en La Fuga CosmicaMartha RamNo ratings yet
- Practica Laboratorio Biología (2020)Document18 pagesPractica Laboratorio Biología (2020)57482984100% (2)
- Informe Lab BiologiaDocument44 pagesInforme Lab BiologiaFranklin GutiérrezNo ratings yet
- Principios Básicos de QuímicaDocument22 pagesPrincipios Básicos de QuímicaCrystal GarzaNo ratings yet
- Medición propiedades físicas sólidos líquidosDocument5 pagesMedición propiedades físicas sólidos líquidosmanuel_narvaez_1550% (2)
- Bosquejo Entrega TrabajoDocument43 pagesBosquejo Entrega TrabajovivianaalexandracuycorredorNo ratings yet
- Discu AlgodonDocument2 pagesDiscu AlgodonNayelis ChavezNo ratings yet
- Formato de Entrega Tarea 4 EcologiaDocument5 pagesFormato de Entrega Tarea 4 EcologiaDaniel Orosco HernandezNo ratings yet
- Tarea 4 - Ecología - Luis AlbertoDocument5 pagesTarea 4 - Ecología - Luis Albertosergio pinedaNo ratings yet
- Vision Global de La Celula PDFDocument2 pagesVision Global de La Celula PDFXimena PinzonNo ratings yet
- Informe Laboratorio - Biologia UTDocument6 pagesInforme Laboratorio - Biologia UTMaria Paula CalderónNo ratings yet
- Informe de RaizDocument10 pagesInforme de RaizMary RosesNo ratings yet
- Informe 1Document9 pagesInforme 1diegoNo ratings yet
- Practica 3Document6 pagesPractica 3JAWERNo ratings yet
- Ensayo de AlgaDocument8 pagesEnsayo de AlgaGLENDYNORENo ratings yet
- Bioseguridad LaboratorioDocument117 pagesBioseguridad LaboratorioDavid PrietoNo ratings yet
- Membrana Difusión Osmosis FactoresDocument6 pagesMembrana Difusión Osmosis FactoresALEXA TATIANA TRIANA GUTIERREZNo ratings yet
- Practicas de Laboratorio de Biologia (Informe Total)Document104 pagesPracticas de Laboratorio de Biologia (Informe Total)Catherin Alejandra OrtizNo ratings yet
- PRACTICA No1Document12 pagesPRACTICA No1johann roldanNo ratings yet
- InventarioFloraProcedimientosDocument1 pageInventarioFloraProcedimientosmarianeNo ratings yet
- 07.1 Informe - Celulas Vegetales y AnimalesDocument9 pages07.1 Informe - Celulas Vegetales y AnimalesArmandoNo ratings yet
- Volver La Mirada Al SujetoDocument3 pagesVolver La Mirada Al SujetoJonathan Castro0% (1)
- Informe Final Practica de LaboratorioDocument23 pagesInforme Final Practica de Laboratoriojohn moreno100% (1)
- Informe Laboratorio - Practica 1 2 3Document26 pagesInforme Laboratorio - Practica 1 2 3greys olarteNo ratings yet
- Sistema Ecológico PDFDocument4 pagesSistema Ecológico PDFJafet Isa100% (2)
- Pre Informe de Laboratorio No 1 2 3 BiologiaDocument66 pagesPre Informe de Laboratorio No 1 2 3 BiologiaRodrigo JimenezNo ratings yet
- Importancia de La Biología Como Ser Vivo y Como IngenieroDocument6 pagesImportancia de La Biología Como Ser Vivo y Como IngenieroKateNo ratings yet
- METODOLOGIADocument2 pagesMETODOLOGIAclaudiaNo ratings yet
- Taller Sobre Densidad de Cuerpos Reguales e IrregularesDocument1 pageTaller Sobre Densidad de Cuerpos Reguales e IrregularesCarlos Eduardo Vinasco100% (1)
- Tarea 2 - BIOQUIMICADocument7 pagesTarea 2 - BIOQUIMICAJhon Barrios100% (1)
- Actividad Final 5 Tarea 5 - Evalacuon POADocument10 pagesActividad Final 5 Tarea 5 - Evalacuon POAGELMIS ANDREA MUÑOZNo ratings yet
- Informe Practica de Laboratorio Grupo 6. (Autoguardado)Document41 pagesInforme Practica de Laboratorio Grupo 6. (Autoguardado)angie carolina mieles hernandez100% (1)
- Guía # 6 Enlace QuímicoDocument13 pagesGuía # 6 Enlace QuímicoWilson Antonio Rincón MartínezNo ratings yet
- Practica 4Document2 pagesPractica 4CRISTIAN CAMILO MONSALVE MORCILLONo ratings yet
- Com Obj29 FraccionesDocument2 pagesCom Obj29 FraccionesPatricia Salazar Morales100% (1)
- Trabajo Final. Estadística Descriptiva UnadDocument32 pagesTrabajo Final. Estadística Descriptiva UnadCarmen Elisa GonzalezNo ratings yet
- Etapa 1 y 2 de FilosofíaDocument24 pagesEtapa 1 y 2 de FilosofíaJohnnyJimenez67% (6)
- Biomoléculas evolución célulasDocument3 pagesBiomoléculas evolución célulasangie garzonNo ratings yet
- Resolución 2115 de 2017Document16 pagesResolución 2115 de 2017oscar espinelNo ratings yet
- Mitosis y Meiosis en Células VegetalesDocument12 pagesMitosis y Meiosis en Células VegetalesPaola TorresNo ratings yet
- Manual Lab. Biol. Cel y Tis. 2019-1 Dr. Raul Miranda BernachoDocument52 pagesManual Lab. Biol. Cel y Tis. 2019-1 Dr. Raul Miranda BernachoRicardo GuzmanNo ratings yet
- Consolidado Final BiodiversidadDocument10 pagesConsolidado Final BiodiversidadMauricio Rodriguez RamirezNo ratings yet
- Cuadro No 1 Descripción Tejidos VegetalesDocument3 pagesCuadro No 1 Descripción Tejidos VegetalesMauricio Rodriguez RamirezNo ratings yet
- Examen de Los Efectos Del ProblemaDocument5 pagesExamen de Los Efectos Del ProblemaMauricio Rodriguez RamirezNo ratings yet
- Analizar Por Qué Es Necesario Que Los Profesionales Revisen Las Teorías y Paradigmas Que Orientan El Conocimiento Desarrollado y Aprendido en Su Formación ProfesionalDocument1 pageAnalizar Por Qué Es Necesario Que Los Profesionales Revisen Las Teorías y Paradigmas Que Orientan El Conocimiento Desarrollado y Aprendido en Su Formación ProfesionalMauricio Rodriguez RamirezNo ratings yet
- Tarea2 Identificación BotánicaEconómicaDocument27 pagesTarea2 Identificación BotánicaEconómicaMauricio Rodriguez RamirezNo ratings yet
- 269 Taller 2 Logica MatematicaDocument7 pages269 Taller 2 Logica MatematicaMauricio Rodriguez RamirezNo ratings yet
- Fase 3 - Estadística para AgrariasDocument22 pagesFase 3 - Estadística para AgrariasMauricio Rodriguez RamirezNo ratings yet
- Tarea2 Identificación BotánicaEconómicaDocument27 pagesTarea2 Identificación BotánicaEconómicaMauricio Rodriguez RamirezNo ratings yet
- Cómo El Diálogo Interdisciplinario Sirve para La Solución de Problemas ActualesDocument2 pagesCómo El Diálogo Interdisciplinario Sirve para La Solución de Problemas ActualesMauricio Rodriguez Ramirez100% (9)
- Cómo El Diálogo Interdisciplinario Sirve para La Solución de Problemas ActualesDocument2 pagesCómo El Diálogo Interdisciplinario Sirve para La Solución de Problemas ActualesMauricio Rodriguez Ramirez100% (9)
- Logica Matematica Taller 1Document9 pagesLogica Matematica Taller 1Mauricio Rodriguez Ramirez0% (1)
- Cuadro Comparativo Instiruciones Que Brindan Extension AgricolaDocument4 pagesCuadro Comparativo Instiruciones Que Brindan Extension AgricolaMauricio Rodriguez RamirezNo ratings yet
- Aprendizaje Colegial e InnovaciónDocument10 pagesAprendizaje Colegial e InnovaciónMauricio Rodriguez RamirezNo ratings yet
- Biologia 113 PreTarea MauricioRodriguezDocument4 pagesBiologia 113 PreTarea MauricioRodriguezMauricio Rodriguez RamirezNo ratings yet
- Informe Laboratorio - Biología 3 5 6 y 7Document34 pagesInforme Laboratorio - Biología 3 5 6 y 7Mauricio Rodriguez RamirezNo ratings yet
- Cuento SolidaridadDocument1 pageCuento SolidaridadMauricio Rodriguez RamirezNo ratings yet
- Extensión AgrícolaDocument3 pagesExtensión AgrícolaMauricio Rodriguez RamirezNo ratings yet
- Ensayo La Importancia Del Sector Agropecuario - MauriciorodriguezDocument5 pagesEnsayo La Importancia Del Sector Agropecuario - MauriciorodriguezMauricio Rodriguez RamirezNo ratings yet
- Cararterizacion Del Riego en El Cultivo Caña de Azucar - 0310111323Document17 pagesCararterizacion Del Riego en El Cultivo Caña de Azucar - 0310111323Mauricio Rodriguez RamirezNo ratings yet
- Trabajo GramineasDocument35 pagesTrabajo GramineasMauricio Rodriguez RamirezNo ratings yet
- Proyecto PisciculturaDocument22 pagesProyecto PisciculturaAndrea VillanuevaNo ratings yet
- Balance Agropecuario 2014colombiaDocument5 pagesBalance Agropecuario 2014colombiaMauricio Rodriguez RamirezNo ratings yet
- Comprension LectoraDocument6 pagesComprension Lectorahenar0% (1)
- Hormonasvegetales 110709101959 Phpapp02Document6 pagesHormonasvegetales 110709101959 Phpapp02Paul BancesNo ratings yet
- Magnoliopsidas y LiliopsidasDocument10 pagesMagnoliopsidas y Liliopsidasmarco leonNo ratings yet
- Informe de Practica - BiologíaDocument13 pagesInforme de Practica - BiologíaLisbeth Flores HidalgoNo ratings yet
- Paquete Tecnológico - CafeDocument12 pagesPaquete Tecnológico - CafeNeztor YaraNo ratings yet
- ArbustosJardinesDiseñoDocument148 pagesArbustosJardinesDiseñoVik Vignati100% (1)
- Ciencias NaturalesDocument12 pagesCiencias NaturalesNadia Maribel Medel PrietoNo ratings yet
- Cedula Del Cultivo de QuinuaDocument22 pagesCedula Del Cultivo de QuinuajaimeparihuanaNo ratings yet
- Phaseolus Vulgaris IIDocument54 pagesPhaseolus Vulgaris IIJonathan Harvey Poveda RicoNo ratings yet
- Universidad Mayor de San Andres Facultad de Agronomía Carrera de Ingenieria AgronómicaDocument90 pagesUniversidad Mayor de San Andres Facultad de Agronomía Carrera de Ingenieria AgronómicaIbar QDNo ratings yet
- Herbario AgronomiaDocument13 pagesHerbario AgronomiaDC JhAymeNo ratings yet
- Guia Autoaprendizaje Estudiante 8vo Grado Ciencia f3 s7 ImpresoDocument5 pagesGuia Autoaprendizaje Estudiante 8vo Grado Ciencia f3 s7 ImpresoJose HernandezNo ratings yet
- Efecto Del N2 Sobre El Crecimiento de Brassica RapaDocument9 pagesEfecto Del N2 Sobre El Crecimiento de Brassica RapaJordiDiazGarciaNo ratings yet
- Usos de los helechos en horticultura, medicina y másDocument2 pagesUsos de los helechos en horticultura, medicina y másFernando Quispe100% (1)
- Tegido VegetalDocument5 pagesTegido VegetalZolo Dexime WilsebasNo ratings yet
- Actividades de Aula. Fuente MoralesDocument36 pagesActividades de Aula. Fuente MoralesMaría Pérez100% (1)
- Morfologia Del La Raiz y El TalloDocument6 pagesMorfologia Del La Raiz y El TallosergioNo ratings yet
- CACTACEASDETACNA Jos Pizarro Excerpted PDFDocument39 pagesCACTACEASDETACNA Jos Pizarro Excerpted PDFOdardauc YllenNo ratings yet
- Clase 11 FarmacobotánicaDocument19 pagesClase 11 FarmacobotánicaAbi RojasNo ratings yet
- CocoDocument47 pagesCocoEspinoza JalitoNo ratings yet
- Árboles y VegetaciónDocument4 pagesÁrboles y VegetaciónJorge CruzNo ratings yet
- PLANTASDocument12 pagesPLANTASsilvanqNo ratings yet
- Filoenia de IngaDocument4 pagesFiloenia de IngaBaldoRinconCotesNo ratings yet
- Manual Cultivo Cebolla AjoDocument49 pagesManual Cultivo Cebolla AjoRichard Alberto Aguilar BarrigaNo ratings yet
- Recursos Forrajeros TrópicalesDocument95 pagesRecursos Forrajeros TrópicalesMario AcostaNo ratings yet
- Guía de trabajo autónomo sobre plantasDocument11 pagesGuía de trabajo autónomo sobre plantasMarjorieNo ratings yet