Professional Documents
Culture Documents
Aminoácidos
Uploaded by
josexuuCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Aminoácidos
Uploaded by
josexuuCopyright:
Available Formats
4.
2- Aminoácidos:
Un aminoácido, como su nombre indica, es una molécula orgánica con un grupo amino (-NH 2) y
un grupo carboxilo (-COOH; ácido). Los aminoácidos más frecuentes y de mayor interés son
aquellos que forman parte de las proteínas.
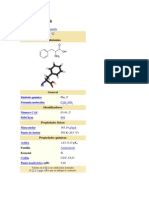
Estructura: La estructura general de un aminoácido se establece por la presencia de un carbono
central alfa unido a: un grupo carboxilo (rojo en la figura), un grupo amino (verde), un hidrógeno
(en negro) y la cadena lateral (azul).
donde "R" representa la cadena lateral, específica para cada aminoácido. Técnicamente
hablando, se los denomina alfa-aminoácidos, debido a que el grupo amino (–NH 2) se encuentra
a un átomo de distancia del grupo carboxilo (–COOH). Como dichos grupos funcionales poseen
H en sus estructuras químicas, son grupos susceptibles a los cambios de pH; por eso, al pH de
la célula prácticamente ningún aminoácido se encuentra de esa forma, sino que se encuentra
ionizado.
Los aminoácidos a pH bajo (ácido) se encuentran mayoritariamente en su forma catiónica (con
carga positiva), y a pH alto (básico) se encuentran en su forma aniónica (con carga negativa).
Sin embargo, existe un pH especifico para cada aminoácido, donde la carga positiva y la carga
negativa son de la misma magnitud y el conjunto de la molécula es eléctricamente neutro. En
este estado se dice que el aminoácido se encuentra en su forma de ion dipolar o zwitterión.
Clasificación de los aminoácidos : Los aminoácidos se clasifican habitualmente según las
propiedades de su cadena lateral:
Neutros polares, polares o hidrófilos : Serina (Ser,S), Treonina (Thr,T), Cisteína (Cys,C),
Asparagina (Asn,N), Glutamina (Gln, Q) y Tirosina (Tyr,Y).
Neutros no polares, apolares o hidrófobos : Glicina (Gly,G), Alanina (Ala,A), Valina
(Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro,P),
Fenilalanina (Phe,F) y Triptófano (Trp,W).
Con carga negativa, o ácidos: Ácido aspártico (Asp,D) y Ácido glutámico (Glu,E).
Con carga positiva, o básicos: Lisina (Lys,K), Arginina (Arg,R) e Histidina (His,H).
Aromáticos: Fenilalanina (Phe,F), Tirosina (Tyr,Y) y Triptófano (Trp,W) (ya incluidos en
los grupos neutros polares y neutros no polares).
A los aminoácidos que necesitan ser ingeridos por el cuerpo para obtenerlos se los llama
esenciales; la carencia de estos aminoácidos en la dieta limita el desarrollo del organismo, ya
que no es posible reponer las células de los tejidos que mueren o crear tejidos nuevos, en el
caso del crecimiento. Para el ser humano, los aminoácidos esenciales son:
Valina (Val)
Leucina (Leu)
Treonina (Thr)
Lisina (Lys)
Triptófano (Trp)
Histidina (His)
Fenilalanina (Phe)
Isoleucina (Ile)
Arginina (Arg) (Requerida en niños y tal vez ancianos)
Metionina (Met)
Propiedades:
Ácido-básicas.
Comportamiento de cualquier aminoácido cuando se ioniza. Cualquier aminoácido
puede comportarse como ácido y como base, se denominan sustancias anfóteras.
Cuando una molécula presenta carga neta cero está en su punto isoeléctrico. Si un
aminoácido tiene un punto isoeléctrico de 6,1 su carga neta será cero cuando el pH sea
6,1.
Los aminoácidos y las proteínas se comportan como sustancias tampón.
Ópticas.
Todos los aminoácidos excepto la glicina tienen el carbono alfa asimétrico, lo que les
confiere actividad óptica; esto es, sus disoluciones desvían el plano de polarización
cuando un rayo de luz polarizada las atraviesa. Si el desvío del plano de polarización es
hacia la derecha (en sentido horario), el compuesto se denomina dextrógiro, mientras
que si se desvía a la izquierda (sentido antihorario)se denomina levógiro. Un aminoácido
puede en principio existir en sus dos formas enantioméricas (una dextrógira y otra
levógira), pero en la naturaleza lo habitual es encontrar sólo una de ellas.
Estructuralmente, las dos posibles formas enantioméricas de cada aminoácido se
denominan configuración D o L dependiendo de la orientación relativa en el espacio de
los 4 grupos distintos unidos al carbono alfa. El hecho de que sea dextrógiro no quiere
decir que tenga configuración D.
Químicas.
Las que afectan al grupo carboxilo, como la descarboxilación.
Las que afectan al grupo amino, como la desaminación.
Las que afectan al grupo R.
Reacciones de los aminoácidos:
En los aminoácidos hay tres reacciones principales que se inician cuando un aminoácido se une
con el piridoxal-P formando una base de Schiff o aldimina. De ahí en adelante la transformación
depende de las enzimas, las cuales tienen en común el uso de la coenzima piridoxal-fosfato. Las
reacciones que se desencadenan pueden ser:
1. la transaminación (transaminasa): Necesita la participación de un α-cetoácido.
2. la descarboxilación
3. la racemización: Es la conversión de un compuesto L en D, o viceversa. Aunque en las
proteínas de un ser vivo los aminoácidos están presentes únicamente en la forma
estructural levógira (L), en las bacterias podemos encontrar D-aminoácidos.
Fuente: http://es.wikipedia.org/wiki/Amino%C3%A1cido.
Mas información y ejercicios en:
http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B1_BIOQUIMICA/t15_PROTEINAS/i
nformacion.htm
You might also like
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017From EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017No ratings yet
- AminoácidoDocument11 pagesAminoácidoAlexander GuadronNo ratings yet
- AMINOACIDOSDocument24 pagesAMINOACIDOSDaniela SmithNo ratings yet
- Estructura Básica de Un AminoácidoDocument6 pagesEstructura Básica de Un AminoácidoJesus DiazNo ratings yet
- Aminoacidos 2022Document12 pagesAminoacidos 2022Sâmuel LópezNo ratings yet
- AMINOACIDODocument12 pagesAMINOACIDOCarmina ChaltelNo ratings yet
- Resumen AminoácidosDocument6 pagesResumen AminoácidosElvisRojas972010No ratings yet
- AminoacidoDocument6 pagesAminoacidoVictor Eduardo Pozo EstradaNo ratings yet
- Estructura General de Un AminoácidoDocument3 pagesEstructura General de Un AminoácidoCRISTHIAN ANTONIO PRIETO COTONo ratings yet
- Produccion de Aminoacidos y BiopolimerosDocument15 pagesProduccion de Aminoacidos y BiopolimerosJhan Montero100% (1)
- AminoácidoDocument9 pagesAminoácidoOliver Martínez BermúdezNo ratings yet
- Aminoácido - Wikipedia, La Enciclopedia LibreDocument14 pagesAminoácido - Wikipedia, La Enciclopedia LibreAnnoli Lugo100% (1)
- AminoácidoDocument9 pagesAminoácidoDiego Alexander Ortiz AsprillaNo ratings yet
- TEMA 3 Aminoácidos y PéptidosDocument7 pagesTEMA 3 Aminoácidos y PéptidosYeniffer MontilvaNo ratings yet
- AminoácidoDocument17 pagesAminoácidoandresleonliveNo ratings yet
- AminoácidoDocument6 pagesAminoácidoDennisOrellanaNo ratings yet
- Aminoacidos ProteinasDocument169 pagesAminoacidos ProteinasRochi Dominguez100% (1)
- Aminoacidos y ProteinasDocument169 pagesAminoacidos y ProteinasExvoxNo ratings yet
- AminoácidosDocument3 pagesAminoácidosMontse BolañosNo ratings yet
- Clase Aminoacidos y ProteinasDocument68 pagesClase Aminoacidos y Proteinaslupita yescaNo ratings yet
- FenilalaninaDocument13 pagesFenilalaninaJonathan CastellanosNo ratings yet
- Aminoacidos y Peptidos PresDocument25 pagesAminoacidos y Peptidos PresAngelNo ratings yet
- Proteinas y EnzimasDocument18 pagesProteinas y EnzimasDiana Fornieles FernandezNo ratings yet
- AminoácidoDocument92 pagesAminoácidoJavier TomalaNo ratings yet
- Trabajo AminoacidosDocument38 pagesTrabajo AminoacidosYojackson Pastran100% (1)
- AminoácidoDocument10 pagesAminoácidoNestorNo ratings yet
- Unidad 4 - ProteinaDocument16 pagesUnidad 4 - ProteinaprimeliaNo ratings yet
- Estructura de AminoácidosDocument8 pagesEstructura de Aminoácidosalcaher72No ratings yet
- AminoacidosDocument34 pagesAminoacidosNatalie BravoNo ratings yet
- Aminoacidos y ProteinasDocument19 pagesAminoacidos y ProteinasInvierno PlNo ratings yet
- Que Son Los AminoácidosDocument4 pagesQue Son Los AminoácidosLaura MartinezNo ratings yet
- Organica 2 Inf 6Document13 pagesOrganica 2 Inf 6ESMIT ROCA SACSARANo ratings yet
- Serie NDocument20 pagesSerie NLeandroNo ratings yet
- Clasificación de Los Aminoácidos en Función de La Naturaleza de Su Cadena LateralDocument8 pagesClasificación de Los Aminoácidos en Función de La Naturaleza de Su Cadena LateralEinstein Martinez MoronNo ratings yet
- AMINOÁCIDOSDocument11 pagesAMINOÁCIDOSHeriberto AngelesNo ratings yet
- Aminoacidos y PeptidosDocument6 pagesAminoacidos y PeptidosRafael B. DiazNo ratings yet
- Aminoacidos y Peptidos I 2021Document55 pagesAminoacidos y Peptidos I 2021paoka100% (1)
- Es Una Molécula Orgánica Con Un Grupo AminoDocument2 pagesEs Una Molécula Orgánica Con Un Grupo AminoHUGO URIEL POSADA DE LA CRUZNo ratings yet
- BIOQUyaMICA I AMINOACIDOS 2020-1Document68 pagesBIOQUyaMICA I AMINOACIDOS 2020-1Sharon PachecoNo ratings yet
- Informe Seminario de ProteínasDocument15 pagesInforme Seminario de ProteínasKatherine A. Mendoza De La CruzNo ratings yet
- Revicion Bibliografica de Los AmiacidosDocument5 pagesRevicion Bibliografica de Los Amiacidosisnamailea BahenaNo ratings yet
- AminoácidosDocument13 pagesAminoácidosluz Erika santiagoNo ratings yet
- Laboratorio de Aminoácidos 2Document14 pagesLaboratorio de Aminoácidos 2Sandy Paola Villera TobonNo ratings yet
- Un AminoácidoDocument19 pagesUn AminoácidoSusanaNo ratings yet
- Cuestionario Tema 6 ProteínasDocument22 pagesCuestionario Tema 6 Proteínasmelanie rojas sanchezNo ratings yet
- Tarea3 Los20AminoácidosProteicos CarmenPontanillaDocument3 pagesTarea3 Los20AminoácidosProteicos CarmenPontanillacarmen PontanillaNo ratings yet
- BIOCÁPSULA AminoácidosDocument4 pagesBIOCÁPSULA AminoácidosEsther MolinaNo ratings yet
- AminoacidosDocument20 pagesAminoacidosClaudia L. Perez100% (2)
- Amino Acid OsDocument35 pagesAmino Acid Osheider manuelNo ratings yet
- Aminoácidos EsencialesDocument5 pagesAminoácidos EsencialesMayerli MoraNo ratings yet
- Aminoácidos y PeptídosDocument32 pagesAminoácidos y PeptídoseliasdavidfutbolNo ratings yet
- Proteínas PDFDocument26 pagesProteínas PDFMiguel ortizNo ratings yet
- AminoasidosDocument19 pagesAminoasidosYulire GarciaNo ratings yet
- Aplicación de Los Aminoácidos en La Química - DayaniDocument18 pagesAplicación de Los Aminoácidos en La Química - DayaniMiguel Angel Campos MarcavillacaNo ratings yet
- Proteinas - Metabolismo y Bioquímica EstructuralDocument6 pagesProteinas - Metabolismo y Bioquímica EstructuralBriyit CastilloNo ratings yet
- AminoácidosDocument9 pagesAminoácidoselisa.avalosNo ratings yet
- Resumen ProteínasDocument18 pagesResumen ProteínasWilson De Jesús Terán FonsecaNo ratings yet
- Aminoacidos y ProteinasDocument47 pagesAminoacidos y ProteinasAngelica DbgNo ratings yet
- Taller 2 Aminoacidos y PeptidosDocument12 pagesTaller 2 Aminoacidos y PeptidosDaniel Felipe CañonNo ratings yet
- Fundamentos Del Arte IMÁGENESDocument2 pagesFundamentos Del Arte IMÁGENESjosexuuNo ratings yet
- Preguntas Sobre Las Brigadas InternacionalesDocument1 pagePreguntas Sobre Las Brigadas InternacionalesjosexuuNo ratings yet
- Biología ExamenDocument9 pagesBiología ExamenjosexuuNo ratings yet
- Concentracion Empresarial y Desarrollo en AlemaniaDocument13 pagesConcentracion Empresarial y Desarrollo en AlemaniajosexuuNo ratings yet
- BiologíaDocument3 pagesBiologíajosexuuNo ratings yet
- GeometríaDocument90 pagesGeometríajosexuuNo ratings yet
- FísicaDocument3 pagesFísicajosexuuNo ratings yet
- Biología 2 BachilleratoDocument2 pagesBiología 2 BachilleratojosexuuNo ratings yet
- MedidasDocument57 pagesMedidasjosexuuNo ratings yet
- Economía de La EmpresaDocument3 pagesEconomía de La EmpresajosexuuNo ratings yet
- GeologíaDocument8 pagesGeologíajosexuuNo ratings yet
- Instrucción S112Document3 pagesInstrucción S112josexuuNo ratings yet
- Permiso Circulacion ProvisionalDocument3 pagesPermiso Circulacion ProvisionaljosexuuNo ratings yet
- Cultura AudiovisualDocument5 pagesCultura AudiovisualjosexuuNo ratings yet
- Dibujo TécnicoDocument6 pagesDibujo TécnicojosexuuNo ratings yet
- Permisos de Conducir de FantasíaDocument3 pagesPermisos de Conducir de FantasíajosexuuNo ratings yet
- PD06-Ald-Cet, RCOOH y DerivadosDocument4 pagesPD06-Ald-Cet, RCOOH y DerivadosdanielNo ratings yet
- Tume Ruesta SegundoDocument21 pagesTume Ruesta SegundoGeorge Dastin Arellano SimbalaNo ratings yet
- Nomenclatura Acidos Grasos AAGG Comparada PDFDocument3 pagesNomenclatura Acidos Grasos AAGG Comparada PDFempreomarNo ratings yet
- Ejemplos de Ácidos Carboxílicos SaturadosDocument8 pagesEjemplos de Ácidos Carboxílicos SaturadosPablo Quelal75% (4)
- Tabla de AminoácidosDocument5 pagesTabla de AminoácidosValeria Colorado BulbarelaNo ratings yet
- Lista de Precios 11 Enero 2021Document22 pagesLista de Precios 11 Enero 2021Operador Telemarketing UnoNo ratings yet
- Taller LipidosDocument3 pagesTaller LipidosAndrea Rodríguez GonzálezNo ratings yet
- Lista de Pedidos Francisco Coronel 7Document2 pagesLista de Pedidos Francisco Coronel 7Takeshi AndrewsNo ratings yet
- Los AminoacidosDocument14 pagesLos AminoacidosAna CastañoNo ratings yet
- Acetato de Etilo - Ácido AcéticoDocument16 pagesAcetato de Etilo - Ácido AcéticoFabio Andre Alanis VallejosNo ratings yet
- UntitledDocument8 pagesUntitledMariana ArregoitiaNo ratings yet
- Lista Actualizada Drog. Plus 23-01-24Document27 pagesLista Actualizada Drog. Plus 23-01-24joseq89navNo ratings yet
- AMINOÁCIDOSDocument26 pagesAMINOÁCIDOSPaola Angelica Mancera RodriguezNo ratings yet
- Anual SM Semana 32 - QuímicaDocument25 pagesAnual SM Semana 32 - QuímicaNando AlarconNo ratings yet
- AGOSTO10Document52 pagesAGOSTO10Luis Augusto Castro GNo ratings yet
- Actualizacion de Precios Enero20213Document38 pagesActualizacion de Precios Enero20213Vanessa Kasandra Pulcha MontenegroNo ratings yet
- Yare CompuDocument2 pagesYare Compuyareli_joeNo ratings yet
- ANTIINFLAMATORIASDocument6 pagesANTIINFLAMATORIASVariedades CajiluguaNo ratings yet
- Guia de Ejercicios Esteres y AmidasDocument6 pagesGuia de Ejercicios Esteres y AmidasTatty KenwanNo ratings yet
- Guia ALDEHIDOSDocument11 pagesGuia ALDEHIDOSBenjiNo ratings yet
- Vademecum MagnachemDocument3 pagesVademecum Magnachemjohn Mata gilNo ratings yet
- Actividad 4. Generalidades de Las Proteínas - JCLRDocument6 pagesActividad 4. Generalidades de Las Proteínas - JCLROmar Samuel Hernández SaavedraNo ratings yet
- Taller #10 (6to)Document4 pagesTaller #10 (6to)Omar SirpaNo ratings yet
- Química Orgánica - Sem-09 - Sesión-09 - 2021-2Document38 pagesQuímica Orgánica - Sem-09 - Sesión-09 - 2021-2Gonzalo RondanNo ratings yet
- Dosis Equivalentes BDZDocument1 pageDosis Equivalentes BDZJezabel DiazNo ratings yet
- AminoacidoDocument6 pagesAminoacidoVictor Eduardo Pozo EstradaNo ratings yet
- Resultados AminoacidosDocument3 pagesResultados AminoacidosLuis Mario HernandezNo ratings yet
- LISTADODROGUERIACARONI16122021Document14 pagesLISTADODROGUERIACARONI16122021Eliana AnguloNo ratings yet
- Ejer - Formulacion OrgánicaDocument10 pagesEjer - Formulacion Orgánicaalexizq79No ratings yet
- Lista 09 Al 13-01-2023 PDFDocument5 pagesLista 09 Al 13-01-2023 PDFMichael Paolo Upiachihua VasquezNo ratings yet