Professional Documents
Culture Documents
Semana 10
Semana 10
Uploaded by
JOSE GABRIEL HUACACHI BAZAN0 ratings0% found this document useful (0 votes)
9 views40 pagesOriginal Title
Semana_10
Copyright
© © All Rights Reserved
Available Formats
PDF or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
0 ratings0% found this document useful (0 votes)
9 views40 pagesSemana 10
Semana 10
Uploaded by
JOSE GABRIEL HUACACHI BAZANCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
You are on page 1of 40
5.6.3 Teorema de equiparticién de la energia
Experimentalmente se encuentra que,
3k
Para gases, la capacidad calorifica molar cy ~ * mientras que para sdlidos ey ~ 3R en un
amplio rango de temperaturas
Esto se puede interpretar como una mauifestaeiéu de los grados de libertad del sistema de tal
1
forma que cada grado de libertad contribuye con 5kT a la energia media del sistema
El utimero de grados de libertad de un sistema es el niimero de variables independientes nece-
sarios para expresar los valores de todas las propiedades de un sistema, en particular el Hamil-
toniano H. Las restricciones o ligaduras limitan el uiimero de grados de libertad.
Noa
Asi Pata V particulas libres H = 3° 2X. donde p? = p+ p3 + p2. Se tienen entonces 3N
23m
grados de libertad,
Asi para V particulas debilmente interactuantes, se tendré un energia media de
Demostramos este resultado.
OH
Blum (0,2,
( oH [en dw
a
ar, fotae
donde H es e] Hamiltoniano clasico: H = H({p,q}) = H(h.--..dy-Di.-
dw = NG dp = dey. doy
a
or; or;
Iniegramos por partes el numerador con respecto a 7}
-ai OH oy
lal Gees
donde (2), ; (2;); son los valores extremos de 2. En los extremos H —+ 00 0 e~## + 0, Inego
ér,
Entonces,
8 [Maw
(5) * eta MP
SiN’ es el niimero de grados de libertad y H({p,q}) = So ain? > a = car?"
(gt = nave?) = kT
NRT
”
(2) ~ (H)~ Svat) — Sonat) =
BI Toorema de equiparticién de la energia establece que si H({p.g}) = Scacat entonces (2) =
NOD
7
donde N/ es el niimoro de grados de libertad del sistema y ({p, a}
(t1, 82, ---. ty"),
Ejemplo.~ Paxticulas libres
2
3
=
2
a
iMe
els
JN’ =3N momentos ; 7 = 2 para cada uno de los 3.
No hay contribucién de las 3’ posiciones
Del Teorema de equiparticién de la energia, (E) =
Ejemplo-Particulas libres en un campo gravitacional
Ny
H({p.a}) = x( Pe gz.)
2am
3N momentos con 9 = 2
N posiciones con 9 = 1
5.6.4 El oscilador arménico
Considoramos un oscilador arménico simple en contacto con el ambiente a temperatura
Boa (n+ 5)hur m= 012.050
ete)
1 y 1
Hy In Zy = 5 8huo + In( —
am Zy _ hw
(ay - St -e
hus
Linite clisico, hw = 77 <1 (altas vemperaturas) = 1+ Bw
ws
(a) = >
0
a
a
Si Shu > 1 (bajas temperaturas)
(i) = nel5 +
SiT = 0, (nyo
Para un sistema formado por N osciladoros arménivos independientes interactuando debilmente,
todos iguales y en posiciones fijas,
por lo tanto (E)
0
a
a
5.6.5 Calor especifico de los sélidos
En un sélido, se tienen vibraciones reticulares de los stomos que lo forman alrededor de sus
posiciones de equilibrio. Escribimos el Hamiltoniano para 1 mol como: (N4: mimero de Avo-
Wa 7 pp
gadro)
Hay (Re zt)
Del teorema de equiparticién de la energia, si T es elevado entone
(or),
Esta es un ley empirica hallada por Dulong y Petit.
s (E) mot = 3NakT = 3RT,
3R > cy © 25 joules x mol! x K~!
A bajas temperaturas se observa que cy disminuye con la temperatura. Un modelo aproximado
para describir este comportamiento es el modelo de Einstein de un solide (Einstein, 1907), se~
gun el cual todos los stomos que forman el sélido oscilan con la misina frecuencia
Consideremos una mol del sdlido como un sistema formado por 3g osciladores independientes,
luego
1d
3+ om al
ale)
Como ev (2), entonces
By
emis
~ (era
gi OFM _ gh, entonces
T kT
_ (ee? (oolt
w= ($) GR) wary
thw .
Ee la temperatura de Binstein
SikT > hwoT > Oe > Oe/TK1 ¥
fh 1
Nahal s+ mor
3N4kT = 3RT (Clasico) + ey = 32.
Op
{B) = BN ha
SikT < hw 0 Oy % T entonces Og/T > 1 y
Experimentalmente, cuando T + 0, Cv « T%. La razén: los dtomos no vibran todos con la
misma frecuencia
Para el diamente @¢ = 13204, mientras que para la mayorin de los sdlidos @¢ = 3205.
5.6.6 Paramagnetismo
Consideremos V étomos magnéticos de espin arbitrario sin interaccion mfitua en presencia de
un campo magnético externo H en la. diteccién del eje 2, El momento magnético de cada stomo
¢s ji, luego la energia magnética de cada atomo es ¢= —ji-
jres proporcional a AJ, donde J es ¢l momento angular total del stomo. Si,
h
jin im es el magnetén de Bohr (e, carga del electrén de masa m; ¢ velocidad de la. luz),
me
entonces,
A= gud
donde g es el factor de Landé del atomo.
Luego € = -(gjpJ)-H = —gpeHJ, con J, =m, m=
2J +1 valores posibles para m.
Jl.
€ puede tomar los valores é = —guaHm.
Si J = 1/2 entonces m= +3
En general Py, x ee" = efaetm
La componente z del momento magnético jx es 41, = gjipm, entonces
Bountm,
‘guegme
Yeast
I,J. Se tienen
Céleulo de Z,:
a
sean = BgyigH = OF HT entoncos
J
Ze = Lema pW yey ew
Z=
0 =P ~ a el senh()
Luego
en? MHA) — eI) sentln( I +3)
_19ln
8 OH
Como (2)
(ns) = fone >
10nZ, dn On
on OH * OH
amZ,
ss) = ghee
= Jgten, entonces
1dlnZ
1 n
Como In Z, = Insenh(J + 5) ~ Insenh(7), entonces
donde By(n) =
(Hs) = ga]
(uz) = 945 Ba(n)
1 De dy de bh ci6n de Brillo
G [er + pret + 5) — 5 e0th()] es In funeisn de Brllowin
‘Tomando en euenta. que,
Siy > 1 cothy=1
Siy<1>
cothy
coth y
_coshy oh be
thy =
Coen y = Senhy
(ye $e.) edn #4)
(tyt ht... J-G-yt ht...)
1484.
a
le
=
IS
Para By():
Si se tienen Ny dtomos por unidad de volumen, In componente 7 del momento magnético medio
por unidad de volumen (M.) 0 Imanacién es
(Mi
Si) <1 (T'alta) entonces, (= Agupll)
No(ns) = NogupJ Ban)
(an)
1
2
8
os
= Nigiod(
_ Nog’ dS +1)
- 3kT
1
es decir que (M.) x =. Esta es la ley de Courie.
Nog?ped (J +1)
3h
Sin >1(T pequetio), (M.) = Nogjtad
six
, entonces (M.) = yH. x es la susceptibilidad magnética,
5.6.7 Teoria cinética de los gases diluidos en equilibrio
Consideremos un gas diluido formado por moléculas que interaccionan debilmente. Para cada
molécula,
Hy int 5.39)
Bye t knt (5.39)
2
donde e es la energia cinética del centro de masa de la molécula y ea ineluye la energfa de
rotacién y vibracién respecto al centro de masa de la molécula,
Para cada moléeula, el resto de moléculas actiian como un foco térmico a temperatura Ty
podemos usar una distribucién canénica,
Sea P,(F p)d*d%p., Ia probabilidad que el contro de masa de la moléenla esté en algun punto
dentro de la regi6n (7) de volumen dF centrado en 7, con momentum en (ji. d3) de vole
men dpi centrado en 'y en algun estado s que define el estado de movimiento interno.
Entonees,
Put perey 0 OE ood SBT (5.40)
Sumando sobre todos los estados s posibles,
PRD ES a MRE T (5AL)
Probabilidad de encontrar la particula en (7,47); (p, d%p) sin tener en cuenta el estado interno.
Si N es el mimero total de moléculas, NP(F,j)) es el niimero medio de moléculas en (7,457) y
Gas).
Si f(F 8)d°FEF es ol nvimero medio de moléculas con centro de masa en (F,d) y con velocidad
en (#8), entonces
eA rast
SEBO T =
Caleulo de C:
I I Mere
[fore ®urree
cv (fe a ) L
(5.42)
(5.43)
a (2m)?
ev (=)
En (5.42),
fab ras =
'V, entonces
{Wards =n (az Panee (5.44)
Esia es la distribucién de velocidades de Maxwell de moléculas de un gas diluido en equilibrio
térmico. Como se puede observar, f no depende de la ditceeién de i.
Calculamos:
g(vs)di's: Niimero medio de moléculas por unidad de volamen con componente «« de la veloci-
dad entre v, yu, + dv, independientemente de sus otras componentes.
aevarto, = ff sees
wn _
- »(s77) [fe BF osdogte.
an ad
glve)der = du, f eo
3/2 ms (dpedied
- [ [RF dosdeyte,
vey [BaRPY?
glve)der = oad ( (2=*P)
Luego,
Caleulamos (v-) ; (0)
| glve}oydey
J otesite,
1
3 (v.) == | g(v.)eedes = 0, pues g(r.) es una funcién par y v, es una funcién impar
2
con | gvz}do, =n
En general (uv!) = 0. sik es impar.
‘También
(2) = 2 / oe.jetdy =
> alan) E)"L-
AD
™
La desviacién estandar o = [(Av,)]}/? es entonces:
m
= {((Av)")}" = [(v) ~ (ue)? =
Obtenemos lo mismo para vy y vz
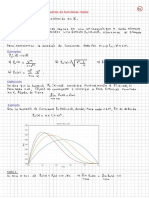
Funcién de distribucién del médulo de la velocidad
Caleulamnos F(v)de: Nrimero de moléeulas por unidad de volumen enyo médulo de su velocidad
v= [al esta entre vy v + de.
F(v)dv = / J(@)dé, donde J’ es sobre todas las direcciones de 7 tales que v < |8] < v + dv.
a S(O)dt =f) Amedeo
}(#) solo depende del médulo det
Lucgo, F( dv =A m ye Po BF dy
0, Flu)de = den) ve Bd
Esta es la distribucién de Maxwell del médulo de las velocidades.
Valores medios:
wo) : J [ [ee Sobre todas tas vlocidades.
También (o) = 2 f ™ F(x) v dv Sobre todas los médulos de las velocidades.
ab
Pie v-dnvtde = Ps) ae
rm \8!2 px mat
4a BF yde
“(s) [ea
tn 2 81 OkTy2
(saz) a (Gr)
Calculamos el médulo de la velocidad més probable &:
Para 6, ©
a
dFood oat op Tenn cee
a 0+ Lee 4 9 49
aA Pe gn ep TO
j2kT
Fsidesirque =
m
Agrupamos los resultados obtenidos:
Fame > (uy > b
5.6.8 Ley del gas ideal a partir de la a distribucién de velocidades
de Maxwell
Tomamos una unidad de drea en el plano y ~ z como en la figura.
Evaluamos el flujo de de particulas que atraviezan la unidad de Area en la unidad de tiempo
con componente de la velocidad entre ve ¥ Us + dvs, de como en la figura.
El niimero de partfeulas por unidad de yolumen con componente de la velocidad entre vy y
te + dis 8,
dn = g(v,)dv,
Consideremos el volumen V que encierra a particulas que se desplazan en la direccién del eje x
con velocidad 1, Al moverse las particulas este volumen se desplaza en la direceisn del eje
le toma a este volumen atravey es el niimero
Si At es el tiempo qui
ar el drea A, entonces
de unidades de volumen que atraviezan la unidad de area en la unidad de tienipo, Ademis,
=u
Luego el mimero de particulas con componente x de su velocidad entre v, y Us + dite que
atraviezen la unidad de Grea en la unidad de tiempo en la direccién del eje 2 es,
don
(dn)e. nd
a
El finjo total de particnlas que se mueven en la direceién del eje 1 positivo (ve > 0) es
rc
g(r2)ratle, = m(v,.+)
Presién p del gas sobre la pared:
El impulso sobre la pared a lo largo del eje x que cada particula produce es
1= AP = mv, —(-mv,) = 2mv,
La presién es cl cambio de momentum por unidad de tiempo por unidad de Area, luego la
presién dp producido por um flujo de particulas dé, es
dp = dé,(2mvz)
la presidn total es,
NkT
* glve)itde, =
0
a
a
Niimero de choques de moléculas de un gas ideal contra una superficie
Cousideremos un gas ideal encerrado en un cierto contenedor de volumen V. Caleulamos el
inimero de moléculas que por unidad de tiempo chocan contra un elemento de superficie dS de
una pared de dicho conteuedor
Sea ©(0)d°F : mimero de moléculas con velocidades entre @ y 7+ di que golpean una unidad
de rea de la pared en la unidad de tiempo, como en la figura.
El volumen del cilindro oblicuo de la figura es
dS.v.dé. cos
Luego,cl mimero de moléculas con velocidades entre # y &+ dé que incide sobre el Area dS de
la pared en el tiempo dt es,
(dS.v.dt. cos) f(@)a°%
El niimero de moléculas con velocidades entre 7 y #-+ di que chocan contra la pared por unidad
de drea y unidad de tiempo es,
BaF = f(Dvcosdd'e
donde Pi = degduyd
Sea @y: mimero total de moléculas que golpean uma unidad de Area de la pared en la unidad
de tiempo , entonces,
_ Pay ser Neos =a f f(v)e®du
a= fe ‘dy send dd dé f(Bucos@ =f f(vyo%de
dn p=
= [fon
1
vy) + Op
N
Por otro lado, i { @of(Ow dv, conn Luego,
a
1
i iv
E] resultado obtenido es independiente de la forma de f(7), es decir que no es necesario que
sea una distribucién de Maxwell, siendo Ia tinica condicién para f que sea independiente de la
direccién de 7. Lo que si es necesario es que sea un gas ideal.
oT
0
a
a
‘Tr
En el caso de una distribucién de Maxwell (v) ae entonces usando la ecuacién de estado
en el equlibrio,
Consideremos ahora dos compartimentos 1 y 2, de paredes fijas y adiabitieas que contienen
gases ideales a presiones py and py y temperaturas T; y Ts, respectivamente, Estos compar-
timentos se comunican través de un pequefio agujero abierto en la pared comin como en la,
figura.
Si la dimension lineal que caracteriza el orificio es grande, entonces la condicién de equilibrio es
Pi = po. Pero si la dimensién lineal del orificio es suficientemente pequeiia, el fendmeno que se
presenta es el de efusién. En este caso la condicién de equilibrio es que el nimero de moléculas
qne cruzan el orificio por unidad de tiempo en un sentido debe ser igual al niimero de las que
cruzan en sentido contrario, Es decir que si R es la rapidez de efusién, entonces en el equilibria
para cada compartimento, la rapidez de efusién de salida es la misma que la de entrada y,
Como ademés p,V,
=MET, y
pv 1
IDV
Dl
_ PVs
AT, entonces
:
avin
You might also like
- Bioquímica GeneralDocument9 pagesBioquímica GeneralJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Biologia Molecular 21 - II (2018)Document10 pagesBiologia Molecular 21 - II (2018)JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Jose TesisDocument68 pagesJose TesisJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Bioquimica General 2018Document8 pagesBioquimica General 2018JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Ep Part1Document1 pageEp Part1JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Biología CelularDocument18 pagesBiología CelularJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Informe N 2 Introducci N A La Astronom ADocument4 pagesInforme N 2 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Semana 11Document50 pagesSemana 11JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Capitulo Fisica NuclearDocument11 pagesCapitulo Fisica NuclearJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Semana 12Document45 pagesSemana 12JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Biologia CelularDocument20 pagesBiologia CelularJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Ilovepdf MergedDocument148 pagesIlovepdf MergedJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Laboratorio 2 Mecanica CuanticaDocument23 pagesLaboratorio 2 Mecanica CuanticaJOSE GABRIEL HUACACHI BAZANNo ratings yet
- CamScanner 10-23-2022 16.44Document10 pagesCamScanner 10-23-2022 16.44JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Ep Part2Document1 pageEp Part2JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Adobe Scan 23 Oct. 2022Document13 pagesAdobe Scan 23 Oct. 2022JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Ilovepdf MergedDocument9 pagesIlovepdf MergedJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Informe N 1 Introducci N A La Astronom ADocument6 pagesInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANNo ratings yet
- CamScanner 10-23-2022 10.40Document7 pagesCamScanner 10-23-2022 10.40JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Informe N 1 Introducci N A La Astronom ADocument6 pagesInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Informe N 1 Introducci N A La Astronom ADocument7 pagesInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANNo ratings yet
- CamScanner 10-06-2022 20.36Document6 pagesCamScanner 10-06-2022 20.36JOSE GABRIEL HUACACHI BAZANNo ratings yet
- Series de Fourier - MergedDocument45 pagesSeries de Fourier - MergedJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Sol pc2mmf2Document5 pagesSol pc2mmf2JOSE GABRIEL HUACACHI BAZANNo ratings yet
- 1lab MCI 2022IIDocument2 pages1lab MCI 2022IIJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Semana13 Clase2bDocument5 pagesSemana13 Clase2bJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Formato Del InformeDocument5 pagesFormato Del InformeJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Laboratorio 1 Mecanica CuanticaDocument11 pagesLaboratorio 1 Mecanica CuanticaJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Semana1-Clase1 MergedDocument91 pagesSemana1-Clase1 MergedJOSE GABRIEL HUACACHI BAZANNo ratings yet
- Sem03 L3Document25 pagesSem03 L3JOSE GABRIEL HUACACHI BAZANNo ratings yet