Professional Documents
Culture Documents
Dap An Hoa 11 PDF
Dap An Hoa 11 PDF
Uploaded by
43. Đào Thị Thu UyênOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Dap An Hoa 11 PDF
Dap An Hoa 11 PDF
Uploaded by
43. Đào Thị Thu UyênCopyright:
Available Formats
ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ 2 MÔN HÓA 11
Năm học 2022-2023
I. PHẦN TRẮC NGHIỆM: 28 câu × 0,25 điểm = 7,0 điểm
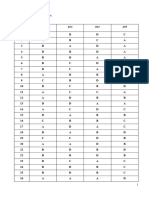
CÂU\Đ
Ề 111 112 113 114 115 116 117 118
1 C A B B B C D D
2 D C D A A B A A
3 A B C B C D C B
4 B A A C A B A B
5 D B A C B A C C
6 D D D C C A B B
7 C C D C C D A C
8 C C B A D A C B
9 C C D C D A B C
10 D B D D A D B C
11 B B D D C D A A
12 A C C C A A A D
13 A C C D C A A A
14 B D C A C D B D
15 C D D D D B C C
16 B C C D D C A C
17 D D B B A B C C
18 D B C B B C D C
19 D D A A B C B C
20 B C D C B A C D
21 D A D A C B A D
22 C A B D A C B A
23 B A B D C A B C
24 B A C B C D C C
25 D D C A D A B D
26 A D A D C B C A
27 A D D D C C A C
28 D D A D D D B D
Gợi ý một số câu Vận dụng:
1. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 2 ml ancol etylic khan vào ống nghiệm khô có sẵn vài viên đá bọt, sau đó thêm từng giọt
đến hết 4 ml dung dịch H2SO4 đặc đồng thời lắc đều. Lắp dụng cụ thí nghiệm như hình vẽ:
Bước 2: Đun nóng hỗn hợp phản ứng sao cho hỗn hợp không trào lên ống dẫn khí.
Bước 3: Đốt khí sinh ra ở đầu vuốt nhọn của ống dẫn khí.
Bước 4: Dẫn khí khí sinh ra ở đầu vuốt nhọn qua dung dịch KMnO4.
Cho các phát biểu sau:
(a) Đá bọt điều hòa quá trình sôi, giúp dung dịch sôi đều không trào lên ống dẫn khí.
(b) Khí thoát ra ở đầu vuốt nhọn là C2H4, khí này cháy với ngọn lửa màu xanh.
(c) Màu của dung dịch KMnO4 bị nhạt dần và xuất hiện kết tủa màu đen.
(d) Ở thí nghiệm trên, có thể thay etanol bằng metanol.
(e) Vai trò của bông tẩm NaOH đặc là hấp thụ khí SO 2, CO2 sinh ra.
Số phát biểu đúng là
A. 4. B. 3. C. 5. D. 2.
2. Cho 13,44 lít (đktc) hỗn hợp X gồm C2H2 và H2 qua bình đựng Ni (nung nóng), thu được hỗn hợp Y
(chỉ chứa ba hiđrocacbon) có tỉ khối so với H2 là 14,4. Biết Y phản ứng tối đa với a mol Br 2 trong dung
dịch. Phần trăm thể tích của C2H2 trong X và giá trị của a lần lượt là :
A. 41,67% và 0,25. B. 41,67% và 0,20. C. 58,33% và 0,15. D. 41,67% và 0,15.
X: nC2H2 = x mol, nH2 = y mol => x + y = 0,6
Y: MY = 28,8; nY = x mol
BTKL: 26x + 2y = 28,8x
=> x = 0,25; y = 0,35 => %VC2H2 = 41,67%
BT Π: 2. nC2H2 = nH2 + nBr2 => a = nBr2 = 2.0,25 – 0,35 = 0,15 mol
3. Hỗn hợp X gồm propan, etylen glicol và một số ancol no đơn chức mạch hở (trong đó propan và
etylen glicol có số mol bằng nhau). Đốt cháy hoàn toàn 5,444 gam X rồi hấp thụ toàn bộ sản phẩm cháy
vào bình đựng dung dịch Ba(OH)2 dư thấy khối lượng bình tăng lên 16,58 gam và xuất hiện m gam kết
tủa trong bình. Giá trị của m gần với giá trị nào sau đây nhất?
A. 47,47. B. 42,15. C. 43,90. D. 45,70.
X gồm C3H8 ; C2H6O2 ; ancol khác.
Vì số mol C3H8 và C2H6O2 bằng nhau => qui về C3H8O và C2H6O
=> Hỗn hợp X gồm các ancol no đơn chức mạch hở
mbình tăng = mCO2 + mH2O = 16,58g
Bảo toàn khối lượng : mX + mO2 = mCO2 + mH2O
=> nO2 = 0,348 mol
Ta có : nX = nO(X) = nH2O – nCO2.
Bảo toàn O : nO(X) +2nO2 = 2nCO2 + nH2O
=> 3nCO2 = 2nO2 => nCO2 = 0,232 mol
=> mBaCO3 = 45,704g
II. TỰ LUẬN (3 điểm)
Các mã đề 111, 113, 115, 117
Bài 1 Đáp án Điểm
1. a)
Fe
0,25
0,25
b) 2CH3OH + 2Na → 2CH3ONa + H2
0,25
c) C6H5OH + KOH → C6H5OK + H2O
0,25
H+ t0
d) CH2=CH-CH3 + H2O → CH3-CH(OH)-CH3
Bài 2 nCO2 = 22,4 : 22,4 = 1 mol; nH2O = 25,2:18 = 1,4 mol
a) nH2O > nCO2 nên 2 ancol thuộc loại no, đơn chức, mạch hở 0,25
Đặt công thức chung của 2 ancol là CnH2n+1OH (n>1)
Ta có: nancol = nH2O - nCO2 = 1,4-1 =0,4 mol 0,25
=> n = nCO2 : nancol = 1:0,4 = 2,5
Do 2 ancol là đồng đẳng liên tiếp => 2 ancol là C2H5OH và C3H7OH 0,25
b) Đặt x và y lần lượt là số mol của 2 ancol C2H5OH và C3H7OH
⇨ x + y = 0,4 0,25
46x + 60y = 15,9 0,25
⇨ x = 0,2 và y = 0,2 0,25
⇨ %mC2H5OH = 57,86%; % mC3H7OH = 42,14%
c) nete = nN2 = 0,84 : 28 = 0,03 mol ⇒ nancol pứ = 2n ete = 0,06 mol;
nH2O = nete = 0,03 mol
Áp dụng ĐLBT khối lượng có:
mancol pứ = m ete + mH2O = 2,5 + 0,03.18 = 3,04 g
Gọi nC2H5OH pứ = a ; nC3H7OH pứ = b ta có a + b = 0,03
46a + 60b = 3,04
0,25
⇒ a = 0,04 ; b= 0,02
⇒ H(X) = (0,04 : 0,2).100% = 20%
H(Y) = (0,02 : 0,2).100% = 10% 0,25
Các mã đề 112, 114, 116, 118
Bài 1 Đáp án Điểm
1. a)
0,25
+ H2O
b) 2C2H5OH + 2Na → 2C2H5ONa + H2 0,25
c) C6H5OH + NaOH → C6H5ONa + H2O 0,25
H+ t0 0,25
d) CH3- CH2 –CH=CH2 + H2O → CH3-CH2- CH(OH)-CH3
Bài 2 nCO2 = 13,44 : 22,4 = 0,6 mol; nH2O = 15,3:18 = 0,85 mol
a) nH2O > nCO2 nên 2 ancol thuộc loại no, đơn chức, mạch hở 0,25
Đặt công thức chung của 2 ancol là CnH2n+1OH (n>1)
Ta có: nancol = nH2O - nCO2 = 0,85-0,6 = 0,25 0,25
=> n = nCO2 : nancol = 0,6: 0,25 = 2,4
Do 2 ancol là đồng đẳng liên tiếp => 2 ancol là C2H5OH và C3H7OH 0,25
b) Đặt x và y lần lượt là số mol của 2 ancol C2H5OH và C3H7OH
⇨ x + y = 0,25 0,25
46x + 60y = 12,9 0,25
⇨ x = 0,15 và y = 0,1 0,25
⇨ %mC2H5OH = 53,49%; % mC3H7OH = 46,51%
c) nete = nO2 = 1,36 : 32 = 0,0425 mol ⇒ nancol pứ = 2n ete = 0,085 mol;
nH2O = nete = 0,0425 mol
Áp dụng ĐLBT khối lượng có:
mancol pứ = m ete + mH2O = 3,705 + 0,0425.18 = 4,47 g
Gọi nC2H5OH pứ = a ; nC3H7OH pứ = b ta có a + b = 0,085
46a + 60b = 4,47
0,25
⇒ a = 0,045 ; b= 0,04
⇒ H(X) = (0,045 : 0,15).100% = 30%
H(Y) = (0,04 : 0,1).100% = 40% 0,25
You might also like
- Dap An 3Document4 pagesDap An 3god gaming NguyễnNo ratings yet
- Đáp Án Gi A K 2 Hóa 10Document3 pagesĐáp Án Gi A K 2 Hóa 108A1 Lê Phạm Minh HiếuNo ratings yet
- ;))Document2 pages;))nguyenvietphu198g2008No ratings yet
- BT Tong Hop HidrocacbonDocument3 pagesBT Tong Hop Hidrocacboncrazycat93No ratings yet
- HDC HSG Hoa Hoc Lop 12 2022Document6 pagesHDC HSG Hoa Hoc Lop 12 2022KỲ ĐỖNo ratings yet
- HƯỚNG DẪN CHẤM - THI THỬ VẬT LÍ 12 - TỈNH BTDocument2 pagesHƯỚNG DẪN CHẤM - THI THỬ VẬT LÍ 12 - TỈNH BTThuý NgaNo ratings yet
- Dap An 3 Khoi Hkii 2223 Up Web - 2742023114827Document6 pagesDap An 3 Khoi Hkii 2223 Up Web - 2742023114827Võ Ngọc Gia KhánhNo ratings yet
- Đề 3 Đáp Án Đề HSG Khối 11 - Sinh 2018-2019Document3 pagesĐề 3 Đáp Án Đề HSG Khối 11 - Sinh 2018-2019nttha.c3clNo ratings yet
- Phieu Soi Dap AnDocument2 pagesPhieu Soi Dap AnKim YếnNo ratings yet
- Đáp án các mã đềDocument1 pageĐáp án các mã đềThành Lê VNo ratings yet
- De Thi Cuoi Ky 2 Toan 12 Nam 2021 2022 So GDDT Thanh Pho Can ThoDocument8 pagesDe Thi Cuoi Ky 2 Toan 12 Nam 2021 2022 So GDDT Thanh Pho Can ThoNguyễn Phương TrúcNo ratings yet
- Phieu Soi Dap An Môn TOÁN 11 1Document2 pagesPhieu Soi Dap An Môn TOÁN 11 1daohuyngoc3No ratings yet
- HDC Mon Toan 11 HK2 2023Document6 pagesHDC Mon Toan 11 HK2 2023lxinhgai90No ratings yet
- DE-THI-MAU (2)Document6 pagesDE-THI-MAU (2)Nguyễn Văn ThànhNo ratings yet
- Dap An ExcelDocument1 pageDap An Excelnmy301801No ratings yet
- DAP-AN-Hoa-10-NCDocument3 pagesDAP-AN-Hoa-10-NChoangbaolinh631No ratings yet
- Đề 3 Đáp Án Đề HSG Khối 11 - Sinh 2018-2019Document2 pagesĐề 3 Đáp Án Đề HSG Khối 11 - Sinh 2018-2019nttha.c3clNo ratings yet
- Anh - CĐ10-02-2024 - HDCDocument2 pagesAnh - CĐ10-02-2024 - HDChaivungocNo ratings yet
- Dap An Toan K10Document2 pagesDap An Toan K10Long DanhNo ratings yet
- Dap AnDocument2 pagesDap AnKiên LêNo ratings yet
- Đáp ÁnDocument2 pagesĐáp ÁnquangNo ratings yet
- Dap An Hoa 12 - ck2 21 - 22Document2 pagesDap An Hoa 12 - ck2 21 - 22mhue1107No ratings yet
- Phieu Soi Dap An Môn ToanDocument8 pagesPhieu Soi Dap An Môn ToanQuốc Hưng NguyễnNo ratings yet
- Đáp Án KT HK 1 Hoa Hoc 12CBDocument1 pageĐáp Án KT HK 1 Hoa Hoc 12CBHuyền ĐỗNo ratings yet
- Dapanthithutotnghiepl 2Document2 pagesDapanthithutotnghiepl 229: Lê Đức Minh QuânNo ratings yet
- GK2DAP AN ANH 12 9861eDocument2 pagesGK2DAP AN ANH 12 9861ephamtien02102006No ratings yet
- Dap an DE CHAN_K12_2223Document2 pagesDap an DE CHAN_K12_2223locarmy111No ratings yet
- ĐÁP ÁN CÁC MÃ ĐỀ HKI - K12 ĐÃ SỬADocument2 pagesĐÁP ÁN CÁC MÃ ĐỀ HKI - K12 ĐÃ SỬAmiliheu0806No ratings yet
- Hướng dẫn chấm đề thi cuối kì I sử 12 NH 23-24Document1 pageHướng dẫn chấm đề thi cuối kì I sử 12 NH 23-24vinhm200610No ratings yet
- Anh Dapanthithutnlan4Document2 pagesAnh Dapanthithutnlan429: Lê Đức Minh QuânNo ratings yet
- Dap AnDocument1 pageDap AnKhuong DuyNo ratings yet
- Dap AnDocument2 pagesDap Anngobakha1993.dbNo ratings yet
- Phieu Soi Dap AnDocument2 pagesPhieu Soi Dap Anthaonguyn1308No ratings yet
- Toan 12 Dapan - 15120229Document1 pageToan 12 Dapan - 15120229Minh TrầnNo ratings yet
- Dap An Phu Tho 1 - 2017Document2 pagesDap An Phu Tho 1 - 2017Phú NguyễnNo ratings yet
- Đáp Án hk2 - S 12Document1 pageĐáp Án hk2 - S 12rainny29092006No ratings yet
- Dap AnDocument1 pageDap AnMinh ChuNo ratings yet
- 1. Phieu Soi Dap an Môn TOÁN (1)Document2 pages1. Phieu Soi Dap an Môn TOÁN (1)phuongny.205No ratings yet
- ĐÁP ÁN TOÁN LẦN 2 SỞ GDHPDocument1 pageĐÁP ÁN TOÁN LẦN 2 SỞ GDHPKhánh Linh NguyễnNo ratings yet
- Đáp ÁnDocument7 pagesĐáp Ánphuonganh20045678No ratings yet
- Đáp ÁnDocument2 pagesĐáp ÁnĐức NguyênNo ratings yet
- Tin Hoc ktck1 2022 2023 Dap An 3 Khoi - 12122022152430Document4 pagesTin Hoc ktck1 2022 2023 Dap An 3 Khoi - 12122022152430quynhpham.31231021759No ratings yet
- Dap An LY TT TN THPT 2021 SS MLDocument1 pageDap An LY TT TN THPT 2021 SS MLsdfjkcvNo ratings yet
- 05.-ĐÁP-ÁN-CUỐI-KÌ-II-HÓA-11Document1 page05.-ĐÁP-ÁN-CUỐI-KÌ-II-HÓA-11Lan PhươngNo ratings yet
- Phieu soi dap an Môn Hoa hoc - Đề thi thử lần 1Document2 pagesPhieu soi dap an Môn Hoa hoc - Đề thi thử lần 1Hải Quân LC NguyễnNo ratings yet
- ĐÁP ÁN 11Document2 pagesĐÁP ÁN 11anh480001No ratings yet
- Dap-an-GK2-lop-10-mon-Toan-2023-2024 (2)Document4 pagesDap-an-GK2-lop-10-mon-Toan-2023-2024 (2)Lê Anh MịnhNo ratings yet
- Đáp án phần trắc nghiệmDocument1 pageĐáp án phần trắc nghiệmKhoa LêNo ratings yet
- Đáp Án Đề Khảo Sát- Môn Lý 10Document3 pagesĐáp Án Đề Khảo Sát- Môn Lý 10thienbovongtamNo ratings yet
- ĐÁP ÁN KIỂM TRA HỌC KÌ I MÔN LÝ KHỐI 12Document1 pageĐÁP ÁN KIỂM TRA HỌC KÌ I MÔN LÝ KHỐI 12Sỹ Quân HuỳnhNo ratings yet
- Dap An Ly 10 - 143202311Document2 pagesDap An Ly 10 - 143202311ntbn30043010No ratings yet
- de-thi-thu-tot-nghiep-thpt-2024-mon-toan-lan-1-so-gddt-ba-ria-vung-tauDocument37 pagesde-thi-thu-tot-nghiep-thpt-2024-mon-toan-lan-1-so-gddt-ba-ria-vung-tau21 Lựu Gia PhongNo ratings yet
- Đáp Án Môn Tiếng Anh Lơp 11Document6 pagesĐáp Án Môn Tiếng Anh Lơp 11Duy Phong VũNo ratings yet
- Đáp Án CDDocument1 pageĐáp Án CDrainny29092006No ratings yet
- Dap AnDocument2 pagesDap AnMinh ĐỗNo ratings yet
- Dap an-THI TH SƠN TÂY 2020Document1 pageDap an-THI TH SƠN TÂY 2020Minh NgọcNo ratings yet
- Phieu-soi-dap-anDocument2 pagesPhieu-soi-dap-anmia284206No ratings yet
- Phieu Soi Dap AnDocument2 pagesPhieu Soi Dap Anmia284206No ratings yet
- De Thi Thu TN THPT 2023 Mon Toan Lan 1 Truong THPT Chuyen DH Vinh Nghe AnDocument33 pagesDe Thi Thu TN THPT 2023 Mon Toan Lan 1 Truong THPT Chuyen DH Vinh Nghe AnHà Thị Phương AnhNo ratings yet
- Upload - 535382944c4cc - 123.22.140.6 - BAI VAN HAYDocument2 pagesUpload - 535382944c4cc - 123.22.140.6 - BAI VAN HAY43. Đào Thị Thu UyênNo ratings yet
- Bai 43Document25 pagesBai 4343. Đào Thị Thu UyênNo ratings yet
- đề ktra chương 1 lớp 11A3Document3 pagesđề ktra chương 1 lớp 11A343. Đào Thị Thu UyênNo ratings yet
- Beige Cute Cartoon Playful Simple Notes PlannerDocument1 pageBeige Cute Cartoon Playful Simple Notes Planner43. Đào Thị Thu UyênNo ratings yet
- Bai 15 CacbonDocument40 pagesBai 15 Cacbon43. Đào Thị Thu UyênNo ratings yet
- ĐỀ CƯƠNG KIỂM TRA CUỐI HỌC KÌ I- LS 11 năm học 2022-2023Document25 pagesĐỀ CƯƠNG KIỂM TRA CUỐI HỌC KÌ I- LS 11 năm học 2022-202343. Đào Thị Thu UyênNo ratings yet