Professional Documents
Culture Documents
Equilibrio Quimico Vci
Equilibrio Quimico Vci
Uploaded by
Alguém Qualquer0 ratings0% found this document useful (0 votes)
10 views1 pageOriginal Title
equilibrio quimico vci
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
10 views1 pageEquilibrio Quimico Vci
Equilibrio Quimico Vci
Uploaded by
Alguém QualquerCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 1
Lista de exercícios – PROF.
JACKSON RODRIGO (Equilíbrio Químico)
1. Escreva a expressão do equilíbrio para as seguintes reações:
a) Ag+ (aq) + 2 NH3 (aq) Ag(NH3)2 (aq)
b) NH3 (aq) + H2O (l) NH4+(aq) + OH- (aq)
c) HClO2 (aq) H+ (aq) + ClO2- (aq)
2. O iodeto de hidrogênio gasoso é colocado em recipiente fechado a 425º C, onde se
decompõe parcialmente em hidrogênio e iodo:
2 HI (g) H2 (g) + I2 (g)
No equilíbrio encontra-se que a pHI = 0,202 atm, pH2 = 0,0274 atm, PI2 = 0,0274 atm.
Qual é o valor de Keq a essa temperatura?
3. Dissolve-se 0,050 mol de di-iodocicloexano, C6H10I2, em CCl4. O volume da solução
é 1,0 L. Quando a reação
C6H10I2 (g) C6H10 (g) + I2 (g)
Atinge o equilíbrio, a 35 ºC, a concentração de I2 é 0,035 mol/L.
a) Quais as concentrações dos demais componentes da reação no equilíbrio?
b) Determine a constante de equilíbrio.
4. Calcule a constante de equilíbrio, a 25ºC, da reação:
2 NOCl (g) 2 NO (g) + Cl2 (g)
A partir da seguinte informação. Numa experiência, colocam-se 2,0 mols de NOCl
num balão de 1,0 L e verifica-se que a concentração de NO no equilíbrio é 0,66
mol/L.
5. (PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está
representado pela equação: 2SO2(g) + O2(g) ↔ 2SO3(g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de
oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de
trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53 b) 0,66 c) 0,75 d) 1,33 e) 2,33
You might also like
- Lista Pré-Vest 14 População Brasileir - AlunoDocument2 pagesLista Pré-Vest 14 População Brasileir - AlunoAlguém QualquerNo ratings yet
- Doc-20240305-Wa0024 240305 160123Document10 pagesDoc-20240305-Wa0024 240305 160123Alguém QualquerNo ratings yet
- FICHA DE ATENDIMENTO - ModeloDocument2 pagesFICHA DE ATENDIMENTO - ModeloAlguém QualquerNo ratings yet
- A Logica No Sistema Juridico - 202403190916Document58 pagesA Logica No Sistema Juridico - 202403190916Alguém QualquerNo ratings yet
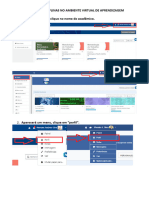
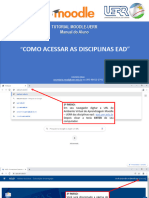
- Habilitar Disciplinas AvaDocument4 pagesHabilitar Disciplinas AvaAlguém QualquerNo ratings yet
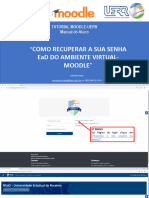
- Recuperar Senha NeadDocument9 pagesRecuperar Senha NeadAlguém QualquerNo ratings yet
- Eletromag Ibr ExercíciosDocument12 pagesEletromag Ibr ExercíciosAlguém QualquerNo ratings yet
- Login NeadDocument4 pagesLogin NeadAlguém QualquerNo ratings yet
- Em23 3 Soc 08 GabDocument1 pageEm23 3 Soc 08 GabAlguém QualquerNo ratings yet
- Em23 3 Soc 05 GabDocument1 pageEm23 3 Soc 05 GabAlguém QualquerNo ratings yet
- Ext21 3 Geo A 21 GabDocument1 pageExt21 3 Geo A 21 GabAlguém QualquerNo ratings yet
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5810)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (590)
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (540)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (401)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (897)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (844)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (266)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (74)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (348)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2259)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1092)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (122)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (822)