Professional Documents
Culture Documents
1QUI01-Química 1 (1) - 23
1QUI01-Química 1 (1) - 23
Uploaded by
lomade22240 ratings0% found this document useful (0 votes)
5 views1 pageOriginal Title
1QUI01-Química 1 (1)-23
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
5 views1 page1QUI01-Química 1 (1) - 23
1QUI01-Química 1 (1) - 23
Uploaded by
lomade2224Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 1
Este material, de distribución gratuita, no contiene necesariamente las modificaciones
que se hayan incorporado durante la realización de las evaluaciones.
PONTIFICIA UNIVERSIDAD CATÓLICA DEL PERÚ
ESTUDIOS GENERALES CIENCIAS
Química 1
3ª Práctica (Pa)
Semestre académico 2017-2
Horarios: 111 Elaborada por los profesores del curso
ADVERTENCIA: QUEDA TERMINANTEMENTE PROHIBIDO EL USO DE CORRECTORES LÍQUIDOS y EL
PRESTAMO DE CALCULADORAS, BORRADORES, ETC.
1. (4 ptos.) A un cilindro de 30 L que contiene aire (composición molar 80 % de N 2 y 20
% de O2) a 20 °C y a presión estándar se le introduce óxido nítrico (NO) hasta que
la presión parcial de este último gas llega a 304,025 mmHg .
a. (2 p) Determine las fracciones molares de cada uno de los gases presentes en el
cilindro.
b. (2 p) Si el óxido nítrico reacciona con el oxígeno produciendo NO2 (g) dentro del
cilindro:
i. (0,25p) Escriba la ecuación química de esta reacción
ii. (0,5p) Si considera que el número de moles de NO es el doble que el
número de moles de O2, determine cuántos moles de producto se obtiene
por la reacción.
iii. (0,5p) Determine la cantidad (moles) de los componentes de la mezcla
gaseosa que queda en el cilindro luego de la reacción.
iv. (0,75p) Determine la presión parcial del NO2 y la presión total en el cilindro
luego de la reacción.
2. (4 ptos.) Se introduce CO2 en un recipiente de volumen desconocido (V1) con una
presión de 0,96 atm y una parte de este gas se traslada a un balón de 25 mL para
generar una presión de 1 atm en dicho balón.
a. (2p.) Si luego de retirar parte del gas la presión que quedó en el primer
recipiente es 0,882 atm, ¿cuál es el volumen desconocido (V1) si todas las
mediciones se llevaron a cabo a temperatura constante? Considere
comportamiento ideal para el CO2
b. (1 p) El CO2 tiene una constante de van der Waals (a) mayor que la del neón.
¿Qué se puede concluir acerca de las fuerzas de atracción entre las moléculas
de CO2 y entre los átomos de neón?
Constante de van der Waals
Sustancia a (L2-atm/mol2)
neón (Ne) 0,211
dióxido de carbono (CO2) 3,59
c. (1p) ¿Qué gas (Ne o CO2) tendrá mayor valor de la constante b.? Explique.
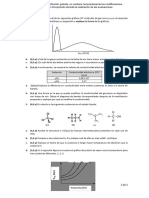
3. (2 ptos.)En el siguiente gráfico, se muestra la distribuciónde las velocidades moleculares
de un mol de un gas a tres distintas temperaturas:
fracción de moléculas B
a. (0,75 p) Indique cuál de las curvas de distribución de velocidades moleculares
(A, B o C) corresponde a la de menor temperatura y cuál a la mayor
temperatura del gas. Justifique su respuesta.
b. (0,50 p) Explique qué es la efusión molecular de un gas.
c. (0,75 p) Utilice la teoría cinético molecular para explicar en qué caso la presión
ejercida por el gas será mayor si el volumen del recipiente (en las tres
mediciones) fue el mismo.
CONTINÚA
You might also like
- 1QUI01-Química 1 (1) - 33Document1 page1QUI01-Química 1 (1) - 33lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 28Document1 page1QUI01-Química 1 (1) - 28lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 31Document1 page1QUI01-Química 1 (1) - 31lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 27Document1 page1QUI01-Química 1 (1) - 27lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 24Document1 page1QUI01-Química 1 (1) - 24lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 18Document1 page1QUI01-Química 1 (1) - 18lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 19Document1 page1QUI01-Química 1 (1) - 19lomade2224No ratings yet
- 1QUI01-Química 1 (1) - 7Document1 page1QUI01-Química 1 (1) - 7lomade2224No ratings yet