Professional Documents
Culture Documents
Bab 08 Teori VB
Uploaded by
Yunita PurnamasariCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Bab 08 Teori VB
Uploaded by
Yunita PurnamasariCopyright:
Available Formats
Bab 8: Teori ikatan valensi
147
Gambar 8.1:
ntaraksi dalam molekul H2
8.1 MOLEKUL DATOM HOMONT
&ntuk mengetahui pendekatan ikatan valensi, dapat dimulai dengan
meninjau molekul hidrogen yang dikembangkan oleh Heitler dan London.
ntaraksi antara atom hidrogen dalam molekul H
2
ditunjukkan pada
Gambar 8.1. Berdasarkan gambar tersebut, tampak bahwa pada saat R
besar, semua jarak selain r
1a
dan r
2b
juga besar, sehingga akan diperoleh
dua atom hidrogen terisolasi, dan fungsi gelombang pada keadaan dasar
adalah |X> yang dapat dinyatakan sebagai:
b 2 a 1
s 1 s 1 X 8.1
dengan |1S
1a
> adalah fungsi gelombang atom hidrogen yang terdiri dari
proton a dan elektron ke-1, dan |1S
2b
> adalah fungsi yang sama untuk
atom hidrogen yang terdiri dari proton b dan elektron ke-2.
Selanjutnya proses pembentukan molekul dilakukan dengan cara
membawa dua atom hidrogen tersebut secara bersamaan sampai
terbentuk jarak ikatan normal. Tiap atom hidrogen mempertahankan
elektron masing-masing pada posisi orbital atom 1s (asumsi bahwa orbital
atom tidak terdistorsi, sama halnya dengan asumsi yang dibuat pada
metode LC, dan ikatan dilakukan dengan cara pertindihan
(overlapping orbital 1s hingga terbentuk pasangan elektron ikatan.
#
7
7
,
7
-
7
,
7
-
!ada bab 7 sudah dibahas teori orbital molekul
sebagai solusi pendekatan Schrodinger terhadap
suatu molekul. Menurut teori M, kerangka molekul
dipandang sebagai inti atom dan elektron yang
saling berantaraksi, kemudian dievaluasi tingkat-
tingkat energi molekul yang dihuni elektron. Tingkat
energi atau orbital ini diperoleh melalui kombinasi
linear orbital-orbital atom.
!ada bab ini akan dibahas pendekatan alternatif
lain, disebut teori ikatan valensi (Valence Bond, VB.
Teori ini memasukkan gagasan pasangan elektron
ke dalam orbital molekul, dimana setiap pasangan
elektron terikat pada dua inti. Jadi terdapat
perbedaan antara teori M dan VB.
!erbedaan mendasar antara pendekatan M dan
VB terletak pada cara pandang terhadap molekul.
!ada pendekatan M, molekul dipandang sebagai
kumpulan inti dan elektron, dan antaraksi semua
elektron dengan inti dan dengan elektron lain
dipertimbangkan dalam perhitungan. !ada pende-
katan VB, molekul dipandang sebagai antaraksi
antara pasangan elektron ikatan dengan inti-inti
atom yang terlibat pada pembentukan molekul.
!embahasan VB dalam ikatan kovalen dimulai
dengan ikatan 9 homointi, dan molekul diatom
heterointi, seperti HCl. Kemudian akan dibahas
elektron 6 dalam molekul seperti pada benzena,
juga akan dikenalkan konsep resonansi.
Bab 8: Teori ikatan valensi
148
Keragaman energi terhadap jarak antar
inti dalam molekul H2
amiltonian untuk sistem:
=
a 2
2
a 1
2
2
2
2
2
1
2 2
r
e
r
e
2 2
]
3 3
12
2 2
b 2
2
b 1
2
r
e
R
e
r
e
r
e
= =
1 1
= =
2 1
S =
2 1
IX X
Dengan terbentuknya ikatan, !ersamaan 8.1 tidak dapat dipakai
lagi, sebab kedua elektron tidak dapat dibedakan (dua atom pada orbital
1s menjadi tumpang tindih dan tidak dapat dikatakan dengan pasti orbital
mana yang ditempati elektron. Kesulitan ini dapat ditangani dengan
menuliskan fungsi gelombang sebagai kombinasi linearnya:
b 1 a 2 2 b 2 a 1 1 2
s 1 s 1 C s 1 s 1 C = C
2 2 1
X C X
8.2
dengan C
1
dan C
2
adalah tetapan normalisasi, dan C
1
= C
2
.
Selanjutnya energi yang berhubungan dengan fungsi gelombang
ditentukan dengan menggunakan prosedur atau metoda LC. Dalam hal
ini, fungsi gelombang yang akan dicari diperkirakan atau dicoba-coba,
kemudian fungsi gelombang yang memiliki energi terendah dipilih.
Tahap pertama adalah menentukan tingkat energi molekul dengan
cara berikut
=
2 2
2 2
8.3
Dengan melakukan deferensial energi terhadap parameter variabelnya:
C
E
C
E
2 1
N
N
N
N
, diperoleh determinan sekuler 2 x 2, yaitu
E ES
ES E
22 21
12 11
8.4
!ersamaan 8.4 memberikan dua penyelesaian yaitu
a
=
S 1
12 11
dan
s
=
S 1
12 11
8.5
Fungsi gelombang yang berhubungan dengan energi tersebut adalah
2
a
=
S 1 2
X X
2 1
dan
S
X X
8.6
Menurut prinsip !auli, dua elektron yang berikatan spinnya harus
berada pada keadaan simetri, H
2
s
, dan yang tidak berikatan harus
berada pada keadaan antisimetri, H
2
a
. Fungsi spin untuk sepasang
elektron ini, yakni
1 2 2 1
2
1
. - . - adalah antisimetris dan kebalikannya
harus simetris jika fungsi totalnya antisimetris. leh karena itu E
s
berhubungan dengan molekul H
2
pada keadaan dasar.
!erhitungan jarak ikatan dan energi ikatan yang berhubungan
dengan !ersamaan 8.6 adalah 0,80 dan 3,14eV. Dengan demikian nilai
estimasi dapat diperoleh walaupun tidak begitu akurat. &ntuk memperbaiki
hasil tersebut dapat dilakukan cara menambahkan variabel pada fungsi
gelombang atau dapat juga dengan menambahkan suku tambahan ke
dalam persamaan.
Cara yang paling sederhana adalah menambahkan muatan inti
sebagai variabel (perisai. Disamping itu, dapat juga suku tambahan
dimasukan, misalnya sifat ion pada fungsi gelombang yang berhubungan
dengan posisi kedua elektron pada orbital 1s dalam proton yang sama,
H2s
H2a
0
#
E
Bab 8: Teori ikatan valensi
149
%abeI 8.1:
Hasil beberapa penyempurnaan
fungsi gelombang H2
dengan pertimbangan bahwa molekul H
2
terurai menjadi H
+
H
. Dengan
demikian akan ada dua hubungan yaitu
a 2 a 1 3
s 1 s 1 X dan
b 2 b 1 4
s 1 s 1 X 8.7
sehingga fungsi gelombang total untuk molekul H
2
dapat ditulis menjadi
4 4 3 3 2 2 1 1 2
X C X C X C X C 8.8
leh karena molekul H
2
mempunyai bentuk simetris, dengan C
1
=
C
2
dan C
3
= C
4
, maka !ersamaan 8.8 dapat ditulis lebih lengkap menjadi
= C (term kovalen) + C' (term ionik) 8.9
Hasil perbaikan terhadap fungsi gelombang diberikan pada Tabel 8.1.
'ariabeI tambahan
Energi ikat,
e'
Jarak ikatan,
HeitIer-London :
Hanya bentuk kovalen
Dengan memasukkan efek perisai
Dengan bentuk ionik dan perisai
Dengan bentuk ionik dan tetapan perisai
berbeda untuk bentuk ionik dan kovalen
James & Coolidge (dengan 13 variabel
HasiI pengamatan
3,14
3,51
3,76
4,00
4,70
4,72
0,80
0,76
0,77
0,75
0,74
0,74
Bagaimana perbandingan fungsi gelombang untuk molekul H
2
yang
dihasilkan melalui pendekatan LC-M dengan pendekatan LC-VB?.
Fungsi gelombang yang diperoleh dari LC-M adalah
b 2 a 2 b 1 a 1 2 1
MO
2
s 1 s 1 C s 1 s 1 C S S
Fungsi gelombang dengan pendekatan LC-VB adalah:
a - - a
VB
s s s s C
Jika kedua fungsi ini dikaji tampak adanya perbedaan mendasar, yaitu
dalam hal penanganan masalah hubungan antar elektron.
Teori M menolak adanya semua hubungan dengan alasan
kebolehjadian menemukan kedua elektron dalam kedua proton sama.
Menurut pendekatan VB, kebolehjadian untuk menemukan kedua elektron
dalam suatu proton nol. Jadi terdapat perbedaan di antara dua pandangan
yang ekstrim ini, tetapi ada pemahaman yang saling melengkapi di antara
kedua pendekatan tersebut.
!erluasan prosedur ikatan valensi ke dalam molekul yang komplek
memiliki aturan berbeda dari pendekatan M. !ada pendekatan ikatan
valensi, diasumsikan bahwa proses pembentukan molekul dapat
digambarkan sebagai pembentukan sepasang elektron valensi dari dua
atom untuk membentuk ikatan valensi, yang secara esensi dapat
digambarkan seperti pada molekul H
2
.
Bab 8: Teori ikatan valensi
150
Gambar 8.2:
Kekuatan ikatan paling besar bila
orientasi kedua orbital sepanjang
sumbu ikatan.
Kriteria pertindihan maksimaI:
1. !ertindihan orbital jenis-s
rbital ini berbentuk simetris sferik
sehingga pertindihannya maksimal
dalamsemua arahh.
2. !ertindihan orbital jenis-p
!ertindihan maksimal tercapai jika
terjadi overlap 2px jika berada pada
sumbu ikatan
8.2 MOLEKUL DATOM HETERONT
!embentukan ikatan valensi pada molekul diatom B melibatkan
antaraksi antara satu elektron dari orbital atom , ditulis dengan
elektron dari orbital atom B, ditulis . Fungsi gelombang untuk sepa-
sang elektron 1 dan 2 (satu dari setiap atom adalah
VB =
2 1 2 1 1 2 2 1
C C C C 8.10
dengan su-script menyatakan kedua elektron. Catatan bahwa, kedua
elektron harus berpasangan dengan spin dan berlawanan.
Fungsi gelombang dapat dituliskan menurut bentuk yang diberikan
pada !ersamaan 8.10 hanya jika atom itu mempunyai dua orbital dari kulit
valensi yang kosong. leh karena itu dapat ditinjau pembentukan ikatan
valensi normal diantara dan atom B dengan satu elektron dari orbital
. - atau , dan satu elektron pasangannya dari orbital . - atau , .
Energi ikatan yang dihasilkan merupakan selisih antara energi
terendah (berkaitan dengan !ersamaan 8.10, diperoleh dari determinan
sekuler dengan energi yang berhubungan dengan dua elektron yang
sama pada atom keadaan terisolasi.
Kekuatan ikatan yang terbentuk bergantung pada derajat overlap
dan selisih energi orbital atom yang hanya melibatkan antaraksi LC-VB.
&mumnya, kekuatan ikatan paling besar terjadi ketika orbital atom dan B
diorientasikan sedemikian rupa sehingga pembentukan ikatan valensi
berada pada sumbu ikatan B. Dengan demikian, orbital yang dipilih
terletak sepanjang sumbu ikatan seperti ditunjukkan pada Gambar 8.2.
rbital atom yang terlibat tidak hanya orbital s,p,d,. standar, tetapi
bolehjadi kombinasi linear dari orbital-orbital atom tersebut atau disebut
juga or-ital hi-rida.
&ntuk lebih jelas dapat ditinjau contoh yang telah dievaluasi dengan
pendekatan M, yaitu molekul HCl. katan pada molekul ini dihasilkan dari
overlap antara dua orbital s pada atom hidrogen dengan dua
kemungkinan orbital setengah-penuh dari atom klorin.
!ermasalahan yang muncul adalah orbital-p mana dari atom klorin
yang digunakan. Seperti diketahui, atom klorin mempunyai konfigurasi KK
2s
2
2p
x
2
2p
y
2
2p
z
1
, dan untuk kasus ini diandaikan ikatan terjadi akibat
overlap dan antaraksi orbital s dari atom hidrogen dengan orbital p
z
dari
atom klorin, persamaannya
2 1 2 : 1 : 1 : 2 2 : 1
s 1 s 1 C p 2 p 2 C p 2 s 1 C p 2 s 1 C Cl 8.11
Energi dari ikatan ini dapat dihitung dengan metode variasi. !ada
kasus ini, tetapan C' lebih besar daripada C'' sebab keelektronegatifan
atom klorin lebih besar. Hal ini sesuai fakta bahwa tetapan C'' yang
berhubungan dengan struktur H
+
Cl
sangat kecil sehingga persamaan
8.11 dapat ditulis menjadi
2 : 1 : 1 : 2 2 : 1
p 2 p 2 C p 2 s 1 C p 2 s 1 C Cl 8.12
Bab 8: Teori ikatan valensi
151
Gambar 8.3:
Diagram energi resonansi menurut
VB untuk molekul HCl
!ersen karakter ion dapat
dinyatakan dengan persamaan:
2
2
C 1
C 1
Gambar 8.4:
Representasi orbital hibrida sp
Dua suku pertama pada !ersamaan 8.12 dapat dianggap sebagai
pembentukan ikatan kovalen dalam HCl, dan bentuk ketiga dapat
dianggap mewakili struktur ionik dari H
+
Cl
.
&ntuk dua keadaan itu, molekul
dikatakan mengalami resonansi hi-ridisasi. Dalam hal ini tidak
dimaksudkan bahwa struktur HCl dan H
+
Cl
benar-benar ada, tetapi
hanya sekedar menunjukkan bahwa fungsi gelombang total ikatan dapat
dipisahkan menjadi fungsi gelombang untuk kedua struktur hipotetik ini.
nergi resonansi dapat didefinisikan se-agai selisih antara energi
ikatan hasil hitungan dengan energi terendah dari struktur yang ada, yaitu
bentuk-bentuk resonansi (Gambar 8.3. !emilihan bentuk-bentuk ini
sebenarnya kurang tepat, sebab jika diyakini cenderung akan memberi-
kan realita fisik terhadap sesuatu yang sebenarnya hanya merupakan
hipotetik dari aplikasi rumusan matematika.
Hal penting dalam perhitungan adalah tetapan (C'
2
pada
!ersamaan 8.12, yang merupakan fraksi karakter ionik dari ikatan. ni
merupakan konsep berguna, sebab merupakan suatu ukuran polaritas dari
ikatan. Jika nilai tetapan C' lebih besar maka ikatan lebih polar.
Jika energi ikatan untuk molekul HCl dihitung menggunakan
!ersamaan 8.12, hasilnya tidak begitu akurat dibandingkan dengan energi
yang diperoleh dari hasil percobaan. da beberapa cara untuk
memperbaiki perhitungan agar mendekati nilai sesuai percobaan, yaitu
dengan menambahkan parameter pada fungsi gelombang seperti pada
kasus sebelumnya dengan pemisahan atau penambahan suku.
!emasukan efek perisai ke dalam persamaan fungsi gelombang
dapat menyelesaikan beberapa masalah tetapi hasilnya masih kurang
memuaskan, sedangkan penambahan suku ke dalam fungsi gelombang
cenderung merusak gambaran kualitatif dari pembentukan ikatan valensi
sebagai hasil antaraksi dua pasang orbital atom. leh karena itu
pendekatan ini tidak digunakan lagi.
Metode lain untuk memperbaiki hasil perhitungan adalah dengan
memilih fungsi gelombang semula, yaitu menggunakan orbital atom
hibrida -ukan orbital s, p, atau d standar. Or-ital hi-rida adalah kom-inasi
linear dari or-ital-or-ital atom standar.
!ada molekul HCl, kulit valensi atom klorin dapat diandaikan terdiri
dari empat pasang orbital: 2 p 2 s
:
, p s
z
, p
x
, p
y
,
sehingga ikatan valensi dalam molekul HCl dapat dianggap sebagai hasil
dari antaraksi antara atom hidrogen dengan konfigurasi s' dan atom
klorin dengan konfigurasi ( 2 p 2 s
:
1
, ( 2 p 2 s
:
2
, p
x
, p
y
.
Fungsi gelombang dengan cara hibridisasi ini adalah:
2 1 1 2 2 1
sp sp C sp s 1 C sp s 1 C Cl 8.13
dengan
s
sp
Cl x Cl
dua orbital hibrida sp ditunjukkan pada Gambar 8.4.
!ada orbital hibrida, sebaran ruang sepanjang sumbu-z lebih besar
daripada sebaran orbital !
z
, sebab sebagian besar kerapatan elektron
pada satu sisi dari atom dipusatkan dalam satu orbital. Jika ukuran sudut
merupakan fungsi, sebaran relatif untuk orbital yang setara memiliki rasio s
=1, p = 1,73, sp = 1,93.
C X C' X
C X
Energi resonansi
Energi
Bab 8: Teori ikatan valensi
152
arakter s dan p dari or-ital yang
tidak -erpasangan akan -eragam
secara komplementer
Dengan demikian, energi ikatan yang dihitung menggunakan hibrida
sp dari atom klorin (!ersamaan 8.13 lebih besar daripada energi ikatan
yang dihitung dari orbital !
z
, sebab untuk jarak ikatan yang ada, integral
H
12
dan S
12
menjadi lebih besar untuk orbital hibrida sp.
!embuktian adanya peningkatan kekuatan ikatan ini hanya dapat
ditentukan menggunakan orbital hibrida sp, sebab energi atom klorin
dengan konfigurasi hipotetik: )
1
:
p 2 1 s 2 1 , )
2
:
p 2 1 s 2 1 ,
p
x
, p
y
tidak sama dengan energi atom klorin pada konfigurasi standar: s
,
p
z
, p
x
, p
y
.
rbital s berada pada tingkat energi lebih rendah di bawah orbital-p,
tingkat hunian bagian kosong dari valensi terluar atom klorin pada orbital s
meningkatkan energi total atom. Selisih energi pada keadaan dasar dari
ion bebas dan pada konfigurasi hipotetik ketika ikatan dibentuk dirujuk
sebagai energi hi-ridisasi keadaan valensi atau istilah sederhananya
sebagai energi hi-ridisasi.
!ersamaan 8.13 memberikan makna yang lebih bervariasi. !ada
persamaan tersebut orbital s dan p
z
dibagi sama di antara dua pasang
orbital hibrida secara sembarang, tidak perlu membagi secara akurat
sebab pembagian seperti bentuk:
:
2
p a 1 as dan
:
2
ap s a 1 juga
dibenarkan.
Disamping itu, jumlah relatif karakter s dan p dalam orbital hibrida
dapat divariasikan melalui variasi nilai a sampai diperoleh kekuatan ikatan
yang maksimum. Namun demikian, a merupakan parameter yang sukar
dievaluasi karena energi hibridisasi berubah dengan berubahnya a,
dengan kata lain, solusi determinan sekuler merupakan fungsi dari a.
Jika semua perbaikan dihimpun ke dalam satu fungsi gelombang
dan menggandakannya dengan fungsi spin untuk kedua pasangan
elektron yang berikatan akan diperoleh
)
2
C s 1 s 1 C
Cl
1 2 2 1 2 1 1 2 2 1
J
. - . -
. - - . . -
2
C
s 1 s 1
2
C
8.14
dengan =
:
2
Cl
p a 1 as ; dan C, C', a adalah tetapan.
!erhitungan energi untuk fungsi gelombang pada !ersamaan 8.14 sama
kasarnya dengan perhitungan ikatan valensi sederhana, walaupun efek
perisai disisipkan, teapi hasil perhitungan ini secara umum lebih baik
daripada perhitungan LC-M.
8.3 MOLEKUL DATOM KOMPLEK8
Secara konseptual sangat mudah untuk memperluas metoda VB
dalam kasus ikatan yang lebih kompleks, tetapi kompleksitas perhitungan
matematika makin rumit dengan makin kompleksnya ikatan, apalagi jika
jumlah ikatan valensinya dipertimbangkan. Sebagai contoh dapat tinjau
molekul N
2
sebagai gambaran.
Bab 8: Teori ikatan valensi
153
Molekul N
2
terbentuk dari 2 atom nitrogen dengan konfigurasi
elektronik pada keadaan dasar: KK 2s
2
2p
x
1
2p
y
1
2p
z
1
. katan-9 dapat
dibentuk melalui antaraksi orbital p
z
dari kedua atom. Dengan cara yang
sama orbital p
x
dapat berantaraksi membentuk ikatan 6
x
, juga orbital p
y
dapat berantaraksi membentuk ikatan 6
y
yang kedua. Jadi secara kualitatif
molekul N
2
mengandung satu ikatan-9 dan dua ikatan-6. Jika ketiga
pasang elektron ini dapat dibedakan, maka fungsi gelombang dapat
dituliskan terpisah (tanpa spin untuk setiap ikatan sebagai:
b 6 a 6 b a
3 xb 4 xa 4 xb 3 xa x
1 :b 2 :a 2 :b 1 :a
p p p p
p p p p
p p p p
6
6
9
8.15
dengan a dan - menyatakan kedua atom yang berikatan dan su-script
menyatakan elektron. Namun demikian, karena elektron tidak terbedakan,
fungsi gelombang terbaik untuk keseluruhan molekul (tanpa elektron 1s
dan 2s harus dikembangkan dalam determinan Slater untuk semua
elektron yang terlibat agar memenuhi prinsip !auli, yakni:
b a xb xa :b :a
p p p p p p 8.16
Jika fungsi spin dimasukkan ke dalam determinan sesuai prinsip
!auli dan mengubah tanda pertukaran spin-spin dari pasangan elektron
ikatan, akan diperoleh fungsi gelombang keseluruhan sebagai berikut:
. - . - - . . - . - . -
b a xb xa :b :a b a xb xa :b :a 2
p p p p p p p p p p p p N
. - - . . - - . . - - .
- . . - . - - . - . . -
- . - . - . . - - . - .
b a xb xa :b :a b a xb xa :b :a
b a xb xa :b :a b a xb xa :b :a
b a xb xa :b :a b a xb xa :b :a
p p p p p p p p p p p p
p p p p p p p p p p p p
p p p p p p p p p p p p
8.17
!ersamaan 8.17 hanya mengandung bentuk kovalen paling
sederhana (dengan mengabaikan kontribusi ionik. !ada umumnya bagian
kovalen dari keseluruhan fungsi gelombang VB untuk molekul yang
mengandung n pasangan elektron berikatan akan tersusun dari 2
n
determinan Slater yang masing-masing berorde 2n.
Gambaran ikatan yang digunakan untuk memperoleh persamaan
8.17 bukan satu-satunya cara menggambarkan ikatan dalam molekul N
2
melainkan juga dapat dilakukan cara yang lain. Sebagai contoh, ikatan
yang dibentuk menggunakan orbital atom nitrogen p
z
, p
x
, p
y
, dapat
dilakukan dengan menggunakan kombinasi linear orbital-orbital atom,
misalnya melalui susunan seperti berikut:
6
1
x
2
1
:
3
1
6
1
x
2
1
:
3
1
3
2
:
3
1
p p p
p p p
p p
8.18
Dalam set persamaan di atas, tiga orbital yang setara secara
simetris ditempatkan di sepanjang sumbu-z membentuk determinan Slater
tanpa spin (berkaitan dengan !ersamaan 8.16.
Bab 8: Teori ikatan valensi
154
Gambar 8.5:
lustrasi ikatan pisang dalam
molekul N2.
b
6
1
x
2
1
:
3
1
a
6
1
x
2
1
:
3
1
b
6
1
x
2
1
:
3
1
a
6
1
x
2
1
:
3
1
b
3
2
:
3
1
a
3
2
:
3
1
p p p
p p p p p p
p p p p p p p
8.19
!ersamaan 8.19 identik dengan !ersamaan 8.16. Nilai determinan tidak
berubah oleh penambahan maupun pengurangan baris dan kolom.
Set !ersamaan 8.18 sebagai hasil kombinasi linear identik dengan
ikatan rangkap tiga dalam molekul N
2
yang dibangun dari tiga ikatan
bengkok yang setara, disebut juga ikatan 'pisang', seperti ditunjukkan
pada Gambar 8.5. Gambar tersebut tidak hanya setara, melainkan juga
identik secara matematik. ni menunjukkan gambaran lebih konvensional
dari satu ikatan 9 dan dua ikatan 6 menurut teori VB.
!ada hakikatnya, !ersamaan 8.17 menggambarkan kerapatan
elektron total dari enam elektron ikatan pada keadaan spin berpasangan,
dimana keenam elektron tersebut dipecah ke dalam tiga pasang. Jadi
setiap set kombinasi linear ternormalisasi dari ketiga pasang orbital p,
setara ataupun tidak akan menghasilkan !ersamaan 8.17. Keadaan ini
analog dengan kerapatan muatan atom poli-elektron, yang juga dapat
dipecah ke dalam fraksi-fraksi sembarang.
katan pisang menggambarkan ikatan rangkap yang sederhana.
Misalnya pada molekul N
2
, dibangun dari dua atom nitrogen yang
berhibridisasi ke dalam orbital hibrida sp
3
dengan satu hibrida dibiarkan
tidak terhuni dan tiga hibrida lainnya membentuk ikatan pisang yang
setara dengan atom nitrogen lain.
8.3 MOLEKUL POLATOMK
Fungsi gelombang pada !ersamaan 8.17 memberikan gambaran
molekul yang lebih rumit, seperti molekul heksana menghasilkan 2
19
determinan Slater dan masing-masing berorde 38. Dalam molekul rumit
hanya ada sedikit pilihan untuk memperlakukan pasangan ikatan sebagai
sesuatu yang takterbedakan bila menggunakan teori VB.
!enerapan teori VB dalam molekul poliatomik cukup beralasan jika
untuk memperoleh gambaran umum tentang ikatan dalam molekul atau
jika hanya ingin membuat perhitungan kasar semiempirik dari energi
ikatan. Tetapi, jika ingin melakukan perhitungan energi molekul secara a-
initio tampaknya hanya membuang waktu. leh karena itu, akan dibahas
secara kualitatif molekul poliatomik menurut teori VB.
Telah diketahui bahwa tidak ada kesukaran dengan ikatan-9 dalam
struktur klasik jika hibridisasi semua atom dalam molekul disederhanakan
misalnya, setiap atom memiliki orbital terletak sepanjang sumbu ikatan
dari atom-atom yang dibentuk. !asangan orbital overlaping yang terletak
sepanjang sumbu setiap ikatan dapat mengakomodasi pasangan elektron
dari ikatan-9. !asangan elektron yang tidak dipakai berikatan dan ikatan-6
yang terbentuk dapat ditambahkan untuk menghasilkan struktur ikatan
valensi.
Bab 8: Teori ikatan valensi
155
rbital
hibrida sp
rbital 2p
sisa
Gambar 8.11:
Pembentukan orbitaI hibrida sp.
Kombinasi orbital atom s dan orbital atom p
menghasilkan orbital hibrida sp dengan
orientasi ruang membentuk sudut 180
o
.
2s
2p
sp
Bentuk orbital atom Be
setelah hibridisasi sp
Kekuatan tolakan pasangan
elektron:
! ! < ! !S < !S !S
! : pasangan elektron ikatan
!S : pasangan elektron sunyi
Gambar 8.10:
Struktur orbital molekul dalam
BeCl2 berbentuk linear
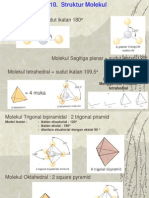
8.3.1 Hibridisasi dan Valensi Terarah
!ada molekul yang lebih kompleks akan dihasilkan berbagai bentuk
molekul seperti segitiga datar, tetrahedral, atau heksagonal. kibatnya,
dalam molekul akan memiliki sudut ikatan tertentu. &ntuk menerangkan
gejala ini dapat digunakan konsep hibridisasi melalui kombinasi dua atau
lebih orbital atom membentuk orbital hibrida.
rbital hibrida memiliki arah tertentu yang dapat berbeda dengan
arah orbital atom semula, sehingga pembentukan orbital hibrida disertai
orientasi sudut orbital. Hal ini disebabkan antara lain adanya tolakan
antara pasangan elektron, sehingga atom-atom dalam molekul akan
mengambil posisi sedemikian rupa sehingga tolakan sekecil mungkin.
Contoh aplikasi teori VB dalam molekul kompleks sebagai berikut.
oIekuI Linear
Menurut teori ikatan valensi, dalam molekul BeCl
2
, orbital 2s dari
atom Be akan overlap dengan orbital 3p
z
dari atom Cl, akibatnya arah
sudut ikatan dan energinya berbeda dari sebelumnya. Berdasarkan hasil
percobaan ditemukan bahwa sudut ikatan Cl-Be-Cl adalah 180
o
sehingga
bentuk molekulnya linear (Gambar 8.10. ni dapat diterangkan melalui
hibridisasi orbital 2s dan 2p
z
membentuk fungsi gelombang berikut:
:
2
1
:
2
1
p 2 s 2 p 2 s 2 sp 8.20
Setiap orbital ikatan terlokalisasi dalam BeCl
2
dapat dikonstruksi
dari pengkombinasian orbital kulit valensi pada atom berilium dengan
orbital 3p dari salah satu atom klorin. rbital valensi dalam atom berilium
terdiri dari orbital 2s
2
, 2p
x
0
, 2p
y
0
, 2p
z
0
. rbital mana yang dapat
membentuk dua orbital ikatan terlokalisasi yang setara dalam BeCl
2
.
Jawabannya adalah menggunakan kombinasi dua orbital valensi dari atom
berilium membentuk pertindihan terbesar dengan setiap orbital 3p
z
dari
atom klorin.
Setelah mengetahui orbital ikatan
terlokalisasi dapat dibentuk melalui
kombinasi orbital valensi dalam atom
berilium, pertanyaan berikutnya adalah:
kombinasi orbital valensi mana dari atom
berilium yang menyediakan pertindihan
maksimal dengan orbital 3p
z
atom klorin,
Berdasarkan persamaan 8.20 diketahui
bahwa, hanya orbital 2s dan satu orbital
2p
z
yang membentuk pertindihan maksi-
mal menghasilkan dua orbital hibrida sp
seperti pada gambar 8.11.
rbital tersebut memiliki dua aspek penting, yaitu: (a setiap orbital
sp menyediakan ruang untuk overlap dengan orbital 3p
z
dari atom klorin;
(b kedua orbital diarahkan pada sudut 180
o
satu sama lain. Selanjutnya,
kedua orbital hibrida sp pada atom berilium dikombinasikan dengan orbital
3p
z
dari atom klorin membentuk dua orbital ikatan terlokalisasi yang
setara, seperti ditunjukkan pada gambar 8.12.
Bab 8: Teori ikatan valensi
156
Dua orbital p yang
masih kosong
I
I
I
I
Gambar 8.12: Pembentukan
orbitaI ikatan-9 terIokaIisasi
daIam moIekuI BeI2.
%iap or-ital ikatan di-entuk melalui
pertindihan sp dari Be dan 3pz dari Cl.
eempat elektron valensi hasil perse-
kutuan dari dua atom Cl dan Be meng-
huni dua or-ital ikatan terlokalisasi
mem-entuk dua ikatan-9 terlokalisasi.
Konfigurasi elektron keadaan dasar Be:
2s
2
2p
0
Konfigurasi elektron setelah promosi:
2s
1
2p
1
Konfigurasi elektron orbital hibrida sp:
(sp
2
px py
Dalam molekul BeCl
2
terdapat empat elektron valensi, pengisian
elektron valensi ke dalam orbital ikatan mengikuti aturan !auli, yaitu setiap
orbital ikatan dihuni oleh dua elektron valensi dengan spin berlawanan.
Konfigurasi elektronik kulit terluar BeCl
2
dapat dituliskan sebagai (9
1
2
(9
2
2
. leh karena keduanya merupakan orbital ikatan terlokalisasi, maka
konfigurasi elektronik (9
1
2
(9
2
2
menyatakan dua ikatan kovalen.
Berdasarkan gambar diketahui bahwa dua orbital ikatan berada
pada posisi 180
o
satu sama lain, hal ini sesuai dengan hasil pengamatan
bahwa geometri molekul dari BeCl
2
adalah linear. Dua orbital 2p yang
tidak digunakan pada atom berilium tidak berperan dalam ikatan.
!embentukan molekul BeCl
2
, dapat ditinjau dari perubahan
konfigurasi elektron valensi atom Be sebagai berikut:
Konfigurasi elektron valensi atom berilium pada keadaan dasar adalah:
2s
2
2p
x
2p
y
2p
z
gar terbentuk dua ikatan kovalen antara dua atom Cl dan atom
Be, harus tersedia dua buah orbital setengah penuh (yang dihuni satu
elektron pada atom Be. &ntuk memenuhi persyaratan tersebut, teori
ikatan valensi menyarankan kombinasi antara orbital 2s dan orbital 2p
x
dalam atom berilium untuk membentuk dua orbital hibrida sp, dimana
kedua orbital tersebut memiliki tingkat energi setara dan berada di antara
orbital 2s dan orbital 2p.
Kedua elektron yang sebelumnya berada pada orbital 2s, sekarang
menghuni orbital hibrida sp melalui promosi elektron. Menurut aturan
Hund, pengisian elektron ke dalam orbital pada tingkat energi yang sama
diusahakan tidak berpasangan dulu dan spinnya sejajar. Karena itu pada
orbital hibrida sp, masing-masing elektron mengisi orbital hibrida sp
dengan spin sejajar.
(sp
2
p
x
p
y
Selanjutnya, tiap orbital hibrida sp bertindihan dengan setiap orbital
3p dari atom Cl membentuk ikatan-9 terlokalisasi yang setara. Konfigurasi
elektron ikatan-9 dalam molekul BeCl
2
adalah:
(9
1
2
(9
2
2
Bab 8: Teori ikatan valensi
157
rbital 2p kosong
rbital p boron yang
masih kosong
Konfigurasi elektron keadaan dasar B:
2s
2
2p
1
Konfigurasi elektron setelah promosi:
2s
1
2p
2
!embentukan orbitak hibrida sp
2
:
(sp
2
3
2py
Gambar 8.12:
!embentukan orbital hibrida sp
2
.
.
Konfigurasi elektron keadaan dasar C:
2s
2
2p
1
Konfigurasi elektron setelah promosi:
2s
1
2p
2
!embentukan orbitak hibrida sp
3
:
(sp
3
4
oIekuI %rigonaI PIanar
Dalam molekul BF
3
terdapat ikatan yang koplanar dengan sudut
ikatan 120
o
. tom boron mempunyai konfigurasi: 1s
2
2s
2
2p
x
1
. Jika
elektron pada orbital 2s dipromosikan akan terbentuk keadaan eksitasi
dengan konfigurasi elektron terluar: 2s
1
2p
z
1
2p
x
1
, dimana ketiga elektron
tidak berpasangan. Selanjutnya, ketiga elektron itu membentuk tiga ikatan
valensi. Menurut teori VB, orbital 2s, 2p
x
dan 2p
y
akan berhibridisasi
membentuk tiga orbital sp
2
dengan energi setara. Fungsi gelombangnya
adalah sebagai berikut:
x
2
1
6
1
3
1 2
x
2
1
6
1
3
1 2
3
2
3
1 2
p 2 p 2 s 2 sp
p 2 p 2 s 2 sp
p 2 s 2 sp
8.21
rbital
:
p 2 tidak memberikan kontribusi terhadap orbital hibrida sp
2
,
sebab sumbu ikatan yang dipilih adalah sumbu-x.
!embentukan orbital hibrida sp
2
ditunjukkan pada Gambar 8.12.
katan yang terbentuk pada B-F adalah ikatan-9, yang dibangun dari
overlap antara orbital hibrida sp
2
dari atom boron dan orbital standar 2p
z
dari atom fluorin (Gambar 8.13.
Gambar 8.13: Pembentukan ikatan daIam BF3.
Tiap ikatan BF dibentuk dari pertin-dihan antara orbital sp2 dari boron dan orbital 2pz dari
fluor. Tiga orbital ikatan BF terlokalisasi dihuni oleh enam elektron valensi yang membangun
tiga ikatan kovalen BF dalam molekul BF3.
oIekuI %etrahedraI
Contoh umum molekul dengan konfigurasi tetrahedral adalah
molekul metana, CH
4
. Sama halnya dengan berilium dan boron, agar atom
karbon dapat berikatan dengan empat atom hidrogen, diperlukan empat
buah orbital dengan elektron tidak berpasangan. Dalam hal ini dilakukan
promosi satu elektron dari orbital 2s kepada orbital 2p dalam atom karbon
memberikan konfigurasi: 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
.
Selanjutnya mengkonstruksi keempat orbital tersebut melalui
kombinasi linear orbital-orbital atom, yaitu satu orbital 2s dengan tiga
orbital 2p pada atom karbon membentuk empat orbital hibrida. leh
karena keempat orbital dihasilkan dari kombinasi orbital 2s dan tiga orbital
2p, orbital tersebut dinamakan orbital hibrida sp
3
. Hasil kombinasi
ditunjukkan pada gambar 8.14.
Bab 8: Teori ikatan valensi
158
Gambar 8.14:
Pertindihan orbitaI 2s dan tiga
orbitaI 2p membentuk orbitaI
hibrida sp
3
.
eempat or-ital hi-rida sp3 eqivalen
satu sama lain. al ini mendorong
geometri di sekitar atom pusat
mem-entuk -angunan tetrahedral
dengan sudut ,5
o
.
Gambar 8.15:
Empat ikatan 9 terlokalisasi dalam
CH4 dibentuk melalui kombinasi
orbital 2s dan tiga orbital 2p pada
atom karbon.
Keempat orbital sp
3
yang dibentuk setara dalam ukuran maupun
tingkat energinya. kibatnya, keempat orbital hibrida sp
3
membentuk
tetrahedral yang simetris di sekitar atom pusat dan molekul yang dibentuk
melalui orbital hibrida sp
3
memiliki geometri tetrahedral. Fungsi
gelombang hasil kombinasi linear orbital-orbital atom dalam sp
3
adalah
sebagai berikut:
: x
2
1 3
: x
2
1 3
: x
2
1 3
: x
2
1 3
p 2 p 2 p 2 s 2 sp
p 2 p 2 p 2 s 2 sp
p 2 p 2 p 2 s 2 sp
p 2 p 2 p 2 s 2 sp
8.22
!embentukan molekul CH
4
dilakukan melalui pertindihan setiap
orbital sp
3
dari atom karbon dengan orbital 1s dari atom hidrogen.
Terdapat delapan elektron valensi dalam molekul CH
4
. Kedelapan elektron
tersebut menghuni ke empat orbital ikatan yang terlokalisasi membentuk
empat ikatan 9, seperti ditunjukkan pada Gambar 8.15.
Pemakaian orbitaI-d daIam ikatan
!embentukan orbital hibrida yang melibatkan orbital-d biasanya
terjadi pada atom pusat dengan bentuk molekul dwilimas segitiga atau
oktahedral, semuanya merupakan senyawa superoktet. Contoh molekul
dengan geometri dwilimas segitiga misalnya !Cl
5
; dan molekul dengan
geometri oktahedral misalnya SF
6
.
2s
2px
2py
2pz
Sp
3
109,5
o
Bab 8: Teori ikatan valensi
159
Fungsi gelombang untuk orbital
hibrida sp
3
d
2
:
z
y x
y x
y x
y x
z 3
z 3
p d d s
p d d s
p d d s
p d d s
d p s
d p s
Kombinasi satu orbital 3s, tiga orbital 3p dan satu orbital 3d
menghasilkan lima orbital hibrida dengan geometri dwilimas segitiga.
Kelima orbital hibrida sp
3
d mempunyai sifat-sifat menarik, karena tidak
eqivalen satu dengan yang lain.
Sejatinya, orbital hibrida tersebut membentuk dua susunan orbital
eqivalen: susunan pertama terdiri dari tiga orbital hibrida equilateral yang
eqivalen; dan susunan kedua terdiri dari dua orbital aksial yang eqivalen.
Sesuai dengan data pengamatan bahwa kelima atom klorin dalam !Cl
5
tidak eqivalen. Kelima orbital ikatan !Cl dibentuk melalui pertindihan
setiap orbital hibrida sp
3
d dengan orbital 3p dari atom klorin. Sepuluh
elektron valensi menghuni lima orbital ikatan-9 terlokalisasi membentuk
lima ikatan kovalen terlokalisasi.
Konfigurasi kesepuluh elektron valensi dalam atom pusat dapat
dijelaskan sebagai berikut:
Konfigurasi elektronik pada keadaan dasar dari atom fosfor adalah:
3s
2
3p
3
3d
0
gar terbentuk lima buah orbital setengah penuh, maka satu orbital 3s,
tiga orbital 3p dan satu orbital 3d dikombinasikan membentuk lima buah
orbital hibrida sp
3
d. Konfigurasi elektronik dalam orbital hibrida sp
3
d
mengikuti aturan Hund menghasilkan
(sp
3
d
5
3d sisa
Selanjutnya, setiap orbital sp
3
d bertindihan secara maksimal dengan
setiap orbital 3p dari atom klorin membentuk lima orbital ikatan-9
terlokalisasi. Kelima orbital ikatan ini membentuk susunan dwilimas
segitiga, menghasilkan geometri molekul !Cl
5
dwilimas segitiga.
Konfigurasi elektron valensi dalam molekul fosfor pentaklorida adalah:
(9
1
2
(9
2
2
(9
3
2
(9
4
2
(9
5
2
.
(91
2
(92
2
(93
2
(94
2
(95
2
katan pada molekul SF
6
terjadi melalui kombinasi linear orbital 3s,
tiga orbital 3p, dan dua orbital 3d dalam atom belerang. Hasilnya adalah
orbital hibrida sp
3
d
2
dengan arah oktahedral beraturan. Keenam orbital
ikatan belerang-fluorin dibentuk melalui pertindihan setiap orbital hibrida
sp
3
d
2
dari atom belerang dengan orbital 2p dari atom fluorin. Dua belas
elektron valensi menghuni keenam orbital ikatan terlokalisasi membentuk
enam ikatan 9 terlokalisasi. Fungsi gelombang untuk keenam orbital ini
ditunjukkan di samping:
&raian berdasarkan konfigurasi elektronik pada atom pusat adalah
sebagai berikut:
Bab 8: Teori ikatan valensi
160
Konfigurasi elektron valensi
pada keadaan dasar dari atom
belerang adalah:
Geometri molekul SF
6
Gambar 8.16:
katan 9 dalam molekul etana
dibentuk melalui pertindihan orbital
hibrida sp
3
.
3s
2
3p
3
3d
0
gar terbentuk enam buah orbital setengah penuh, maka satu orbital 3s,
tiga orbital 3p dan dua orbital 3d dikombinasikan membentuk enam buah
orbital hibrida sp
3
d
2
. Konfigurasi elektronik dalam orbital hibrida sp
3
d
2
mengikuti aturan Hund, menghasilkan:
(sp
3
d
6
3d sisa
Selanjutnya, setiap orbital sp
3
d
2
bertindihan secara maksimal
dengan setiap orbital 2p dari atom florin membentuk enam orbital ikatan-9
terlokalisasi. Keenam orbital ikatan membentuk susunan oktahedral
beraturan dan bentuk molekul SF
6
juga oktahedral. Konfigurasi elektron
valensi dalam molekul SF
6
adalah: (9
1
2
(9
2
2
(9
3
2
(9
4
2
(9
5
2
(9
6
2
.
(91
2
(92
2
(93
2
(94
2
(95
2
(96
2
!ada kasus !Cl
5
dan SF
6
, digunakan orbital 3s, 3p, dan beberapa
orbital 3d dari atom pusat membentuk orbital hibrida. Menurut teori ikatan
valensi, kombinasi orbital atom pada pembentukan orbital hibrida hanya
terjadi pada orbital yang memiliki tingkat energi setara. ni berarti, orbital-
orbital 3, 3p, dan 3d dapat dikombinasikan sebab orbital-orbital tersebut
memiliki energi yang tidak berbeda jauh, tetapi kombinasi orbital 3d
dengan orbital 2s dan 2p tidak akan menghasilkan orbital hibrida yang
efektif sebab tingkat energi orbital berbeda jauh.
Hibridisasi daIam senyawa karbon
pakah hibridisasi terjadi pada senyawa karbon, khususnya pada
ikatan karbon-karbon? Contoh sederhana adalah molekul etana, C
2
H
6
.
Bentuk molekul etana dapat diuraikan dalam bentuk orbital hibrida sp
3
atom karbon. katan valensi karbon-karbon dalam etana dibentuk melalui
pertindihan antara orbital sp
3
dan orbital sp
3
dari masing-masing atom
karbon. Enam ikatan valensi karbon-hidrogen dihasilkan dari pertindihan
orbital sp
3
sisa dengan orbital 1s dari atom hidorgen. Dengan demikian
ada tujuh ikatan dalam etana.
Tiap atom karbon mempunyai empat elektron valensi dan tiap atom
hidrogen mempunyai satu, sehingga total elektron valensi dalam molekul
etana adalah 14 elektron valensi. Keempat belas elektron valensi ini
menghuni tujuh orbital ikatan, dan setiap orbital dihuni oleh dua elektron
dengan spin berlawanan. Gambaran orbital pada molekul etana
ditunjukkan pada gambar 8.16.
S
Bab 8: Teori ikatan valensi
161
Gambar 8.17:
!ertindihan orbital hibrida sp
2
-sp
2
membentuk ikatan-9 karbon-
karbon.
Gambar 8.18:
!ertindihan orbital p dan orbital p
yang tidak digunakan hibridisasi
membentuk ikatan 6.
katan rangkap dua karbon-karbon
katan rangkap dua karbon-karon juga dapat dijelaskan
menggunakan teori ikatan valensi. Salah satu molekul paling sederhana
yang mengandung ikatan rangkap dua karbon-karbon adalah etena, C
2
H
4
,
atau biasa disebut etilena.
Geometri molekul etilena sangat berbeda dari etana atau golongan
alkana lainnya. Semua atom pada etilena terletak pada satu bidang datar,
dan tiap atom karbon berikatan dengan tiga atom lain. Hal ini
mengisyaratkan bahwa tiap atom karbon membentuk geometri segitiga
datar yang dapat dijelaskan dengan menerapkan orbital hibrida sp
2
. leh
karena itu, ikatan-9 dalam etilena dapat diterangkan dengan orbital sp
2
pada setiap atom karbon.
Tahap pertama untuk menganalisis ikatan pada etilena adalah
menggabungkan dua atom karbon melalui kombinasi orbital sp
2
dari
masing-masing atom karbon. Hasil ikatan karbon-karbon ini adalah ikatan-
9 seperti ditunjukkan pada gambar 8.17. Empat atom hidrogen diikat oleh
atom karbon, masing-masing mengikat dua atom hidrogen melalui
pertindihan orbital sp
2
dan orbital 1s. Kelima ikatan yang dibentuk
semuanya ikatan-9.
!ada masing-masing atom karbon masih tersisa satu orbital 2p
yang belum digunakan untuk berikatan dengan orientasi tegak lurus
terhadap bidang H~C~H. Kedua ujung molekul dari etilena dapat berotasi
di sekitar sumbu ikatan-9 karbon-karbon guna memaksimalkan posisi
orbital 2p sisa. ni terjadi jika orbital 2p sisa sejajar satu sama lain
membentuk orbital ikatan 6. Dengan demikian, ikatan rangkap dalam
etilena dibangun oleh orbital-9 dan orbital-6 seperti ditunjukkan pada
gambar 8.18.
Tingkat energi ikatan-9 dan ikatan-6 tidak sama. Karena itu,
walaupun ikatan rangkap dua lebih besar daripada ikatan tunggal, tetapi
bukan berarti kekuatan dua kali dari ikatan tunggal. Energi ikatan karbon-
karbon tungal sekitar 350 kJ/mol, sedangkan energi ikatan karbon-karbon
rangkap dua sebesar 600 kJ/mol
katan rangkap dua dalam etilena terdiri dari ikatan-9 dan ikatan-6,
masing-masing dihuni oleh dua elektron dengan spin berlawanan. katan-6
mengunci molekul agar tetap berada pada posisi datar (tidak dapat
berotasi di sekitar sumbu ikatan sehingga geometri molekul etilena
membentuk planar.
katan 6 lebih lemah dari ikatan 9, sehingga keberadaannya
menimbulkan kereaktifan bagi senyawa C
2
H
4
, dan senyawa-senyawa lain
yang memiliki ikatan 6 terlokalisasi.
katan rangkap dua pada karbon-karbon memiliki dua daerah
kerapatan muatan, satu di atas dan satu lagi di bawah bidang molekul,
dan kedua awan muatan ini memiliki orbital yang sama dan tidak dapat
dianggap terpisah, bidang molekul merupakan bidang nodal orbital 6.
Bab 8: Teori ikatan valensi
162
Gambar 8.19:
Kerangka ikatan 9 dalam asetilena.
Or-ital ikatan 9 pada C~C hasil dari
kom-inasi dua or-ital hi-rida sp, dari
masing-masing atom kar-on. Dua
or-ital ikatan 9 pada C~ hasil dari
kom-inasi or-ital sp dari kar-on dan s
dari hidrogen.
Gambar 8.20:
rbital 2p dari dua atom karbon
yang berdam-pingan dalam
molekul asetilen.
Or-ital pz yang terarah sepanjang
sum-u z -erkom-inasi dengan pz lain
mem-entuk or-ital ikatan-6, dan or-ital
py yang terarah sepanjang sum-u y
-erkom-inasi dengan orital py yang
lain mem-entuk or-ital ikatan-6 kedua.
katan rangkap tiga karbon-karbon
Senyawa karbon yang mengandung ikatan rangkap tiga cukup
banyak. Salah satu contoh yang paling sederhana adalah etuna, C
2
H
2
,
atau disebut asetilena. Geometri molekul asetilena adalah linear, dimana
setiap atom karbon hanya mengikat dua atom lain. Sebagaimana telah
diuraikan di atas, untuk menganalisis ikatan dalam molekul dengan
geometri linear dapat diterapkan orbital hibrida sp. leh sebab itu, kita
akan menerapkan orbital hibrida sp pada setiap atom karbon dalam
asetilena.
&ntuk menerangkan ikatan dalam molekul asetilena
dapat diterangkan menurut dua tahap. !ertama kombinasi
dua orbital sp dari masing-masing atom karbon untuk
membentuk orbital ikatan-9 C~C, kemudian orbital hibrida sp
dari masing-masing atom karbon dikombinasikan dengan
orbital 1s dari atom hidrogen membentuk dua orbital ikatan-9
pada C~H. Kerangka ketiga ikatan-9 ini dapat dilihat pada
Gambar 8.19.
Dua orbital 2p sisa pada masing-masing atom karbon saling tegak
lurus terhadap sumbu H~C~C~H seperti ditunjukkan pada gambar 8.20.
Kedua orbital ini dapat dikombinasikan membentuk dua orbital ikatan-6
sehingga terdapat lima orbital ikatan dalam molekul asetilena. Tiga orbital
ikatan-9 dan dua orbital ikatan-6.
Distribusi muatan total untuk empat elektron ini membentuk silinder
yang simetris di sekitar sumbu ikatan C-C (Gambar 8.21. Sama halnya
dengan ikatan yang terjadi pada molekul N
2
berupa ikatan pisang. Bentuk
molekul dari asetilena adalah linear berupa silindris.
a)
b)
Gambar 8.21:
Sumbu z
Sumbu y
Sumbu C-C
Dua ikatan 6:
2pz-2pz dan 2py-2py
katan 9: sp-sp
ikatan 9: sp-1s
ikatan 9: sp-1s
Bab 8: Teori ikatan valensi
163
(a lustrasi ikatan dalam molekul
asetilena; dan (b distribusi muatan
total keempat elektron pada ikatan
6 membentuk silindris
Gambar 8.22:
Struktur resonansi untuk molekul
benzena
Struktur molekul benzena
8.3.2 Resonansi
Teori VB dapat dipakai untuk membahas beberapa aspek secara
lebih rinci menggunakan konsep resonansi yang diterapkan dalam sistem
konjugat seperti pada molekul benzena atau molekul poli-atom lainnya.
Menurut teori VB, molekul hidrogen dapat dinyatakan dengan dua
fungsi gelombang yang menggambarkan struktur hipotetik: H
(1 + H
B
(2
dan H
(2 + H
B
(1. Struktur sebenarnya merupakan hibrida resonansi dari
kedua keadaan tersebut. Gejala ini dinamakan resonansi. &mumnya,
makin banyak struktur hipotetik yang dapat dituliskan dari suatu molekul,
makin stabil molekul tersebut sebab energi resonansinya besar.
!ada molekul benzena, mekanika kuantum telah mengakomodasi
bahwa struktur molekul benzena adalah sumbangan dari dua struktur
Kekule dan tiga struktur Dewar seperti ditunjukkan pada Gambar 8.22.
Fungsi gelombang untuk molekul benzena dapat dituliskan dengan
mengambil kombinasi linear dari fungsi gelombang ikatan valensi untuk
kelima struktur hipotetik ini. Jika struktur ikatan-9 yang dibangun dari
hibrida sp
(pada setiap atom karbon dengan dua karbon yang
berdampingan, dimana atom hidrogen diabaikan, maka bagian ikatan-6
dapat dinyatakan dengan fungsi gelombang sebagai berikut:
V
5
V
4
C C C C C 6 6 6 6 6 6 5.23
dengan 6
, 6
, ., 6
V
adalah fungsi gelombang untuk ikatan-6
nonantaraksi untuk struktur sampai V. Contohnya 6
akan menjadi:
- . . - - . . - - . . - 6
4 4 3 2 3 2 6 1 6 1
I
p p p p p p p p p p p p 8.24
dengan p
n
menyatakan orbital 2p
z
dari atom karbon nomor n.
leh karena dua struktur Kekule dan tiga struktur Dewar dapat
dipertukarkan menurut bentuk heksagonal, maka:
C
= C
= C dan C
3
= C
4
= C
5
=C'
sehingga fungsi gelombang untuk molekul benzena dapat ditulis dalam
bentuk mampat sebagai
ewar Struktur C ekule Struktur C C
6 6
8.25
dan molekul benzena dapat dikatakan mengalami resonansi hibrida dari
struktur Kekule dan struktur Dewar.
!enggunaan bentuk resonansi ini sedikit berbeda dari penggunaan
pada struktur N
2
. !ada molekul N
2
, ikatan valensi tertentu dianggap
terbentuk dari hibrida resonansi struktur ion dan struktur kovalen,
sedangkan pada benzena molekul keseluruhan dianggap terbentuk dari
resonansi beberapa struktur kovalen murni dengan beberapa ikatan
kovalen pada posisi berbeda.
Tetapan C dan C' dalam bentuk kuadrat (C
2
dan C'
2
menyatakan
kontribusi fraksional dari dua jenis struktur. Kontribusi fraksional ini tidak
''
Bab 8: Teori ikatan valensi
164
perlu kuantitatif seperti halnya
pada parameter prinsip variasi
yang bergantung pada struktur
dan pendekatan fungsi
gelombang apa yang
digunakan, sebab keduanya
tidak memiliki makna fisik yang
nyata.
Gambar 8.23:
Hibrida resonansi dari molekul
S3.
Gambar 8.24:
Diagram tingkat energi molekul
S3.
Gambar 8.25:
Struktur molekul B2H6
Bentuk energi resonansi dapat dihitung dari selisih energi antara
sistem nyata dan sistem hipotetik dari kontribusi struktur yang berenergi
rendah. !ada kasus benzena, bentuk energi resonansi merupakan selisih
energi antara molekul benzena dan salah satu dari dua struktur Kekule,
hasilnya sekira 39 kkal/mol.
Contoh sederhana penerapan teori VB untuk resonansi misalnya
pada molekul S
3
. Molekul planar dari S
3
mengalami hibrida resonansi
dengan tiga bentuk struktur klasik seperti ditunjukkan pada Gambar 8.23.
katan-9 dibangun dari hibrida sp
pada atom belerang dan orbital p (atau
hibrida sp pada atom oksigen, dan ikatan-6 dibentuk dari overlap orbital p
z
pada belerang dengan orbital p di luar bidang dari salah satu atom
oksigen. Fungsi gelombang untuk molekul S
3
ditulis sebagai
3
3
SO 6 6 6 8.26
&ntuk mengetahui hal ini tinjau Gambar 8.24 yang memberikan
gambaran LC dari molekul S
3
dan dapat menunjukkan bahwa dugaan
adanya ikatan-6 kurang tepat. !ada diagram tingkat energi menunjukkan
bahwa sekurang-kurangnya ada tiga atau empat orbital molekul yang
memiliki karakter ikatan-6. Satu ikatan-6 berhubungan dengan orbital
ikatan a"
.
Kesulitan yang ditemukan pada molekul S
3
adalah pengabaian
orbital-d pada atom belerang, tetapi ini dapat diperbaiki melalui hibridisasi
orbital p
z
, d
zy
dan d
zx
pada belerang dan membentuk tiga ikatan-6 yang
setara dengan ketiga atom oksigen. leh karena energi orbital-d lebih
tinggi dari masing-masing ikatan-6 maka akan lebih lemah daripada
ikatan-6 semula, tetapi jumlah ketiganya mempunyai energi lebih besar
daripada resonansi satu ikatan-6.
8.3.3 katan Pusat-tiga
Konsep hibridisasai dapat juga diterapkan untuk menerangkan
molekul dengan ikatan pusat-tiga. Contoh dari ikatan pusat-tiga misalnya
pada senyawa boron, yaitu diboran (B
2
H
6
. Jika ikatan pada senyawa itu
didasarkan pada teori konvensional, maka di alam akan ditemukan
senyawa diboran yang lebih sederhana, yaitu BH
3
. Tetapi fakta
menunjukkan bahwa senyawa semacam itu tidak pernah eksis, yang ada
hanya diboran sebagai bentuk sederhananya.
Jika distribusi elektron pada senyawa diboran digambarkan secara
Lewis, maka akan tampak bahwa senyawa ini akan kekurangan satu
S
S
S
5
8
/
6
9
Bab 8: Teori ikatan valensi
165
elektron untuk dapat berikatan.
Dengan kata lain, senyawa
seperti ini dinamakan senyawa
defisien elektron.
Berdasarkan hasil
analisis diketahui bahwa
senyawa diboran memiliki
struktur seperti ditunjukkan
pada Gambar 8.25. !enjelasan
mengenai ikatan dalam
senyawa defisien elektron
dapat diberikan melalui konsep
hibridisasi. Jika ditinjau
kombinasi ketiga atom yang
terdiri dari dua atom sejenis, X
dan X' serta atom jenis lain,
misalnya Y, dan masing-masing
atom menyumbangkan satu
orbital atomnya untuk
membentuk ikatan, maka
diharapkan akan terbentuk tiga
orbital molekul, terdiri dari
orbital ikatan, orbital anti-ikatan,
dan orbital non-ikatan.
Struktur dimer dari senyawa
(lCl
3
2
%abeI 8.2:
Kekuatan dan panjang ikatan untuk orbital hibrida
Dalam molekul B
2
H
6
, dua gugus BH
2
dengan semua atomnya
terletak pada bidang datar. !ada setiap gugus BH
2
terdapat dua elektron
ikatan dan satu elektron sisa. Kedua gugus tersebut dihubungkan satu
dengan yang lainnya melalui jem-atan hidrogen. Disinilah letak defisiensi
elektron, untuk satu B-H-B hanya tersedia dua elektron.
Sekarang tinjau susunan dua ikatan pusat tiga, masing-masing
mengandung dua atom boron dan satu atom hidrogen memberikan satu
orbital molekul. Hal ini tentu memerlukan penggunaan orbital hibrida pada
atom boron yang mendekati hibridisasi sp
3
dikombinasikan dengan orbital
1s dari tiap atom hidrogen, sehingga menghasilkan dua set orbital molekul
pusat-tiga, yang akan menghasilkan dua orbital molekul ikatan pusat-tiga.
leh karena tersedia empat elektron, maka dua elektron dapat diletakkan
pada setiap orbital ikatan hingga terbentuk struktur molekul yang stabil.
!ada umumnya, orbital molekul dapat disusun dari kombinasi linear
orbital atom dalam jumlah lebih dari dua, sehingga terjadi ikatan multi-
pusat. leh karena itu, tidak ada alasan untuk membatasi ikatan pusat-tiga
hanya pada diboran saja. Faktanya, dalam senyawa boran yang lebih
tinggi ditemukan juga suatu ikatan pusat-tiga tambahan yang melibatkan
tiga atom boron. Contoh lain dari senyawa yang mengandung pusat-tiga
misalnya senyawa dimer [lCl
3
]
2
.
8.3.4 Kekuatan katan dan Karakter 8
!ada pembahasan di atas, kekuatan ikatan dihubungkan dengan
derajat overlap orbital. Ternyata hal ini kurang tepat jika diterapkan pada
orbital hibrida sp. &ntuk mengatasi hal ini, jari-jari orbital s diberi nilai satu,
Bab 8: Teori ikatan valensi
166
kemudian sumbu orbital hibrida
diukur dari inti relatif terhadap
orbital s, dan diperoleh nilai sp
= 1,93 pm, sp
2
= 1,99 pm, sp
3
=
2,00 pm.
Menurut cara di atas
diharapkan kekuatan ikatan
naik sejalan dengan naiknya
orde ikatan, tetapi fakta
menunjukkan terbalik.
Kekuatan ikatan berbanding
terbalik dengan panjang ikatan
seperti disajikan pada Tabel
8.2, yang menyatakan
hubungan antara kekuatan
ikatan C-H dan panjang ikatan
C-H untuk beberapa molekul.
Jika karakter s dari orbital
hibrida bertambah, maka
panjang ikatan C-H makin
pendek sehingga energi ikatan
bertambah besar.
katan -H
pada
OrbitaI
hibrida
Panjang
ikatan/pm
Energi ikatan/kJ.moI
-1
Metana sp
3
109,3 431
Etana sp
2
107,8 445
Etuna sp 105,6 506
8.4 PERBANDNGAN TEOR MO DAN VB
!erbedaan antara kedua pendekatan dalam menguraikan ikatan
kovalen dapat disimpulkan berdasarkan pertimbangan aturan main seperti
hibridisasi, resonansi, dan keadaan tereksitasi dari kedua teori itu.
Hibridisasi merupakan langkah pertama dalam teori VB, tapi dalam
M tidak diperlukan, walaupun teori M dapat juga menerangkan proses
hibridisasi. Hibridisasi menurut teori VB berhubungan langsung dengan
gagasan Lewis, yaitu ikatan pasangan-elektron.
Jika molekul dalam ikatan valensi digambarkan dengan dua-
elektron terlokalisasi di antara dua atom, maka diperlukan orbital atom
yang tepat dalam pembentukannya. &ntuk memperoleh orbital pada
pembentukan ikatan valensi adalah hibridisasi dari orbital atom standar. Di
lain pihak, menurut teori M molekul apapun secara keseluruhan
Bab 8: Teori ikatan valensi
167
terdelokalisasi, tidak hanya
orbital atom terluar melainkan
juga orbital atom bagian dalam.
Hibridisasi dapat
dianggap "perata-rataan dari
orbital molekul. &ntuk
menjelaskannya dapat ditinjau,
misalnya molekul metana.
Menurut teori M, akan
diperoleh delapan elektron
valensi untuk satu orbital ikatan
a
1
dan tiga orbital ikatan
terdegenerasi t
2
. Semua orbital
molekul ini terdelokalisasi dan
orbital a
1
memiliki energi
berbeda dari orbital t
2
. Menurut
teori VB, kedelapan awan
elektron dalam metana
membentuk ikatan valensi
setara dengan empat pasang
elektron, masing-masing
pasangan elektron
dilokalisasikan di antara atom
karbon dan hidrogen.
Jika kedua teori eksak,
maka akan memberikan energi
total molekul yang sama, dan
energi dari setiap ikatan valensi
akan berada di antara orbital
molekul a
1
dan orbital molekul
t
2
. Tetapi energi dari salah satu
ikatan valensi C-H dalam CH
4
terisolasi, sehingga jika
dikalikan empat tidak diizinkan,
sebab keempat ikatan valensi
C-H dalam molekul CH
4
tidak
ortogonal dan bentuk diagonal
dari determinan tidak nol.
Secara matematika,
pendekatan M membagi awan
muatan total sistem ke dalam
bentuk ortogonal, dan tidak
perlu orbital yang setara,
sedangkan pendekatan VB
membagi awan muatan total
secara ekivalen tetapi bukan
orbital ortogonal yang
terlokalisasi.
Kedua teori ini memiliki
kelebihan dan kekurangan.
Teori VB biasanya mudah divisualkan, mudah dituliskan fungsi
gelombangnya, dan mudah dimanipulasi secara kualitatif, tetapi sukar
dihitung. Sedangkan teori M lebih mudah dalam perhitungan, tetapi
sukar divisualkan dan sukar dikualitatifkan akibat sifat delokalisasi.
Keduanya akan sejalan jika kerapatan elektron total molekul dipecah ke
dalam orbital yang setara dan ortogonal, tetapi menurut teori grup hal ini
tidak mungkin.
Konsep resonansi sebagai kulminasi teori VB tidak dikenal dalam
teori M. Konsep resonansi harus diberlakukan dalam teori VB agar
terjadi delokalisasi pasangan elektron ikatan melalui lebih dari tiga atom,
sebab tanpa itu semua, pasangan elektron ikatan yang dilokalisasi di
antara dua atom sangat kecil. Menurut teori M, delokalisasi tidak begitu
berperan penting, sebab pasangan elektron sudah terdelokalisasi sejak
molekul dibentuk.
katan 9 dalam molekul benzena dibentuk melalui hibrida sp
2
!ertindihan orbital p yang tidak digunakan dalam hibridisasi membentuk ikatan 6
(VB.
Elektron-elektron dalam ikatan 6 terdelokalisasi
Bab 8: Teori ikatan valensi
168
Struktur molekul benzena menurut
teori VB dan M (Bentuk molekul
dan sudut ikatan mengikuti teori
VB. Kerapatan muatan elektron 6
terdelokalisasi mengikuti teori M
Barangkali keunggulan
terbesar dari teori M adalah
dalam menangani energi
molekul tereksitasi. Walaupun
ini tidak ditekankan, tetapi
sudah dapat dipastikan adanya
eksitasi, sedangkan teori VB
hanya berlaku pada keadaan
dasar. Hal ini dapat disimak
kembali dalam perhitungan
pada molekul H
2
, dimana
energi keadaan dasar yang
diungkapkan dalam teori VB
menjadi salah satu
penyelesaian dalam
determinan sekuler
(!ersamaan 8.4.
Dengan demikian, jika
berhubungan dengan keadaan
tereksitasi, maka teori M
merupakan salah satu teori
yang layak untuk digunakan.
Hal ini tentunya dapat juga
digunakan untuk menentukan
tingkat energi keadaan dasar,
khususnya untuk molekul
sederhana.
Jika berhubungan
dengan stereokimia molekul
secara kualitatif, maka teori VB
lebih unggul, tetapi hasil yang
diperoleh kurang akurat.
Contoh, jika molekul CH
2
Cl
2
dikatakan tetrahedral dengan
panjang ikatan CCl sekitar
1,76, ini bukan masalah untuk
kedua teori, tetapi jika ingin
menerangkan mengapa
ClCCl bersudut 111,8
0
dan jarak CCl adalah 1,77 dalam CH
2
Cl
2
,
maka bagi teori VB merupakan masalah dan perlu penanganan secara
mendalam.
!ada umumnya, teori VB dalam menganalisis berbagai aspek
berkaitan dengan stereokimia lebih baik daripada teori M, sehingga teori
VB banyak diterapkan untu tujuan ini, tetapi bukan berarti teori M tidak
dapat diterapkan untuk menjelaskan stereokimia. &ntuk molekul
sederhana atau molekul simetris, teori M dapat memberikan jawaban
yang baik bahkan bolehjadi lebih baik dari VB. Sebagai gambaran, teori
M dapat menerangkan dengan sangat memuaskan dalam ikatan pusat-
tiga (diboran dibandingkan teori VB.
Dalam hal tertentu, kedua teori dapat diterapkan secara bersama-
sama terhadap bagian-bagian yang berbeda dari molekul. Misalnya,
ikatan-9 pada benzena menjadi ikatan valensi sederhana dan ikatan-6
menjadi sistem terdelokalisasi dalam M. Biasanya, beberapa solusi
'gabungan' seperti ini merupakan cara terbaik untuk mengatasi masalah
seperti itu. Contoh kebersamaan dari kedua teori tersebut dapat
diterapkan dalam membahas struktur molekul benzena.
Berdasarkan eksperimen diketahui bahwa benzena membentuk
heksagonal beraturan dengan sudut ikatan 120
. &ntuk menerangkan ini
dapat digunakan teori VB. Menurut teori VB, bentuk heksagonal dengan
sudut 120
dicapai melalui hibridisasi orbital sp
2
membentuk kerangka
ikatan 9. Berdasarakan pengamatan lain, elektron-elektron 6 pada cincin
benzena terdelokalisasi. Sifat delokalisasi muatan dapat diterangkan
dengan teori M. Dengan demikian kedua teori dapat diterapkan secara
bersama-sama, tidak ada pertikaian di antara keduanya. Dalam hal ini
mereka hidup rukun dan damai.
EVALUA8 BAB 8
1. Berikan fungsi gelombang ikatan valensi untuk
ion molekul hidrogen.
2. pa perbedaan antara fungsi gelombang orbital
molekul dan fungsi gelombang ikatan valensi?
Terangkan
3. Mengapa fungsi gelombang orbital molekul
untuk H
2
tidak dapat diterapkan pembentukan
ikatan valensi H
2
menurut teori VB?
4. Jelaskan perbedaan mendasar antara teori VB
dan teori M?
5. Manakah integral pertindihan berikut memiliki
nilai nol?
(a Suatu fungsi s mendekati fungsi p
z
sepan-
jang sumbu-z
(b Suatu fungsi s mendekati fungsi p
y
sepan-
jang sumbu-x
(c Suatu fungsi p
y
mendekati fungsi pz sepan-
jang sumbu-y
(d Dua fungsi p
x
saling mendekat satu sama
14. Terangkan menurut teori VB
yang digunakan pada ato
geometri tertentu di sekitar ato
15. Berapa sudut yang dibentu
hibrida sp
2
dan orbital sp
3
pada
16. Terangkan apa perbedaan an
dan ikatan phi?
17. Bagaimana penjelasan ikata
ikatan karbon-karbon yang m
cis- dan trans-?
18. rbital hibrida apa yang dihar
pusat dalam setiap molekul be
(a lBr
3
; (b BeCl
2
; (c SiCl
4
;
19. Tunjukkan bahwa ikatan rangk
dapat dianggap satu ikatan
ikatan phi atau dua ikatan
pandangan ini identik secara m
20. Jelaskan orbital hibrida yang
|::i/ i /:J:/ /:/:/ /:/ J:.:/i /:/::/ J:J /:/:j/
Bab 8: Teori ikatan valensi
169
You might also like
- Soal CPNS Paket 2Document58 pagesSoal CPNS Paket 2icoirs 2016100% (4)
- IKATANDocument14 pagesIKATANAnggia RahayuNo ratings yet
- Teori Orbital MolekulDocument11 pagesTeori Orbital MolekulAni NuraeniNo ratings yet
- Teori Pita EnergiDocument20 pagesTeori Pita EnergiJunika100% (1)
- Zat Padat Pembahasan 1Document29 pagesZat Padat Pembahasan 1Kemas Pake KoperNo ratings yet
- Kelompok 11 KimanorDocument16 pagesKelompok 11 KimanorBang OtNo ratings yet
- Dalam Bab Ini Kita Prihatin Dengan PertanyaanDocument29 pagesDalam Bab Ini Kita Prihatin Dengan PertanyaanliskaNo ratings yet
- Halo SemuaDocument24 pagesHalo SemuaFatimatuz zahrohNo ratings yet
- Buku Teori Ikatan ValensiDocument33 pagesBuku Teori Ikatan ValensiJoNo ratings yet
- Penerapan MK Pada Teori Ikatan KimiaDocument29 pagesPenerapan MK Pada Teori Ikatan KimiaValia RahmaNo ratings yet
- Ikatan KovalenDocument7 pagesIkatan KovalenAzizah AulyahNo ratings yet
- 009 VBT Atau Teori Ikatan ValensiDocument10 pages009 VBT Atau Teori Ikatan ValensisitaNo ratings yet
- STRUKTUR ATOMDocument20 pagesSTRUKTUR ATOMYohanesFeriKriswanto50% (2)
- Modul 2 Struktur Dan Ikatan AtomDocument20 pagesModul 2 Struktur Dan Ikatan Atomagung rismantoNo ratings yet
- Struktur Atom Dan Ikatan AtomDocument46 pagesStruktur Atom Dan Ikatan Atompraadiitaa100% (2)
- Kronig-PenneyDocument20 pagesKronig-PenneyTriapani Mukti Gilang AnugrahNo ratings yet
- Ikatan Kimia I 2Document62 pagesIkatan Kimia I 2Mia YukimuraNo ratings yet
- FismodDocument7 pagesFismodAnty MalisaNo ratings yet
- Bab 2 Ikatan Dan StrukturDocument31 pagesBab 2 Ikatan Dan StrukturDian Eka FajriyantoNo ratings yet
- 02 Struktur MolekulDocument20 pages02 Struktur MolekulsaprifarmasiNo ratings yet
- Teori Orbital MolekulDocument16 pagesTeori Orbital MolekulLaila RoikhatulNo ratings yet
- 1 Struktur Atom Dan Ikatan Antar AtomDocument23 pages1 Struktur Atom Dan Ikatan Antar AtomHappy AprilliaNo ratings yet
- Teori Orbital Kel 6Document24 pagesTeori Orbital Kel 6Rya AzhNo ratings yet
- Dinamika Elektron Dalam LogamDocument6 pagesDinamika Elektron Dalam LogamMuhamad Ridwan HamdaniNo ratings yet
- Struktur MolekulDocument17 pagesStruktur Molekulnikhayatul qibtiyahNo ratings yet
- Tugas 2 Ikatan KimiaDocument17 pagesTugas 2 Ikatan KimiaNurwahyuniNo ratings yet
- Struktur Atom Dan Ikatan AtomDocument46 pagesStruktur Atom Dan Ikatan Atompraadiitaa50% (2)
- Bab III IKT Rev Bahn AjarDocument66 pagesBab III IKT Rev Bahn AjarHably Darajatal 'ulyaNo ratings yet
- MOLEKUL DAN IKATANDocument20 pagesMOLEKUL DAN IKATANAspo RamadhanNo ratings yet
- Teori Orbital Molekul Heteronuklir, Homonuklir, KoordinasiDocument24 pagesTeori Orbital Molekul Heteronuklir, Homonuklir, Koordinasiianatul khafidlah0% (1)
- Teori Orbital Molekul: Lischer 5 CommentsDocument11 pagesTeori Orbital Molekul: Lischer 5 CommentsSumitro SihombingNo ratings yet
- Model Gas ElektronDocument17 pagesModel Gas Elektroniin boinNo ratings yet
- Makalah Zat PadatDocument28 pagesMakalah Zat PadatSri RahmayaniNo ratings yet
- Pita EnergyDocument12 pagesPita EnergySofian AL KahfiNo ratings yet
- Energi ionisasi pertama dan afinitas elektron menunjukkan keperiodikan sifat kimia unsurDocument23 pagesEnergi ionisasi pertama dan afinitas elektron menunjukkan keperiodikan sifat kimia unsurchyeebiyooNo ratings yet
- ElektronegativitasDocument13 pagesElektronegativitasama annisaNo ratings yet
- Molekul Diatomik HomonuklirDocument7 pagesMolekul Diatomik HomonuklirZul FikarNo ratings yet
- MODEL ATOM FISIKA MODERNDocument20 pagesMODEL ATOM FISIKA MODERNUci RahmaddaniiNo ratings yet
- Kuliah Ke 7 Lanjutan - Ikatan Kimia LanjutanDocument31 pagesKuliah Ke 7 Lanjutan - Ikatan Kimia LanjutandelianaNo ratings yet
- STRUKTUR ATOM DAN IKATAN KIMIADocument12 pagesSTRUKTUR ATOM DAN IKATAN KIMIADevita Marlina Venessa SihiteNo ratings yet
- ZAT PADAT 12 Teori Pita Energi ElektronDocument18 pagesZAT PADAT 12 Teori Pita Energi ElektronahmadNo ratings yet
- STRUKTUR DAN IKATAN KIMIADocument28 pagesSTRUKTUR DAN IKATAN KIMIAcut dara voennaNo ratings yet
- Pertemuan Ke-9-Teori Pita Energi Elektron Dalam Zat PadatDocument15 pagesPertemuan Ke-9-Teori Pita Energi Elektron Dalam Zat Padatdelsa adeatmaNo ratings yet
- Makalah Ikatan Kimia TOM (Teori Orblital Molekul)Document11 pagesMakalah Ikatan Kimia TOM (Teori Orblital Molekul)Farikha UlyNo ratings yet
- Ketikan Materi MolekulDocument19 pagesKetikan Materi MolekulNurma Erlita DamayantiNo ratings yet
- BAB II Teori Orbital MolekulDocument12 pagesBAB II Teori Orbital Molekulrenidewitasari27No ratings yet
- Molekul KompleksDocument16 pagesMolekul Kompleksdayat029No ratings yet
- Pertemuan Ke 6 Bab 6 Teori Pita Energi Elektron Dalam Zat PadatDocument18 pagesPertemuan Ke 6 Bab 6 Teori Pita Energi Elektron Dalam Zat PadatShoffan FatkhullohNo ratings yet
- 03 Bab2Document20 pages03 Bab2JalaludinNo ratings yet
- Adoc - Tips - A Kestabilan Atom B Struktur Lewis C Ikatan Ion DDocument15 pagesAdoc - Tips - A Kestabilan Atom B Struktur Lewis C Ikatan Ion DDevi Elmira ImranNo ratings yet
- Kimia Kuantum Bab5Document72 pagesKimia Kuantum Bab5ArtistaPrihastutiKardiatNo ratings yet
- MAKALAH REKAYASA PERANCANGAN MEKANIKDocument24 pagesMAKALAH REKAYASA PERANCANGAN MEKANIKYohanes SilalahiNo ratings yet
- Dinamika Elektron LogamDocument11 pagesDinamika Elektron LogamNurul Hasanah0% (1)
- ITB-KALENDERDocument1 pageITB-KALENDERMuhammad Rizqi Nauval AfifNo ratings yet
- Brocure 2016Document4 pagesBrocure 2016Indana ZulfaNo ratings yet
- Kuliah PendahuluanDocument1 pageKuliah PendahuluanWidayat WahyuNo ratings yet
- Bro Sur 2015 Pascai TBDocument6 pagesBro Sur 2015 Pascai TBIrwan RamliNo ratings yet
- Permainan Dalam Olah RagaDocument2 pagesPermainan Dalam Olah RagaYunita PurnamasariNo ratings yet
- Soal CPNS Paket 9Document16 pagesSoal CPNS Paket 9icoirs 2016100% (3)
- Formasi CPNS LIPI Tahun 2018 - 18sep2018Document10 pagesFormasi CPNS LIPI Tahun 2018 - 18sep2018Muhamad EdwardNo ratings yet
- Wisata Dalam NegeriDocument25 pagesWisata Dalam Negeriicoirs 2016No ratings yet
- CoverDocument1 pageCoverYunita PurnamasariNo ratings yet
- Air HeksagonalDocument3 pagesAir HeksagonalYunita PurnamasariNo ratings yet
- Air HeksagonalDocument3 pagesAir HeksagonalYunita PurnamasariNo ratings yet
- CoverDocument1 pageCoverYunita PurnamasariNo ratings yet
- Soals2 1Document7 pagesSoals2 1Yunita PurnamasariNo ratings yet
- Cover PKNDocument1 pageCover PKNFitri SachiiNo ratings yet
- PKNDocument26 pagesPKNYunita PurnamasariNo ratings yet
- CoverDocument1 pageCoverYunita PurnamasariNo ratings yet
- COVER Lap BiokimDocument1 pageCOVER Lap BiokimYunita PurnamasariNo ratings yet
- CoverDocument1 pageCoverYunita PurnamasariNo ratings yet
- Abs TrakDocument1 pageAbs TrakYunita PurnamasariNo ratings yet
- Abs TrakDocument1 pageAbs TrakYunita PurnamasariNo ratings yet
- Kursus JahitDocument2 pagesKursus JahitYunita PurnamasariNo ratings yet
- COVER Lap BiokimDocument1 pageCOVER Lap BiokimYunita PurnamasariNo ratings yet
- PPL NON-DIKDocument61 pagesPPL NON-DIKYunita Purnamasari100% (1)
- COVER Lap BiokimDocument1 pageCOVER Lap BiokimYunita PurnamasariNo ratings yet
- Kata PengantarDocument2 pagesKata PengantarYunita PurnamasariNo ratings yet
- Harga NaOHDocument3 pagesHarga NaOHYunita PurnamasariNo ratings yet