Professional Documents
Culture Documents
Biljni Lekovi PDF
Biljni Lekovi PDF
Uploaded by
sale809425Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Biljni Lekovi PDF
Biljni Lekovi PDF
Uploaded by
sale809425Copyright:
Available Formats
Volumen 66, Broj 1
VOJNOSANITETSKI PREGLED
AKTUELNE TEME
Strana 53
UDC: 615.311::581.19
Znaaj zakonskih propisa za racionalnu primenu biljnih lekova
Significance of herbal drugs legislation for their rational use
Sneana M. Cupara, Slobodan M. Jankovi
Medicinski fakultet, Kragujevac
Kljune rei:
fitoterapija; zakonodavstvo; kontrola kvaliteta;
farmakopeje; lekovi, kliniko ispitivanje.
Uvod
Upotreba lekovitih biljaka nala je svoje mesto i u savremenoj terapiji. Izraz racionalna fitoterapija, koji se sve
ee susree podrazumeva korienje biljnih proizvoda koji
su formulisani, proizvedeni i stavljeni u promet na osnovu
eksperimentalno i/ili kliniki potvrene efikasnosti i bezbednosti primene 1.
Racionalna fitoterapija, kao savremeni pristup, nije u
suprotnosti sa tradicionalnim biljnim leenjem, ve esto
proistie iz njega. U tradicionalnom leenju lekovitim biljem, u zavisnosti od podneblja primene, susreu se razliiti
pogledi. Holistiki pristup, posebno uoljiv u tradicionalnoj
kineskoj i indijskoj medicini, podrazumeva da jedna biljka
ispoljava dejstvo na organizam u celini. Kako se ljudski organizam smatra celinom, shodno tome celina je i biljka kojom se koriguje eventualno naruena ravnotea u zdravlju.
Primer su monografije lekovitih biljaka Indijske farmakopeje
koje pri opisivanju karakteristika jedne biljke navode vie
njenih razliitih delovanja na razliite organe u organizmu,
koje navedena biljka moe da ispolji u zavisnosti od naina
kombinovanja sa drugim biljkama. U zemljama Zapadne Evrope, pak, ee je u upotrebi biljni preparat napravljen od
jedne biljke ili njenog ekstrakta sa namerom da se postigne
efekat na ciljnom organu. Ukoliko se koriste kombinacije lekovitog bilja u jednom biljnom preparatu ovaj cilj se postie
tako to se izabere vie razliitih biljaka koje istovremeno
deluju na oboleli organ.
Bilo da je re o racionalnoj fitoterapiji ili tradicionalnom leenju lekovitim biljem u upotrebi su esto identini
termini. Tradicionalnu upotrebu lekovitog bilja npr. esto
nazivaju fitoterapijom, dok se, s druge strane, nauni podaci
o lekovitom bilju esto koriste za opravdanje ili potvrdu njegove tradicionalne upotrebe. U oblast biljnih lekova grubo se
svrstavaju i homeopatski lekovi. Meutim izrazi biljni i
homeopatski lek nisu sinonimi. Biljni lek se izrauje od
Key words:
phytotherapy; legislation; quality control;
pharmacopoeias; drug evaluation.
sveeg ili suvog biljnog materijala ili ekstrakta nekog dela
biljke i koristi se za prevenciju ili suzbijanje jasno odreenih
simptoma po emu on lii na konvencionalni lek. Homeopatski lek sadri minimalne koliine susptancije koja bi u veoj
dozi kod zdravog oveka izazvala simptome nalik onima
koje taj lek moe da suzbije. Za razliku od biljnog, homeopatski lek deluje na organizam kao celinu (psihiki, fiziki i
emocionalno), a izrauje se drugaije od biljnog leka. Iako
mnogi homeopatski lekovi potiu od biljnih sirovina, oni ne
spadaju u biljne lekove, jer se homeopatski lekovi prave i od
drugih sirovina (mineralnih i ivotinjskih) posebnom tehnologijom razblaivanja poetne supstancije.
Prema podacima Svetske zdravstvene organizacije
(SZO) preparate na bazi lekovitog bilja koristi 80% svetskog
stanovnitva. Medicinska primena lekovitog bilja u Evropi
ima dugu tradiciju, dok u nekim delovima sveta (npr. Kina,
Indija) biljni lekovi jo uvek predstavljaju centralnu kariku u
lancu zdravstvenih usluga 2.
Institucije koje reguliu biljne lekove na tritu
Evrope i SAD
Biljni lekovi prisutni su na tritu svih zemalja u Evropi, iako se veliina trita razlikuje u svakoj od zemalja.
Zbog velikih razlika u klasifikaciji biljnih proizvoda meu
zemljama lanicama Evropske unije (EU), zakonski propisi
za ove preparate postali su prioritet za EU krajem 80-tih godina. Naime, neujednaenost kriterijuma za klasifikaciju biljnih proizvoda dovela je do toga da su oni u nekim zemljama lanicama bili prisutni kao medicinski preparati sa definisanim terapijskim dejstvom, u drugim registrovani kao dijetetski preparati bez posebnih terapijskih indikacija, a u treim kao biljni suplementi sa terapijskim dejstvom. Da bi se
ovaj problem reio 1989. godine oformljeno je udruenje pod
nazivom Evropsko nauno udruenje za fitoterapiju (European Scientific Cooperative on Phythotherapy ESCOP), sa
Correspondence to: Sneana M Cupara, Medicinski fakultet u Kragujevcu, Svetozara Markovia 69, 34 000 Kragujevac, Srbija.
Tel.: +381 63 386 485. E-mail: snezanacupara@yahoo.com
Strana 54
VOJNOSANITETSKI PREGLED
ciljem da se postave zajedniki kriterijumi za klasifikaciju
biljnih lekova, da se podstaknu nauna istraivanja u domenu
lekovitog bilja i da se doprinese institucionalizovanom prihvatanju fitoterapije u Evropi 3. European Scientific Cooperative on Phythotherapy osnovalo je est nacionalnih naunih organizacija sa namerom da se fitoterapijske organizacije
objedine na evropskom nivou. Danas u sastav ESCOP-a ulazi 13 nacionalnih udruenja iz Evrope, kao i Ameriki botaniki savet (American Botanical Council). Jedan od osnovnih
zadataka postavljenih pred ESCOP bio je sakupljanje svih
naunih podataka o jednoj biljnoj vrsti ili drogi, ukljuujui i
predklinike i klinike studije. European Scientific Cooperative on Phythotherapy je to realizovao objavljivanjem 80
monografija za pojedinane biljne droge 4. Dodatno, 1997.
godine osnovana je i radna grupa pod nazivom Working
Group on Herbal Medicinal Products (HMPWG) na inicijativu Evropskog saveta i sadanje Evropske agencije za lekove (bive Evropske agencije za evaluaciju lekova EMEA).
Ova grupa znaajno se oslonila na monografije ESCOP-a u
stvaranju formata Evropskog zakljuka o karakteristikama
proizvoda (European Summary of Product Characteristics
SPC). Ovu radnu grupu danas je nasledio Komitet za biljne
lekove (Herbal Medicinal Product Committee HMPC) i on
nastavlja saradnju sa ESCOP-om 5.
U skladu sa direktivom Evropskog saveta koja definie
medicinski proizvod (Direktiva 2001/83/EEC), svaki biljni
preparat koji ispunjava kriterijume ove direktive smatra se
medicinskim proizvodom i podlee istim propisima kao i
drugi medicinski proizvodi 6.
Posebna Evropska direktiva koja se odnosi na tradicionalne biljne preparate stupila je na snagu u aprilu 2004. godine sa zahtevom da je zemlje lanice uvrste u svoje pravilnike za registraciju proizvoda do oktobra 2005 (Council Directive 2004/24/EC) 7. Ovom direktivom zahteva se da se pri
registraciji tradicionalnih biljnih preparata zadovolje specifini standardi koji se odnose na kvalitet i sigurnost njihove
humane upotrebe. Preporuka ove direktive je da takvi registrovani preparati budu pogodni za upotrebu bez lekarskog recepta. Pored uobiajenih zahteva za registrovanje (GMP potvrda), novinu u odnosu na prethodnu direktivu predstavlja i
zahtev za dokazanom tradicionalnom upotrebom u periodu
od 30 godina za datu indikaciju, od kojih najmanje 15 mora
biti na teritoriji Evropske unije, kao i poseban izvetaj o bezbednosti upotrebe biljnog preparata za datu indikaciju. Sa
druge strane, od proizvoaa se zahteva da obezbede sistem
za praenje podataka o neeljenim dejstvima o kojima bi se
izvetaji dostavljali nacionalnim regulatornim institucijama.
Ovom direktivom ustanovljen je i sadanji Komitet za
biljne proizvode (Herbal Medicinal Product Committee
HMPC) sa osnovnom namerom da pripremi detaljno obraene monografije i listu biljnih supstancije i preparata koji su u
medicinskoj upotrebi dovoljno dugo vremena da se njihova
upotreba smatra bezbednom u normalnim uslovima korienja. Monografija sadri profesionalno miljenje Komiteta o
odreenom biljnom proizvodu na osnovu naunih podataka
ili tradicionalne upotrebe u okviru Evropske unije. Za svaku
biljnu supstanciju navedeni su indikacija, jaina, upotreba
kao i drugi relevantni podaci koji se tiu njene bezbedne
Volumen 66, Broj 1
upotrebe ili preparata koji je sadri. Lista kao i verzije monografija su na raspolaganju za javnu konsultaciju obino u
trajanju od 3 meseca na web stranici EMEA (European Medicinal Evaluation Agency) 5.
Iako se na nivou EU ine napori za usaglaavanje propisa koji se odnose na biljne preparate, u SAD situacija je sasvim drugaija. Kako biljni proizvodi u SAD ne spadaju u
kategoriju proizvoda koje regulie Uprava za hranu i lekove
(Food and Drug Adminitration FDA), to FDA nije odgovorna za donoenje odobrenja za njihovu upotrebu. Oni su
regulisani posebnim zakonskim aktom o dijetetskim dodacima ili suplementima Dietary Supplement Health and Education Act 8, 9. U praksi, pokazalo se da to nije odgovarajui
model za regulativu i da se javljaju brojni problemi (prisustvo biljnih supstancija opasnih po zdravlje, nedostatak upotrebe GMP, loa signatura proizvoda, neadekvatno izvetavanje o neeljenim efektima i dr). Kako bi se umanjili nedostatci postojeeg regulatornog reenja, FDA poela je da razvija posebne strategije za praenje i proveru biljnih proizvoda i njihovih sastojaka 1012.
Zakonska regulativa biljnih lekova kod nas
U naoj zemlji zakonski propisi za biljne proizvode u
saglasnosti su sa preporukama evropske Direktive
2001/83/EEC i dopunom Direktive 2004/24/EEC. Zakon o
lekovima i medicinskim sredstvima (Slubeni glasnik Republike Srbije br. 84/2004 i 85/2005) regulie biljne lekovite
proizvode.
Fitopreparati kao aktivni sastojak sadre usitnjene ili
spraene delove biljaka, balzame, smole, lekovita masna ulja,
etarska ulja ili ekstrakte biljaka. U ovu grupu spadaju ajevi i
ajne meavine, ali i moderni farmaceutski oblici (instant
praak, umee tablete, tablete za vakanje, obloene tablete,
kapsule, sirup, sprej i sl). Tradicionalni biljni lek sadri biljku, biljnu drogu (pojedinanu ili meavinu), preparate biljne
droge (pojedinane ili meavinu) za koje se na osnovu iskustva i dugotrajne primene zna da se bezbedno mogu koristiti
u svrhu terapije i prevencije. Tradicionalni biljni lekovi podleu odredbama evropske Direktive 2001/83/EEC i dopune
Direktive 2004/24/EEC, koje dozvoljavaju sadraj vitamina i
minerala, pri emu oni tada samo doprinose delovanju glavne biljne komponente i nisu posebno naznaeni u uputstvu.
Tradicionalnim biljnim lekom ne smatraju se lekovi koji sadre hemijski definisane, izolovane sastojke biljaka (npr.
mentol, kardiotonine glikozide, i dr). Ukoliko lekovite biljke ili njihovi delovi ulaze u sastav prehrambenih proizvoda
ili dijetetskih preparata, onda je re o biljnim suplementima.
Struno miljenje o klasifikaciji proizvoda izdaje Agencije
za lekove i medicinska sredtsva Srbije (ALIMS) ija je nadlenost utvrena lanom 6 Zakona o lekovima i medicinskim
sredstvima 13.
Postojei problemi u praksi
Kvalitet, bezbednost upotrebe i efikasnost biljnih preparata najvanija su pitanja koja se reguliu propisima. Uprkos
dobro postavljenom regulatornom mehanizmu za biljne preCupara SM i Jankovi SM. Vojnosanit Pregl 2009; 66(1): 5356.
Volumen 66, Broj 1
VOJNOSANITETSKI PREGLED
parate, u praksi se javljuju problemi. Najvei problem za
primenu zakonskih propisa u oblasti kvaliteta odnosi se na
biljne preparate koje upotrebljavaju indijska tradicionalna
kineska ili ajurvedska medicina, jer se kod njih najee sreu nepravilnosti kao to su namerna ili sluajna upotreba zabranjenih biljnih supstancija, kontaminacija toksinim ili
sintetskim supstancijama ili signatura koja ne odgovara upotrebljenim sastojcima. Svetska zdravstvena organizacija sprovela je ispitivanje kontrole i zakona koji se trenutno primenjuju na biljne preparate u 141 zemlji sveta 14. U odnosu na
ispitivanja iz prethodnih godina uoene su pozitivne promene, jer su postojei problemi u praksi motivisali vei broj
zemalja da u poslednje etiri godine uspostave nacionalne
strategije za regulisanje upotrebe biljnih preparata 15. U obliku vodia SZO je ponudila i tehniku podrku za razvoj metodologije za praenje efikasnosti, kvaliteta, pripreme, bezbedne upotrebe biljnih proizvoda, njihovog reklamiranja i razmene informacija. Nekoliko dokumentovanih problema koji
su se javili u proizvodnji i distribuciji biljnih preparata u
svetu jasno odslikavaju potrebu za preciznim i strogo sprovedenim zakonskim propisima:
zamena kineskog Illicum verum Hook. f. japanskim
Illicum anisaticum L. Suvi plodovi ne mogu se razlikovati
golim okom, pri emu je japanski varijetet slian kineskom,
ali pokazuje gastroenteroloku i neuroloku toksinost zbog
prisutnog anizatina. Godine 2001. nekoliko sluajeva trovanja zabeleeni su u Holandiji, Francuskoj i paniji, pri emu
su se kod beba koje su grekom pile infuz od japanskog anisa
javile konvulzije epileptinog tipa 16;
kardiotoksinost koja se javila pri upotrebi Aconitum
vrsta u lekovima tradicionalne kineske medicine 17. Koren
vrsta Aconitum u tradicionalnoj kineskoj medicini potapa se
u vodu ili kuva u vreloj vodi sa ciljem da alkaloidi akonitina
hidrolizuju u manje toksine akoninske derivate. Meutim,
ako ovi procesi nisu kontrolisani krajnji proizvod je toksian;
pojava sranih aritmija prouzrokovanih zamenom bokvice za Digitalis lanata. Utvreno je da su velike koliine
pogrenog biljnog materijala bile poslate u periodu od dve
godine na vie od 150 adresa proizvoaa, veletrgovina i distributera u SAD 18.
Vie puta primeeno je da pojedini biljni preparati u
svetu sadre nedozvoljene teke metale, druge toksine sup-
Strana 55
stancije ili sintetske lekove zbog ega se posebno motri na
ovaj problem oneienja biljnih preparata kineske i ajurvedske medicine 1922. Teki metali u biljnim proizvodima mogu
da potiu iz same biljke ili grekom dospevaju u proizvod
tokom njegove izrade. Meutim, nekada se teki metali dodaju namerno kao sastojci neophodni za izradu tradicionalnih
formulacija u kineskoj ili ajurvedskoj medicini. Tako npr.
Kineska farmakopeja sadri oficinalne monografije za arsenov disulfid, ivin hlorid (kalomel), ivin sulfid, crveni ivin
oksid, kao i formulacije mnogih proizvoda koji sadre jednu
ili vie ovakvih supstancija 23. U jednom od istraivanja u
SAD, koje je obuhvatilo 70 ajurvedskih proizvoda, 20% preparata sadravalo je tetne koncentracije olova, ive i arsena,
dok je u drugoj studiji iz 1998, takoe u SAD, dokumentovano da je 32% uvoznih azijskih proizvoda bilo oneieno
nedeklarisanim supstancijama (efedrin, hlorfenamin, metiltestosteron, fenacetin) ili tekim metalima (iva, olovo, arsen) 24, 25. Zabrinjavajua bila je pojava tetnih sintetskih
supstancija (fenfluramin, sibutramin, metilfenidat) u biljnim
proizvodima za mravljenje na bazi tradicionalne kineske
medicine. U cilju spreavanja slinih situacija u Velikoj
Britaniji, Medicines and Healthcare Products Regulatory
Agency (MHRA) otvorila je posebnu web stranicu, Herbal
Safety News, na kojoj se mogu nai upozorenja koja se tiu
upotrebe pojedinih biljnih lekova 26. Nadalje, za oekivati je
da e razvoj analitikih metoda za kontrolu kvaliteta biljnih
preparata omoguiti njihovu bezbedniju primenu u praksi 2729.
Zakljuak
Kvalitet i bezbednost upotrebe biljnih preparata ostaju i
dalje prioritet koji treba zakonski urediti na svetskom nivou.
Za registraciju biljnog preparata kao leka postoje isti zahtevi
kao i za registraciju drugih lekova u pogledu dokumentacije
koja treba da sadri predklinika i klinika ispitivanja. Ovakva ispitivanja vrlo su zahtevna, a kako sloenost molekulske grae, ak i jednokomponentnih biljnih preparata, ometa
utvrivanje jedinstvenih kriterijuma za jasno praenje njihovih terapijskih efekata, ispunjavanje zahteva za registrovanje
biljnih preparata kao lekova u praksi jo uvek je izazov i za
naunike i za proizvoae.
L I T E R A T U R A
1. Barnes J, Anderson LA, Phillipson JD. Herbal Medicines. 3rd ed.
London Pharmaceutical Press; 2007.
2. Evans WC. Trease and Evans Pharmacognosy. 15th ed. London, WB Saunders; 2001.
3. Steinhoff B. The contribuition of the European Scientific Cooperative on Phythotherapy and World Health Organization
monographs. Drug Inform J 1999; 33: 1722.
4. ESCOP Monographs, editors. The Scientific Foundation
for Herbal Medicinal Products. 2nd edition Exeter (UK)
2003.
5. EMEA Committee for Herbal Medicinal Products (HMPC).
Community Herbal Monographs. Available from:
www.emea.europa.eu/htms/human/hmpc/hmpcmonographs
dopt.htm, March 2007.
Cupara SM i Jankovi SM. Vojnosanit Pregl 2009; 66(1): 5356.
6. Council Directive 2001/83/EC. Official Journal of the European Communities 2001; 311: 67128.
7. Council Directive 2004/24/EC. Official Journal of the European Communities 2004; 136: 8590.
8. The Dietary Supplement Health and Education Act 1994, Pub
L No. 103417, Washington: 103 congress. Available from:
www.dietary-supplements.info.nila.gov/aspx
9. FDA Centre for Food Safety and Applied Nutrition. Dietary
supplements. Available from:
http://vm.cfsan.fda.gov/~dms/supplmnt.html
10. Marcus DM, Grollman AP. Botanical medicines the need for
new regulations. N Engl J Med 2002; 347(25): 20736.
11. Wechsler J. Standards for supplements. Pharmaceutical Technology Europe 2003; March: 1820. Available from:
Strana 56
12.
13.
14.
15.
16.
17.
18.
19.
20.
VOJNOSANITETSKI PREGLED
www.medicinescomplete.com/mc/herbals/current/10007273
88.html
Food and Drug Adminstration. FDA announces major initiatives for dietary supplements. 2004 November. Available from:
www.fda.gov/bbs/topics/nwes/2004/NEW01130.html
Djurovi D. Pharmaceutical legislation important base for the
product clasiffication. Arh farm 2007; 57: 17891. (Serbian)
Anon. National Policy on Traditional Medicine and Regulation
of Herbal Medicines: Report of a WHO global survey. Geneva: WHO, 2005. Available from:
www.correofarmaceutica.com/documents/190905_plantas.pdf
Anon. Legal Status of Traditional Medicine and Complementary/Alternative Medicine: A Worldwide review. Geneva:
WHO, 2001. Available from: www.whqlitdoc.who.int/
q/2001/WHO_EDM_TRM_2001.2.pdf
Biessels GJ, Vermeij FH, Leijten FS. Epileptic seizure after a cup
of tea: intoxication with Japanese star anise. Ned Tijdschr
Geneeskd 2002; 146: 80811. (Duch)
Tai YT, But PP, Joung K, Lan CP. Cardiotoxicity after accidental
herb induced aconite poisoning. Lancet 1992; 340(8830):
12546.
Slifman NR, Ohermeyer WR, Aloi BU, Masser SM, Correll WA Jr,
Cichowicz SM, et al. Contamination of botanical dietary supplements by Digitalis lanata. N Engl J Med 1998; 339(12): 80611.
Ernst E. Contamination of herbal medicines. Pharm J 2005;
275: 1678.
De Smet. Health risks of hearbal remedies: An update. Clin
Pharmacol Therapeutics 2004; 76 (1): 117.
Volumen 66, Broj 1
21. Ernst E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review. J Intern Med 2002; 252(2):
10713.
22. Ernst E. Heavy metals in traditional Indian remedies. Eur J
Clin Pharmacol 2002; 57(12): 8916.
23. Pharmakopoeia of the Peoples Republic of China (English
edition volume I/II/III). Bejing. Chemical Industry Press,
2005.
24. Saper RB, Vales SN, Paquin J, Burns MJ, Aisehberg DM, Davis
RB, et al. Heavy metal content of Ayurvedic herbal medicine
product JAMA 2004; 292: 286873.
25. Ko RJ. Adulterans in Asian plant medicines. N Engl J Med
1998; 339(12): 847.
26. Medicines and Healthcare products Regulatory Agency
(MHRA).
Herbal
Safety
News.
Available
from:
www.mhra.gov.uk
27. Lau A, Holmes MJ, Woo, SO koh HL. Analysis of adulterants in
a traditional herbal medicinal product using liquid chromatography mass spectrometry - mass spectrometry, J Pharm
Biomed Anal 2003; 31(2): 4016.
28. Liang YZ, Xie P, Chan K. Quality control of herbal medicines, J
Chromatogr Analyt Technol Biomed Life Sci 2004; 81(12):
5370.
29. Gong F. Information theory applied to chromatographic fingerprint of herbal medicine for quality control, J Chromatogr
A 2003; 1002(12): 2540.
Rad primljen 28. III 2008.
Cupara SM i Jankovi SM. Vojnosanit Pregl 2009; 66(1): 5356.
You might also like
- Vladeta Jerotić TekstoviDocument168 pagesVladeta Jerotić TekstoviWhisperer Bowen100% (4)
- AMERIKA Nikola StojanovicDocument8 pagesAMERIKA Nikola StojanovicWhisperer BowenNo ratings yet
- Deficit Pažnje I Hiperaktivnost Kod DeceDocument9 pagesDeficit Pažnje I Hiperaktivnost Kod DeceWhisperer BowenNo ratings yet
- Formule Iz PlanimetrijeDocument4 pagesFormule Iz PlanimetrijeMirjana PerićNo ratings yet
- Eksplozivna SnagaDocument4 pagesEksplozivna SnagaWhisperer BowenNo ratings yet
- 2casopis bk10Document162 pages2casopis bk10Whisperer BowenNo ratings yet
- Starokineska MedicinaDocument10 pagesStarokineska MedicinaWhisperer BowenNo ratings yet
- Sportska MedicinaDocument8 pagesSportska MedicinaWhisperer BowenNo ratings yet
- Analiza Antropološkog Prostora SportisteDocument10 pagesAnaliza Antropološkog Prostora SportisteWhisperer BowenNo ratings yet
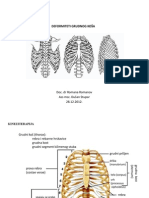
- 12 Deformiteti Grudnog KosaDocument13 pages12 Deformiteti Grudnog KosaWhisperer BowenNo ratings yet
- Hematoloski Status I TreniranostDocument8 pagesHematoloski Status I TreniranostWhisperer BowenNo ratings yet
- 1 Vezba KINEZITERAPIJADocument16 pages1 Vezba KINEZITERAPIJAWhisperer BowenNo ratings yet
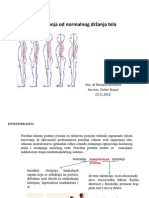
- 7 Odstupanje Od Normalnog Drzanja Tela LordozaDocument14 pages7 Odstupanje Od Normalnog Drzanja Tela LordozaWhisperer BowenNo ratings yet
- 8 Odstupanje Od Normalnog Drzanja Tela KifozaDocument13 pages8 Odstupanje Od Normalnog Drzanja Tela KifozaWhisperer BowenNo ratings yet
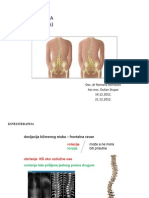
- 10 I 11 SkoliozaDocument28 pages10 I 11 SkoliozaWhisperer Bowen100% (1)
- Periferne PolineuropatijeDocument80 pagesPeriferne PolineuropatijeGoshev Blagojcho100% (2)