Professional Documents
Culture Documents
Physique
Physique
Uploaded by
Jabri Imene0 ratings0% found this document useful (0 votes)
6 views5 pagesOriginal Title
physique (6)
Copyright
© © All Rights Reserved
Available Formats
PDF or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
0 ratings0% found this document useful (0 votes)
6 views5 pagesPhysique
Physique
Uploaded by
Jabri ImeneCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
You are on page 1of 5
REPUBLIQUE TUNISIENNE ||
MINSTEREDE VEDUCATION | Section: Mathématiques
EXAMEN DUBACCALAUREAT =: Durée : 3h
Epreuve : Sciences Physiques
Coefficient : 4
SESSION 2017 ‘Session de contréle
Chimie : (7 points)
Exercice 1 : (3,5 points)
A 25°C, les ions ferriques Fe™ réagissent avec les ions thiocyanates SCN” pour donner les ions
thiocyanatofer(III) [Fe(SCN)]?". Cette réaction chimique est modélisée par l’équation :
Fe" + SCN" = [Fe(SCN)]*
‘A une température constante et a Vinstant de date t = 0 pris comme origine des temps, on mélange un
volume Vi = 20 mL d'une solution aqueuse de nitrate de fer(IIl) Fe(NOs)3 de concentration molaire
C= 0,30 mol.L™ avec un volume V2 = 40 mL d'une solution de thiocyanate de potassium KSCN de
concentration molaire C2 = 0,15 mol.L”. On obtient alors un systéme S de volume total V qu'on supposera
égal a Vi + V2.
Par une méthode appropriée, on détermine la quantité d’ions complexes m, ._.2,dans le systéme S a
Véquilibre chimique , on obtient(m,, 2, )iq = 4,410 mol .
1) a- Verifier que les quantités de matiére en ions Fe* et SCN’ dans le systéme S 4 Vinstant t= 0 ont la
méme valeur ng que l’on calculera.
b- Montrer que la constante d’équilibre K relative a ’équation de cette réaction est: K = vai ot
n,(1-t,)
‘trreprésente son taux d’avancement final. Calculer la valeur de K.
2) On répartit équitablement le systéme $ obtenu A l’équilibre dans deux fioles jaugées (Fy) et (F2) dont la
contenance de chacune est de 100 mL.
a- Dans la fiole (F;), on ajoute de l’eau distillée jusqu’au trait de jauge ; on obtient un systéme S).
Préciser, en le justifiant, le sens d’évolution du systéme S; avant d’atteindre |"équilibre chimique.
az-Déterminer la composition molaire de $; en ions Fe**, SCN* et [Fe(SCN)]** 4 Péquilibre
chimique.
b- Dans la fiole (F:), on ajoute une faible quantité de nitrate de fer(III), sans variation sensible de
‘volume du mélange réactionnel, on obtient alors un systéme S».
Préciser, en le justifiant, le sens d’évolution du systéme S> avant d’atteindre I'équilibre chimique.
Exercice 2 : (3, 5 points)
Toutes les solutions sont prises 4 25°C, température pour laquelle le produit ionique de I’eau est Ke = 10.
A Taide d'une solution aqueuse (Sq) d’acide chlorhydrique (H3O° + C£) de concentration molaire
Cy= 10" mol.L", on effectue séparément le dosage d’un volume V, = 20 mL d’une solution aqueuse (S;)
@hydroxyde de sodium NaOH (base forte) de concentr molaire Cy et d'un volume
V2 = 20 mL. d'une solution aqueuse (S2) d’ammoniac NH; (base faible) de concentration molaire C2.
Dans chacun de ces deux dosages, on suit & l'aide d’un pH-métre, I’évolution du pH du mélange
réactionnel en fonction du volume ajouté V4 de la solution acide (Sa).
Sur la figure 1 de la feuille annexe (page §/5), sont tracées les courbes traduisant la variation du pH en
fonction de Va. Les points E et E? représentent respectivement les points d’équivalence acido-basique de
(2) et(e).
1) En exploitant les courbes (€) et (@’) =
a-attribuer, en le justifiant, pour chaque courbe de dosage la base correspondante;
b- montrer que Cy = C2= 10" mol.L";
¢- préciser Je caractére (acide, basique, neutre) du mélange obtenu a l’équivalence pour chaque dosage ;
d- déterminer le pK, du couple acide/base relatif 4 l’ammoniac.
2)a- Ecrire I’équation de la réaction chimique correspondant & chaque dosage.
- Montrer que ces deux réactions sont totales.
us
3) A Taide d’une pipette, om préieve un volume Vy = 20 mL, de la solution ($3) d’ammoniac de
concentration molaite C= 107 mol.L." qu’on introduit dans un bécher et on lui ajoute un volume Voss
€’cau distillée. Ainsi, on prépare une solution ($’2) plus diluée que la solution ($3). On dose ta solution
(S'2) de volume total V2’, qu’on supposera égal a Vy + Veau, par la méme solution acide (Sq) que
précédemment. On constate que la valeur du pH I’équivalence augmente de 0,35 par rapport a celle
obtenue dans le dosage décrit a Ja question 1), Cependant, le volume de la solution acide ajouté &
équivalence Vag n’a pas changé.
a- Expliquer pourquoi Var n’a pas subi de changement.
b- Déterminer la valeur de Veu sachant que le pH du mélange réactionnel & Péquivalence pour le
dosage de la solution dammoniac est donné par la relation suivante : pH = Fox, logC), ott C est
la concentration molaire de lacide conjugué de 'ammoniac l’équivalence acido-basique et Ky la
constante d’acidité du couple qui lui est ass
Physique : (13 points)
Exercice 1 : (6,50 points)
A- On considére le circuit électrique de la figure 2, constitué par Passociation en
série d’un générateur (G) de tension, supposé idéal de force électromotrice
= 10 V, d'un conducteur chmique de résistance R réglable, dune bobine (B)
inductance L et de résistance r et d’un interrupteur (K).
Le sens positif de lintens
du circuit.
1) a- Montrer que l'équation différentielle régissant I"évolution de la tension
i du courant électrique est indiqué sur le schéma
sn) sn) at bomes di condvteur hier: Figere2
du (t RE
Be 4 Fact) = BE, ott =~ est laconstante de temps du circuit,
ato L Rir
b- En déduire expression de la tension Up aux bornes du conducteur ohmique en fonction de E, ret R
lorsque le régime permanent s‘établit dans le circuit.
u,(-e 4)
de Ug.
c- Vérifier que la solution de I’équation différentielle précédente est de la forme : uy (t)
En déduire que pour t= 7, la tension aux bornes du conducteur ohmique vaut 63 %
2) On effectue les deux expériences suivantes
~ experience (a): on réalise le circuit de la figure 2 et on ajuste la résistance R du conducteur chmique
lavaleur R, = 240.2 ;
- expérience (b) : on remplace dans le circuit de la figure 2, la bobine (B) par une autre bobine (B’)
d’inductance L? et de résistance r identique a celle de (B). On ajuste la résistance R ala valeur Ry,
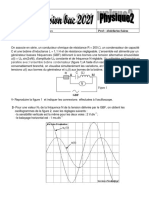
un (V)
Pour chacune de ces deux expériences, on ferme
Vinterrupteur (K) & instant t= 0 et on suit 4 Paide
d'un systme approprié d’acquisition de données, 9,6
Tévolution temporelle de la tension uyse(t) aux
bomes du conducteur ohmigue. 8
‘On obtient respectiverent les chronogrammes (é)
et (&) de la figure 3.
Ms)
\(%)
En exploitant les chronogrammes () et ():
a- préviser les valeurs Ug, et Uy de la tension aux
bomes du conducteur ohmique lorsque le
régime permanent s’établit dans le circuit
respectivement dans les expériences (a) et (b) ;
b- déduire les valeurs des constantes de temps T,
et tp du circuit respectivement dans les deux gt
5 16
expériences (a) et (b); Figure 3. (ms)
ws
¢- déterminer la valeur de la résistance r de la bobine (B) ct déduire la valeur de Li
- déterminer Ry et 1
B- Afin de retrouver les valeurs de L” et de r de (B’), on réalise le circuit de
la figure 4, comportant montés en série : la bobine (B’), un condensateur
(© de capacité C = 10 pF, un conducteur ohmique de résistance R
réglable, un interrupteur (K) et un ampéremétre (A) de résistance
négligeable. L’ensemble est alimenté par un générateur de basses
fréquences (GBF) délivrant une tension alternative sinusoidale
u(Q) = Uy 2sin(2aNt), de tension efficace U constante et de fréquence N
réglable. On branche deux voltmétres (V;) et (V2) respectivement aux
bores du conducteur ohmique ct aux bores du dipéle constitué par
Fensemble : { (BY); (C)}-
1) En ajustant ta fréquence du (GBF) a la fréquence Ny = 159 Hz et en réglant la résistance R a la valeur
Rj = 40 Q, Pintensité instantanse du courant qui circule dans le circuit est i(t) =1, V2sim(2aN,t+ ot
1, est lintensité efficace du courant électrique. Par ailleurs, les deux voltmétres (V)) et (V2) indiquent
respectivement les valeurs Uy = 2.00 V et Ur= 2,55 V.
a- Déterminer la valeur de lintensité Ih
b- Préciser, en le justifiant, le caractére du circuit (inductif, capacitif ou résisti
¢- La figure § de la feuille annexe (page 5/5 4 remplir par le candidat et a remettre avec sa copie),
représente la construction de FRESNEL inachevée associée au circuit étudié ala fréquence Ny
e1- Compléter la construction de FRESNEL a "échelle : 4 em correspondent & 1 V.
On associe les vecteurs:
ns
© OA Ala tension uus(t) = u(t) aux bores du conducteur ohinique
¢ AB Ala tension urn(t) aux bomes du dipole { (B’); (C)};
© OB la tension w(t) aux bornes du générateur,
¢- Déduire les valeurs de r, L’ et U.
ajustant la fréquence du (GBF) & une valeur No, le volumétre (V2) affiche une tension U,= 0,70 V et
lampéremétre (A) indique une intensité du courant I; = 70 mA.
‘a- Montrer que le circuit est en état de résonance d’intensité.
b- Déterminer alors Ny
Exereice 2: (4 points)
On donne : - ta constante de Planck h = 662.10 J.s ; la célérité de la lumigre dans le vide ¢ = 3.108 m.s™
TeV =1,6.10'4; 1nm= 10" m;
- les domaines du spectre des ondes électromagnétiques avec échelle non respecté
ww 400 730 1 10"
te
RY RX UV Visible Infrarouge Micro-onde Aenea
Les niveaux d’énergie de Iatome d’hydrogene sont donnés par l'expression : E,
et m un entier naturel non nul.
1) a Préciser le phénoméne physique (émission ov absorption) qui se produit lors de la transition de
Vatome d’hydrogene d'un niveau d’énergie Ey Aun niveau d’énergic Em, avec m
a deux raisons pour lesquelles les chercheurs ont privilégié l'utilisation des rayonnements alpha dans la
radiothérapie au lieu des rayonnements béta ;
b- les contraintes a éviter pour qu'un émetteur alpha soit efficace dans le traitement des tumeurs
cancéreuses.
2) Sachant que le nombre de charge du noyau de plomb est Z = 82, écrire I’équation de la transformation
nucléaire de formation du noyau de Bismuth en précisant les lois de conservation utilisées.
3) Identifier le noyau radioactif qui générc le rayonnement alpha.
Dégager & partir du texte la valeur de la période radioactive de ce radioélément.
Section: .........-.N®d’inscription:
Signatures des surveillants
Nom et Prénom :....
Date et lieu de naissance :
Feuille annexe a remplir par le candidat et a remettre avec la copie - Sciences Physiques (Section : Mathematiques)
Figures
vs
‘Axe origine des phases (y = 0)
You might also like
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5807)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1091)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (842)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (590)
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (897)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (537)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (346)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (821)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (122)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (401)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2259)
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (266)
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (74)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- Serie2 PhysiquesDocument5 pagesSerie2 PhysiquesJabri ImeneNo ratings yet
- Serie1 ChimeDocument3 pagesSerie1 ChimeJabri ImeneNo ratings yet
- Correction Ex1 Physession 2020 Bac MathDocument1 pageCorrection Ex1 Physession 2020 Bac MathJabri Imene0% (1)
- Correction Ex1 Chimie Session 2020 Bac MathDocument1 pageCorrection Ex1 Chimie Session 2020 Bac MathJabri ImeneNo ratings yet
- Physique CDocument5 pagesPhysique CJabri ImeneNo ratings yet
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImeneNo ratings yet
- ReddmittlDocument5 pagesReddmittlJabri ImeneNo ratings yet
- Equilibre ChimiqueDocument5 pagesEquilibre ChimiqueJabri ImeneNo ratings yet
- GesundheitDocument4 pagesGesundheitJabri ImeneNo ratings yet