Professional Documents
Culture Documents
HIDROLISIS GARAM (Bahan Ajar)
HIDROLISIS GARAM (Bahan Ajar)
Uploaded by
Ricky nelsonOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
HIDROLISIS GARAM (Bahan Ajar)
HIDROLISIS GARAM (Bahan Ajar)
Uploaded by
Ricky nelsonCopyright:
Available Formats
HIDROLISIS GARAM
KONSEP HIDROLISIS :
HIDRO = AIR Hidrolisis : Penguraian senyawa kimia
(garam) oleh air membentuk ion H+
HIDROLISIS
(asam) atau ion OH- (basa)
LISIS = PENGURAIAN
REAKSI PEMBENTUKAN GARAM :
ASAM + BASA → GARAM + AIR
Contoh : NH4OH + H2SO4 → (NH4)2SO4 + H2O
Basa Asam garam air
JENIS HIDROLISIS GARAM (yang terhidrolisis hanya pembentuk garam yang sifatnya
lemah) :
1. Hidrolisis Total (garam yang terbentuk berasal dari asam lemah dan basa lemah)
Contoh : ion NH 4+ (berasal dari NH4OH : basa lemah) → Kb
(NH4)2CO3
ion CO32- (berasal dari H2CO3 : asam lemah) → Ka
Reaksi Hidrolisis :
NH4+ + H2O ↔ NH4OH + H+ → menghasilkan ion H+ (asam)
CO32- + H2O ↔ H2CO3 + OH- → menghasilkan ion OH- (basa)
Garam yang mengalami HIDROLISIS TOTAL akan menghasilkan ion H+ (asam) dan ion OH-
(basa) dalam larutan
Garam yang mengalami HIDROLISIS TOTAL akan bersifat :
ASAM : jika Ka > Kb
BASA : jika Kb > Kb
MENGHITUNG pH HIDROLISIS TOTAL
[H+] = konsentrasi ion H+
[H+] = √
𝑲𝒘 𝒙 𝑲𝒂 Kw = tetapan disosiasi air (10-14)
𝑲𝒃
Ka = tetapan disosiasi asam
Kb = tetapan disosiasi basa
Contoh soal : seorang siswa hendak menghitung pH 100 ml larutan garam CH3COONH4 0,1 M, jika
diketahui Kw = 10-14, Ka CH3COOH = 10-5, Kb NH4OH = 2,5 x 10-6, maka berapakah perkiraan pH
larutan garam tersebut?
Jawab :
[H+] = √ =√ =√ =2x M
pH = 5 – log 2 (pH < 7 bersifat asam)
2. Hidrolisis Parsial (garam yang terbentuk dari asam lemah dan basa kuat ATAU dari asam kuat
dan basa lemah)
Hidrolisis Asam (garam yang terbentuk dari asam kuat dan basa lemah)
Contoh : ion NH4+ (berasal dari NH4OH : basa lemah) → Kb
NH4Cl
ion Cl- (berasal dari HCl : asam kuat)
Reaksi Hidrolisis :
NH4+ + H2O ↔ NH4OH + H+ → menghasilkan ion H+ (asam)
Cl- + H2O tidak terhidrolisis
Larutan garam yang mengalami HIDROLISIS ASAM adalah larutan garam yang terbentuk
dari ASAM KUAT dan BASA LEMAH serta menghasilkan ion H+ dalam air
MENGHITUNG pH HIDROLISIS ASAM
[H+] = konsentrasi ion H+
𝑲𝒘
[H+] = √ 𝑲𝒃 𝒙 𝑴𝒌𝒐𝒏𝒋𝒖𝒈𝒂𝒔𝒊 Kw = tetapan disosiasi air (10-14)
Kb = tetapan disosiasi basa
Mkonjugasi = konsentrasi asam konjugasi
Contoh soal :
Dalam suatu praktikum dengan materi hidrolisis, seorang siswa diminta untuk menghitung pH
100 ml Larutan garam (NH4)2SO4 0,1 M baik secara perhitungan maupun menggunakan alat pH
meter. Jika Kw = 10-14 dan Kb NH4OH = 2 x 10-5, maka perkiraan perhitungan pH larutan
tersebut adalah …
Jawab : [H+] = √ =√
= 10-5
pH = 5
Hidrolisis Basa (garam yang terbentuk dari asam lemah dan basa kuat)
Contoh : ion CH3COO- (barasal dari CH3COOH : asam lemah) → Ka
CH3COONa
ion Na+ (berasal dari NaOH : basa kuat)
REAKSI HIDROLISIS :
CH3COO- + H2O ↔ CH3COOH + OH- → menghasilkan ion OH- (basa)
Na+ + H2O
Larutan garam yang mengalami HIDROLISIS BASA adalah larutan garam yang terbentuk dari
asam lemah dan basa kuat serta menghasilkan ion OH- di dalam air
MENGHITUNG pH HIDROLISIS BASA
[H+] = konsentrasi ion H+
𝑲𝒘
[OH-] = √ 𝑲𝒂 𝒙 𝑴𝒌𝒐𝒏𝒋𝒖𝒈𝒂𝒔𝒊 Kw = tetapan disosiasi air (10-14)
Kb = tetapan disosiasi basa
Mkonjugasi = konsentrasi basa konjugasi
Contoh soal :
Dalam suatu praktikum dengan materi hidrolisis, seorang siswa diminta untuk menghitung pH
100 ml Larutan garam Na2CO3 0,4 M baik secara perhitungan maupun menggunakan alat pH
meter. Jika Kw = 10-14 dan Ka H2CO3 = 10-5, maka perkiraan perhitungan pH larutan tersebut
adalah …
Jawab : [OH-] = √ =√
= 2 x 10-5
pOH = 5 – log 2 pH = 9 + log 2
Contoh soal reaksi :
pH yang terjadi jika 200 ml larutan Ca(OH)2 0,1 M direaksikan dengan 200 ml larutan CH3COOH
0,2 M (Ka = 10-5) adalah …
Jawab :
Reaksi : Ca(OH)2 + 2 CH3COOH → (CH3COO)2Ca + 2 H2O
m : 20 mmol 40 mmol - -
r : 20 mmol 40 mmol 20 mmol 40 mmol
s : - - 20 mmol
Mkonjugasi = x valensi
= x 2 = 0,1 M
[OH-] = √ =√
= 10-5 M
pOH = 5 pH = 9
3. Tidak Terhidrolisis (garam yang terbentuk dari asam kuat dan basa kuat)
Contoh : ion Na+ (berasal dari NaOH : basa kuat)
NaCl
ion Cl- (berasal dari HCl : asam kuat)
TIDAK ADA REAKSI HIDROLISIS-nya
Created By
Ricky Nelson, S.Si
You might also like
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5819)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1093)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (845)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (590)
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (897)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (540)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (348)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (822)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (122)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (401)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2259)
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (266)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (74)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- 7.SP - .C.5 Solve Word Problems Involving Probability - IIDocument3 pages7.SP - .C.5 Solve Word Problems Involving Probability - IIRicky nelsonNo ratings yet
- Chapel WarningDocument16 pagesChapel WarningRicky nelsonNo ratings yet
- Rekomendasi Kegiatan HCLDocument1 pageRekomendasi Kegiatan HCLRicky nelsonNo ratings yet
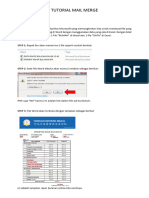
- Tutorial Mail MergeDocument4 pagesTutorial Mail MergeRicky nelsonNo ratings yet
- Worksheet Math Grade 7 Using Probability 0Document2 pagesWorksheet Math Grade 7 Using Probability 0Ricky nelsonNo ratings yet
- 7.SP .B.4 7th Grade Compare The Means of Two Population Worksheets PDF Set 1Document4 pages7.SP .B.4 7th Grade Compare The Means of Two Population Worksheets PDF Set 1Ricky nelsonNo ratings yet
- Titrasi Asam BasaDocument3 pagesTitrasi Asam BasaRicky nelsonNo ratings yet
- 7.SP .B.3 7th Grade Sample Data To Draw Informal Inferences Worksheets PDF 1Document4 pages7.SP .B.3 7th Grade Sample Data To Draw Informal Inferences Worksheets PDF 1Ricky nelsonNo ratings yet
- LEMBAR LAPORAN KoligatifDocument3 pagesLEMBAR LAPORAN KoligatifRicky nelsonNo ratings yet
- RPP 5 - Reaksi Reduksi Dan Oksidasi Serta Tata Nama SenyawaDocument7 pagesRPP 5 - Reaksi Reduksi Dan Oksidasi Serta Tata Nama SenyawaRicky nelsonNo ratings yet
- Soal Latihan Listrik StatisDocument4 pagesSoal Latihan Listrik StatisRicky nelsonNo ratings yet
- RPP 4 - Larutan Elektrolit Dan Larutan NonelektrolitDocument6 pagesRPP 4 - Larutan Elektrolit Dan Larutan NonelektrolitRicky nelsonNo ratings yet
- Silabus Kimia Xi 2021Document16 pagesSilabus Kimia Xi 2021Ricky nelsonNo ratings yet
- Remed Ikatan KimiaDocument3 pagesRemed Ikatan KimiaRicky nelsonNo ratings yet
- RPP 3 - Ikatan Kimia, Bentuk Molekul, Dan Interaksi AntarmolekulDocument12 pagesRPP 3 - Ikatan Kimia, Bentuk Molekul, Dan Interaksi AntarmolekulRicky nelsonNo ratings yet
- Mid X GanjilDocument5 pagesMid X GanjilRicky nelsonNo ratings yet
- RPP 6 - Hukum-Hukum Dasar Kimia Dan StoikiometriDocument13 pagesRPP 6 - Hukum-Hukum Dasar Kimia Dan StoikiometriRicky nelsonNo ratings yet
- Program SemesterDocument2 pagesProgram SemesterRicky nelsonNo ratings yet
- Silabus Kimia X 2021Document14 pagesSilabus Kimia X 2021Ricky nelsonNo ratings yet
- Pemetaan Kompetensi Dan Teknik PenilaianDocument5 pagesPemetaan Kompetensi Dan Teknik PenilaianRicky nelsonNo ratings yet
- Mid Ganjil XIIDocument3 pagesMid Ganjil XIIRicky nelsonNo ratings yet
- Latihan Konsep MolDocument1 pageLatihan Konsep MolRicky nelson100% (1)
- Lembar Laporan (Titrasi)Document2 pagesLembar Laporan (Titrasi)Ricky nelsonNo ratings yet
- Teacher Evaluation: ContactsDocument3 pagesTeacher Evaluation: ContactsRicky nelsonNo ratings yet
- Soal Ulangan KoligatifDocument1 pageSoal Ulangan KoligatifRicky nelsonNo ratings yet
- LKPD 1Document7 pagesLKPD 1Ricky nelsonNo ratings yet
- Ikatan KimiaDocument8 pagesIkatan KimiaRicky nelsonNo ratings yet