Professional Documents
Culture Documents
Exercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se Aquece
Uploaded by
Athos PlaineOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Exercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se Aquece
Uploaded by
Athos PlaineCopyright:
Available Formats
Exercício 1: Calcule o consumo de energia em um forno elétrico em kWh/t quando se aquece
ferro puro até uma temperatura de T supondo que as perdas sejam de X calor cedido ao forno.
O ferro é carregado no forno a 25 °C (298 K).
Dados:
T (ºC): 1678
X (%): 23
Entalpia do Fe líquido a 1900 K (kcal/mol): 18.433
Entalpia do Fe líquido a 2000 K (kcal/mol): 19.533
Massa molar do Fe (g/mol de Fe): 55.85
1 kWh = 860 kcal
Temos aqui um exercício de balanço térmico.
Que pode ser entendido como:
Calor ganho pelo sistema (CGS) = calor ganho pelo exterior (CGE).
Dentro do CGS temos: calor contido dos reagentes (CR); calor das reações exotérmicas (CREx);
e calor cedido por energia elétrica, transmissão, queima de combustível (CE).
Dentro do CGE temos: calor contido dos produtos (CP); calor das reações endotérmicas (CREn);
e calor das perdas (P).
Para calcularmos a energia elétrica precisamos obter o calor (sigla):
{1:SHORTANSWER:=CE#Resposta correta! Essa foi tranquila.~CR#Resposta errada, tente
novamente! Nesse caso CR corresponde ao calor contido dos reagentes.~CREx#Resposta
errada, tente novamente! Nesse caso CREx corresponde ao calor contido das reações
exotérmicas.~CP#Resposta errada, tente novamente! Nesse caso CP corresponde ao calor
contido dos produtos.~CREn#Resposta errada, tente novamente! Nesse caso CREn
corresponde ao calor contido das reações endotérmicas.~P#Resposta errada, tente
novamente! Nesse caso P corresponde ao calor das perdas.~CGS#Resposta errada, tente
novamente! Nesse caso CGS corresponde ao calor ganho pelo sistema.~CGE#Resposta errada,
tente novamente! Nesse caso CGE corresponde ao calor ganho pelo exterior.}
Esse calor pode ser dado pela seguinte relação com os outros calores: {1:MULTICHOICE_V:CP +
CREn - P - CREx - CR#Resposta errada, tente novamente!~CE - CREn + P - CREx + CR#Resposta
errada, tente novamente!~=CP + CREn + P - CREx - CR#Correto!~ CE + CREn + P + CREx -
CR#Resposta errada, tente novamente!~ CP - CREn - P + CREx - CR#Resposta errada, tente
novamente!}
Vamos então, então calcular cada tipo de calor.
Calor contido nos reagentes corresponde ao calor contido (kcal/ton de Fe) no Fe a 298 K e é
igual a: {1:NUMERICAL:=0#O calor é nulo uma vez que trata-se de uma substância puro em seu
estado padrão}
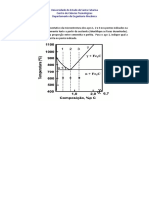
Calor contido nos produtos corresponde ao calor contido no Fe na temperatura T em K .
T(K) = {1:NUMERICAL:=1951#Perfeito, é só somar 273}
Fazendo a interpolação para temperatura T obtemos que o calor dos produtos é igual a
(kcal/mol de Fe): {3:NUMERICAL:=18.994:0.5#Correto!}
Passando para cal/g de Fe temos: {3:NUMERICAL:=340.089525514772:0.5#Correto!}
Passando para kcal/ton de F, obtemos: {1:NUMERICAL:=340089.525514772:0.5#Correto!}
Essa corresponde a quantidade de energia que devemos fornecer para fundir o Fe puro a
temperatura T.
Calor contido nas reações exotérmicas é igual a (kcal/ton de Fe): {1:NUMERICAL:=0#O calor é
nulo uma vez que não temos reações exotérmicas ocorrendo}
Calor contido nas reações endotérmicas é igual a (kcal/ton de Fe): {1:NUMERICAL:=0#O calor é
nulo uma vez que não temos reações endotérmicas ocorrendo}
O calor contido nas perdas deve ser levado em consideração e é igual a (kcal/ton de Fe):
{3:NUMERICAL:=101585.182945971:0.5#Correto!}
Uma vez que calculamos os 5 calores, podemos obter o calor CE, o qual é dado em função dos
anteriomente calculados.
CE (kcal/ton de Fe): {3:NUMERICAL:=441674.708460742:0.5#Correto!}
Convertendo para kWh/ton de Fe temos: {3:NUMERICAL:=513.575242396212:0.5#Correto!}
Dessa forma, quanto de energia elétrica seria necessário para fundir Z toneladas de Fe.
Onde Z = 27
CE (kWh) para tal processo é igual a: {3:NUMERICAL:=13866.5315446977:0.5#Correto!}
You might also like
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5794)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1090)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (838)
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (895)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (588)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (537)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (344)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- Solution Manual For ChenDocument51 pagesSolution Manual For Chenbuxtehude0482% (56)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (821)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (119)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (399)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2219)
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (266)
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (73)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- Sistemas de Ar-Condicionado de AeronavesDocument58 pagesSistemas de Ar-Condicionado de AeronavesAthos Plaine100% (1)
- Exercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se AqueceDocument2 pagesExercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se AqueceAthos PlaineNo ratings yet
- Lista de Exercício Aula 4Document3 pagesLista de Exercício Aula 4Athos PlaineNo ratings yet
- Lista 3Document1 pageLista 3Athos PlaineNo ratings yet
- Exercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se AqueceDocument2 pagesExercício 1: Calcule O Consumo de Energia em Um Forno Elétrico em KWH/T Quando Se AqueceAthos PlaineNo ratings yet
- Lista de Exercício Aula 3Document2 pagesLista de Exercício Aula 3Athos PlaineNo ratings yet
- Questões PDFDocument1 pageQuestões PDFAthos PlaineNo ratings yet
- Aço VC-131Document2 pagesAço VC-131Caio2101No ratings yet
- Questão 3Document1 pageQuestão 3Athos PlaineNo ratings yet
- Assignment 5 Solutions PDFDocument6 pagesAssignment 5 Solutions PDFMuhammad IdrisNo ratings yet
- Aços VH13ISO para trabalho a quenteDocument2 pagesAços VH13ISO para trabalho a quenterenatoeliegeNo ratings yet
- VW9 PTDocument2 pagesVW9 PTAthos PlaineNo ratings yet
- Lista 4Document1 pageLista 4Athos PlaineNo ratings yet
- Villares Metals completa linha de aços para ferramentasDocument9 pagesVillares Metals completa linha de aços para ferramentasLidiane SilvaNo ratings yet
- Microstructure From Processing: Evaluation and Modelling Grain Size Control: Lecture 3Document52 pagesMicrostructure From Processing: Evaluation and Modelling Grain Size Control: Lecture 3Athos PlaineNo ratings yet
- Sites InteressantesDocument1 pageSites InteressantesAthos PlaineNo ratings yet
- Microstructure From Processing: Evaluation and Modelling Grain Size Control: Lecture 3Document52 pagesMicrostructure From Processing: Evaluation and Modelling Grain Size Control: Lecture 3Athos PlaineNo ratings yet
- FisicaEstadoSolido v4Document28 pagesFisicaEstadoSolido v4Athos PlaineNo ratings yet
- Lista 1e2 2017Document3 pagesLista 1e2 2017Athos PlaineNo ratings yet
- Escolha o Certo e Honre a DeusDocument55 pagesEscolha o Certo e Honre a DeusAthos PlaineNo ratings yet
- Física do Estado Sólido: Teoria de Bandas e Excitações ElementaresDocument452 pagesFísica do Estado Sólido: Teoria de Bandas e Excitações ElementaresSantos DouradoNo ratings yet
- BoloDocument1 pageBoloAthos PlaineNo ratings yet
- Concurso - UFRPEDocument6 pagesConcurso - UFRPEAthos PlaineNo ratings yet
- Encyclopedia Article 2001 PDFDocument4 pagesEncyclopedia Article 2001 PDFAthos PlaineNo ratings yet
- Introdução à Difração de Raios-X em CristaisDocument20 pagesIntrodução à Difração de Raios-X em CristaisDébora MeireNo ratings yet
- Concurso - UFRPE PDFDocument1 pageConcurso - UFRPE PDFAthos PlaineNo ratings yet
- ListaDocument1 pageListaAthos PlaineNo ratings yet
- 1 Introduopneumtica 120222173238 Phpapp01Document21 pages1 Introduopneumtica 120222173238 Phpapp01RicardoNo ratings yet