Professional Documents
Culture Documents
(H) Ka (Acid)
(H) Ka (Acid)
Uploaded by
Elsayed ElazazyOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
(H) Ka (Acid)
(H) Ka (Acid)
Uploaded by
Elsayed ElazazyCopyright:
Available Formats
خطوات حل اسئلة لفصل الثالث /االتزان االيوني لالستاذ فارس مجيد السهيل
1
اوال -:تحدٌد كم مادة موجودة بالسؤال
مالحظات -:
ثانٌا -:معرفة طبٌعة المادة ( حامض ضعٌف و قوي
-1كل مادة تنتهً بمقطع
( ٌك ) فهً حامض ( قاعدة ضعٌفة او قوٌة
ماعدا الفٌنول و
النتروز ) ملح قاعدي او حامضً )
-2كل مادة تنتهً بمقطع
ثالثا -:معرفة طبٌعة المحلول الناتج ( فً حالة وجود اكثر من مادة )
( ٌن ) فهً قاعدة
ضعٌفة ما عدا االمونٌا رابعا -:استخدام القانون المناسب .حسب المعطى بالسؤال .
-3كل مادة ٌوجد لها ثابت
تفكك , Ka , Kb
درجة تاٌن % ,للتاٌن
السؤال يتكون من مادة واحدة -:
فهً مادة ضعٌفة .
أ – حامض ضعيف الٌجاد اي مطلوب ٌخص الحامض الضعٌف نستخدم
– 4كل مادة تبدء بـ
هٌدروكسٌد هً قاعدة قوٌة
[ H ]2 ][H
Ka =
او = درجة لتاين
] [acid
] [ acid
الٌجاد اي مطلوب نستخدم ب – قاعدة ضعيفة
[O H ]2 ] [O H
Kb = = درجة التاين
] [base
] [ base
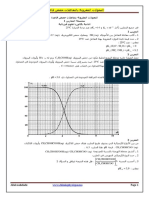
مثال -:لتر من محلول االمونٌا له ٌ PHساوي ( ) 11ودرجة تاٌنه . 0.02جد موالت المحلول .
] [O H الحل /مواد السؤل /مادة واحدة بالسؤال
= درجة التاين طبٌعة المادة /قاعدة ضعٌفة
] [base
] 0.02 = [0H] / [base المعطى بالسؤال /درجة التاٌن
PH = 11
POH = 14 – 11 = 3 [OH] = 10-POH [OH] =10-3
2
] 0.02 = 10-3 / [ base نعوض فً قانون درجة التاٌن
[ base ] = 0.05 M
نحول التركٌز الى موالت
n=MxV n = 0.05 x 1 = 0.05 mol
مثال /اذٌب 0.27 gمن الهٌدروسٌانٌك فً 100 mlمن الماء .احسب الدالة الحامضٌة للمحلول اذا علمت
ان Ka = 1x 10-5
HCN H + CN الحل /مادة واحدة
0.1 0 0 حامض ضعٌف
0.1 X X المعطى بالسؤال Ka
m=MxVxM 0.27 = M x 0.1 x 27 نحول الغرامات الى تركٌز موالري
m = 0.1 M
[ H ]2
Ka = 1 x 10-5 = [H]2 / 0.1 [H]2 = 10-6
] [ acid [H] = 10-3 ]PH = -log [H PH = - log 10-3
PH = 3
ج – حامض قوي -:نستخدم المخطط االتً
غالبا اما ٌعطً التركٌز و ٌطلب الـ PHاو العكس
التركٌز ( اذا اعطى التركٌز ٌحول الى Hثم ٌحول الى PH ][H PH
واذا اعطى الـ ٌ PHحول الى Hثم الى تركٌز )
] x [ acidعدد ذرات[ H ] = H حٌث
3
غالبا اي مادة تركيزها اكبر او د – قاعدة قوية -:نستخدم المخطط االتً
يساوي 1 Mنطبق لها قانون
التخفيف
M1 x V1 = M2 x V2 التركٌز ] [ OH PH
] x [ baseعدد ذرات [ OH ] = OH حٌث
مثال /ما عدد موالت هٌدروكسٌد الصودٌوم الواجب اضافتها الى نصف لتر من الماء لٌصبح
ٌ PHساوي ( . )13
الحل /مادة واحدة بالسؤال /قاعدة قوٌة
NaOH Na + OH نكتب معادلة التفكك للقاعدة
Y 0 0
0 Y Y
المعطى ٌ PHحول الى OHثم الى تركٌز
PH = 13 POH = 14 – 13 = 1 [ OH] = 10-POH [OH] 10-1
] [OH] = 1 x [ base ] 10-1 = 1 x [ base [ base] = 10-1
نحول الموالري الى مول
n=MxV n = 10-1 x 0.5 = 0.05 mol
مثال /احسب الدالة القاعدٌة لمحلول الكبرٌتٌك تركٌزه 0.01 M
H2SO4 2H + SO4 الحل /مادة واحدة /حامض قوي
0.01 0 0
0 2x 0.01 0.01
[ H ] = 0.02 = 10-2 ]PH = -log [H PH = -log 10-2
PH = 2 POH = 14 – PH POH = 14 – 2 = 12
4 هـ -ملـــــــــح
اغلب االمالح اسمها يجب تميز الملح اوال
ٌتكون من كلمتٌن
الملح الحامضً الملح القاعدي
الكلمة االولى تنتهً بـ
-1ال ٌحتوي العناصر السابقة ٌ – 1حتوي احد العناصر
( ٌد ,ات ٌ ,ت)
والكلمة الثانٌة تنتهً Na , K , Ba , Ca
بمقطع ( ٌوم ) مثل
PH - 2اصغر من 7 PHاكبر من 7 -2
خالت البوتاسٌوم
نترٌت البارٌوم ٌ – 3عطً بالسؤال Kb ٌ – 3عطً بالسؤال Ka
كلورٌد البرٌدٌنٌوم او ثابت تفكك االٌون الموجب او ثابت تفكك االٌون السالب
وهنا نستخدم قوانٌن الجذر ( اذا كان الموجود Kaاو ) Kb
او قوانٌن الـ ( PHاذا الموجود PKaاو ) PKb
Kw x c Kw x Ka
= ][H = ][H
Kb C
) PH = 1/2 ( PKw – PKb – Log C ) PH = 1/2 ( PKw + PKa + Log C
تمرٌن / 10احسب تركٌز اٌون الهٌدروكسٌد لمحلول سٌانٌد البوتاسٌوم ( )Ka = 4.9 x 10-10علما ان
تركٌزه ٌساوي . 0.1 M
الحل /مادة واحدة
اسم المادة ٌتكون من كلمتٌن تنتهً االولى ب ( ٌد ) و الثانٌة ب ( ٌوم )
اذا المادة ملح /بما ان االسم ٌحتوي البوتاسٌوم او Kaبالسؤال
اذا الملح قاعدي
نختار قانون الجذر الن المعطى Kaولٌس PKa
5
Kw x Ka
[ H ] = 10-14 x 4.9 x 10-10 / 0.1
= ][H
C
[ H ] = 49 x 10-24
[ H ] = 7 x 10-12 M
[ OH ] x [ H ] = 1x 10-14 [ OH ] = 1x10-14 / 7x10-12
[ OH ] = 0.14 M
مالحظة -:لتحوٌل الكتلة ( الغرامات ) الى تركٌز موالري او العكس نستخدم القانون
m = M x V (L) x M
اذا اعطى الغرامات ٌطبق القانون فً اول خطوة بالسؤال
اذا طلب الغرامات ٌطبق القانون فً اخر خطوة من السؤال
و االن لنحاول معا حل بعض االسئلة -:
س / 1ما عدد موالت البرٌدٌن الواجب اضافتها الى نصف لتر من الماء لٌصبح ٌ PHساوي ( ) 10
علما ان ثابت تفكك البرٌدٌن ٌساوي 2 x 10-5
الحل /مادة واحدة – تنتهً بمقطع ( ٌن )
قاعدة ضعٌفة
المعطى بالسؤال ثابت التفكك Kb
] Kb = [ OH ]2 / [ base PH = 10 POH = 14 – 10 =4
[ OH ] = 10-POH [ OH ] =10-4 M
] 2x10-5 = (10-4)2 / [ base [ base ] = 0.0005M
n=MxV n = 0.0005 x 0.5 = 0.00025 mol
6
س / 2لتر من محلول خالت الصودٌوم فٌه ) M = 72 g /mol ( [ OH ] = 10-5 Mو ثابت تفكك
االلكترولٌت الضعٌف المشتق منه الملح = . 10-5جد غرامات الملح .
الحل /مادة واحدة – اسم المادة من كلمتٌن
ٌوم و ات
المادة ملح /تحتوي الصودٌوم /ملح قاعدي
اذا قانون الجذر بالسؤال Kb
[ H ] = Kw x Ka / C
[ OH ] x [H] = 10-14
[ H ] = 10-9
10-9 = 10-14 x 10-5 / C
10-18 = 10-19 / C
C = 0.1 M
m=MxVxM
m = 0.1 x 1 x 72 = 7.2 g
س / 3سؤال 25 – 3
كم هً كتلة هٌدروكسٌد البوتاسٌوم ( ) M = 56 g/molالالزم اضافتها الى 200 mlمن الماء
لتصبح ٌ PHساوي ( ) 11للمحلول الناتج .
الحل /مادة واحدة /تبدء بـ هٌدروكسٌد
قاعدة قوٌة
KOH K + OH نكتب معادلة تاٌنها
Y 0 0 نحول PHالى OHثم نحول الى تركٌز
0 Y Y PH = 11 POH = 14 -11
POH = 3 [OH] = 10-POH [OH]=10-3
][ OH ] = 1 x [base [ base ] = 10-3M
7
m=MxVxM m = 10-3 x 200/100 x 56 نحول التركٌز الى كتلة
m = 0.0112 g
س / 4احسب التغٌر فً PHللماء بعد اضافة 1 mlمن 1 Mمن HClالى لتر منه .
الحل /مادة واحدة HCl
الماء ال ٌعتبر مادة من حامض قوي
المواد عند حساب عدد
مواد السؤال PH1 = 7 اذا بما ان االضافة للماء
ولحساب التغٌر فً PHعلٌنا حساب PH2
بعد اضافة الحامض اصبح المحلول الناتج هو حامض HClالمخفف
الحظ تركٌز 1 Mو علٌه نطبق قانون التخفٌف
M1 x V1 = M2 x V2 1 x 10 = M2 x 1000 M2 = 0.01 M
HCl H + Cl
0.01 0 0 ] [ H ] = 1 x [ acid
0 0.01 0.01 [H]= 1 x 0.01
[ H ] = 10-2 ]PH = -log[H
PH = -log 10-2 PH = 2
عند االضافة الى
الماء PH1 = 7 وهو PH2
PH = PH2 – PH1 PH = 2 – 7 = -5
الحظ -:تكون اشارة PHسالبة عند اضافة مادة حامضٌة .
You might also like
- وزاريات الفصل الثالث PDFDocument60 pagesوزاريات الفصل الثالث PDFAli N. MohammedNo ratings yet
- (H) Ka (Acid)Document28 pages(H) Ka (Acid)Elsayed ElazazyNo ratings yet
- PH PK PDFDocument12 pagesPH PK PDFFatïma ZohraNo ratings yet
- الأس الهيدروجينيDocument9 pagesالأس الهيدروجينيSamr Ali100% (1)
- Wa0032.Document41 pagesWa0032.نعمة حسنNo ratings yet
- Dzexams Docs 3as 904821Document2 pagesDzexams Docs 3as 904821ặděɱ ɱěžĥŏud-أدمہ مہزهودNo ratings yet
- Dzexams Docs 3as 904821Document3 pagesDzexams Docs 3as 904821wwaassiim2006No ratings yet
- مسائل الاتزان الكيميائيDocument9 pagesمسائل الاتزان الكيميائيMO HANo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2jackNo ratings yet
- امتحان ف3Document2 pagesامتحان ف3mneeb ahmeedNo ratings yet
- G12A Sem2 Unit5 الدرس الثالثDocument22 pagesG12A Sem2 Unit5 الدرس الثالثmr MeetNo ratings yet
- 3as Phys Be 2017 2Document8 pages3as Phys Be 2017 2Mohamed taha EL M'HAMDINo ratings yet
- قواعد حساب،PhDocument14 pagesقواعد حساب،Phhashem AliNo ratings yet
- واجب الحيوي 2Document1 pageواجب الحيوي 2Nawaf 5466No ratings yet
- DAHEL MT - Lycée Benalioui Salah SETIFDocument7 pagesDAHEL MT - Lycée Benalioui Salah SETIFSarl IBN ROCHDNo ratings yet
- التفاعل بين المحاليل الحمضية الحمضية و المحاليل الأساسيةDocument9 pagesالتفاعل بين المحاليل الحمضية الحمضية و المحاليل الأساسيةChahine OffNo ratings yet
- 3-3 Transformation Chimiques S'effectuant Dans Les Deux SensDocument2 pages3-3 Transformation Chimiques S'effectuant Dans Les Deux SensHaroun SamihNo ratings yet
- Ex Regul AsservDocument4 pagesEx Regul AsservZahk LbatlNo ratings yet
- Na OH H CL: HO HCO CO HODocument7 pagesNa OH H CL: HO HCO CO HOTaiba100% (1)
- سلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيDocument10 pagesسلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيTarakk KaziNo ratings yet
- تطور جملة كيميائية نحو حالة التوازنDocument3 pagesتطور جملة كيميائية نحو حالة التوازنsahraouilahsen6No ratings yet
- لقطة شاشة 2023-02-16 في 1.37.26 صDocument14 pagesلقطة شاشة 2023-02-16 في 1.37.26 صmizare29gNo ratings yet
- ملخصات العلوم الفيزيائية 2 ثانويDocument6 pagesملخصات العلوم الفيزيائية 2 ثانويAs benNo ratings yet
- Physics2as-Resume Chimie BensaidDocument6 pagesPhysics2as-Resume Chimie BensaidMohamed BensoulaNo ratings yet
- ملخص دروس الكمياء 2 ثانوي إعدد الأستاذ نصر الله بن سعيد PDFDocument6 pagesملخص دروس الكمياء 2 ثانوي إعدد الأستاذ نصر الله بن سعيد PDFHalimi Abdellah Takieddine100% (1)
- تصحيح التمرين رقم 3 في درس المعايرة حمض قاعدة في مادة الفيزياء والكيمياء مستوى السنة الثانية بكالورياDocument2 pagesتصحيح التمرين رقم 3 في درس المعايرة حمض قاعدة في مادة الفيزياء والكيمياء مستوى السنة الثانية بكالورياZakaria ElhammoumiNo ratings yet
- طرق التحليل الحجميDocument4 pagesطرق التحليل الحجميAhmed Khotcho100% (1)
- التحولات الكيميائية التي تحدث في منحيينDocument7 pagesالتحولات الكيميائية التي تحدث في منحيينEl Youbi MohammedNo ratings yet
- Exc3b 2bac PDFDocument2 pagesExc3b 2bac PDFAbdelmoghit IdhsaineNo ratings yet
- Exo Acide Base Faible CinetiqueDocument2 pagesExo Acide Base Faible CinetiqueIhsan Mokhlisse100% (1)
- حلول اسئلة اختبارات نهاية الرزم التعليمية-محولDocument10 pagesحلول اسئلة اختبارات نهاية الرزم التعليمية-محولJann ahNo ratings yet
- ملخص شامل في الكيمياءDocument7 pagesملخص شامل في الكيمياءbekhaddachimaNo ratings yet
- Corpsvtn 212Document7 pagesCorpsvtn 212Farid HaririNo ratings yet
- DS1G1 2bac 2014 SVTDocument5 pagesDS1G1 2bac 2014 SVTAbderrazak AferyadNo ratings yet
- درس-8-ت-أيونات الهيدروجين والرقم الهيدروجينيDocument2 pagesدرس-8-ت-أيونات الهيدروجين والرقم الهيدروجينيSenkuNo ratings yet
- تمارين تطبيقية للتفاعلات الحمضية القاعديةDocument1 pageتمارين تطبيقية للتفاعلات الحمضية القاعديةfalkosatNo ratings yet
- تطور جمل كيميائية نحو التوازنDocument9 pagesتطور جمل كيميائية نحو التوازنmidi zenineNo ratings yet
- Sujets DEBILIDocument29 pagesSujets DEBILIسمير دبيليNo ratings yet
- 06Document3 pages06Deneche LinaNo ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)
- امتحان تجريبي 2018Document8 pagesامتحان تجريبي 2018Abdelouahed AbidNo ratings yet
- المكثف 2021Document79 pagesالمكثف 2021Batool Al-kharabshehNo ratings yet
- BacSMAgadir 2010Document8 pagesBacSMAgadir 2010ahmed ez-zarroukNo ratings yet
- مفهوم التقدم لتفاعل كيميائي وحصيلة المادةDocument5 pagesمفهوم التقدم لتفاعل كيميائي وحصيلة المادةAICHA MERABETNo ratings yet
- DS2 S1 2 Bac PCDocument4 pagesDS2 S1 2 Bac PCdemnate100% (1)
- فرض كتابي رقم 2 التوازن الكيميائي،قياس المواصلة و الفيزياء النوويةDocument4 pagesفرض كتابي رقم 2 التوازن الكيميائي،قياس المواصلة و الفيزياء النوويةالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- فرض كتابي رقم 2 التوازن الكيميائي،قياس المواصلة و الفيزياء النوويةDocument4 pagesفرض كتابي رقم 2 التوازن الكيميائي،قياس المواصلة و الفيزياء النوويةالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- أهم ما جاء في 4Document14 pagesأهم ما جاء في 4zaki48No ratings yet
- Screenshot 2021-05-24 at 3.26.24 PMDocument6 pagesScreenshot 2021-05-24 at 3.26.24 PMraghadNo ratings yet
- ملخص حول المعايرة الـ بي أش متريةDocument2 pagesملخص حول المعايرة الـ بي أش متريةUmm BædNo ratings yet
- Sujet 1Document5 pagesSujet 1Malika PhysiqueNo ratings yet
- قوانين الكيمياء 3ثDocument6 pagesقوانين الكيمياء 3ثsohilamohamed6412No ratings yet
- Equilibres 4 5Document3 pagesEquilibres 4 5Manga MainNo ratings yet
- Corppcr 21Document10 pagesCorppcr 21Zakaria AbdelhayNo ratings yet
- ثابت الاتزان2Document4 pagesثابت الاتزان2Rehab. ANo ratings yet
- GUEZOURI Aek - Lycée Maraval - OranDocument14 pagesGUEZOURI Aek - Lycée Maraval - Oranmouhammed alajeeNo ratings yet
- ةوق Hcl .Na₂Co₃Document3 pagesةوق Hcl .Na₂Co₃Maoth AhmedNo ratings yet
- إمتحان تجريبي 2022 علوم الحياة و الأرضDocument6 pagesإمتحان تجريبي 2022 علوم الحياة و الأرضMARWANo ratings yet