Professional Documents
Culture Documents
تتبع تطور تحول كيميائي
Uploaded by
marouaneCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
تتبع تطور تحول كيميائي
Uploaded by
marouaneCopyright:
Available Formats
بسم هللا الرحامن الرحمي
تتبع تطور تحول كيميائي
تمرين 1
-1أكتب معادلة احتراق الكربون في غاز ثنائي األوكسجين.
-2نحرق 1,3molمن الكربون في 4molمن غاز ثنائي األوكسجين.
:2-1أنجز جدوال لتطور التفاعل الحاصل بين الكربون و غاز ثنائي األوكسجين متضمنا الحالة البدئية و الحالة خالل التفاعل و الحالة النهائية.
:2-2أحسب كمية مادة كل من الكربون و غاز ثنائي أوكسيد الكربون عندما يأخذ التقدم القيمة . x 0, 2mol
-3تكون قيمة التقدم األقصى هي ، x max 1,3mol :أحسب كمية مادة كل متفاعل متبق في الحالة النهائية ،و استنتج المتفاعل المحد .
تمرين 2
تركيزه C=5.10 mol.Lعلى كتلة m=135mgمن مسحوق
-2 -1
في كأس ,نصب حجما V=20mLمن محلول ) (Sلحمض الكلوريدريك
)H+(aq
3
األلومنيوم ) . Al(sفتتكون أيونات األلومنيوم ) , A(aqو يتصاعد غاز ثنائي الهيدروجين ). H2 (g
1صف كيف يمكنك إبراز وجود أيونات األلومنيوم ؟
2نفس السؤال بالنسبة لغاز ثنائي الهيدروجين .
3احسب كميتي المادة البدئيتين للمتفاعلين .
4أنشئ جدول التقدم و حدد المتفاعل المحد و التقدم األقصى .
5حدد حصيلة المادة عند نهاية التفاعل .
6احسب التركيز المولي أليونات األلومنيوم في الكأس .
7ما حجم غاز ثنائي الهيدروجين المتصاعد في شروط التجربة ( 25°Cو. )1bar
نعطي M ( A) 27 g.mol 1 :و )R = 8,314 (SI
تمرين 3
في شروط معينة ،تتفاعل كمية من الكربون كتلتها ، m 2, 4 gمع حجم V 3,6 lمن ثنائي األوكسجين فينتج ثنائي أوكسيد الكربون.
-1أكتب المعادلة الكيميائية للتفاعل الحاصل .
-2أنجز الجدول الوصفي لهذا التفاعل .
-3حدد المتفاعل المحد ثم استنتج التقدم األقصى .
-4أنجز حصيلة مادة التفاعل .
-5أرسم مخطط تغيرات كميات مادة المتفاعالت بداللة تقدم التفاعل السلم ) 1cm 0,02mol (:بالنسبة لتقدم التفاعل
و 1cm 0,05mol بالنسبة لكميات المادة للمتفاعالت .
-6أحسب حجم أحادي أوكسيد الكربون الناتج و حجم ثنائي األوكسجين المتبقي عند نهاية التفاعل.
نعطي M (C ) 12 g.mol 1 :و Vm 24l.mol 1
تمرين 4
نأخذ قارورة سعتها V=0,5lعند 25 Cو ندخل فيها قطعة من الزنك Znكتلتها m=0,22gثم نصب عليها حجما VS=20mlمن محلول كلورور
0
الهيدروجين ) (H+aq+Cl-aqتركيزه . C=2,0 mol·L-1
-1الكشف عن نواتج التفاعل :
نضع في أنبوب اختبار قطعة من الزنك Znثم نصب عليها قليال من محلول حمض الكلوريدريك و نغلقه بعض الدقائق.
:1-1نفتح األنبوب و نقربه من اللهب .ماذا تالحظ ؟ حدد الناتج الذي تم الكشف عنه.
:1-2نضيف إلى المحلول قليال من محلول الصودا .ماذا تالحظ ؟ حدد الناتج الذي تم الكشف عنه.
-2أكتب المعادلة الكيميائية للتفاعل الحاصل .
-3أحسب كمية مادة المتفاعالت في الحالة البدئية.
-4أحسب قيمة xmaxالتقدم األقصى للتفاعل .
-5احسب ) n (H2كمية المادة لثنائي الهيدروجين الناتج.
-6اعتمادا على معادلة الحالة للغازات الكاملة احسب قيمة ) P(H2ضغط ثنائي الهيدروجين الناتج
نعطي R=8,314 (SI) :و . M(Zn)=65,4 g.mol-1
تمرين 5
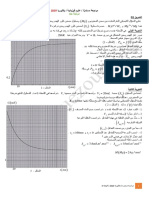
نحرق عند درجة الحرارة ، 20 Cكمية من تبن المحدد كتلتها mفي قنينة حجمها V 500mlبها غاز ثنائي الكلور تحت ضغط pفينتج دخان
0
أشقر لكلورور المحدد . IIIيمثل المخطط جانبه تطور كميتي مادة المتفاعلين بداللة تقدم التفاعل . x
-1أكتب المعادلة الكيميائية للتفاعل الحاصل .
-2حدد مبيانيا التركيب المولي للمجموعة عند الحالة البدئية و المتفاعل المحد و التقدم األقصى للتفاعل.
-3أحسب mو . p
-4أنجز حصيلة مادة التفاعل .
-5أحسب الضغط النهائي p fداخل القارورة عندما تأخذ درجة الحرارة قيمتها البدئية . 20 C
0
-6أرسم على المخطط السابق تطور كمية مادة كلورور الحديد IIIالناتج بداللة التقدم . x
نعطي M ( Fe) 55,8 g.mol 1 :و ) . R 8,134(S.I
You might also like
- Tamarind As - U7 - Oxred - 2023Document3 pagesTamarind As - U7 - Oxred - 2023Ma RyNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Soumia KerdNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Hina BouzerzourNo ratings yet
- BAC23 Doc1Document2 pagesBAC23 Doc1Sekkoum AhmedNo ratings yet
- Serie2as - U7 - Oxred - 2023Document3 pagesSerie2as - U7 - Oxred - 2023abdenouraitchikh27No ratings yet
- Ttba Thol Kimiaii Slsla Altmarin 1 3Document4 pagesTtba Thol Kimiaii Slsla Altmarin 1 3Amine AlaoUii AlaouiNo ratings yet
- Ø Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙDocument2 pagesØ Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙRiad ErENo ratings yet
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)
- تمارين تتبع تطور تحول كيميائي أولى باك النموذج1Document12 pagesتمارين تتبع تطور تحول كيميائي أولى باك النموذج1yahya elbahieNo ratings yet
- Composition de Physique 3AS - Sujet 01Document2 pagesComposition de Physique 3AS - Sujet 01Hasan Rajawi100% (1)
- سلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022Document7 pagesسلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022widad doudiNo ratings yet
- تمارين مرشحة لبكالوريا 2019 وحدة أكسدة ارجاعDocument5 pagesتمارين مرشحة لبكالوريا 2019 وحدة أكسدة ارجاعquelafamile dzNo ratings yet
- سلسلة تمارين 1 علميDocument2 pagesسلسلة تمارين 1 علميAndyTeck Pro (Android)No ratings yet
- Kichah ExoacideDocument2 pagesKichah Exoacidekhalil75No ratings yet
- Ø Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙDocument7 pagesØ Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙZi vinNo ratings yet
- الاختبار الثالثDocument2 pagesالاختبار الثالثnounoussyanNo ratings yet
- الوحدة 01 السلسلة 01Document3 pagesالوحدة 01 السلسلة 01Manil FélixNo ratings yet
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- Exc3b 2bac PDFDocument2 pagesExc3b 2bac PDFAbdelmoghit IdhsaineNo ratings yet
- - سلسلة تمارين في تعيين كمية المادة بواسطة المعايرة أكسدة - إرجاع للسنة 2 الشعب العلمية للاستاذ التيجاني دهامDocument2 pages- سلسلة تمارين في تعيين كمية المادة بواسطة المعايرة أكسدة - إرجاع للسنة 2 الشعب العلمية للاستاذ التيجاني دهامBessekri BessekriNo ratings yet
- Na OH H CL: HO HCO CO HODocument7 pagesNa OH H CL: HO HCO CO HOTaiba100% (1)
- Dzexams Docs 2as 906595Document3 pagesDzexams Docs 2as 906595Chi KouNo ratings yet
- SerieReac DjamelDocument1 pageSerieReac Djamelben amor melikaNo ratings yet
- Composition de Physique 3AS - Sujet 02Document2 pagesComposition de Physique 3AS - Sujet 02Hasan RajawiNo ratings yet
- سلسلة تمارين تتبع تحول كيميائيDocument3 pagesسلسلة تمارين تتبع تحول كيميائيYoussef JakeNo ratings yet
- ch2 4-Suivi D'une Transformation Chimique ActivitéDocument2 pagesch2 4-Suivi D'une Transformation Chimique ActivitéRachid SadNo ratings yet
- Compo12 AsamadDocument2 pagesCompo12 AsamadmutraceNo ratings yet
- Exc4 1bac PDFDocument4 pagesExc4 1bac PDFHarakat ElhoucineNo ratings yet
- BBL AbedDocument4 pagesBBL Abedعبد العزيز مروىNo ratings yet
- سلسلة مراجعة لأهم المكتسبات القبليةDocument3 pagesسلسلة مراجعة لأهم المكتسبات القبليةTeacher EnglishNo ratings yet
- 4- تتبع تحول كيميائيDocument10 pages4- تتبع تحول كيميائيMr GamerNo ratings yet
- Dzexams Uploads Sujets 1021979Document5 pagesDzexams Uploads Sujets 1021979Kerboub IdrisNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- Exo Acide Base Faible CinetiqueDocument2 pagesExo Acide Base Faible CinetiqueIhsan Mokhlisse100% (1)
- - نماذج احيائي منهج عربي 4Document4 pages- نماذج احيائي منهج عربي 4hassanghfran283No ratings yet
- جدول التقدم - الفيزياء و الكيمياءDocument3 pagesجدول التقدم - الفيزياء و الكيمياءMiimii ChøůÇhãNo ratings yet
- 1 6Document5 pages1 6azizNo ratings yet
- تمارين المعايرات المباشرة أولى باك النموذج 1 PDFDocument12 pagesتمارين المعايرات المباشرة أولى باك النموذج 1 PDFAyoub FatheNo ratings yet
- 1975Document7 pages1975nounoussyanNo ratings yet
- PpppooDocument2 pagesPpppooImad Eddine sahraouiNo ratings yet
- Bbl13 BouzidDocument7 pagesBbl13 Bouzidcylia ciciNo ratings yet
- Exc7 1bac PDFDocument4 pagesExc7 1bac PDFSouhail Alessandro67% (3)
- 3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTDocument5 pages3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTe.maskarNo ratings yet
- Composition 2 Eme Trimestre 2AS MDocument2 pagesComposition 2 Eme Trimestre 2AS MdfdfdfNo ratings yet
- 995b0d319aeafe05eb92faaa179762c7Document85 pages995b0d319aeafe05eb92faaa179762c7net_codeNo ratings yet
- سلسلة المراجعة الشاملة للمحور الاول في مادة الفيزياء للسنة الثالثة ثانوي جميع الشعب العلمية 2020 - 2021Document14 pagesسلسلة المراجعة الشاملة للمحور الاول في مادة الفيزياء للسنة الثالثة ثانوي جميع الشعب العلمية 2020 - 2021dhodphdgdu26836No ratings yet
- السلسلة 4Document2 pagesالسلسلة 4Sami RabhiNo ratings yet
- أفضل باقة معلوماتية للأستاذ قزوري في الفيزياء - الفصل الأول - عقبة بن نافع - بكالوريا 2021Document96 pagesأفضل باقة معلوماتية للأستاذ قزوري في الفيزياء - الفصل الأول - عقبة بن نافع - بكالوريا 2021Leave me Alone100% (2)
- SujetB SidiAich 3trimDocument5 pagesSujetB SidiAich 3trimomdabdouNo ratings yet
- Dzexams 1as Physique 2834393Document5 pagesDzexams 1as Physique 2834393Lydia KhelifiNo ratings yet
- حساباتDocument5 pagesحساباتabdaljbar318kaskoshNo ratings yet
- 5Document4 pages5e.maskarNo ratings yet
- Exos BelkacemDocument4 pagesExos BelkacemMilia dyNo ratings yet
- Controle 4Document4 pagesControle 4marouaneNo ratings yet
- Controle 3Document1 pageControle 3marouaneNo ratings yet
- PC 3Document2 pagesPC 3marouaneNo ratings yet
- Controle 1Document2 pagesControle 1marouaneNo ratings yet
- Controle 2Document1 pageControle 2marouaneNo ratings yet
- PC 2Document1 pagePC 2marouaneNo ratings yet
- PC 1Document2 pagesPC 1marouaneNo ratings yet
- أهمية القياس في الكيمياءDocument1 pageأهمية القياس في الكيمياءmarouaneNo ratings yet
- التراكيز والمحاليل الإلكتروليةDocument1 pageالتراكيز والمحاليل الإلكتروليةmarouaneNo ratings yet