Professional Documents
Culture Documents
ATOMSKA Kvantna Fizika
Uploaded by
Dejan NikolicOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
ATOMSKA Kvantna Fizika
Uploaded by
Dejan NikolicCopyright:
Available Formats
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
1. Zakoni zraenja idealnog crnog tijela
Idealno crno tijelo - ono tijelo koje upije (apsorbira) sve zraenje koje na njega padne - model : uplja kugla poaena iznutra, sa malomrupicom na povrini Zbog zakona ouvanja energije (Z.O.E.) : a + r + t = 1 a koeficijent apsorpcije r koeficijent refleksije t koeficijent transmisije Za idealno crno tijelo je : a = 1 Kirchhoffov zakon tijelo zrai upravo one iznose energije koje moe i apsorbirati
e( ,T ) = a( ,T )
e koeficijent emisije
Omjer izlazne snage zraenja i koeficijenta absorpcije tog tijela konstantan je za sva tijela u termodinamikoj ravnotei (vrijedi za bilo koju temperaturu tijela i za bilo koju valnu duljinu zraenja) termodinamika ravnotea - tijelo e uspostaviti zajedniku temperaturu izmjenom energije putem elektromag zraenja; svako tijelo je i abmiter i absorber (dobar apsorber je i dobar emiter)
STEFAN BOLTZMANNOV zakon snaga zraenja idealnog crnog tijela razmjerna je povrini i etvrtoj potenciji termodinamike temperature : P = AT [W ] , watt P snaga zraenja A - povrina tijela T termodinamika temperatura ( K, kelvin ) 8 2 4 = 5,67 10 Wm K , Stefan Boltzmannova konstanta
4
WIENOV ZAKON (zakon pomaka) - umnoak apsolutne temperature crnog tijela i valne duljine na kojoj je snaga zraena maksimalna je konstanta : m T = b c= f 3 b = 2,9 10 mK , Wienova konstanta c brzina svjetlosti m valna duljina na kojoj je snaga zraenja maksimalna Wienov zakon je dobiven eksperimentalnim putem; na slici dolje su 2 krivulje ovisnosti intenziteta zraenja o frekvenciji energije koju zrai idealno crno tijelo na 2 razliite temperature. Vidi se da je krivulja zraenja na vioj temperaturi pomaknuta u lijevo prema krivulji zraenja na nioj temperaturi. I I intenzitet zraenja I valna duljina
teorija
I=
P W A m2
c = m f m
f frekvencija zraenja fm frekvencija kod koje je snaga zraenja najvea
Ameriki fiziari Rayleigh i Jeans (itaj : Rejli i Dins) teorijskim putem su doli do zakona zraenja koji se nije slagao sa rezultatima dobivenim pokusima, naroito u podrujima visokih frekvencija.Ta je injenica u povijesti fizike poznata pod nazivom ULTRALJUBIASTA KATASTROFA. Naime,
matematika obrada (integralni raun) energija zraenja crnog tijela davala je rezultate da energija zraenja raste na neizmjerne vrijednosti kada frekvencija zraenja raste.
Izlaz iz problema pronaao je njemaki fiziar Max Planck, koji je uveo pojam KVANT. Klasina fizika (19.st.) tumaila je zraenje tijela na nain da tijela zrae KONTINUIRANE (neprekinute) iznose energija. Problem nestaje ako se pojava tumai diskontinuiranim zraenjem energije : znai mora postojati najmanja koliina energije koju tijelo zrai ( zraenjem u paketiima, tzv. kvantima KVANTNA FIZIKA )
1 Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
2. Planckova formula, o fotonu
8f 2 Rayleigh - Jeansov zakon : E = 3 kT c ultraljubiasta (ULJ) katastrofa
Planckova formula :
E=
8 h c3
f3 e
hf kT
poznata i kao Planckov zakon zraenja
Planckova formula za energiju jednog kvanta : h = 6,62610-34 J s Planckova konstanta Planckova formula za energiju vie kvanata :
Ekvanta = hf E = Nhf
kvant zrnce, paketi, najmanja koliina, .... foton
N = 1,2,3... broj kvanata
o FOTONU ( roj fotona svjetlost elektromagnetski val ) Svojstva fotona : - giba se brzinom c = 3108 m/s (foton nikad ne miruje nema energiju mirovanja) - nema masu (foton je estica bez mase nema energiju mirovanja) - za fotone NE VRIJEDI ZAKON OUVANJA BROJA fotona - foton traje vjeno ... ali esto ulazi u interakciju s materijom ... ( za fotone vrijeme ne tee, ne postoji pojam vremena ... ) - fotoni imaju dvojnu (dualnu) prirodu : fotoni su i estice i valovi .. kada e pokazati koju prirodu ovisi o uvjetima u kojima se nalaze; kada putuju kroz prostor/tvar manifestiraju valna svojstva; kada stupaju u meudjelovanje s materijom pokazuju estina svojstva ( fotouinak )
Materija se dijeli na 2 skupine : TVAR lokalizirana energija ( energiju nosi estica ) POLJE ne lokalizirana energija ( energija se nalazi u prostoru u kojem je prisutno polje ) na fotone djeluje gravitacijska sila savijanje zrake svjetlosti u gravitacijskom polju ( podruje ope teorije relativnosti )
moe se opisati sljedeim formulama : E = hf , c = f , E = pc p =
E c
( m = 0) , p =
Oznake fizikalnih veliina : E energija fotona f frekvencija fotona valna duljina fotona
p koliina gibanja (impuls) n indeks loma sredstva 1 elektronvolt - mjerna jedinica za energiju 1eV = 1,6 10 19 J
c brzina fotona/svjetlosti ( u vakuumu i zraku ); inae vrijedi formula n =
1 1 J w = E 2 + H 2 3 2 2 m
c v
w gustoa energije fotona , tlak fotona
J Nm = 3 = Nm 2 = Pa 3 m m
dimenziona analiza [w] =
slika fotoefekta
foton
ureaj za tlak fotona
svjetlost = fotoni zrcalo tamna ploha
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
3. Fotoelektrini uinak (efekt)
Foto-uinak je pojava izbacivanja elektrona ( tzv. fotoelektrona ) s povrine fotoni metala pod utjecajem svjetlosti ( EM-zraenja, fotona, kvanata svjetlosti,...). Pojavu je prvi opazio Halwachs, krajem 19.st. (prema drugom izvoru bio je to R.Hertz). Seriju eksperimenata o fotouinku izveo je Phillip Lenard. (Nobelova nagrada 1905.g.). Rezultati Lenardovih pokusa : elektroni 1. broj izbaenih elektrona proporcionalan je intenzitetu upadne svjetlosti: N ~ I 2. kinetika energija izbaenih elektrona razmjerna je frekvenciji upadne svjetlosti: Ek ~ f 3. postoji frekvencija ( fg ) ispod koje se fotoefekt ne dogaa
Prema dotada postojeoj, valnoj teoriji svjetlosti, mogao se objasniti samo prvi rezultat (toka1). Prema toj teoriji oekivalo se da i kinetika energija elektrona bude razmjerna intenzitetu svjetlosti ( I ~ A2 ), tj. Ek ne bi trebalaovisiti o frekvenciji. Osim toga, fotoefekt bi mogao izazvati EM-val bilo koje frekvencije.
Potpuno tumaenje fotouinka dala je estina, tj. KORPUSKULARNA teorija svjetlosti. Fotoefekt je protumaio A. Einstein, 1905.god. pomou Planckove formule E = hf uvoenjem pojma KVANTA SVJETLOSTI FOTONA svjetlost je roj fotona ; fotoni = estice svjetlosti Fotoefekt je interakcija 1-1 ( 1 foton, 1 elektron ). ( 1921.g. Einstein dobiva Nobelovu nagradu. ) Einsteinova formula fotoefekta je u biti zakon ouvanja energije : Ek kinetika energija izbaenog elektrona Wi izlazni rad elektrona iz metala Wi = hf g
hf = Ek + Wi
h = 6,625 10 34 Js
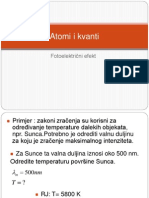
Izlazni rad (energija ionizacije) je energija koju je potrebno dati elektronu da napusti atom. fg granina frekvencija, najmanja frekvencija fotona koji mogu izazvati fotoefekt Grafiki prikaz Einsteinove formule : Wi < 0 , jer treba uloiti vanjsku energiju da se elektron otrgne od 1 2 atoma Ek = me v zadatak za vjebu : uta zbirka. 6.2. 2 Elektrone pri fotoefektu na platini zaustavlja potencijal od 0,8 V. Izlazni rad za platinu je 5,3 eV. Kolika je valna duljina fotona pri tom fotouinku ? ( R : = 0,204 m; vidi dolje uputu)
c = g f g
c = f
Uputa : postoji pojam zaustavni potencijal tj. napon koenja U fotoefekta to je napon koji treba uspostaviti izmeu anode i katode u fotocijevi da zaustavi elektrone uz samu povrinu metala. Uvjet se svodi na jednakost energije elektrinog polja i kinetike energije elektrona.
fotoni anoda elektroni
Formula za opisani proces je : eU = 1 m v 2 e katoda 2 hf = eU + Wi Einsteinova formula drugi oblik : slika desno : fotoelija slui kao sklopka, tj. PREKIDA
( kad svjetlost padne na katodu, strujni krug se zatvori, a kada se zraka prekine i strujni krug se prekine) konstante : 31 19
me = 9,11 10
kg
e = 1,6 10
izvor napona
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
4. Zadaci fotouinak
15
FORMULE :
Zadatak : Kada je metalna ploa obasjana fotonima frekvencije 2,23 10 mv 2 Hz iz nje izlijeu elektroni kinetike energije 6,6 eV. Ako istu plou hf = W + E Ek = i k obasjavamo fotonima frekvencije 4,62 1015 Hz najvea kinetika 2 energija izbaenih elektrona iznosi 16,5 eV. Izraunaj vrijednost h = 6,626 10 34 Js Planckove konstante. Naboj elektrona je 1,6 10-19 C. W Rjeenje : Wi = hf g f g = i h f1 = 2,23 1015 Hz hf1 = E1 + Wi c hc c = f g = = E1 = 6,6eV f g Wi hf 2 = E 2 + Wi ( 1) f 2 = 4,62 1015 Hz zbrajanjem gornje dvije jednadbe hf = Wi + eU E 2 = 16, dobijemo5eV E E1 h= 2 = 6,63 10 34 Js e = 1,6 10 19 C f f
2 1
h=?
FORMULE :
E = hf
E = Nhf c = f E = pc p= h m=0
1) Neka radio postaja odailje 1028 fotona u tri sekunde. Energija svakog fotona je 10-24 J. Izraunaj : a) frekvenciju tih fotona c = 3108 m/s b) snagu te radio postaje ( u kW ) 2) a) Koliko fotona u 1s emitira radio postaja ako snop fotona ima snagu 12 kW, a svaki foton nosi energiju 100 eV? b) izraunaj impuls fotona 3) kada monokromatska svjetlost valne duljine 2,82 m obasjava fotokatodu,
5 1 1 w = E 2 + H 2 izlaze elektroni brzinom 3,110 m/s. Izraunaj : a) graninu frekvenciju b) graninu valnu duljinu za fotouinak 2 2
4) Da li e svjetlost valne duljine 1,510-7 m izazvati fotouinak na metalu, za koji je izlazni rad 5 eV ? 5) Koliki je napon potreban za zaustavljanje fotoelektrona, ako ti elektroni, nakon izlaska iz metala imaju brzinu 1,6 106 m/s . Masa elektrona iznosi 9,1110-11kg. 6) Fotoni energije 20 MeV upada okomito na ploicu metala. Izraunajte : a) koliki impuls fotoni daju toj ploici b) koliki bi joj impuls dali da upadnu pod kutem od 30 ? ( vidi sliku ) Napomena : treba izraunati komponentu p1. 7) Koliko e fotoelektrona izbaciti s povrine metala izlaznog rada 2,510-5eV 1020 fotona, ako je energija jednog fotona 6,62610-24J. Koliki je napon zaustavljanja za taj metal ? Masa elektrona iznosi 9,1110-11kg. Naboj elektrona je 1,610-19C. 8) Kolika je kinetika energija elektrona izbaenih iz kalija svjetlou valne duljine 500 nm , ako je granina valna duljina fotona koji mogu izazvati fotoefekt 551 nm. 9) Elektrone pri fotoefektu na eljezu zaustavlja potencijal 2,4 V. a) Odredi valnu duljinu svjetlosti koja je uzrokovala fotoefekt. b) Izraunaj graninu valnu duljinu ! Izlazni rad za eljezo je 4,63 eV. 10) Granina valna duljina za fotoefekt na elektrodi od litija je 504 nm. Koliki se potencijal mora upotrijebiti da se zaustave elektroni koji izlaze iz te elektrode, ako se ona osvijetli fotonima valne duljine 0,32 m ?
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
5. Rntgensko- zraenje
Otkrio ga je W.C. RNTGEN 1901.g. dobio Nobelovu nagradu ( prva Nobelova nagrada ) x ( rendgenska ) cijev ; Opis procesa u cijevi : - iz katode izlaze elektroni, udaraju u anodu, te iz nje izbijaju fotone; taj proces je obrnut procesu fotoefekta K- katoda (-); izraena iz volframa: grijana na 2700 K
K A
A ... anoda ( + ); izraena iz materijala malog izlaznog rada U ( 30 150 ) kV ; napon izmeu K i A Jednadba za x cijev :
.
hf x = eU f x =
f x frekvencija x-zraenja U napon x valna duljina x-zraenja
E x energija x-zraenja
eU (1018 10 22 ) Hz h
c = f
x 1 pm 10 nm
E x 10 2 10 22 eV
x zraenje je VISOKOENERGETSKO zraenje
NAELO RADA x- cijevi
Ako brzi elektron koji izlazi iz katode pogodi u elektronski omota atoma mete (anode), moe izbiti elektron iz unutarnje ljuske te e na to prazno mjesto uskoiti elektron iz vie energetske ljuske i pritom emitirati foton x-zraenja. Na taj nain emitira se zraenje samo tono odreenih frekvencija (valnih duljina) vidljivi su kao iljci na grafu ovisnosti I - I K K I intenzitet zraenja Na grafu je prikazan karakteristian spektar x-zraenja)
..
- valna duljina
g granina valna duljina za metal od kojeg je izraena anoda
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
6. Modeli atoma
Prvi modeli atoma : Demokrit (5.st.pr.Kr.) atom = nedjeljiv
J.R.Bokovi, 18.st. ideja o silama izmeu estica; bila je temelj razvoja atomske fizike J.J.Thomson 1899.g otkrio elektron (Nobelova nagrada 1906.g.); dao tzv. statiki model atoma ili tzv. plum-pudding model E.Rutherford 1911.g sruio Thomsonov model i dao tzv. planetarni model atoma na temelju pokusa bombardiranja tankog listia zlata esticama ( Nobelova nagrada 1908.g. za kemiju ) Rezultat Rutherfordovog pokusa : pozitivan naboj koncentriran je samo u malom dijelu atoma, i to u njegovom sreditu JEZGRA (nukleus) vei dio volumena atoma oko pozitivno nabijene jezgre je prazan prostor, u kojem oko jezgre krue elektroni pod utjecajem elektrostatske sile koja ima ulogu centripetalne sile ( slino kao to planeti krue oko Sunca ) Niels Bohr dao model atoma poznat kao BOHROV MODEL ( Nobelova nagrada 1922.g. ) relativno dobar model u to doba ali jedino tumai ponaanje H-atoma model je nastao kao rezultat J.J. Balmerovih eksperimenata ( 1885.g.) Balmer se bavio analizom spektra zraenja H-atoma
BOHROV KVANTNI MODEL ATOMA : - nastao 1913.g na temelju Planckove ideje o kvantima i rezultata Rutherdovog modela - temelji se na 2 postulata 1. Bohrov postulat : Elektroni se oko jezgre gibaju po krunim putanjama sa tono odreenim radijusima i na njima imaju tono odreene energije tzv. STACIONARNA ENERGIJSKA STANJA. Gibajui se po tim putanjama elektron ne zrai energiju. U odsutnosti vanjskih utjecaja elektroni se nalaze u najniim stacionarnim energetskim stanjima. h me masa elektrona Za stacionarna stanja vrijedi : me r v = n 2 rn radijus staze (putanje) elektrona n redni broj staze
Bokovieva krivulja
Time je Bohr KVANTIZIRAO ENERGIJE i putanje elektrona u atomu . Pri tom krunom gibanju
ulogu centripetalne sile ima Kulonova privlana sila izmeu jezgre i elektrona.
2. Bohrov postulat : Pod utjecajem vanjskog djelovanja elektron moe prijei u vie stacionarno energetsko stanje. Elektron emitira energiju u obliku fotona kad preskae iz stanja vie energije u stanje nie energije, a kad apsorbira energiju prelazi iz stanja nie energije u stanje vie energije. Pri tome je razlika energijskih razina jednaka energiji emitiranog (apsorbiranog) fotona :
foton
(zakon ouvanja energije)
E = hf = E m E n
elektron
spektar : emisijski nastaje kada elektron prelazi iz stanja vie u stanje nie energije (slika iznad) apsorpcijski nastaje kada elektron prelazi iz stanja nie u stanje vie energije (sl. dolje) Atomi apsorbiraju samo fotone onih energija koje u pobuenom stanju emitiraju !
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
H atom
Balmer je eksperimentalnom metodom ( pokusom ) otkrio formulu pomou koje se vrlo precizno moglo predvidjeti koje valne duljine vidljivog dijela spektra zrai vodik u plinovitom stanju :
= R(
1 1 2 ) n = 3,4,5, .... 2 n 2
R = 1,097107 m-1 , Rydbergova konstanta
Taj niz valnih duljina vidljivog dijela spektra vodikovog atoma nazvan je Balmerov niz ili Balmerova serija. Kasnije su slijedila otkria slinih diskretnih valnih duljina i u drugim podrujima spektra H atoma : Paschen je otkrio seriju u infracrvenom podruju ( Paschenova serija ) :
= R(
1 1 2 ) 2 3 n
n = 4,5,6, ...
Lyman otkriva 1916. godine seriju valnih duljina u u ultraljubiastom (ULJ) podruju ( Lymanova serija )
= R(
1 1 2 ) 2 n 1
n = 2,3,4, ...
Valna duljina zraenja u vodikovom spektru moe se odrediti formulom :
= R(
1 1 2) 2 m n
m, n - prirodni brojevi, za koje vrijedi m < n
n = m + 1, m + 2, m + 3,....
1 1 Zbog c = f f = cR 2 2 n m
Spektar zraenja H atoma objanjen je u okviru Bohrovog modela atoma kao posljedica Bohrovih postulata :
2 1. kvantizacija radijusa putanje elektrona rn = n r1
r1 = 5,3 10 11 m ...tzv. Bohrov radijus
( radijus putanje elektrona koji se nalazi u najniem energijskom stanju )
rn - radijus n-te staze (putanje)
Energije elektrona u atomu su kvantizirane zbog kvantiziranosti putanje
En =
13,6 n2
[eV ]
za n = 1 E1 = -13,6 eV (energija ionizacije H atoma)
2. uvjet zraenja iz atoma atom zrai samo kada elektron skae iz stanja vie u stanje nie energije :
1 1 E f = E m E n = 13,6 2 2 ( eV) n m
cR m2
E f = hf
Iz formule za frekvenciju dobije se formula za tzv. graninu frekvenciju pojedinog niza : iznad ove energije atom je ioniziran, tj. elektron je slobodan
f = f gr n
f gr =
c = gr f gr
f gr - granina frekvencija najvia frekvencija pojedine serije
gr - granina valna duljina (najmanja valna duljina pojedine
serije)
= gr n
gr
R m2
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
7. Atomski spektri
Model atoma koji je predloio N. Bohr mogao je protumaiti samo spektar H-atoma. Ve u nastojanju da se protumai spektar He-atoma Bohrova teorija nije bila dostatna. No, ipak, povijesna zasluga N. Bohra je u tome to je : izvor zraenja smjestio u atom (elektromagnetsko zraenje dolazi iz atoma) kvantizirao energije elektrona u atomu tumaenje naela zraenja iz atoma : E = Em En = hf , zakon ouvanja energije
Naelo emisije iz atoma : elektroni prelaze iz stanja vie energije u stanje nie energije i pti tome zrae fotone
kvantizirane su i energije atoma i energije molekula Svaki atom ima svoj vlastiti, JEDINSTVENI spektar zraenja. Radi se ili o emisijskom ili o apsorpcijskom spektru, ovisi o uvjetima u kojima se atom nalazi. Spektar pojedinog elementa se dobije tzv. spektralnom analizom : O okular S spektroskop P plin ( zagrijani, tj. pobueni plin )
P 1 S 2
1, 2 ice spojene u struju
Spektroskop je ureaj za promatranje spektra. Prouavanjem emisijskih i apsorpcijskih spektara moe se zakljuiti o sastavu pojedinog uzorka materijala. Na tom se naelu zasniva metoda poznata pod imenom SPEKTRALNA ANALIZA. Ona se vrlo esto rabi u fizici, kemiji i primijenjenim strukama (forenzici i sl.). Prvi ovjek koji je opazio spektar, bio je austrijski fiziar J. Fraunhoffer u 19. st. On je, kroz zaaeno staklo, na kojem je urezao niz tankih pukotina ( prva optika mreica ) promatrao Sunce i uoio niz tamnih linija u kontinuiranom spektru Sunca.
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
VRSTE spektara (spektri atoma i molekula)
Kontinuirani spektar: emitiraju ga uareno vrsto tijelo i plin velike gustoe i visoke temperature
prizma
el. arulja pukotina
detektor ( npr. fotografska ploa)
Linijski spektri: emitiraju ih razrijeeni ugrijani plinovi i pare metala u atomarnom stanju
arna nit visoki napon pukotina prizma detektor
spektar H-atoma
Detaljnije : Apsorpcijski spektar vodika - svjetlost koju emitira izvor kontinuiranog spektra (bijela svjetlost)
prolazi kroz razrjeeni plin vodika. Uoite tamne linije na istim mjestima (valnim duljinama, tj. frekvencijama ili energijama) koje emitira razrjeeni i pobueni plin vodik.
Na dolje navedenim linkovima moete vidjeti spektre pojedinih atoma. http://physics.mef.hr/webpraktikum/spektroskopija/Page1.htm Pogledajte i ovo: http://jersey.uoregon.edu/vlab/elements/Elements.html
klikom na bilo koji element vidjet ete njegov spektar
Apsorpcijski spektar Sunca
Vrpasti spektri: daju ih plinovi i pare metala u molekularnom stanju
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
8. Valna priroda estica
Louis de Broglie (de Brolj) ( 1892. 1987. ) franc. fiziar, dao je hipotezu : estice imaju valna svojstva (1929. Nobelova nagrada)
Valna duljina pridruena estici : = Gornja jednadba moe pisati : =
h p
h mv
1 p
m masa estice
v brzina estice
ili
p - impuls (koliina gibanja)
p = mv , klasina fizika
p = mv , relativistika fizika
Hipoteza je potvrena pokusom ogiba ( difrakcije ) elektrona na kristalima. POKUS Davissona i Germera ( Nobelova nagada 1937.g. ) : Kristal je optika mreica za elektrone.
MnO Na foto - ploi nastaje ogibna slika elektrona. (tzv. Laueov dijagram laueogram) Max Laue, austijski fiziar
Pri ogibu na kristalu elektroni zadovoljavaju tzv. Braggov uvjet : k = 2d sin k red ogibne slike k = 1, 2, 3,...
valna duljina elektrona d udaljenost mrenih ravnina kristala tj. konstanta optike mreice (reetke) (theta) kut sjaja ( kut koji zatvara upadna zraka sa mrenom ravninom
DE = d sin
EF = d sin
DE + EF = 2d sin
razlika hoda
= k , uvjet konstruktivne interferencije, dolazi do pojaanja valova
De Broglieva jednadba povezuje i valna i korpuskularna svojstva elektrona. Ono to vrijedi za elektron, vrijedi i za ostale estice. No, valovi-estice nisu poput elektromagnetskih valova : brzina im je manja od brzine svjetlosti i nije stalna. Ali, kao i EM-valovi, niti estice ne pokazuju uvijek valna svojstva. To ovisi o odnosu valne duljine estice i njene veliine : uvjet koji odreuje kada estica pokazuje pokazuje valna svojstva : d veliina estice d << uvjet koji odreuje kada estica ne pokazuje pokazuje valna svojstva : d Zato elektron uvijek pokazuje valna svojstva ? Odgovor : Kada se izrauna valna duljina pridruena elektronu dobije se vrijednost puno manja od veliine elektrona, koja se procjenjuje na priblino ~ 10-16 m. Npr. kada se elektron giba brzinom 105 m/s, njegova valna duljina je 7,3 nm : h 6,626 10 34 elektron u atomu formira stojni val : = = = 7,3 10 9 m = 7,3 nm 31 5 mv 9,1110 10
10
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
9. Heisenbergove relacije neodreenosti
dualizam val estica SIMETRIJA PRIRODE Niels Bohr je izrekao naelo KOMPLEMENTARNOSTI ( nadopunjavanja ) : VALNA I ESTINA SLIKA SU KOMPLEMENTARNE. Werner Heisenber, njem. fiziar : 1927. g. izrekao relacije (formule) neodreenosti (imao je 25 godina) 1932. g. dobio Nobelovu nagradu
Heisenbergove relacije su posljedica dualizma kvantnomehanikih pojava i :
govore o nepouzdanosti pri ISTODOBNOM mjerenju tzv. komplementarnih veliina KOMPLEMENTARNE veliine su : x ( poloaj ) i p ( impuls ) E ( energija ) i t ( vrijeme ) (kut ) i L ( kutna koliina gibanja )
rezultat su interakcije ( meudjelovanja ) mjernog ureaja ( subjekta ) i atomske estice ( objekta ) u procesu mjerenja
relacije glase :
x p
h 2
E t
h 2
E neodreenost pri mjerenju energije x neodreenost (nepouzdanost) pri mjerenju poloaja p neodreenost pri mjerenju impulsa t neodreenost pri mjerenju vremena h = 1,05 10 34 Js , tzv. reducirana Planckova konstanta ( itaj : h precrtano ) = 2
Tumaenje relacija neodreenosti : U istom mjerenju, vea pouzdanost pri mjerenju jedne veliine dovodi do to vee nepouzdanosti druge veliine. Dodatni komentar : U svijetu atoma ne postoji pojam putanje. Na koji nain u klasinoj fizici moemo odrediti poloaj (putanju) neke estice? Promatranjem gibanja okom, ureajima ( dalekozor, teleskop, poveala, mikroskop optiki, elektronski, laserski ). Predmet mora biti OSVIJETLJEN (mi taj predmet vidimo upravo zahvaljujui refleksiji svjetlosti). Kako, npr. odrediti poloaj elektrona? Morali bismo ga osvijetliti! No, budui da je elektron vrlo malen, to bismo morali initi u posebnom mikroskopu s dovoljno velikim poveanjem. Ali, ... javlja se tekoa : MIKROSKOPOM SE NE MOGU JASNO VIDJETI OBJEKTI MANJI OD VALNE DULJINE SVJETLOSTI KOJOM IH OSVJETLJAVAMO ( posljedica ogiba svjetlosti na otvoru mikroskopa ). Dakle, svjetlost u kojoj bismo promatrali elektron i njegovu stazu-niz toaka putanje morala bi imati valnu duljinu razmjernu veliini elektrona ( oko 10-16 m ).Tu valnu duljinu ima gama zraenje. Gama zraenea ima vrlo veliku energiju i koliinu gibanja! Zbog toga bi takvo zraenje, pri naletu na elektron, znatno promijenilo stanje gibanja samog elektrona! Ta je promjena svaki puta drugaija, nepredvidiva je u sudaru pojedinanih elektrona s fotonima gama zraenja. ak ni uz savreno dobru aparaturu ne bismo mogli odrediti putanju elektrona uzastopnim osvjetljavanjem i fotografiranjem njegova poloaja. Obimna istraivanja su pokazala da nema izlaza iz tog ogranienja; to je posljedica valno-estine prirode materije. Ni na koji nain nije mogue odrediti tonu putanju estice na razini veliine atoma. OBJEKT ( atomska estica ) I SUBJEKT ( ureaj ) NEODVOJIVO SU POVEZANI UTJECAJEM SUBJEKTA NA OBJEKT U PROCESU MJERENJA i to se ne moe izbjei. Ispitujui svijet atoma, u njemu se moramo odrei uobiajenog pojma putanje, jer je ne moemo izmjeriti, tj. tono odrediti. Ali, zato se ne bi moglo postii da, prilikom procesa mjerenja, jedan atomski objekt tek neznatno djeluje na drugi? Stvar je u tome da su oba, i mjerni ureaj i objekt, u istom kvantnom svijetu. Osnovno je obiljeje kvantnih pojava njihova DISKRETNOST. U tom svijetu nita ne biva sasvim malo meudjelovanje tamo tee u kvantima ili SVE ili NITA. Mi ne moemo po volji slabo djelovati na kvantni sustav sve do nekog trenutka on to djelovanje uope nee osjetiti. Ali, im veliina djelovanja toliko naraste da ju je sustav spreman primiti, to onda obino dovodi do njegovog prijelaza u novo ( takoer kvantno ) stanje, a esto i do njegovog raspada.
11
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
10.Kvantnomehaniki model atoma
( QM model atoma ) Modeli atoma koji su postajali prije QM modela, nisu imali veeg uspjeha u potpunom tumaenju spektara zraenja iz atoma. Bohrov model je mogao protumaiti samo ponaanje H atoma i to u uvjetima ne prejakog vanjskog elektrinog i magnetskog polja. Ipak, zasluge su Bohrovog modela : 1. uvedena je KVANTIZACIJA energije elektrona u atomu broj n kasnije nazvan GLAVNI KVANTNI BROJ 2. izvor zraenja stavljen je u sam atom Loe u Bohrovom modelu bio je pojam staze elektrona i injenica da se tim modelom nisu mogli protumaiti spektri zraenja niti jednog drugog atoma, osim vodikovog atoma. Budui su nam poznate relacije neodreenosti, i barem djelomino njihov smisao, tj. pria o meudjelovanju mjernog ureaja i atomske estice, nee nam biti teko razumjeti razlog uvoenja posebnog naina interpretacije putanje atomske estice, prije svega elektrona. Rekli smo da je elektron ISTODOBNO i estica i val, ali on je zapravo neto tree, to mi NE MOEMO NITI ZAMISLITI. Donekle zorno tumaenje dao je austrijski fiziar Ervin Schrdinger pojam kvantnog elektronskog oblaka, koji je opisan jednadbom gibanja elektrona. (1933.g. dobio Nobelovu nagradu). Uveo je veliinu nazvanu valna funkcija, (psi) . ZORNO ZNAENJE ima samo njena norma ( apsolutna vrijednost ) na kvadrat, koja predstavlja VJEROJATNOST NALAENJA ELEKTRONA U DIJELU VOLUMENA V tzv. kvantni elektronski oblak.
Schrdingerova jednadba je osnovna jednadba u suvremenoj kvantnoj fizici. Na pitanje kako se odvija gibanje u svijetu atoma odgovor daje kvantna fizika : niti kao jednostavno gibanje estice, niti kao jednostavno irenje vala, ve je to gibanje opisano odgovarajuom matematikom funkcijom, tzv. valnom funkcijom . Ona utjelovljuje i valna i estina svojstva materije. Valna funkcija ima svojstvo vala, to upuuje na pojave ogiba i interferencije, a ima i estina svojstva, ali na poseban nain : KVADRAT APSOLUTNE VRIJEDNOSTI VALNE FUNKCIJE U SVAKOJ TOCI PROSTORA DAJE VJEROJATNOST DA ESTICA BUDE u 2 malom djeliu volumena V oko te toke. predoavamo tzv. KVANTNIM OBLAKOM ( na
onom mjestu u kvantnom oblaku na kojem je estica ee vea je gustoa kvantnog oblaka ). VALNA FUNKCIJA NIJE VAL MATERIJE NEGO VAL VJEROJATNOSTI.
12
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
U kvantnoj fizici objekt se moe nalaziti u stanjima samo odreenih energija, a svako je stanje opisano odgovarajuom valnom funkcijom.
pogledajte sliku kvantnog elektronskog oblaka : http://www.quantumintro.com/
pogledajte i ovaj link : http://www.falstad.com/qmatom/
Postoji nekoliko povijesno vanih eksperimenata, koji su doveli do uvoenja novih kvantnih brojeva. Osim glavnog kvantnog broja n, koji je uveden Bohrovom teorijom, uvedena su jo 3 nova kvantna broja : Starkov uinak cijepanje* spektralnih linija H atoma u jakom elektrinom polju ( 107 V ) - uveden je kvantni broj l , orbitalni kvantni broj - radi se o tzv. FINOJ strukturi spektralnih linija
(* cijepanje izmeu dvije susjedne razine energije (spektralne linije) pojavljuju se nove razine (linije)
Zeemanov uinak cijepanje spektralnih linija u jakom magnetskom polju ( 4 T )
- uvodi se kvantni broj m, magnetski kvantni broj - radi se o tzv. superfinoj strukturi spektralnih linija - http://www.mip.berkeley.edu/physics/noteindex.html#zeeman Stern Gerlachov uinak cijepanje spektralnih linija u nehomogenom magnetskom polju - uvodi se magnetski spinski kvantni broj ms
Model atoma je u okviru QM-modela, protumaen temeljem sljedeih injenica : 1) 2) 3) 4) 5) 6) Schrdingerovom jednadbom jednadba gibanja elektrona Heisenbergovim relacijama neodreenosti nepouzdanost mjerenja komplementarnih veliina uvoenjem kvantnih brojeva ( n, l, m i ms ) i izbornih pravila za njih Paulijevim naelom iskljuenja Hundovim pravilom naelom minimuma potencijalne energije
13
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
11. Paulijevo naelo i tumaenje Periodnog sustava elemenata ( PSE )
U QM - modelu, na temelju rezultata eksperimenata sa atomima i rjeavanjem Schrdingerove jednadbe, uvedena su 4 KVANTNA BROJA i njihova IZBORNA PRAVILA.
KVANTNI BROJEVI OZNAKA n l m ms NAZIV glavni kvantni broj orbitalni kvantni broj magnetski orbitalni kv. broj magnetski spinski kvantni broj IZBORNA PRAVILA ( broj moguih stanja elektrona ) 1, 2, 3, ...
ljuske: K,L,M,N,O,P,Q ... podljuske: s,p,d,f,g,h ... kuice strelice u kuicama
0, 1, 2, .... , (n-1) - l,(- l +1), ... -1, 0,+1, ... ,( l +1),l
+ 1 2
1 2
SPIN elektrona : ukljuuje relativistiko ponaanje elektrona i gubi zorno znaenje (Paul Dirac) i nije vrtnja elektrona oko vlastite osi ; Paul Dirac (Nobelova n. 1933.) i Enrico Fermi (Nobelova n.1938.) pronalaze matematiku, statistiku metodu naziva Fermi Diracova raspodjela, koja opisuje nain na koji estice zvane FERMIONI zaposjedaju kvantna energijska stanja. 1 3 5 fermioni estice polucjelobrojnog spina ( , , ,... ) 2 2 2 1 elektron je fermion, mogueg spina : 2
Wolfgang Pauli ( Nobelova n.1945.) je utvrdio da za fermione vrijedi NAELO ISKLJUENJA (1925.g.), koje glasi : U jednom kvantnom stanju, odreenom sa sva 4 kvantna broja , moe se nalaziti samo jedan elektron. ( to je tzv. jednoelektronsko energijsko stanje )
Broj moguih elektronskih stanja u atomu za odreene kvantne brojeve :
KVANTNI BROJEVI Broj moguih stanja ms, m, l , n m, l , n l,n n 1 2 2( 2l +1 )
2 (2l + 1) = 2n 2
l =0 n 1
dodatak :
z- os kvantizacije L zamah, kutna koliina gibanja Ako je vrijednost kvantnog broja =1 tada postoje tri mogue vrijednosti za kvantni broj m i to: 1, 0, 1.
L z =h
=1 L= h [2] m =1
L z =0
L z =h
L L L
=1 L= h [2] m =0 =1 L= h [2] m =1
Skup svih moguih energijskih razina elektrona u atomu naziva se JEDNOELEKTRONSKI SPEKTAR ATOMA, tj. elektronska konfiguracija.
Za potpuno tumaenje jednoelektronskog spektra atoma treba jo znati :
14
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
Hundovo pravilo : Pri popunjavanju orbitala ( npr. px, py, pz ) u stanjima iste energije ( isti l ) broj paralelnih spinova je maksimalan.
Naelo minimuma potencijalne energije svaki fizikalni sustav spontano ( kada je izvan vanjskog utjecaja ) zauzima stanje minimuma potencijalne energije.
Poloaj nekih nivoa je energijski povoljniji, tj. razine se popunjavaju u smjeru poveanja zbroja ( n+ l ), pri emu se razine s jadnakom vrijednou tog zbroja popunjavaju u smjeru poveanja n : ... E(3p) < E(4s) E(3d) < E(4p) < E(5s) E(4d) < E(5p) < E(6s) E(5d) E(4f) ....
Tumaenje i izgradnja periodnog sustava trijumf je kvantne mehanike.
Broj kemijskih elemenata u periodnom sustavu odreen je brojem raspoloivih kvantnih stanja energija elektrona.
ZADACI : 1. Koliko se elektrona moe smjestiti u s-stanje, koliko u p-stanje a koliko u d-stanje ? ( R : s-stanje ima 2 elektrona, p-stanje ima 6, a d-stanje 10 elektrona ) 2. Odredimo redni broj energijske ljuske koja sadri 50 jednoelektronskih stanja ? 50 =5 ) ( R : 50 = 2n2 n = 2
15
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
Shematski prikaz moguih kvantnih stanja elektrona za prve 4 energijske razine :
za n = 1
l=0
m=0
1s2
K ljuska
2s2
n=2
l=0 l=1
m=0
L ljuska
2p6
m=-1 m=0 m=1
3s2
n=3
l=0 l=1 l=2
m=0
3p6
m=-1 m=0 m=1 M ljuska ) m=-2 m=-1 m=0 m=1 m=2
3d10
n=4
l=0 l=1 l=2
m=0
4s2
m=0 m=1
m=-1
4p6
m=-2
m=-1
m=0
m=1
m=2
4d 10
( N ljuska )
l=3
m=-3
m=-2
m=-1
m=0
m=1
m=2
m=3
4f 14
16
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
12. Stimulirana emisija
L light A mplitication by S - timulated E emission of R radiation
Stimulirana emisija zraenja LASERI
http://physics.mef.hr/Predavanja/Laser/index.html
spontana emisija zraenja : atomi uobiajenih izvora svjetlosti ( Sunce, lampe, arulje ... ) zrae nevezano (nekorelirano) jedan s drugim; dakle, JEDAN ATOM ZRAI NEOVISNO O DRUGOM Takvo zraenje je : 1. nekoherentno 2. nepolarizirano nekoherentna 3. izotropno (u svim smjerovima u prostoru oko izvora ) svjetlost 4. male snage ( intenziteta ) stimulirana emisija zraenja - da bi se ostvarila stimulirana emisija potrebno je imati 1. INVERZIJU NASELJENOSTI energijskih razina ( tzv. populacijska inverzija )
vie elektrona ima na vioj energijskoj razini
- inverzija se postie pomou atoma koji imaju tzv. metastabilno stanje 2. atome koji imaju tzv. METASTABILNO STANJE energije, tzv. METASTABILNU RAZINU (NIVO) energije
pojanjenje :
osnovno stanje svakog atoma je stabilno (stacionarno) stanje; ono traje vjeno, ako se atom nalazi daleko od vanjskih utjecaja pobueno stanje je svako ono koje je vie energije od osnovnog; kod veine atoma elektron u pobuenom stanju boravi jako kratko (naelo minimuma potencijalne energije) 10 8 s, tzv. prosjeno vrijeme ivota elektrona u pobuenom stanju Samo neki atomi, pod odreenim uvjetima, posjeduju tzv. metastabilna stanja, a to su ona kojima je >> 10-8s (tzv. dugoivua stanja). prosjeno vrijeme ivota elektrona u pobuenom stanju (metastabilnog stanja) iznosi oko : 10 3 s Postojanjem takvog stanja bit e omogueno ostvariti inverziju naseljenosti, injenicu da je broj elektrona u vioj energijskoj razini VEI od broja elektrona u osnovnom stanju (slika):
N2 > N1 pobuenje time je ostvarena emisija LAVINE fotona , a to je laserska akcija
LASER - Light amplification by stimulated emission of radiation (pojaanje svjetlpsti stimuliranom emisijom zraenja) Laser je kvantni izvor koherentne svjetlosti. Zraenje svih atoma je usklaeno. Fotoni izlazne laserske svjetlosti su: 1. koherentni (jednake frekvencije, jednake faze) 2. polarizirani (jednaka polarizacija) 3. istog smjera irenja 4. velike snage ( mW, ... , GW, TW- tzv. pulsni laseri )
17
koherentna svjetlost
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
Podjela lasera :
a) prema agregatnom stanju aktivne tvari plinski tekui ( tzv. laser s bojilom ) vrsti ( kristalni, amorfni, poluvodiki ) b) prema nainu pobude elektrona na vie energijske razine : optiki ( pobuda se izvodi pomou svjetlosti ) sudarima elektrona i atoma u plinu ozraivanjem estica visokih energija kemijskim reakcijama c) prema nainu rada (zraenja fotona) kontinuirani pulsni
Primjena lasera : medicina; mjerna tehnika; prijenos informacija; ispitivanje i obrada materijala; holografija; znanost; svemirske tehnologije .... Pravci razvoja lasera : XRASER ( laser u podruju x zraka ) GRASER ( laser u podruju - zraka kontrolirana fuzija, 3D slike molekula )
Dodatak : HOLOGRAFIJA : snimanje holograma E ( x, t ) = E 0 (t kx ) rekonstrukcija slike Vano svojstvo : svaki dio holograma u sebi sadri i informacije o cijelom hologramu. http://eskola.hfd.hr/projekt/sp-5/teorija5.html Nobelova nagrada :
1971 Dennis Gabor "za otkrie i razvoj metoda holografije"
He Ne laser
http://physics.mef.hr/Predavanja/Laser/index.html - pripada grupi plinskih lasera - dobiju se fotoni laserske svjetlosti u podruju crvene svjetlosti ( = 632,8nm ) Radi na sljedeem naelu : staklena cijev se napuni mjeavinom He-Ne plinova u odnosu 20:80; neon je medij u kojemu se odvija fizikalni proces emisije laserske svjetlosti na slici dolje je prikazan energijski dijagram za atome He i Ne; struja koja prolazi kroz mjeavinu plinova, kroz sudare atoma He i elektrona iz struje uzrokuju pobudu atoma helija u stanje E3, koje je metastabilno energija stanja helija E3 (20,61 eV) je vrlo blizu energiji neonskog stanja E2 (20,66 eV); stoga, kada se atom helija u stanju E3 sudari s atomom neona u osnovnom stanju E0, energija pobude atoma helija se vrlo esto prenese na atom neona, koji se pobudi u stanjeE2; na ovaj nain neonska energijska razina E2 postane naseljenija elektronima od razine E1 nastala je inverzija naseljenosti energijskih razina Ovu inverziju gustoe naseljenosti je relativno lako izvesti zbog : (1) na poetku je razina E1 skoro potpuno prazna, (2) metastabilnost helijske razine E3 osigurava kontinuirani prijelaz atoma neona na razinu E2 i (3) atomi iz razine E1 vrlo brzo se vraaju (preko meustanja) u osnovno stanje E0
18
Nina Obradovi, prof.
ATOMSKA i KVANTNA FIZIKA
gradivo 4. razreda
E3
E2 E1
laserska cijev = rezonantna upljina
lavina fotona ; STOJNI VAL polupropusno zrcalo ( Brewsterov kut )
Rubinski laser
rubinski laser je napravljen 1960.; sastoji se od rubidijevog tapa duine nekoliko cm, a okruen je helikoidalnom ksenonskom lampom rubin je prozirni kristal Al2O3 koji sadri malu koliinu (oko 0,05 %) kroma Cr3+ koji zamjenjuju Al3+ Cr3+ ima metastabilno stanje ije je vrijeme poluivota 0,003 s ksenonska lampa pobuuje Cr3+ u vie stanje koje se brzo raspada u metastabilno stanje te laserska svjetlost nastaje prijelazom iz tog metastabilnog stanja u osnovno stanje
19
Nina Obradovi, prof.
You might also like
- Fizikalna CvitasDocument527 pagesFizikalna CvitasTia DalmaNo ratings yet
- AV2 - Mehanicki Valovi - Rijeseni Zadaci - CD Grupe PDFDocument6 pagesAV2 - Mehanicki Valovi - Rijeseni Zadaci - CD Grupe PDFmuzicarNo ratings yet
- NUKLEARNA - FIZIKA - SkripteDocument21 pagesNUKLEARNA - FIZIKA - SkripteMatija Pevec100% (1)
- RELATIVNOST-PTR - SkripteDocument33 pagesRELATIVNOST-PTR - SkripteMatija Pevec100% (4)
- Fizika - MagnetizamDocument4 pagesFizika - MagnetizamDcx0800100% (1)
- Obrazložena Rješenja Zadataka S Prošlih Matura - FizikaDocument174 pagesObrazložena Rješenja Zadataka S Prošlih Matura - FizikaSanjar1961No ratings yet
- Fizika 3 Pitanja I Zadatci Za Modul 4Document9 pagesFizika 3 Pitanja I Zadatci Za Modul 4Matea DugandžićNo ratings yet
- Određivanje Gustoće Tekućine Pomoću UzgonaDocument6 pagesOdređivanje Gustoće Tekućine Pomoću Uzgonamislav bogdanNo ratings yet
- Mehanika 1 - TeorijaDocument10 pagesMehanika 1 - TeorijaTomo Ajkula Stanić100% (1)
- Pitanja I Odgovori Za Usmeni Ispit Iz OsnovaDocument89 pagesPitanja I Odgovori Za Usmeni Ispit Iz Osnovasipe50% (2)
- ATOMSKA-kvantna - Fizika - SkripteDocument19 pagesATOMSKA-kvantna - Fizika - SkripteMatija Pevec100% (1)
- 32 Interferencija Svjetlosti Na Tankim Prozirnim SlojevimaDocument7 pages32 Interferencija Svjetlosti Na Tankim Prozirnim SlojevimaKasim SmajićNo ratings yet
- Elektromagnetizam - Rijeseni Zadaci PDFDocument11 pagesElektromagnetizam - Rijeseni Zadaci PDFAmerNo ratings yet
- Osnove Elektortehnike-Usmeni AdobeDocument12 pagesOsnove Elektortehnike-Usmeni AdobeFenris VanagandrNo ratings yet
- Skripta - ELEKTROSTATIKADocument16 pagesSkripta - ELEKTROSTATIKARobert WeissNo ratings yet
- ELEKTROSTATIKADocument25 pagesELEKTROSTATIKADario ĐurićNo ratings yet
- Fizika II (Pomak)Document15 pagesFizika II (Pomak)Tchuxy100% (1)
- FizikaDocument7 pagesFizikarobi robiNo ratings yet
- Fizika - Priprema Za Drzavnu MaturuDocument45 pagesFizika - Priprema Za Drzavnu Maturusweet_andy100% (1)
- Fizika III (Pomak)Document22 pagesFizika III (Pomak)Tchuxy100% (2)
- Skripta OF1 1Document66 pagesSkripta OF1 1jasamfaca3No ratings yet
- Toplina - SkripteDocument19 pagesToplina - SkripteMatija Pevec100% (1)
- Optika - Rijeseni ZadaciDocument12 pagesOptika - Rijeseni ZadaciJason BellNo ratings yet
- MagnetizamDocument6 pagesMagnetizamTiffany007No ratings yet
- Prirucnik Za Upis Na MedDocument39 pagesPrirucnik Za Upis Na MedIlijana NiksicNo ratings yet
- Amperova SilaDocument2 pagesAmperova SilaSlivkiNo ratings yet
- 08 Heisenbergove Relacije NeodredenostiDocument8 pages08 Heisenbergove Relacije NeodredenostiTijana MrdakovicNo ratings yet
- MitozaDocument3 pagesMitozaMemet-AbiNo ratings yet
- Pregled MagnetizamDocument2 pagesPregled MagnetizamAdnanAdoHasicNo ratings yet
- Kvantno Mehanički Model AtomaDocument20 pagesKvantno Mehanički Model AtomaRen Dom100% (1)
- Biologija - DMDocument122 pagesBiologija - DMEmilio Nemčić0% (1)
- TM KinematikaDocument3 pagesTM KinematikaSnježana Kučić-MirkovićNo ratings yet
- ZadaciDocument1 pageZadaciMilena RakinNo ratings yet
- Fizika OoioDocument9 pagesFizika Ooioopsad0as0as100% (1)
- 1 Uvod I ValoviDocument111 pages1 Uvod I ValoviDomagoj MagašNo ratings yet
- Predstava Hamleta u selu Mrduša Donja: Groteskna tragedija u pet slikaFrom EverandPredstava Hamleta u selu Mrduša Donja: Groteskna tragedija u pet slikaNo ratings yet
- Fiz 2Document9 pagesFiz 2Adnan ColoNo ratings yet
- Kvantna FizikaDocument13 pagesKvantna FizikaSara KocijanNo ratings yet
- Toplotno ZračenjeDocument2 pagesToplotno ZračenjeAdel MustaficNo ratings yet
- Fizika FinalnoDocument10 pagesFizika FinalnoBakir PanjetaNo ratings yet
- Toplotno ZračenjeDocument1 pageToplotno Zračenjemilica jurukovskiNo ratings yet
- Toplotno ZracenjeDocument24 pagesToplotno ZracenjeAdis EfendicNo ratings yet
- Kvantna FizikaDocument5 pagesKvantna FizikaDaris SmajovicNo ratings yet
- Uvod U Modernu Fiziku PDFDocument80 pagesUvod U Modernu Fiziku PDFplfratarNo ratings yet
- FotoEfekt - Prezentacija Za Srednju ŠkoluDocument31 pagesFotoEfekt - Prezentacija Za Srednju ŠkoluKristijan karic100% (1)
- Kvantna MehanikaDocument31 pagesKvantna Mehanikaanitamodric63100% (1)
- 3.2 OptikaDocument147 pages3.2 OptikaAmiraNo ratings yet
- 3-Kvantna Priroda SvjetlostiDocument29 pages3-Kvantna Priroda SvjetlostiKesić ĐorđeNo ratings yet
- Elektronska Struktura AtomaDocument22 pagesElektronska Struktura AtomasabinaNo ratings yet
- FizikaDocument5 pagesFizikalisa.radicevicNo ratings yet
- Fizika 2 Kolokvij NeobaveznaDocument18 pagesFizika 2 Kolokvij Neobaveznabvfhjzl kscsNo ratings yet
- Fizika (Modeli Atoma) PDFDocument7 pagesFizika (Modeli Atoma) PDFSara JozićNo ratings yet
- Uvod U Modernu FizikuDocument118 pagesUvod U Modernu FizikudamirepicNo ratings yet
- Fizika 2 Kolokvij ObaveznaDocument9 pagesFizika 2 Kolokvij Obaveznabvfhjzl kscsNo ratings yet
- Fizika 2Document1 pageFizika 2gugubabaduduNo ratings yet
- 14 Bohr Model Atom ADocument8 pages14 Bohr Model Atom Apilas_nikolaNo ratings yet
- Predavanje FizDocument12 pagesPredavanje FizGoran DiklićNo ratings yet
- Najbitnija Pitanja Iz Opće I Anorganske KemijeDocument31 pagesNajbitnija Pitanja Iz Opće I Anorganske KemijeVedran PetrićNo ratings yet
- Zakocno Rendgensko Zracenje, Fotoelektricni Efekat, Comptonov EfekatDocument11 pagesZakocno Rendgensko Zracenje, Fotoelektricni Efekat, Comptonov EfekatEtf_Unsa100% (1)