Professional Documents
Culture Documents
Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3
Uploaded by
Abdellah FaqdaniOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3
Uploaded by
Abdellah FaqdaniCopyright:
Available Formats
سلسلة تمارين التتبع الزمني لتحول كيميائي ــ سرعة التفاعل ثانو ية القدس التأهيلية ــ الشماعية
د :سريبة هشام الفئة المستهدفة :الثانية بكالور يا المدير ية الإقليمية اليوسفية
التمرين 1
يهدف هدا التمرين إلى دراسة حركية خليط تفاعلي يتكون بدئيا من الحجم V 1 50mlمن حمض الأوكساليك C 2 H 2O 4تركيزه
C1 2,1.102 mol .l 1وحجما V 2 50mlمن محلول محمض لثنائي كرومات البوتاسيوم 2k aq Cr2O 72aq تركيزه
C 2 102 mol .l 1ننمدج هدا التفاعل بالمعادلة ال كيميائية التالية :
Cr2O72aq 3C 2 H 2O 4aq 8H aq 2Cr 3aq 6CO 2 g 7H 2Ol
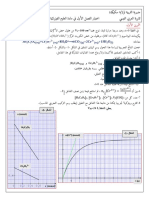
نتتبع تطور تركيز أيونات ال كروم Cr 3 بالمعايرة فنحصل على المنحنى أسفله.
– 1حدد المزدوجتين المتدخلتين في هدا التفاعل واكتب نصف المعادلة المقرون بكل مزدوجة.
– 1 – 2أنشئ الجدول الوصفي للتفاعل.
– 2 – 2حدد المتفاعل المحد والتقدم الأقصى . x max
– 3نأخد حجما V 10mlمن الوسط التفاعلي بالنسبة لكل معايرة.
– 1 – 3ما الطر يقة المتبعة لتوقيف التفاعل المدروس خلال المعايرة ؟ .
- 2 – 3أوجد تعبير السرعة الحجمية vلتفاعل بدلالة . Cr 3
- 3 – 3أحسب قيمة السرعة الحجمية عند اللحظة . t 250s
– 4 – 3عرف زمن نصف التفاعل t 1ثم عين قيمته.
2
– 4أدكر طر يقة أخرى تمكن من تتبع هدا التحول .
التمرين 2
2
S 2Oتفاعل كلي وبطيء ننمدجه بالمعادلة التالية. 8 aq Iبايونات ثيوكبريتات aq أكسدة أيونات اليودور
S 2O82aq 2I aq 2SO 42aq I 2aq
لدراسة هدا التحول ،نمزج في لحظة t 0Sحجما V 1 40mlمن محلول مائي ليودور البوتاسيوم K aq I aq تركيزه
1
C 1 0.20mol .lمع حجم V 2 40mlمن محلول مائي لثيوكبريتات البوتاسيوم
2
2K aq S 2O8 aq تركيزه . C 2 0.05mol .l
1
في بداية التجربة الخليط التفاعلي عديم اللون ثم يتغير تدر يجيا إلى ان يصبح لونه بنيا.
-1بما يفسر ظهور اللون البني في الخليط التفاعلي؟.
-2حدد المزدوجتين Ox Re dالمتدخلتين في هدا التفاعل.
2
كمية المادة البدئية للأيونات . S 2O8 aq -3أحسب n1كمية المادة البدئية للأيونات I aq و n 2
-4أنشئ الجدول الوصفي لتفاعل.
واستنتج المتفاعل المحد. x max -5حدد قيمة التقدم الأقصى
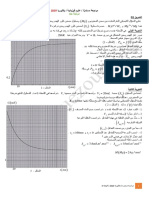
. t بدلالة الزمن x -6النتائج المحصل عليها خلال 50minالأولى مكنت من خط منحنى تطور تقدم التفاعل
باعتمادك على المنحنى:
موضحا ال كيفية المتبعة. – 1 - 6حدد زمن نصف التفاعل t 1
2
- 2- 6أحسب السرعة الحجمية البدئية لتفاعل
1 d I d S 2O82
.v v و - 3 – 6بين أنه يمكن التعبير عن السرعة الحجمية لتفاعل بالعلاقتين :
2 dt dt
التمرين 3
You might also like
- Révision BAC 2018Document172 pagesRévision BAC 2018ZineChini100% (5)
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- 1 6Document5 pages1 6azizNo ratings yet
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- Exos BelkacemDocument4 pagesExos BelkacemMilia dyNo ratings yet
- Dzexams Docs 3as 907415Document5 pagesDzexams Docs 3as 907415abdouh4214No ratings yet
- Suivi TemporelDocument3 pagesSuivi Temporelmourafiq faysal100% (1)
- Bbl13 BouzidDocument7 pagesBbl13 Bouzidcylia ciciNo ratings yet
- Exam 2021Document2 pagesExam 2021سمير دبيليNo ratings yet
- 1975Document7 pages1975nounoussyanNo ratings yet
- تمرين حول حجم غاز,Document2 pagesتمرين حول حجم غاز,Achref SaidNo ratings yet
- Local Media144796206Document42 pagesLocal Media144796206Rawae SahraouiNo ratings yet
- سلسلة وحدة المتابعة الزمنية لتحول كيميائي التصحيح النموذجيDocument46 pagesسلسلة وحدة المتابعة الزمنية لتحول كيميائي التصحيح النموذجيAmine AtchiNo ratings yet
- سلسلة وحدة المتابعة الزمنية لتحول كيميائي التصحيح النموذجيDocument19 pagesسلسلة وحدة المتابعة الزمنية لتحول كيميائي التصحيح النموذجيNihadNo ratings yet
- سلسلة التتع الزمني لتحول 9Document1 pageسلسلة التتع الزمني لتحول 9Haroun SamihNo ratings yet
- Série 3 $ Suivi Temporel D'une Transformation 2bac ArDocument4 pagesSérie 3 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- Compo116 AhmedDocument2 pagesCompo116 AhmedAymen DjellalNo ratings yet
- اختبار يحتوي تمرين معايرة س2Document2 pagesاختبار يحتوي تمرين معايرة س2mouad drouicheNo ratings yet
- 8Document2 pages8e.maskarNo ratings yet
- Compo114Ter LahmarDocument6 pagesCompo114Ter Lahmarعبد العزيز مروىNo ratings yet
- تمرين في الناقلية مع الحلDocument4 pagesتمرين في الناقلية مع الحلferiel taibiNo ratings yet
- سلسلة تمارين 1Document5 pagesسلسلة تمارين 1lisaNo ratings yet
- المتابعة الزمنية لتفاعل كيميائي في وسط مائيDocument28 pagesالمتابعة الزمنية لتفاعل كيميائي في وسط مائيSimokiskiNo ratings yet
- Tamarind As - U7 - Oxred - 2023Document3 pagesTamarind As - U7 - Oxred - 2023Ma RyNo ratings yet
- تمارين مرشحة لبكالوريا 2019 وحدة أكسدة ارجاعDocument5 pagesتمارين مرشحة لبكالوريا 2019 وحدة أكسدة ارجاعquelafamile dzNo ratings yet
- Sujets DEBILIDocument29 pagesSujets DEBILIسمير دبيليNo ratings yet
- 4 5879874055732990293Document5 pages4 5879874055732990293Loup le DésertNo ratings yet
- الوحدة 01 السلسلة 01Document3 pagesالوحدة 01 السلسلة 01Manil FélixNo ratings yet
- الموضوع رقم 1Document4 pagesالموضوع رقم 1Espoire Lavie0% (1)
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- سلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياDocument1 pageسلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياKhalid100% (1)
- التتبع الزمني لتحول كيميائي - سرعة التفاعلDocument6 pagesالتتبع الزمني لتحول كيميائي - سرعة التفاعلAmine taikNo ratings yet
- Kichah ExoacideDocument2 pagesKichah Exoacidekhalil75No ratings yet
- Physics 3mtm16 3trim2Document16 pagesPhysics 3mtm16 3trim2الصحبة الصالحةNo ratings yet
- 17Document9 pages17LaziriAbdelhalimNo ratings yet
- ثالثة ع ت التبسيDocument2 pagesثالثة ع ت التبسيWissam GouasmiaNo ratings yet
- Serie2as - U7 - Oxred - 2023Document3 pagesSerie2as - U7 - Oxred - 2023abdenouraitchikh27No ratings yet
- يتفاعل الزنك مع محلول حمض الكبريتيكDocument1 pageيتفاعل الزنك مع محلول حمض الكبريتيكanon-774739100% (2)
- ch2 4-Suivi D'une Transformation Chimique ActivitéDocument2 pagesch2 4-Suivi D'une Transformation Chimique ActivitéRachid SadNo ratings yet
- 5Document4 pages5e.maskarNo ratings yet
- الوحدة 01 سلسلة 01 السنة ثالثةDocument2 pagesالوحدة 01 سلسلة 01 السنة ثالثةÊš PőîřNo ratings yet
- سلسلة المراجعة في عطلة الشتاءDocument13 pagesسلسلة المراجعة في عطلة الشتاءFouad Ayadi100% (1)
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- Compo213ab MatmarDocument6 pagesCompo213ab MatmarmeriemNo ratings yet
- السلسلة 4Document2 pagesالسلسلة 4Sami RabhiNo ratings yet
- التتبع الزمني لتحول كميائي سرعة التفاعلDocument10 pagesالتتبع الزمني لتحول كميائي سرعة التفاعلalmuslim80% (5)
- سلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021Document16 pagesسلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021سمير دبيليNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- نمادج للباكالوريا الماء الأوكسيجينيDocument2 pagesنمادج للباكالوريا الماء الأوكسيجينيBrahim TomzineNo ratings yet
- Mentouri AinMlilaDocument2 pagesMentouri AinMlilamohamed rezigNo ratings yet
- التتبع الزمني لتحول كيميائيDocument8 pagesالتتبع الزمني لتحول كيميائيYou ZbirNo ratings yet
- lateur1الأختبار الثاني 2008-2009 الجزائرDocument2 pageslateur1الأختبار الثاني 2008-2009 الجزائرassembleur7777100% (1)
- موضوع مقترح 01Document3 pagesموضوع مقترح 01louay11999999No ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)
- سلسلة تمارين 2Document6 pagesسلسلة تمارين 2lisaNo ratings yet
- سلسلة تمارينDocument6 pagesسلسلة تمارينMalak ElaichouchiNo ratings yet
- استرة كواكب دورانDocument2 pagesاسترة كواكب دورانSIMO FORNo ratings yet
- ExoU4 HAADocument4 pagesExoU4 HAAvbzrgNo ratings yet
- التحولات ح,ق و الكهرباءDocument1 pageالتحولات ح,ق و الكهرباءYassine0% (1)
- 2Document1 page2Abdellah FaqdaniNo ratings yet
- 2Document1 page2Abdellah FaqdaniNo ratings yet
- الثورات الإجتماعية و السياسيةDocument2 pagesالثورات الإجتماعية و السياسيةAbdellah FaqdaniNo ratings yet
- ابدؤها بقول بسم الله - شعرDocument3 pagesابدؤها بقول بسم الله - شعرAbdellah FaqdaniNo ratings yet
- Aldoal Alaslia Slsla Altmarin 1Document2 pagesAldoal Alaslia Slsla Altmarin 1Abdellah FaqdaniNo ratings yet
- 2Document1 page2Abdellah FaqdaniNo ratings yet
- أشكال استغلال الإنسان للمجال في الأريافDocument2 pagesأشكال استغلال الإنسان للمجال في الأريافAbdellah Faqdani100% (1)
- السلسلة الخامسة في درس الموجات الميكانيكية السنة الثانية بكالورياDocument6 pagesالسلسلة الخامسة في درس الموجات الميكانيكية السنة الثانية بكالورياAdnan Ait BaddazNo ratings yet
- 11NR15Document1 page11NR15Abdellah FaqdaniNo ratings yet
- الكوارت الطبيعية تعريفها وأنواعهاDocument1 pageالكوارت الطبيعية تعريفها وأنواعهاAbdellah FaqdaniNo ratings yet
- IssalSalek NazmDocument6 pagesIssalSalek NazmAbdellah FaqdaniNo ratings yet
- Alfrdh 1 Nmothj 1 Alriadhiat Aola Bak Alom Tjribia Aldora Alaola Altshih 2Document3 pagesAlfrdh 1 Nmothj 1 Alriadhiat Aola Bak Alom Tjribia Aldora Alaola Altshih 2Abdellah FaqdaniNo ratings yet
- Série 1 - Ar Travail Et Puissance D'une ForceDocument1 pageSérie 1 - Ar Travail Et Puissance D'une ForceAbdellah FaqdaniNo ratings yet
- المتتاليات العدديةDocument8 pagesالمتتاليات العدديةAbdellah FaqdaniNo ratings yet
- المتتاليات العددية PDFDocument8 pagesالمتتاليات العددية PDFAbdellah FaqdaniNo ratings yet
- 1Document1 page1Abdellah FaqdaniNo ratings yet
- PC Rabat Sale Kenitra 2019 (WWW - Pc1.ma) PDFDocument3 pagesPC Rabat Sale Kenitra 2019 (WWW - Pc1.ma) PDFAbdellah FaqdaniNo ratings yet
- Série 2 - Ar Travail Et Puissance D'une ForceDocument1 pageSérie 2 - Ar Travail Et Puissance D'une ForceAbdellah FaqdaniNo ratings yet
- 2Document1 page2Abdellah FaqdaniNo ratings yet
- Ku 9376Document3 pagesKu 9376Abdellah FaqdaniNo ratings yet
- Alfrdh 1 Nmothj 1 Alriadhiat Aola Bak Alom Tjribia Aldora Alaola Altshih 2 PDFDocument3 pagesAlfrdh 1 Nmothj 1 Alriadhiat Aola Bak Alom Tjribia Aldora Alaola Altshih 2 PDFAbdellah FaqdaniNo ratings yet
- PLC 2Document87 pagesPLC 2NM HKNo ratings yet
- Primaire Orale 2020 PDFDocument77 pagesPrimaire Orale 2020 PDFAbdellah FaqdaniNo ratings yet
- Cour Wajibona Nahwa Arasol Fi Rihab 2bacDocument3 pagesCour Wajibona Nahwa Arasol Fi Rihab 2bacAbdellah FaqdaniNo ratings yet