Professional Documents
Culture Documents
Rev U12022
Uploaded by
Islam668Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Rev U12022
Uploaded by
Islam668Copyright:
Available Formats
21 / 01 / 2022 مراجعة عامة للوحدة األولى
التمرين 01
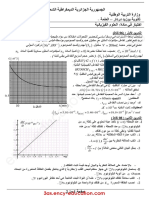
y غير النقي ( يحتوي على شوائب ال تؤثّر على التفاعل ) .نغمرها عند اللحظة t = 0في محلول صفيحة كتلتها m = 1,3gمن التوتياء )( Zn
0,275
حجمه V = 100 mLوتركيزه المولي . C = 0, 2 mol / Lالثنائيتان المتفاعلتان هما Zn2+ / Znو . I 2 / I − ) ( I2 مائي لثنائي اليود
0,25 – 1اكتب معادلة هذا التفاعل ،وأنشئ جدول التقدّم .
0,225 - 2إن متابعتنا لهذا التحول الكيميائي التام م ّكنتنا من تمثيل البيان ) . I 2 = f (t
0,2 أ) هل نعتبر هذا التفاعل سريعا ؟ علّل .
GUEZOURI ب) اقترح طريقة واصفا فيها البروتوكول التجريبي المتّبع لمعايرة ثنائي
0,175
اليود في المزيج المتفاعل ،مع ذكر الكواشف المستعملة والزجاجيات
0,15 الضرورية لذلك .
جـ) احسب قيمة التقدم األعظمي .
0,125
– 3احسب السرعة الحجمية للتفاعل عند اللحظة . t = 0
0,1
- 4بيّن أن التركيز المولي لثنائي اليود عند اللحظة t = t1/ 2يُكتب بالشكل :
0,075 C + I2 f
، I 2 (tثم استنتج من البيان قيمة . t1/ 2 )
=
0,05
1/ 2
2
- 5جد التركيب المولي للمزيج عند اللحظة . t = t1/ 2
0,025
– 6جد درجة نقاوة صفيحة التوتياء .
0y 100 M ( Zn
100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 ) = 1700
1600 65, 4 g /xmol
1,1 التمرين 02
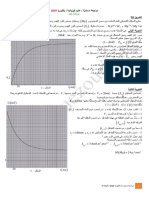
( H 3O , Clهو تفاعل بطيء وتام .
+ −
) إن تفاعل مسحوق األلمنيوم ) ( Alمع محلول حمض كلور الهيدروجين
1
نضيف كميّة كتلتها 𝑔 𝑚 = 1,35من مسحوق األلمنيوم إلى محلول مائي لحمض كلور الهيدروجين حجمه 𝐿𝑚 𝑉 = 200وتركيزه المولي
0,9 ] . 𝐶 = [𝐻3 𝑂+
التفاعل الحادث هو ، 2 Al + 6 H 3O + = 2 Al 3+ + 3H 2 + 6 H 2O :في درجة حرارة ثابتة .
0,8 نتابع التحول ابتداء من اللحظة ، t = 0وذلك بحساب التركيز المولي لشوارد H 3O +
0,7
GUEZOURI في المزيج من حين آلخر .نمثّل البيان ) H 3O + = f ( t
0,6 – 1أنشئ جدول التقدم ،وبيّن أن المزيج في شروط ستوكيومترية .
C
0,5 = ، H 3O + ثم استنتج قيمة . t1/ 2 – 2بيّن أنه عند t = t1/ 2يكون
2
1 d H 3O
0,4 +
. vvol =− – 3بيّن أن السرعة الحجمية للتفاعل تُكتب بالشكل :
0,3
6 dt
احسب قيمتها عند اللحظة . t = 0
0,2
0,1
0,1
0 2,5 5 7,5 10 12,5 15 17,5 20 22,5 25 27,5 30 32,5 35 37,5 40 42,5 x
مراجعة عامة للوحدة األولى /دروس الدعم /نوفمبر 2022 1
التمرين ( 03تجريبي)
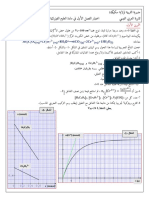
نتابع تطور التفاعل بين ماء جافيل وشوارد اليود ،وذلك عن طريق معايرة ثنائي اليود الناتج .األدوات والمحاليل المستعملة :
-مــاء ّ
مقطر ،قطع جليدية ،صمغ النشاء . -بياشر 250mL ، 200mL ، 100mL
-مــاء جافيل ) (𝑁𝑎+ , 𝐶𝑙𝑂−تركيزه C1 = ClO − = 1 mol / L مدرجة 50 mL
-سحــاحة ّ
صات سعاتها 20mL ، 10mL
-ما ّ
(
C2 = I − = 0,2 mol / L ، K + ,I − ) -محلول يود البوتاسيوم
-أنابيب اختبار
y ( +
2Na ,S 2O3تركيزه المولي 2−
-محلول ثيوكريتات الصوديوم ) -حوض
55 C3 = S 2O3 2− = 0,04 mol / L
50
نأخذ حجما V1 = 50 mLمن ماء جافيل ،ونضيف له قطرات من حمض اإليثـانويك (ال يتغير الحجم) .حمض اإليثانويك يلعب دور وسط .
45
نمزج هذا الحجم مع حجم V2 = 50 mLمن يود البوتاسيوم .
40
نقسّم المزيج بالتساوي في 10أنابيب اختبار ،ونضعها في حمـام مائي درجته ثـابتة ،وذلك عند اللحظة ( t = 0بدء التفاعل) .
35 في اللحظة tنخرج األنبوب األول ونضعه في الثلج المه ّ
شم ،ثم نعاير ثنائي اليود الموجود فيه بواسطة محلول ثيوكريتات الصوديوم .
30 نكرر التجربة مع األنابيب األخرى في لحظات أخرى ونسجل في كل تجربة
ّ
حجم محلول ثيوكريتات الصوديوم ) (VEالالزم للتكافؤ .
25
نمثّل بيانيا V Eبداللة الزمن .
20
– 1اقترح الطريقة التي نحضر بها حجما V ' = 200 mLمن ماء جافيل
15 C1
= ' . C1 السابق بتركيز
20
10
– 2اكتب معادلة تفاعل ماء جـافيل مع يود البوتاسيوم .
5
الثنائيتان المتفاعلتان هما I 2 / I − :و . ClO − / Cl −
0 200
200 400 600 800 1000 1200 1400 1600 1800 2000 2200 2400 2600 2800 3000 3200 3400 x
– 3أنشئ جدول التقدّم وجد العالقة بين التقدّم ) ( xوكميّة مادة ثنائي اليود I 2في اللحظة . t
–4
أ) اكتب معادلة تفاعل المعايرة .نستعمل الثنائيتين I 2 / I − :و . S 4O6 2− / S 2O3 2−ثم صف البروتوكول التجريبي لهذه المعايرة .
ب) بين أن كمية مادة ثنــائي اليود في المزيج تكتب بالعالقة . n ( I 2 ) = 5 C3VE
جـ) كيف نحدّد لحظة التكافؤ ؟
– 5حدّد زمن نصف التفاعل ) . ( t1 / 2
– 6احسب السرعة الحجمية للتفاعل في المزيج المتفاعل عند اللحظة . t = 400 s
مراجعة عامة للوحدة األولى /دروس الدعم /نوفمبر 2022 2
التمرين 04
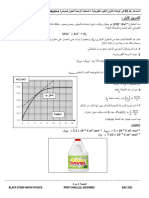
y هو تفاعل بطيء في البرودة . ( Na +
, OH −
) (CH COO − C Hوهيدروكسيد الصوديوم )
3 2 5 إن تفاعل التصبّن بين إيثانوات اإليثيل
2,75 معادلة التفاعل هي CH3COO − C2 H5 + OH = CH3COO− + C2 H 5OH
−
نمزج عند n0 mol t = 0من هيدروكسيد الصوديوم و n0 molمن
2,5
. CH3COO − C2 H5حجم المزيج . V =100 mL
2,25 نقوم بقياس الناقلية النوعية للمزيج في لحظات مختلفة ونمثل البيان ) . = f ( t
- 1أنشئ جدول التقدم لهذا التفاعل .
2 - 2جد ) ( 0الناقلية النوعية للمزيج عند t = 0بداللة :
، OH − ، Na + ، V ، n0ثم احسب قيمة . n0
1,75
- 3بيّن أن تفاعل التصبن هو تفاعل تام .
-4
1,5
أ) بين أن في اللحظة tيكتب التقدم الكيميائي بالشكل :
C0V
1,25 = ، xحيث 0و fهما الناقليتان النوعيتان قبل بدء ) ( − t
0 − f 0
1 التفاعل وعند نهاية التفاعل .
910 ب) احسب تقدّم التفاعل عند اللحظة . t = 40 mn
0,75 عرف السرعة الحجمية للتفاعل .
جـ) ّ
0,5 د) جد السرعة الحجمية للتفاعل عند اللحظة . t = 0
يُعطى ، OH − = 20 mS .m2 .mol −1 ، Na+ = 5 mS .m2 .mol −1 :
0,25
250
CH COO− = 4 ,1mS .m2 .mol −1
3
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 x
مراجعة عامة للوحدة األولى /دروس الدعم /نوفمبر 2022 3
You might also like
- Compo116 AhmedDocument2 pagesCompo116 AhmedAymen DjellalNo ratings yet
- Bac2023 Ytb Unite 01 03Document2 pagesBac2023 Ytb Unite 01 03استاذك في الفيزياءNo ratings yet
- Exos BelkacemDocument4 pagesExos BelkacemMilia dyNo ratings yet
- Alttba Alzmni Llthol Sraa Altfaal Anshta 1Document3 pagesAlttba Alzmni Llthol Sraa Altfaal Anshta 1Raja AferyadNo ratings yet
- موضوع مقترح 01Document3 pagesموضوع مقترح 01louay11999999No ratings yet
- 8Document2 pages8e.maskarNo ratings yet
- فرض رقم 2 السنة الثانية ع - فيزيائيةDocument2 pagesفرض رقم 2 السنة الثانية ع - فيزيائيةالغزيزال الحسن EL GHZIZAL Hassane100% (5)
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- تمرين حول حجم غاز,Document2 pagesتمرين حول حجم غاز,Achref SaidNo ratings yet
- Bbl13 BouzidDocument7 pagesBbl13 Bouzidcylia ciciNo ratings yet
- تقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيDocument2 pagesتقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيNa LineNo ratings yet
- lateur1الأختبار الثاني 2008-2009 الجزائرDocument2 pageslateur1الأختبار الثاني 2008-2009 الجزائرassembleur7777100% (1)
- Physics 3se19 1trim4Document4 pagesPhysics 3se19 1trim4Nadia Bougherira100% (1)
- BBL AbedDocument4 pagesBBL Abedعبد العزيز مروىNo ratings yet
- Cmpo1 WadiDocument4 pagesCmpo1 Wadiعبد العزيز مروىNo ratings yet
- السلسلة 4Document2 pagesالسلسلة 4Sami RabhiNo ratings yet
- 1799693 فرض رقم 2 السنة الثانية ع فيزيائيةDocument2 pages1799693 فرض رقم 2 السنة الثانية ع فيزيائيةessadikine anassNo ratings yet
- الموضوع 01Document3 pagesالموضوع 016qqps4tsq5No ratings yet
- Dzexams Docs 3as 907415Document5 pagesDzexams Docs 3as 907415abdouh4214No ratings yet
- Série 3 $ Suivi Temporel D'une Transformation 2bac ArDocument4 pagesSérie 3 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- SolCompo2 Biskra3Document4 pagesSolCompo2 Biskra3amine milanoNo ratings yet
- Dzexams Uploads Sujets 1021979Document5 pagesDzexams Uploads Sujets 1021979Kerboub IdrisNo ratings yet
- ثالثة ع ت التبسيDocument2 pagesثالثة ع ت التبسيWissam GouasmiaNo ratings yet
- 1975Document7 pages1975nounoussyanNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- Physics 3se18 1trim4Document3 pagesPhysics 3se18 1trim4Mohamed LoghbiNo ratings yet
- باقة تمارين - الحلول الوحدة الأولى المفصلة للأستاذ فرقاني فارس - من رفع عقبة بن نافعDocument77 pagesباقة تمارين - الحلول الوحدة الأولى المفصلة للأستاذ فرقاني فارس - من رفع عقبة بن نافعmeriomaffNo ratings yet
- SujetB SidiAich 3trimDocument5 pagesSujetB SidiAich 3trimomdabdouNo ratings yet
- المتابعة الزمنية لتفاعل كيميائي في وسط مائيDocument28 pagesالمتابعة الزمنية لتفاعل كيميائي في وسط مائيSimokiskiNo ratings yet
- Examin 000Document2 pagesExamin 000dam 12No ratings yet
- Revision 1Document6 pagesRevision 1habaniNo ratings yet
- Physics 3se20 1trim7 PDFDocument6 pagesPhysics 3se20 1trim7 PDFnino ninoNo ratings yet
- Mentouri AinMlilaDocument2 pagesMentouri AinMlilamohamed rezigNo ratings yet
- تقويم الوحدة 2024Document4 pagesتقويم الوحدة 2024widad doudiNo ratings yet
- Composition de Physique 3AS - Sujet 04Document2 pagesComposition de Physique 3AS - Sujet 04Hasan RajawiNo ratings yet
- فيزياء - الموضوع التحضيري 01 التصحيح للفصل الأول - نافع - بكالوريا 2022Document12 pagesفيزياء - الموضوع التحضيري 01 التصحيح للفصل الأول - نافع - بكالوريا 2022Ahmed FerdjiouiNo ratings yet
- التتبع الزمني لتحول كيميائيDocument8 pagesالتتبع الزمني لتحول كيميائيYou ZbirNo ratings yet
- سلسلة التتع الزمني لتحول 9Document1 pageسلسلة التتع الزمني لتحول 9Haroun SamihNo ratings yet
- exU1Ter JellouDocument7 pagesexU1Ter JellouAymen DjellalNo ratings yet
- Dzexams 2as Physique 828488Document3 pagesDzexams 2as Physique 828488Mohamed MohamedNo ratings yet
- Bac Hebdo 13Document2 pagesBac Hebdo 13Lydia AmiratNo ratings yet
- السلسلة رقم 02 في الوحدة الأولىDocument4 pagesالسلسلة رقم 02 في الوحدة الأولىzineeddine0750No ratings yet
- تمارين من الوحدة الاولى PDFDocument5 pagesتمارين من الوحدة الاولى PDFzakkou100% (1)
- Aspirateur) (214 Geiger-Muller 211 t = 0 A (t) ) لكشلا 1) N (t) m (t) = m e m t=0Document4 pagesAspirateur) (214 Geiger-Muller 211 t = 0 A (t) ) لكشلا 1) N (t) m (t) = m e m t=0سوسو officielNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- التتبع الزمني لتحول كميائي سرعة التفاعلDocument10 pagesالتتبع الزمني لتحول كميائي سرعة التفاعلalmuslim80% (5)
- 1 PDFDocument14 pages1 PDFDjom AnaNo ratings yet
- Controle1pc s1 2018 (WWW - Pc1.ma)Document2 pagesControle1pc s1 2018 (WWW - Pc1.ma)imad azhariNo ratings yet
- التتبع الزمني لتحول كيميائي - سرعة التفاعلDocument6 pagesالتتبع الزمني لتحول كيميائي - سرعة التفاعلAmine taikNo ratings yet
- 4 5879874055732990293Document5 pages4 5879874055732990293Loup le DésertNo ratings yet
- Dzexams 2as Physique As - E2 20201 1467236 1Document5 pagesDzexams 2as Physique As - E2 20201 1467236 1Oussama ChaïbNo ratings yet
- التتبع الزمني الموجات الضوئية و الصوتيةDocument2 pagesالتتبع الزمني الموجات الضوئية و الصوتيةYassineNo ratings yet
- Dev115Ter BrahimDocument3 pagesDev115Ter Brahimkar telNo ratings yet
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- Dzexams 3as Physique 356279Document4 pagesDzexams 3as Physique 356279Yasser R99No ratings yet
- نمادج للباكالوريا الماء الأوكسيجينيDocument2 pagesنمادج للباكالوريا الماء الأوكسيجينيBrahim TomzineNo ratings yet
- Exo Terminal CorectionDocument28 pagesExo Terminal CorectionshadowNo ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)