Professional Documents
Culture Documents
Protein I
Uploaded by
urgentas10 ratings0% found this document useful (0 votes)
67 views12 pagesThis document discusses the structure of proteins. It states that proteins are macromolecules composed of amino acids linked by peptide bonds, and that they possess multiple levels of structure including primary, secondary, tertiary, quaternary, and supraquaternary structure. It also describes how proteins can be denatured or degraded by processes that disrupt the weak bonds between levels of structure, such as by heat, acids, bases, or enzymes. Denaturation can be reversible or irreversible and changes the physical and chemical properties of the protein.
Original Description:
Proteini biohemija
Original Title
Protein i
Copyright
© © All Rights Reserved
Available Formats
PPTX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentThis document discusses the structure of proteins. It states that proteins are macromolecules composed of amino acids linked by peptide bonds, and that they possess multiple levels of structure including primary, secondary, tertiary, quaternary, and supraquaternary structure. It also describes how proteins can be denatured or degraded by processes that disrupt the weak bonds between levels of structure, such as by heat, acids, bases, or enzymes. Denaturation can be reversible or irreversible and changes the physical and chemical properties of the protein.
Copyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
67 views12 pagesProtein I
Uploaded by
urgentas1This document discusses the structure of proteins. It states that proteins are macromolecules composed of amino acids linked by peptide bonds, and that they possess multiple levels of structure including primary, secondary, tertiary, quaternary, and supraquaternary structure. It also describes how proteins can be denatured or degraded by processes that disrupt the weak bonds between levels of structure, such as by heat, acids, bases, or enzymes. Denaturation can be reversible or irreversible and changes the physical and chemical properties of the protein.
Copyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
You are on page 1of 12
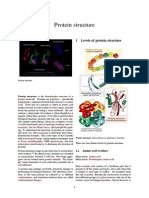
PROTEINI
Makromolekule graene iz aminokiselina
meusobno povezanih peptidnim vezama.
Posjeduju viestepenu strukturu.
Aminokiseline povezane u polipeptidni
lanac predstavljaju primarnu strukturu
bjelanevina.
Proteini mogu imati i :
1. sekundarnu strukturu
2. tercijarnu strukturu
3. kvaternarnu strukturu
4. suprakvaternarnu strukturu
U stvaranju primarne strukture uestvuju
iskljuivo kovalentne peptidne veze.
U organizaciji natprimarnih struktura
uestvuju slabe veze, prije svega vodikove.
Za razaranje ovih veza, a samim time i za
naruavanje pojedinih stupnjeva strukture
proteina e biti potrebno primjeniti sile
razliite jaine, kao i razliite agense.
Naruavanje strukture proteina
1. Procesi kojima se naruavaju samo
natprimarni stupnjevi strukture proteina
bez naruavanja primarne strukture tj.
osnovnog polipeptidnog lanca.
Ti se procesi ostvaruju primjenom slabijih
sila, a nazivaju se procesima
denaturacije proteina.
Denaturiui agensi mogu biti: zagrijavanje,
djelovanje RTG ili UV zraka,ultrazvuk,
promjena pH dodavanjem baza ili kiselina.
Procesi kojima se naruava primarna struktura
proteina proteoliza ili hidroliza.
Proteolizom nastaju krupniji i sitniji
fragmenti koji se zovu albumoze i
peptoni.
Proteoliza se moe postii djelovanjem
hidrolitikih enzima (pepsin, tripsin), kao i
kuhanjem rastvora proteina uz dodatak
mineralnih kiselina.
Denaturacija proteina moe biti reverzibilna
i ireverzibilna.
Reverzibilna denaturacija predstavlja
prolazno naruavanje natprimarnih
stupnjeva struktura koje se vraaju na
poetni oblik nakon uklanjanja
denaturiueg agensa.
Ireverzibilna denaturacija predstavlja
definitivno naruavanje prirodne strukture
proteina usljed ega se nepovratno
mijenjaju fiziko-hemijska i bioloka
svojstva proteina.
Proteini denaturisani kiselinama nazivaju
se acid-albumini.
Djelovanjem alkalija nastaju alkali-
albuminati.
Termika denaturacija dovodi do kidanja
sekundarnih veza.
Nakon toga dolazi do interakcije
fragmenata te se stvaraju agregati
koagulum ili ugruak.
Taloenje proteina
Proteini sadre amino (-NH2 ) i
karboksilnu (COOH) grupu pa imaju
svojstva amfotermnih jedinjenja, tj.
mogu da disociraju kiselom i baznom
grupom u zavisnosti od pH sredine i
izoelektrine take.
Molekule proteina se najlake taloe kada
su u jonskom obliku tj. kao Zwitter jon.
Proteini u plazmi su u koloidnom stanju.
Na koloidnim i amfotermnim svojstvima se
baziraju reakcije taloenja proteina.
Taloenje se vri oduzimanjem
hidratacione vode tj. isoljavanjem.
Bojene reakcije na proteine koriste se za
dokazivanje specifinih svojstava proteina,
a bazirane su na prisustvu specifinih
aminokiselina u grai proteina.
You might also like
- Proteins Structure and TestsDocument8 pagesProteins Structure and TestsSPMUSER9ANo ratings yet
- Clinical Chemistry - ProteinsDocument6 pagesClinical Chemistry - Proteinsrosellae.No ratings yet
- Proline and HydroxyprolineDocument7 pagesProline and HydroxyprolineYutman Wa dagoNo ratings yet
- Protein Denaturation: Effects of Heat, Acids, Salts, and AcetoneDocument4 pagesProtein Denaturation: Effects of Heat, Acids, Salts, and AcetoneRena Emmanuelle PalenciaNo ratings yet
- Amino Acids - 2 - NoDocument9 pagesAmino Acids - 2 - NoSunny Thakur17No ratings yet
- ZO 503 Physiological Chemistry by Dr.S.S.KunjwalDocument22 pagesZO 503 Physiological Chemistry by Dr.S.S.KunjwalAbhishek Singh ChandelNo ratings yet
- New ProteinsDocument7 pagesNew ProteinsBles Cy LagrimasNo ratings yet
- Biochemistry Experiment JournalDocument46 pagesBiochemistry Experiment JournalEra MelaniaNo ratings yet
- Lecture 5 WK 5 FPGDocument9 pagesLecture 5 WK 5 FPGMKCNo ratings yet
- PKU 2. Mohammad Afifudin A 18030194020 PKO ProteinDocument9 pagesPKU 2. Mohammad Afifudin A 18030194020 PKO Proteinafif armadaniNo ratings yet
- Classification of Protein Based On Composition PDFDocument4 pagesClassification of Protein Based On Composition PDFRidwan HambaliNo ratings yet
- Asam Amino WPS OfficeDocument4 pagesAsam Amino WPS OfficeSalsabila Putri LubisNo ratings yet
- Lec. 4Document6 pagesLec. 4Dr. Mohamed ShamsNo ratings yet
- Pre-Lab Expt 5-Denaturation of ProteinsDocument3 pagesPre-Lab Expt 5-Denaturation of ProteinsMaria Isabella Francesca C. BargayoNo ratings yet
- Group II TBM Class: ProteinDocument53 pagesGroup II TBM Class: ProteinAziz RahmatullahNo ratings yet
- Understanding Proteins from Primary to Quaternary StructureDocument10 pagesUnderstanding Proteins from Primary to Quaternary StructureDarshan RNo ratings yet
- Classification of ProteinsDocument27 pagesClassification of ProteinsAlexia Mary Solei BacolodNo ratings yet
- 3-Bch303 Chapter3 Protein Structure and FunctionDocument105 pages3-Bch303 Chapter3 Protein Structure and Functionsandaramae04No ratings yet
- Ostateczna Prezentacja PeroksysyomyDocument17 pagesOstateczna Prezentacja PeroksysyomyOlgaNo ratings yet
- BioChemistry Report Group 2 ProteinDocument35 pagesBioChemistry Report Group 2 ProteinJowe VarnalNo ratings yet
- Proteins: Proteins Are Large Biomolecules, or Macromolecules, Consisting of One orDocument15 pagesProteins: Proteins Are Large Biomolecules, or Macromolecules, Consisting of One orKaleem KhanNo ratings yet
- ProteinsDocument9 pagesProteinsCRUZ, ANNA MARIELLENo ratings yet
- Era Melania - PKU 18 - 18030194085 - Jurnal Praktikum Penentuan Kadar Protein Dengan Metode BiuretDocument18 pagesEra Melania - PKU 18 - 18030194085 - Jurnal Praktikum Penentuan Kadar Protein Dengan Metode BiuretEra MelaniaNo ratings yet
- MC 2 Worksheet Week 4Document3 pagesMC 2 Worksheet Week 4Leah Mariz RocaNo ratings yet
- Name: Saksha Govind Ubale Paper 1: Biochemistry College Name: Icle'S Motilal Jhunjhunwala ACADEMIC YEAR: 2020-2021Document9 pagesName: Saksha Govind Ubale Paper 1: Biochemistry College Name: Icle'S Motilal Jhunjhunwala ACADEMIC YEAR: 2020-2021Pravin GoleNo ratings yet
- Chemistry of Amino Acids, Peptides and Proteins: Structures, Properties, FunctionsDocument16 pagesChemistry of Amino Acids, Peptides and Proteins: Structures, Properties, FunctionsJeszieNo ratings yet
- Amino Acids and ProteinsDocument48 pagesAmino Acids and ProteinsSteph VeeNo ratings yet
- Proteins: Nature's WorkhorsesDocument4 pagesProteins: Nature's WorkhorsesSatheesh KumarNo ratings yet
- What Is Protein Denaturation?Document2 pagesWhat Is Protein Denaturation?Angel DiangNo ratings yet
- BIOL 151: Chapter 4-6 Notes: Chapter 4: Protein Structure and FunctionDocument11 pagesBIOL 151: Chapter 4-6 Notes: Chapter 4: Protein Structure and FunctionJasminCaoNo ratings yet
- BiochemistryDocument7 pagesBiochemistrymalaver528No ratings yet
- Proteini Struktura ProteinaDocument11 pagesProteini Struktura ProteinaMunibSelimovicNo ratings yet
- UntitledDocument454 pagesUntitledMegan Grace EbreoNo ratings yet
- Modificaciones postraduccionales proteínasDocument6 pagesModificaciones postraduccionales proteínasbianka guadalupe castro velazcoNo ratings yet
- Lecture 3-ProteinsDocument9 pagesLecture 3-ProteinsOminousCroakNo ratings yet
- Protein Structure PDFDocument6 pagesProtein Structure PDFmradu1No ratings yet
- Protein Structure Powerpoint Presentation Newest Pink and PurpleDocument21 pagesProtein Structure Powerpoint Presentation Newest Pink and Purpleapi-281150432No ratings yet
- Molecular Protien StuctureDocument5 pagesMolecular Protien Stucturechetan0047No ratings yet
- Proteins Lecture by Miss ChandaDocument24 pagesProteins Lecture by Miss ChandabongiweNo ratings yet
- BiochemistryDocument113 pagesBiochemistryMohammed Faizuddin siddiqui100% (1)
- Leccture Notes Protein Part 2 2023 - ADocument3 pagesLeccture Notes Protein Part 2 2023 - APretty Grace101No ratings yet
- Protein: Organic Chemistry Practice Task Lecturer: Dr. Ismono, M.SDocument11 pagesProtein: Organic Chemistry Practice Task Lecturer: Dr. Ismono, M.SEra MelaniaNo ratings yet
- Protein Folding and Misfolding Determined by Amino Acid SequenceDocument17 pagesProtein Folding and Misfolding Determined by Amino Acid SequenceMazhar FarNo ratings yet
- Biochem Module 4 - Proteins and StructureDocument15 pagesBiochem Module 4 - Proteins and StructureAnothando GobaNo ratings yet
- Proteins Are Synthesized On Ribosomes As Linear PolypeptitesDocument16 pagesProteins Are Synthesized On Ribosomes As Linear Polypeptitesthamizh555No ratings yet
- Seminar On Protein and Peptides Drug DeliveryDocument37 pagesSeminar On Protein and Peptides Drug DeliverykeyurNo ratings yet
- 4 ProteinsDocument35 pages4 ProteinsIslam SamirNo ratings yet
- Unit I Protein StructureDocument66 pagesUnit I Protein StructurenikteshgNo ratings yet
- PTM by SamsonDocument28 pagesPTM by SamsonSathish KumarNo ratings yet
- Hydrophilic and Hydrophobic Amino AcidsDocument6 pagesHydrophilic and Hydrophobic Amino AcidsShardy Lyn RuizNo ratings yet
- Labster ProteinsDocument12 pagesLabster ProteinsKurstein FerriolNo ratings yet
- Amino Acids and ProteinsDocument6 pagesAmino Acids and ProteinsMary Joy GaloloNo ratings yet
- Application of 2 D-HPLC System For Plasma Protein SeparationDocument10 pagesApplication of 2 D-HPLC System For Plasma Protein Separationtrinhmy81No ratings yet
- ProteinsDocument40 pagesProteinsHaseeb CkNo ratings yet
- Protein: Proteins (Document17 pagesProtein: Proteins (subhasis1172No ratings yet
- Module 7 General Biology 1Document10 pagesModule 7 General Biology 1kimberlyfritzzunigaNo ratings yet
- General Biology ReviewerDocument7 pagesGeneral Biology ReviewerGenne kayeNo ratings yet
- ProteinsDocument1 pageProteinsKhey AgamNo ratings yet
- Protein Turnover and Lysosome FunctionFrom EverandProtein Turnover and Lysosome FunctionHarold L. SegalNo ratings yet
- Ralph's Healthy Choice: L-Glutathione - Science, Production & BenefitsFrom EverandRalph's Healthy Choice: L-Glutathione - Science, Production & BenefitsNo ratings yet
- BBL 434 - Bioinformatics: D. SundarDocument22 pagesBBL 434 - Bioinformatics: D. SundarSparsh Negi100% (1)
- Cell OrganellesDocument25 pagesCell OrganellesLettynia Mellisze Famoso SorongonNo ratings yet
- Experiment 8 and 9 PDFDocument17 pagesExperiment 8 and 9 PDFKrizzi Dizon GarciaNo ratings yet
- Alkaloids PDFDocument81 pagesAlkaloids PDFAmit88% (8)
- CHAPTER 19 Tricarboxylic Acid CycleDocument11 pagesCHAPTER 19 Tricarboxylic Acid Cycle楊畯凱No ratings yet
- The main functions and structure of centrioles in cell divisionDocument2 pagesThe main functions and structure of centrioles in cell divisiontherese lamelaNo ratings yet
- Class Practice Test 01 Nucleic Acid (23-11-2023)Document4 pagesClass Practice Test 01 Nucleic Acid (23-11-2023)hemachaturvedi560No ratings yet
- Enzyme CatalysisDocument23 pagesEnzyme CatalysisPrashant SinghNo ratings yet
- Nutrition & You - Chapter 6Document40 pagesNutrition & You - Chapter 6Bridget KathleenNo ratings yet
- COMP90016 2023 08 Variant Calling IIDocument41 pagesCOMP90016 2023 08 Variant Calling IILynn CHENNo ratings yet
- Year-12-Biology Excel Revision Cards PDFDocument109 pagesYear-12-Biology Excel Revision Cards PDFTylerNo ratings yet
- Miscellaneous Biochemistry QuestionsDocument8 pagesMiscellaneous Biochemistry QuestionsphoenixscarNo ratings yet
- New Bioprocessing Strategies: Development and Manufacturing of Recombinant Antibodies and ProteinsDocument473 pagesNew Bioprocessing Strategies: Development and Manufacturing of Recombinant Antibodies and Proteinsmohammad100% (1)
- SCIENCE9 Q1 WEEK6 (LESSONS 17-18) - Photosynthesis (22 Pages)Document22 pagesSCIENCE9 Q1 WEEK6 (LESSONS 17-18) - Photosynthesis (22 Pages)Rhyan Zero-four BaluyutNo ratings yet
- Genetics Extra CreditDocument3 pagesGenetics Extra CreditNicole Leigh KleinasNo ratings yet
- Ancient Dna 1994 PDFDocument275 pagesAncient Dna 1994 PDFJoseph El KhouryNo ratings yet
- Growth Factor For Bone RegenerationDocument17 pagesGrowth Factor For Bone RegenerationOluwasegun ModupeNo ratings yet
- Benefits of Vitamin B7 For Your DogDocument12 pagesBenefits of Vitamin B7 For Your DogPreethi DassanayakeNo ratings yet
- 1.1 Cell WsDocument7 pages1.1 Cell WsJyoti SinghNo ratings yet
- GB1 - Diagnostic Test - 2022Document10 pagesGB1 - Diagnostic Test - 2022Arlene ZingapanNo ratings yet
- CELL STRUCTURE AND PHYSIOLOGYDocument37 pagesCELL STRUCTURE AND PHYSIOLOGYAliyu Aisha100% (1)
- (Mebooksfree Net) Adv&Pat&Cer&Str&Pat&Tri&Dwi&1stDocument188 pages(Mebooksfree Net) Adv&Pat&Cer&Str&Pat&Tri&Dwi&1stgabriellaNo ratings yet
- Glucose DeterminationDocument3 pagesGlucose DeterminationMelody PardilloNo ratings yet
- Introduction of MetabolismDocument51 pagesIntroduction of MetabolismrahmatNo ratings yet
- Amino Acid: Met - Asp - Pro - Tyr - Val - THR - UAADocument5 pagesAmino Acid: Met - Asp - Pro - Tyr - Val - THR - UAAkimNo ratings yet
- Single, Three Letter Amino Acid Codes: Amino Acids Properties, EtcDocument3 pagesSingle, Three Letter Amino Acid Codes: Amino Acids Properties, EtcZoya AmjadNo ratings yet
- Bioenergetics and Lipid MetabolismDocument34 pagesBioenergetics and Lipid MetabolismM Daffa Abhista ReviansyahNo ratings yet
- PHYSICAL SCIENCE Q3 Week 4 - v2Document21 pagesPHYSICAL SCIENCE Q3 Week 4 - v2Evangelyn Patatag-CatacutanNo ratings yet
- Cell Wall Synthesis Inhibitors (CompleteDocument44 pagesCell Wall Synthesis Inhibitors (CompletegrayNo ratings yet
- Activity 5 Physioex 9.0 Exercise 1Document4 pagesActivity 5 Physioex 9.0 Exercise 1Adela Lhuz50% (2)