Professional Documents
Culture Documents
Dif. Destilacija
Uploaded by
Liza GrayOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Dif. Destilacija
Uploaded by
Liza GrayCopyright:
Available Formats
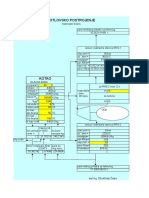
3. SHEMA EKSPERIMENTALNE NAPRAVE KEMIJSKO INENIRSTVO 4.
LETNIK
6.DIFERENCIALNA DESTILACIJA
1.NALOGA Z diferencialno destilacijo binarne zmesi etanola in vode izraunaj s pomojo ravnotenih podatkov koliino in sestavo enega produkta, ki ustreza koliini in sestavi drugega produkta. Destilacijo praktino izvedi in primerjaj rezultate PARAMETRI: masa zaetnega etanola in vode je 1300g (13 molskih %), predestiliramo da dobimo 42% molsko zmes etanola in vode. 2.OSNOVE Zmes razlino hlapnih kapljevin lahko loimo s pomojo uparevanja in sledeo kondenzacijo hlapov. V destilatu bo bolj koncentrirana laje hlapna komponenta, manj hlapna pa ostane v kotlu (destilacijski ostanek). Destilacija torej temelji na razlini sestavi hlapov glede na tekoo zmes iz katere izvirajo. Najenostavneja je nestacionarna arna destilacija, imenujemo jo tudi diferencialna destilacija. Kapljevinsko zmes natoimo v kotel, jo segrejemo do vrelia in predestiliramo eleni del vloka. Hlape pa kondenziramo in ujamemo v predloko. Vsaka izmed komponent v parni fazi je v ravnoteju z vrelo tekoino. Ker pa so komponente razlino hlapne, dobimo v parni fazi ve bolj hlapne komponente. Ker gre za nestacionaren proces, se sestava tekoe in parne faze tekom destilacije spreminjata: ydm = d (mx) ydn = d (nx) = ndx xdn
Po preureditvi in integraciji za dane meje dobimo tako imenovani Rayleighov integral:
ln
n dx = n0 x0 y x
Reujemo ga lahko na razline naine. V naem primeru ne poznamo eksplicitne zveze med x in y , zato ga reujemo grafino, zgornjo mejo pa doloimo s poskuanjem.
4.MERITVE IN IZRAUNI Zaetna zmes: m = 1300 g
( molski ) o xe tan ol = 27.6 o (uteni ) o zmesi = 0.955 g / ml
xe tan ol = 13 o ne tan ol = 7.8mol nvoda = 52.3mol n0 = ne tan ol + nvoda = 7.8mol + 52.3mol = 60.1mol Doloitev x konnega v kotlu iz ravnotenih podatkov:
x 0.053 0.0625 0.0673 0.0715 0.0871 0.126 0.143 y 0.314 0.339 0.37 0.362 0.406 0.468 0.487 1/y-x 3.83 3.62 3.3 3.44 3.136 2.92 2.91
odvisnost 1/y-x od x
4.5 4 3.5 3 2.5 2 1.5 1 0.5 0 0.04 0.05 0.06 0.07 0.08 0.09 x
1/y-x
0.1
0.11 0.12 0.13 0.14 0.15
pri x=0.07 je povrina pod krivuljo p=0,187 in iz teh podatkov sledi izraun za n, nD in xD : x = 0.07 p = 0.187 n dx = = 0.187 n0 x0 y x
x
ln
n = e 0.187 = 0.829 n0 n = 60.1mol * 0.829 = 49.833mol nD = n0 n = 60.1mol 49.833mol = 10.25mol n0 x0 = nx + nD xD xD = n0 x0 nx 60.1mol * 0.13 49.833mol * 0.07 = = 0.42 nD 10.25mol
iz izraunov vidimo da je na x pravilen Izraun volumna destilata: n = 10.25mol x = 0.42 = 0.86 g / ml m = x * n * M e tan ol + (1 x) * n * M H 2O m = 0.42 *10.25mol * 46 g / mol + (1 0.42) *10.25mol *18 g / mol = 305.04 g Vdestilata = m 305.04 g = = 354.7 ml 0.86 g / ml
Dobljene eksperimentalne vrednosti: Tzaaet = 82.90 C Tkonon = 85.30 C Vdestilata = 360ml xD = 0.41
= 0.86 g / ml
nD = nD = mD VD = M xD M e tan ol + (1 xD ) M H 2O 360ml * 0.86 g / ml = 10.5mol 0.41* 46 g / mol + (1 0.41)18 g / mol
Vos tan ka = 920mlml x = 0.065
= 0.98 g / ml
n = n =
m M
xM e tan ol + (1 x ) M H 2O
920ml * 0.98 g / ml = 45.5mol 0.065 * 46 g / mol + (1 0.065)18 g / mol
5. REZULTATI
izraunano eksperimentalno n (ostanka) 49.83mol 45.5mol V (ostanka) 1006ml 920ml V (destilata) 354.7ml 360ml x (ostanka) 7% 6.5% n (destilata) 10.25mol 10.5mol x (destilata) 42% 41% T (vrelia) 82.9C
6.KOMENTAR
You might also like
- Teorija Metalurških Procesa - ZadaciDocument12 pagesTeorija Metalurških Procesa - ZadaciVanja ŠuicaNo ratings yet
- Kemija DM Skripta Proljece2015 2Document72 pagesKemija DM Skripta Proljece2015 2Knjižnica J. A. KomenskogNo ratings yet
- OptikaDocument39 pagesOptikaVladimir MagocNo ratings yet
- Vaje Iz Kemijskega RačunanjaDocument38 pagesVaje Iz Kemijskega RačunanjaAndraž ŠuligojNo ratings yet
- Ni (II) Koordinacijska Spojina Z enDocument4 pagesNi (II) Koordinacijska Spojina Z enAna RadićNo ratings yet
- 7B RektifikacijaDocument6 pages7B RektifikacijaMartin PetricNo ratings yet
- Dnevnik Laboratorijskih VežbiDocument13 pagesDnevnik Laboratorijskih VežbijovanNo ratings yet
- FT2 Kolokvij 2 Rok 2009Document4 pagesFT2 Kolokvij 2 Rok 2009api-3814389No ratings yet
- Zbirka NalogDocument24 pagesZbirka Nalogswift91No ratings yet
- Tehnologija Betona - Racunski PrimeriDocument28 pagesTehnologija Betona - Racunski Primerinovakno10% (2)
- Ekonomičnost Potrošnje GorivaDocument6 pagesEkonomičnost Potrošnje GorivaClark1995No ratings yet
- Skripta 2. LetnikDocument43 pagesSkripta 2. LetnikIvan GrceNo ratings yet
- 1 Števila (BF)Document12 pages1 Števila (BF)Nikola PilašNo ratings yet
- Celotna Destilacija Z VodnoparoDocument18 pagesCelotna Destilacija Z VodnoparoSimon ErjavecNo ratings yet
- Pozarne KonstrukcijeDocument26 pagesPozarne Konstrukcijenba teamNo ratings yet
- Elek Prevodnost Galv Členi 22 23Document8 pagesElek Prevodnost Galv Členi 22 23EvaNo ratings yet
- Obarjalne Titracije4Document9 pagesObarjalne Titracije4Dejan DjokićNo ratings yet
- GyyyyDocument65 pagesGyyyyJasna MaksimovaNo ratings yet
- Skripta FT2Document39 pagesSkripta FT2api-3814389100% (3)
- Kemija - SkriptaDocument172 pagesKemija - SkriptaSomeoneNo ratings yet
- Računski Seminar - IPTRDocument23 pagesRačunski Seminar - IPTRGašper MožinaNo ratings yet
- FK - EMŠF - 18 Januar 2021 1Document6 pagesFK - EMŠF - 18 Januar 2021 1xander12341234No ratings yet
- Shema Kotlovnice Sa Proracunomza Turbinudrugi14.08.2009Document5 pagesShema Kotlovnice Sa Proracunomza Turbinudrugi14.08.2009zeljkodzNo ratings yet
- Optoelektronika Za GRIDDocument6 pagesOptoelektronika Za GRIDBojana PetrovićNo ratings yet
- KLIMATIZACIJA - UGODJE1-predlogaDocument7 pagesKLIMATIZACIJA - UGODJE1-predlogaIvanNo ratings yet
- Analogna Integrisana ElektronikaDocument4 pagesAnalogna Integrisana ElektronikaMujić EmirNo ratings yet
- Navodila Za Izvedbo Vaje Acidoalkalimetrija 2011Document10 pagesNavodila Za Izvedbo Vaje Acidoalkalimetrija 2011Nika JapeljNo ratings yet
- Izpit PrimerDocument2 pagesIzpit Primerxander12341234No ratings yet
- Vodoravni MetDocument3 pagesVodoravni Metmancanaglic08No ratings yet
- NAK-Programska Naloga Preraä-UnDocument12 pagesNAK-Programska Naloga Preraä-UnRadoje RadojicicNo ratings yet
- HEMIJA DT 2022 OS Za SAJTDocument15 pagesHEMIJA DT 2022 OS Za SAJTEdita IbukićNo ratings yet
- Statika Konstrukcija II Graficki RadDocument22 pagesStatika Konstrukcija II Graficki RadDusan Bimba FilipovicNo ratings yet
- 2019-Priprava Na Ustni Izpit Iz MAT Pri PMDocument76 pages2019-Priprava Na Ustni Izpit Iz MAT Pri PMkrajncstanislav70No ratings yet
- Pravila Za Raä Unanje Z NapakamiDocument8 pagesPravila Za Raä Unanje Z NapakamiMiha MočnikNo ratings yet
- Stehiometrijski Račun U Pet Koraka Do RešenjaDocument4 pagesStehiometrijski Račun U Pet Koraka Do RešenjaRadica MiljkovicNo ratings yet
- Zbrika Iz TermodinamikeDocument115 pagesZbrika Iz TermodinamikeHuskovsky100% (1)
- Vprašanja Z Odgovori, KemijaDocument7 pagesVprašanja Z Odgovori, KemijaMonikaGrajNo ratings yet
- 12 Zadaci KondukcijaDocument10 pages12 Zadaci KondukcijaMedina HodzicNo ratings yet
- Sitnorebrasta Medjuspratna KonstrukcijaDocument5 pagesSitnorebrasta Medjuspratna KonstrukcijaMilica MiskovNo ratings yet
- Velikost DelcevDocument28 pagesVelikost Delcevapi-3814389No ratings yet
- Priprava Na 2 Kolokvij - BiokemijaDocument2 pagesPriprava Na 2 Kolokvij - BiokemijaPetra ŠtinglNo ratings yet
- Ft2 Vaje Naloge Iz Velikosti Delcev 5Document2 pagesFt2 Vaje Naloge Iz Velikosti Delcev 5api-3814389No ratings yet
- Poslovno Rač.Document90 pagesPoslovno Rač.ttkxxoqflwonqhxguqNo ratings yet
- 1L 09 Entalpija Kemijske ReakcijeDocument3 pages1L 09 Entalpija Kemijske ReakcijeTinkara VraničarNo ratings yet
- Elektrokemija ZadaciDocument2 pagesElektrokemija ZadaciLorenaKordićNo ratings yet
- 30.3. Zaokroževanje Decimalnih Števil PDFDocument2 pages30.3. Zaokroževanje Decimalnih Števil PDFSlavcNo ratings yet
- 09 04 Espressioni Goniometriche Calcolatrice 3 0Document2 pages09 04 Espressioni Goniometriche Calcolatrice 3 0travis678infoNo ratings yet
- Vaja1merjenje Premera in GostoteDocument3 pagesVaja1merjenje Premera in GostoteIra VDNo ratings yet
- Statika Konstrukcija IiiDocument9 pagesStatika Konstrukcija IiiHarunNo ratings yet
- Arhitektonska FizikaDocument25 pagesArhitektonska FizikaNemanja DespotovicNo ratings yet
- Hookov ZakonDocument5 pagesHookov ZakonLenart GrmekNo ratings yet
- Bahan Diskusi Stoikiometri Pekan Ke-4Document17 pagesBahan Diskusi Stoikiometri Pekan Ke-4Nur AnnisahNo ratings yet
- Prva VajaDocument32 pagesPrva VajaMartin PetricNo ratings yet
- Dimenzioniranje Cirkulacijskega Voda Za Toplo Sanitarno VodoDocument3 pagesDimenzioniranje Cirkulacijskega Voda Za Toplo Sanitarno VodoJony M. TemnikarNo ratings yet
- 2) Stezni SpojDocument4 pages2) Stezni SpojJurica0% (2)