Professional Documents
Culture Documents
درس المتابعة الزمنية عن طريق المعايرة اللونية
Uploaded by
Redouane RedaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
درس المتابعة الزمنية عن طريق المعايرة اللونية
Uploaded by
Redouane RedaCopyright:
Available Formats
شرح دروس مادة الفيزياء – بكالوريا https://www.touahria.
com -
الحلقة ( )7درس المتابعة الزمنية لتحول كيميائي عن طريق المعايرة اللونية
تهدف الحركية الكيميائية إلى المتابعة الزمنية لتحول كيميائي بمراقبة كميات المادة المتبقي أو المتشكلة لمتفاعالت أو
نواتج في لحظات مختلفة ،لتحديد التقدم ) x(tلغرض معرفة تركيب الجملة في أية لحظة.
– الطريقة الكيميائية:
المعايرة اللونية :
متى نستعمل هذه الطريقة؟
ترتكز على معايرة أحد األنواع الكيميائية الذي يتميز بلونه .وهي طريقة سهلة.
- 01خطوات إيجاد كمية المادة بهذه الطريقة:
- 1نعاير في لحظات مختلفة حجما من الوسط التفاعلي حجمه ثابت ،بتفاعل سريع لتحديد كمية مادة النوع الكيميائي الناتج.
- 2ننجز جدول التقدم .
- 3نستخرج عالقة التقدم ) x(tفي أية لحظة بداللة كمية مادة الناتج عن التحول البطيء المعاير .
- 4نستنتج تركيب الجملة الكيميائية في أية لحظة.
- 02الخواص األساسية لتفاعل المعايرة:
- 1أن يكون التفاعل تآمآ وسريعآ.
- 2أن يكون وحيدا أي عدم تتدخل التفاعالت الثانوية فيه.
- 3أن نتمكن من تحديد نقطة التكافؤ بدقة.
- 03نشاط:
−2 −1
نحضر محلوال ) (sبمزج 𝑚 𝑉1 = 100من الماء االكسجيني 𝐻2 𝑂2تركيزه المولي 𝑙 𝐶1 = 4,5. 10 𝑚𝑜𝑙.مع
حجم 𝑙𝑚 𝑉2 = 100من محلول يود البوتاسيوم ) )𝑞𝑎( (𝐾 +(𝑎𝑞) + 𝐼 −تركيزه المولي
.𝐶2 = 2. 10−1 𝑚𝑜𝑙. 𝑙 −1
تعطى الثنائيتان(𝐻2 𝑂2 (𝑎𝑞)/𝐻2 𝑂(ℓ)) ، (𝐼2 (𝑎𝑞)/𝐼 − (𝑎𝑞)) :
)𝒍( 𝑶 𝟐𝑯𝟐 𝑯𝟐 𝑶𝟐 (𝒂𝒒) + 𝟐𝑯+ (𝒂𝒒) + 𝟐𝑰− (𝒂𝒒) = 𝑰𝟐 (𝒂𝒒) +
نقسم المحلول ) (sعلى عدة أنابيب متماثلة كل منها يحتوي على حجم V=20mlوفي اللحظة t=4minنضيف إلى األنبوب
األول الماء وقطع من الجليد ثم نعاير ثنائي اليود )𝑞𝑎( 𝐼2المتشكل بواسطة ثيوكبريتات الصوديوم
ّ
-1
))𝑞𝑎( (2𝑁𝑎+ (𝑎𝑞) + 𝑆2 𝑂32−تركيزه المولي C=1,0mol.Lنكرر التجربة السابقة كل أربع دقائق مع بقية
األنابيب ،علما أن حجم الثيوكبريتات المضاف عند التكافؤ .VE
𝑰𝟐 (𝒂𝒒) + 𝟐𝑺𝟐 𝑶𝟐− − 𝟐−
)𝒒𝒂( 𝟔𝑶 𝟒𝑺 𝟑 (𝒂𝒒) = 𝟐𝑰 (𝒂𝒒) +
http://www.facebook.com/Prof.touahria.abdelaziz 1 من اعداد األستاذ :طواهرية عبد العزيز
شرح دروس مادة الفيزياء – بكالوريا https://www.touahria.com -
نكرر العملية مع األنابيب العشرة كل أربع دقائق فنتحصل على القيم في الجدول التالي:
)t (min 0 4 8 12 16 20 24 28 32 36
𝑙𝑚 𝐸𝑉 / 5 7,5 8,5 8,8 9 9 9 9 9
𝑙𝑜𝑚𝑚) 𝑛′(𝐼2 0 0,25 0,37 0,42 0,44 0,45 0,45 0,45 0,45 0,45
جدول التقدم للتفاعل الرئيسي:
معادلة التفاعل )𝑙( 𝑂 𝐻2 𝑂2 (𝑎𝑞) + 2𝐻+ (𝑎𝑞) + 2𝐼 − (𝑎𝑞) = 𝐼2 (𝑎𝑞) + 2𝐻2
حالة التفاعل تقدم التفاعل كميات األفراد الكيميائية بوحدة mol
X(t) = 0الحالة االبتدائية 𝑛1 بوفرة 𝑛2 0 بوفرة
𝑡𝑋 = ) X(tالحالة االنتقالية 𝑡𝑋 𝑛1 - بوفرة 𝑡𝑋𝑛2 - 2 𝑡𝑋 بوفرة
𝑥𝑎𝑚𝑋 X(t) = 𝑋𝑓 𝑛1 -الحالة النهائية بوفرة 𝑥𝑎𝑚𝑋𝑛2 - 2 بوفرة 𝑥𝑎𝑚𝑋
العالقة بين كمية مادة ثنائي اليود ) 𝟐𝑰( 𝒏′في اناء المعايرة وكمية مادة ثنائي اليود ) 𝟐𝑰(𝒏 الموجودة في المزيج ككل:
) 𝑛(𝐼2 ) 𝑛′ (𝐼2 ) 𝑛(𝐼2 ) 𝑛′ (𝐼2
) 𝐶(𝐼2 ) = 𝐶 ′ (𝐼2 = = ) 𝟐𝑰(𝒏𝒕 (𝑰𝟐 ) = 𝟏𝟎𝒏𝒕 ′
𝑇𝑉 𝑝𝑉 𝑝𝑉10 𝑝𝑉
)𝒍𝒎𝟎𝟐 = 𝒑𝑽 (𝑽𝑻 = 𝟐𝟎𝟎𝒎𝒍 ,
)t (min 0 4 8 12 16 20 24 28 32 36
𝑙𝑚 𝐸𝑉 / 5 7,5 8,5 8,8 9 9 9 9 9
𝑙𝑜𝑚𝑚) 𝑛′(𝐼2 0 0,25 0,37 0,42 0,44 0,45 0,45 0,45 0,45 0,45
𝑙𝑜𝑚𝑚) 𝑥(𝑡) = 𝑛(𝐼2 0 2,5 3,7 4,2 4,4 4,5 4,5 4,5 4,5 4,5
من جدول التقدم في الحالة االنتقالية:
𝑡𝑥 𝑛𝑡 (𝐻2 𝑂2 ) = 𝑛1 − 𝑡𝑥𝑛𝑡 (𝐼 − ) = 𝑛2 − 2 𝑡𝑥 = ) 𝑛𝑡 (𝐼2
حساب كمية المادة االبتدائية لللمتفاعالت:
𝑛1 = 𝐶1 . 𝑉1 )𝑛1 = (4,5. 10−2 ). (0,1 𝑙𝑜𝑚𝑚 𝑛1 = 4,5
𝑛2 = 𝐶2 . 𝑉2 )𝑛2 = (2. 10−1 ). (0,1 𝑙𝑜𝑚𝑚 𝑛2 = 20
مثال :مكونات المزيج التفاعلي عن اللحظة 𝒏𝒊𝒎𝟖 = 𝒕 :
𝑡𝑥 = ) 𝑛𝑡 (𝐼2 𝑙𝑜𝑚𝑚𝑛𝑡 (𝐼2 ) = 3,7 (الحظ الجدول السابق عن 𝑛𝑖𝑚) 𝑡 = 8
𝑡𝑥 𝑛𝑡 (𝐻2 𝑂2 ) = 𝑛1 − 𝑛𝑡 (𝐻2 𝑂2 ) = 4, 5 − 3,7 𝑙𝑜𝑚𝑚 𝑛𝑡 (𝐻2 𝑂2 ) = 0,8
𝑡𝑥𝑛𝑡 (𝐼 − ) = 𝑛2 − 2 )𝑛𝑡 (𝐼 − ) = 20 − 2(3,7 𝑙𝑜𝑚𝑚 𝑛𝑡 (𝐼 − ) = 12,6
http://www.facebook.com/Prof.touahria.abdelaziz 2 من اعداد األستاذ :طواهرية عبد العزيز
شرح دروس مادة الفيزياء – بكالوريا https://www.touahria.com -
بنفس الطريقة نحسب مكونات المزيج عند كل لحظة فنتحصل الجدول التالي:
)t (min 0 4 8 12 16 20 24 28 32 36
𝑙𝑚 𝐸𝑉 / 5 7,5 8,5 8,8 9 9 9 9 9
𝑙𝑜𝑚𝑚) 𝑛′(𝐼2 0 0,25 0,37 0,42 0,44 0,45 0,45 0,45 0,45 0,45
𝑙𝑜𝑚𝑚) 𝑥(𝑡) = 𝑛(𝐼2 0 2,5 3,7 4,2 4,4 4,5 4,5 4,5 4,5 4,5
𝑙𝑜𝑚𝑚) 𝑛𝑡 (𝐻2 𝑂2 4,5 2 0.8 0,3 0,1 0 0 0 0 0
𝑙𝑜𝑚𝑚) 𝑛𝑡 (𝐼 − 20 15 12,6 11,6 11,2 11 11 11 11 11
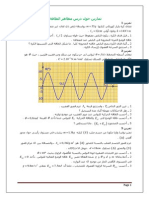
المنحنيات الخاصة بتطور مختلف األنواع الكيميائية المكونة للمزيج التفاعلي :
𝑙𝑜𝑚𝑚) 𝑛(𝐻2 𝑂2 𝑙𝑜𝑚𝑚) 𝑛(𝐼 −
5 25
4.5
4 20
3.5
3 15
2.5
2 10
1.5
1 5
0.5
0 0
0 4 8 12 16 20 24 0 4 8 12 16 20 24
)𝑛𝑖𝑚(𝑡 )𝑛𝑖𝑚(𝑡
𝑙𝑜𝑚𝑚) 𝑥(𝑡) = 𝑛(𝐼2
5
4.5
االستنتاج:
4
3.5 يمكننا متابعة تطور تحول كيميائي يتميز أحد مكوناته
3
2.5
( متفاعل أو ناتج) بلونه عن طريق المعايرة اللونية.
2
1.5
1
0.5
0
0 4 8 12 16 20 24
)𝑛𝑖𝑚(𝑡
لهذه الطريقة بعض العيوب من أهمها:
- 1يجب أن يكون تفاعل المعايرة سريعا أمام التحول الكيميائي المدروس .
- 2تنجز الدراسة بصفة متقطعة .
- 3تتم العملية علي عينات تأخذ من الوسط التفاعلي .
- 4نتعامل مع كميات كبيرة .
ّ
هام جدا :لمشاهدة شرح الدرس على اليوتيوب اتبع الرابط التالي:
https://youtu.be/GdZERtcqN7w
http://www.facebook.com/Prof.touahria.abdelaziz 3 من اعداد األستاذ :طواهرية عبد العزيز
You might also like
- - - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةDocument6 pages- - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةAbdou0% (2)
- - - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFDocument5 pages- - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFAbdou100% (1)
- 2AS U12 - E3 - Cour-Exe 04Document34 pages2AS U12 - E3 - Cour-Exe 04sylvie jackline50% (2)
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- تمارين في الفيزياء حول الاحماض و الاسسDocument2 pagesتمارين في الفيزياء حول الاحماض و الاسسBelkacem Prince80% (5)
- المناقشة البيانية جميع الحالات المتوقعةDocument5 pagesالمناقشة البيانية جميع الحالات المتوقعةines ghodbane100% (4)
- تمارين وحلول خاصة بالوحدة الاولى المتابعة الزمنية لتحول كيميائي في وسط مائيDocument35 pagesتمارين وحلول خاصة بالوحدة الاولى المتابعة الزمنية لتحول كيميائي في وسط مائيhakima03274% (38)
- Bac Physiq Ser1Document20 pagesBac Physiq Ser1Abdou VerrattiNo ratings yet
- تمارين الاكسدة والارجاع مع الحلول بلعمريDocument8 pagesتمارين الاكسدة والارجاع مع الحلول بلعمريalaa eddine100% (6)
- عمل مخبري الوحدة-01-المتابعة-الزمية-لتحول-كيميائي-مخففة PDFDocument18 pagesعمل مخبري الوحدة-01-المتابعة-الزمية-لتحول-كيميائي-مخففة PDFham sad100% (2)
- 3as U01 - E3 - Cour-Exe 01Document42 pages3as U01 - E3 - Cour-Exe 01Samy Abdelgafor Madani60% (5)
- الماء الأكسجيني و الدرجة الكلورومتريةDocument6 pagesالماء الأكسجيني و الدرجة الكلورومتريةMokhtar LadjineNo ratings yet
- سلسلة تمارين الناقليةDocument2 pagesسلسلة تمارين الناقليةne3mah78% (37)
- سلسلة تمارين مع الحل حول المتتاليات العددية للسنة 2 ثانوي علوم تجريبية - الأستاذ قويسم إبراهيم الخليل - موقع الأستاذ راحيس عمر PDFDocument59 pagesسلسلة تمارين مع الحل حول المتتاليات العددية للسنة 2 ثانوي علوم تجريبية - الأستاذ قويسم إبراهيم الخليل - موقع الأستاذ راحيس عمر PDFAkramNo ratings yet
- سلسلة تمارين في الاحتمالات مع الحل المفصل للسنة 2 ثانوي شعبة علوم تجريبية من إعداد الأستاذ ل. وليدDocument21 pagesسلسلة تمارين في الاحتمالات مع الحل المفصل للسنة 2 ثانوي شعبة علوم تجريبية من إعداد الأستاذ ل. وليدMellah ImadNo ratings yet
- باقة 30 موضوع تحضيري ممتاز مع الحل في مادة الرياضيات - شعبة رياضيات- عقبة بن نافع - بكالوريا 2020Document302 pagesباقة 30 موضوع تحضيري ممتاز مع الحل في مادة الرياضيات - شعبة رياضيات- عقبة بن نافع - بكالوريا 2020AICE100% (5)
- 2AS U07 - E3 - Cour-Exe 04Document7 pages2AS U07 - E3 - Cour-Exe 04Mariem Mari33% (3)
- سلسلة تمارين في العلوم الفيزيائية للسنة الثالثة ثانويDocument38 pagesسلسلة تمارين في العلوم الفيزيائية للسنة الثالثة ثانويالغزيزال الحسن EL GHZIZAL Hassane100% (5)
- سلسلة تمارين في المرجح مع الحل للسنة ثانية1643922886Document26 pagesسلسلة تمارين في المرجح مع الحل للسنة ثانية1643922886Memes تقفل طار لقفلNo ratings yet
- متابعة تحول كيميائي عن طريق قياس الناقلية TPDocument5 pagesمتابعة تحول كيميائي عن طريق قياس الناقلية TPadd manalNo ratings yet
- سلسلة الأستاذ ملكي علي للبكالوريا رقم 03Document5 pagesسلسلة الأستاذ ملكي علي للبكالوريا رقم 03Abdennour soufi50% (2)
- مجلة الهستونات العدد الخامس في الاتصال العصبي الاستاذة كتفي شريفDocument25 pagesمجلة الهستونات العدد الخامس في الاتصال العصبي الاستاذة كتفي شريفabd salam bourass100% (4)
- سلسلة تمارين حول الاحتمالاتDocument21 pagesسلسلة تمارين حول الاحتمالاتSabi BoulahlibNo ratings yet
- ملخص الوحده الأولى في الفيزياء 3 ثانويDocument2 pagesملخص الوحده الأولى في الفيزياء 3 ثانويedd1rasacom58% (26)
- تمارين الوحدة الثالثة في البكالوريا بالحلDocument21 pagesتمارين الوحدة الثالثة في البكالوريا بالحلAbdou Islem100% (1)
- سلسلة تمارين بالحل المفصل في وحدة الأسترةDocument13 pagesسلسلة تمارين بالحل المفصل في وحدة الأسترةSalim Salim100% (3)
- حدود ميكانيك نيوتنDocument6 pagesحدود ميكانيك نيوتنCHAREFHAMMA100% (5)
- معادلات ومتراجحات أسية و لوغاريتميةDocument12 pagesمعادلات ومتراجحات أسية و لوغاريتميةMourad Mouradbensalem100% (10)
- ملخص الوحدة الأولى المتابعة الزمنية لتحول كيميائي في محلول مائيDocument4 pagesملخص الوحدة الأولى المتابعة الزمنية لتحول كيميائي في محلول مائيAmi ncrNo ratings yet
- ملخص كل دروس العلوم الطبيعية للسنة الثالثة ثانويDocument16 pagesملخص كل دروس العلوم الطبيعية للسنة الثالثة ثانويLabed Charaf Eddine85% (48)
- سلسلة تمارين الإحتمالات للسنة الثانية ثانوي للأستاذ بوقطوفDocument2 pagesسلسلة تمارين الإحتمالات للسنة الثانية ثانوي للأستاذ بوقطوفMellah Imad75% (4)
- تمارين الطاقة الداخلية مع التصحيح PDFDocument13 pagesتمارين الطاقة الداخلية مع التصحيح PDFHadir kahoul100% (7)
- السقوط الشاقولي تمارين بكالورياDocument6 pagesالسقوط الشاقولي تمارين بكالورياoussama houari100% (2)
- الاختبار بالحلgDocument13 pagesالاختبار بالحلgاستاذك في الفيزياءNo ratings yet
- سلسلة تمارين الاحتمالات + الحل للسنة الثانيةDocument17 pagesسلسلة تمارين الاحتمالات + الحل للسنة الثانيةMellah ImadNo ratings yet
- Rev18 HiverDocument9 pagesRev18 HiveryousefNo ratings yet
- معايرة مصل فيزيولوجيDocument7 pagesمعايرة مصل فيزيولوجيSmail Ain Semene100% (1)
- مذكرة قياس الناقلية مخففةDocument17 pagesمذكرة قياس الناقلية مخففةdii sou75% (4)
- 2AS U07 - E3 - Cour-Exe 02Document12 pages2AS U07 - E3 - Cour-Exe 02Mariem MariNo ratings yet
- سلسلة تمارين الاحتمالات + الحل للسنة الثانيةDocument17 pagesسلسلة تمارين الاحتمالات + الحل للسنة الثانيةMellah Imad0% (1)
- لقذيفةDocument8 pagesلقذيفةSafia Safi50% (2)
- فيزياء - باقة الامتياز في الوحدة 1 - نافع - بكالوريا 2023Document65 pagesفيزياء - باقة الامتياز في الوحدة 1 - نافع - بكالوريا 2023ouiza merrouki83% (24)
- المناقشة البيانية بمختلف أنواعها .. الأستاذ ناعم محمد PDFDocument10 pagesالمناقشة البيانية بمختلف أنواعها .. الأستاذ ناعم محمد PDFyoutube Games100% (2)
- الدوال العددية في البكالوريا (الناطقة و الصماء) (للشعب العلمية) .Document3 pagesالدوال العددية في البكالوريا (الناطقة و الصماء) (للشعب العلمية) .Nouh Nahnouh50% (2)
- القسم 1 اختبارات + الحل - (ر + تر) - فيزياء - نافع بكالوريا 2023Document311 pagesالقسم 1 اختبارات + الحل - (ر + تر) - فيزياء - نافع بكالوريا 2023Ma Ry100% (1)
- تمرين مقترح للوحدة الاولى مصححDocument3 pagesتمرين مقترح للوحدة الاولى مصححBoudriaAbdRahime100% (1)
- سلسلة تمارين الوحدة 1 تركيب البروتين تغطي كل أفكار الوحدة للباكالوريا1652523267Document56 pagesسلسلة تمارين الوحدة 1 تركيب البروتين تغطي كل أفكار الوحدة للباكالوريا1652523267Said CherguiNo ratings yet
- علوم ط - اتصال عصبي -باقة الامتياز (10) مواضيع تحضيرية + الحل - نافع - بكالوريا 2022Document114 pagesعلوم ط - اتصال عصبي -باقة الامتياز (10) مواضيع تحضيرية + الحل - نافع - بكالوريا 2022insaf Makhloufi78% (18)
- 2AS U06 - E3 - Cour-Exe 02 PDFDocument19 pages2AS U06 - E3 - Cour-Exe 02 PDFAlgi Algi100% (1)
- سلسلة تمارين الإحتمالات مع الحلDocument48 pagesسلسلة تمارين الإحتمالات مع الحلحو اءNo ratings yet
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- مسألة 27 مجلة الأستاذ سرخاد عبدالباسطDocument1 pageمسألة 27 مجلة الأستاذ سرخاد عبدالباسطZaki Laidoune80% (5)
- Sciences2se ModakiratDocument45 pagesSciences2se Modakiratapi-24974205883% (60)
- سلسلة دعم سنة ثانيةDocument2 pagesسلسلة دعم سنة ثانيةhoussem100% (2)
- الحلقة (7) درس المتابعة الزمنية عن طريق المعايرة اللونية PDFDocument3 pagesالحلقة (7) درس المتابعة الزمنية عن طريق المعايرة اللونية PDFu w uNo ratings yet
- - - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFDocument5 pages- - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFamina derkaouiNo ratings yet
- Decroissance RadioactiveDocument7 pagesDecroissance RadioactiveRedouane RedaNo ratings yet
- كورسDocument22 pagesكورسRedouane RedaNo ratings yet
- 00 سلسلة تمارين الموجات2-1Document20 pages00 سلسلة تمارين الموجات2-1Redouane RedaNo ratings yet
- متابعة تحول كيميائي عن طريق المعايرة اللونيةDocument5 pagesمتابعة تحول كيميائي عن طريق المعايرة اللونيةRedouane Reda100% (1)
- تمثيل جدول التقدم وحساب التراكيزDocument8 pagesتمثيل جدول التقدم وحساب التراكيزRedouane RedaNo ratings yet
- المجرَّاتDocument121 pagesالمجرَّاتmharat100% (1)
- Phy 2010 SVT-NSDocument5 pagesPhy 2010 SVT-NSakamouss01No ratings yet
- التتبع الزمني لتحول كيميائيDocument7 pagesالتتبع الزمني لتحول كيميائيRedouane RedaNo ratings yet
- 27NS SVT 2012 PDFDocument6 pages27NS SVT 2012 PDFRedouane RedaNo ratings yet
- 5 - Transformations Acide BasiquesDocument9 pages5 - Transformations Acide BasiquesRedouane RedaNo ratings yet
- دروس الفيزياء النوويةDocument19 pagesدروس الفيزياء النوويةRedouane RedaNo ratings yet
- BacDocument10 pagesBacRedouane Reda100% (1)
- امتحانات موحدة - الثالثة إعدادي -مادة الفزياء-2010Document53 pagesامتحانات موحدة - الثالثة إعدادي -مادة الفزياء-2010Korrasaty_Blog50% (2)
- مدونة السير على الطرقDocument134 pagesمدونة السير على الطرقRedouane RedaNo ratings yet
- إنتشار موجة ضوئية PDFDocument8 pagesإنتشار موجة ضوئية PDFRedouane RedaNo ratings yet
- QCM2 ChimieDocument22 pagesQCM2 ChimieRedouane RedaNo ratings yet
- Bac ExerciceDocument4 pagesBac ExerciceRedouane RedaNo ratings yet
- درس التناقص الإشعاعي-بكالوريا بامتيازDocument7 pagesدرس التناقص الإشعاعي-بكالوريا بامتيازRedouane RedaNo ratings yet
- bac الفرض الكتابي رقم 2 التصحيحDocument5 pagesbac الفرض الكتابي رقم 2 التصحيحRedouane RedaNo ratings yet
- سلسلة تمارين مظاهر الطاقةDocument4 pagesسلسلة تمارين مظاهر الطاقةRedouane RedaNo ratings yet
- الدوران والشغل و المقادير المرتبطة بكمية المادة 1Document1 pageالدوران والشغل و المقادير المرتبطة بكمية المادة 1Redouane RedaNo ratings yet
- Enérgie Cinétique 1ere Annee ScendaireDocument4 pagesEnérgie Cinétique 1ere Annee ScendaireRedouane RedaNo ratings yet
- ف1Document2 pagesف1Redouane RedaNo ratings yet
- Champ MagnétiqueDocument3 pagesChamp MagnétiqueRedouane RedaNo ratings yet
- تمرين بالحل التحولات النوويةDocument2 pagesتمرين بالحل التحولات النوويةRedouane Reda50% (4)
- Ac SGDocument2 pagesAc SGRedouane RedaNo ratings yet
- فرض محروس رقم 1 الدورة 2Document2 pagesفرض محروس رقم 1 الدورة 2Redouane RedaNo ratings yet